一种调控胡杨耐盐性的基因PeCLH2及其应用的制作方法
一种调控胡杨耐盐性的基因peclh2及其应用
技术领域
1.本发明涉及一种调控胡杨耐盐性的基因peclh2及其应用,属于植物基因工程技术领域。
背景技术:
2.胡杨(populus euphratica)属杨柳科杨属(populus)胡杨派(section turanga),为雌雄异株植物,分化时间大概在2mya(millions of years ago百万年前)左右,是荒漠生态系统的优势模式乔木树种,具有非常重要的经济价值和生态价值。胡杨广泛分布于亚洲的中西部、北非和欧洲南部的干旱荒漠地区,而60%的天然胡杨林都分布于中国,中国的胡杨林有91.1%都分布于新疆的塔里木河流域,是新疆的荒漠区的主要树种和珍惜的抗逆种质资源,是研究植物抗盐、抗干旱等非生物胁迫的重要模式树种之一。从20世纪50年代以后,国内对于胡杨的研究已经进行了很多了,包括遗传育种、育苗造林等方面,并且,随着人们对于胡杨研究越来越深入,发现胡杨在稳定生态平衡、研究亚洲和非洲的沙漠地区的气候变化等方面,有重要作用,因此,研究胡杨对于非生物胁迫尤其是盐胁迫和干旱胁迫方面的响应及其分子机制,有重要意义。
3.盐胁迫可以诱导活性氧物质(reactive oxygen species,ros)的产生,低浓度活性氧物质(reactive oxygen species,ros)可以作为植物激活盐胁迫抗性响应的信号,但是高浓度活性氧物质(reactive oxygen species,ros)会损害蛋白质、脂质、dna和碳水化合。植物体内多余活性氧物质(reactive oxygen species,ros)的清除依赖酶促系统和非酶促系统两条途径。酶促系统通过多种酶对ros进行降解,目前,已经被研究发现的酶包括超氧化物歧化酶(sod)、抗坏血酸过氧化物酶(apx)、过氧化氢酶(cat)、愈创木酚过氧化物酶(gpx)、脱氢抗坏血酸还原酶(dhar)、单脱氢抗坏血酸还原酶(mdha)、谷胱甘肽过氧化物酶(gr)、谷胱甘肽s-转移酶(gst)。非酶促系统通过非酶促抗氧化物质的产生来应对活性氧物质,抗氧化物主要有抗坏血酸(ash)、生物碱、类胡萝卜素、类黄酮、谷胱甘肽、酚类化合物、生育酚等。通过上述两种系统降低植物体内过高的活性氧物质水平,维持活性氧物质的稳态,有利于提高植物抵抗盐胁迫的能力。
4.因此,提供一种调控胡杨耐盐性的基因peclh2及其应用,有助于了解和深入研究胡杨抗逆的生长机理,为后续遗传育种构建优良性状胡杨打下良好基础,进而提高胡杨的利用效率,对于非生物胁迫尤其是盐胁迫方面的响应及其分子机制和研究抗逆新品种具有重要的现实意义和应用前景。
技术实现要素:
5.本发明的目的在于提供一种调控胡杨耐盐性的基因peclh2,并利用其表达载体转化杨树,以期促进林木分子育种技术的发展,为优良树种的培育或筛选提供技术手段,同时为探索胡杨耐盐性的分子机理奠定基础。
6.为解决上述技术问题,本发明采用如下技术方案:
7.一种调控胡杨耐盐性的基因peclh2,其编码区核苷酸序列和氨基酸序列分别如seq id no.5和seq id no.6所示。
8.优选地,peclh2 cds全长1005bp,编码335个氨基酸和1个终止密码子。
9.所述调控胡杨耐盐性的基因peclh2在提高杨树耐盐性中的应用。
10.所述调控胡杨耐盐性的基因peclh2在提高杨树耐盐性中的应用,其特征在于:使植物包含基因peclh2或使杨树过表达基因peclh2和抑制表达基因peclh2。
11.所述调控胡杨耐盐性的基因peclh2在提高杨树耐盐性中的应用,其特征在于:构建含有基因peclh2的植物过表达载体,将其异源转化到84k杨树,筛选,获得转基因阳性植株,通过阳性植株和野生型植株表型及耐盐性分析,获得耐盐性的转基因植株。
12.所述调控胡杨耐盐性的基因peclh2在提高植物耐盐性中的应用,包括以下步骤:
13.(1)采集胡杨组培苗,进行rna提取,反转录成cdna,克隆出peclh2的cds序列,再将其连接pmdc32载体进行测序,鉴定正确后,构建过表达载体和抑制表达载体,异源转化到84k杨树中;
14.(2)利用潮霉素抗性和pcr技术对peclh2基因异源转化84k杨树进行阳性植株筛选,得到转基因阳性植株,并对其进行rna提取和表型统计,对其转基因植株进行盐处理,验证其抗盐性,获得耐盐性的转基因植株。
15.对转基因84k杨树和野生型84k杨树进行表型观察和耐盐性处理发现,在盐胁迫处理后,过表达转基因植株株高、根长和鲜重均较野生型高,说明peclh2基因的过表达提高了转基因84k杨树的耐盐性,抑制表达则抑制转基因84k杨树耐盐性。
16.以上研究结果证明,peclh2对杨树具有一定的盐耐受性和抗盐性,其在林木分子育种及优良品种选育中具有重要应用价值。
17.与现有技术相比,本发明的主要有益技术效果在于:
18.本发明以银腺杨84k(populus alba
×
p.glandulosa)为材料,筛选鉴定出了peclh2基因,基于其过表达和抑制植株的表型鉴定表明,其在盐处理下,能够提高耐盐胁迫能力,说明peclh2基因能够正向调节植物(杨树)的耐盐性,为筛选优势抗逆基因提供了新的选择,在林木基因工程领域有重要应用价值。
19.下面通过具体实施方式和附图对本发明作进一步说明,但并不意味着对本发明保护范围的限制。
附图说明
20.图1-1为本发明实施例1中过表达peclh2转基因84k杨树株系阳性植株检测;
21.图1-2为本发明实施例1中抑制表达rnai-peclh2转基因84k杨树株系阳性植株检测;
22.图2-1为本发明实施例1中过表达peclh2转基因84k杨树植株的表达量检测;
23.图2-2为本发明实施例1中抑制表达rnai-peclh2转基因84k杨树植株的表达量检测;
24.图3-1为本发明实施例1中盐处理后过表达和抑制表达84k杨树转基因表型统计;
25.图3-2为本发明实施例1中盐处理后过表达和抑制表达84k杨树转基因株系株高统计;
26.图3-3为本发明实施例1中盐处理后过表达和抑制表达84k杨树转基因株系鲜重统计;
27.图3-4为本发明实施例1中盐处理后过表达和抑制表达84k杨树转基因根长统计;
28.图4-1为本发明实施例1中盐处理后转基因株系84k杨树pod含量;
29.图4-2为本发明实施例1中盐处理后转基因株系84k杨树sod含量;
30.图4-3为本发明实施例1中盐处理后转基因株系84k杨树mda含量;
31.图4-4为本发明实施例1中盐处理后转基因株系84k杨树植物可溶性糖含量;
32.图4-5为本发明实施例1中盐处理后转基因株系84k杨树叶绿素含量;
33.图4-6为本发明实施例1中盐处理后转基因株系84k杨树相对电导率含量。
具体实施方式
34.下面结合具体实施例对本发明做进一步的说明,以下实施例中未进行详细说明的操作可参照分子克隆,相关试剂盒使用说明的操作实现。
35.除非特别说明,下面实施例中所涉及的试剂均为市场上可购的常规试剂,所用的方法均为本技术领域常用的方法。
36.一、胡杨peclh2基因的克隆
37.以胡杨(p.euphratica)为材料,使用天根多糖多酚总rna试剂盒,对胡杨进行总rna提取,方法如下:
38.(1)将约0.1克左右大小的胡杨叶片组织用液氮进行冷冻,放入液氮预冷过的研钵中进行研磨,研磨过程中始终保持叶片组织样品处于冷冻状态,待组织样品研磨成粉末状后,转移至1.5毫升离心管中,然后,加入500微升裂解液+10微升β-巯基乙醇)的2毫升灭菌的离心管中,然后用涡轮振荡器将组织与试剂充分混匀;
39.(2)12000转,离心2分钟,弃上清;
40.(3)将上清移至过滤柱上,12000转,离心2分钟,小心吸取上清至新的离心管中;
41.(4)加入0.4倍(200微升)无水乙醇,混匀,移入吸附柱中,12000转,离心15s,弃液体;
42.(5)向吸附柱中加入80微升dna酶工作液,室温静置15分钟;(dna酶:10微升dna酶储存液+70微升缓冲液)
43.(6)向吸附柱中加入350微升去蛋白液,12000转,离心15s,弃液体;
44.(7)向吸附柱中加入500微升漂洗液,12000转,离心15s,弃液体;
45.(8)重复(7);
46.(9)12000转,离心2分钟,移入新的离心管中,晾干,加入30微升无rna超纯水,溶解沉淀,室温静置2分钟,12000转,离心1分钟,即得到植物总rna提取液;
47.每个样品取2.0微克rna,通过使用天根反转录试剂反转录为cdna,实验耗材均无rna污染,反应均在冰上进行,反转录步骤如下:
48.1)gdna去除反应(10微升体系)见下表1:
49.表1
50.[0051][0052]
反应条件:42℃,反应3分钟;
[0053]
2)上一步反应产物作为模板进行反应(20微升体系)见下表2:
[0054]
表2
[0055][0056]
3)将1)加入2),反应条件:42℃,反应15分钟;95℃反应3分钟,使用时稀释10微升cdna+190微升超纯水,即为使用模板cdna;使用primer3软件设计引物(扩增子包含起始密码子及终止密码子),进行基因全长扩增(引物中引入gateway接头);
[0057]
其中,peclh2 orf正向引物peclh2-cds-f如序列表中seq id no.1所示(表3),反向引物peclh2-cds-r如seq id no.2(表4)所示;正向引物rnai-peclh2-cds-f如序列表中seq id no.3所示(表5),反向引物rnai-peclh2-cds-r如seq id no.4(表6)所示;
[0058]
表3
[0059][0060]
表4
[0061][0062]
表5
[0063][0064]
表6
[0065][0066]
以胡杨cdna为模板,用相应引物进行pcr扩增,pcr反应体系(20微升体系)见下表7:
[0067]
表7
[0068][0069]
反应条件见下表8:
[0070]
表8
[0071][0072]
目的片段进行切胶回收,采用美国omega生物技术公司胶回收试剂盒,对pcr扩增的peclh2目的片段进行切胶回收,具体操作步骤如下:
[0073]
1)将目的片段条带切胶于1.5毫升灭菌离心管中,加入600微升结合液,50℃至胶融化;
[0074]
2)将已融化的液体移入过滤柱中,12500转,离心2分钟,弃废液;
[0075]
3)加入600微升洗脱液,12500转,离心30分钟,弃废液;
[0076]
4)重复(3),弃废液;
[0077]
5)空离心过滤柱12500转,2分钟;
[0078]
6)将过滤柱转入一新的1.5毫升离心管中,加入30微升灭菌去离子水,室温静置5分钟,12500转,离心2分钟,重复洗脱一次;
[0079]
7)0.1%琼脂糖凝胶电泳检测后,-20℃保存;
[0080]
获得基因全长cdna序列为1005bp,命名为peclh2基因,序列如序列表seq id no.5所示(表9),其所编译表达蛋白序列如seq id no.6所示(表10);
[0081]
表9
[0082][0083]
表10
[0084][0085]
二、peclh2基因植物表达载体构建
[0086]
过量表达和抑制表达载体的构建
[0087]
使用gateway方法进行过表达载体构建,通过pcr扩增得到的带有gateway标签的peclh2的胶回收产物,首先通过bp反应(赛默飞,上海,中国)将其构建pdonr222中间载体上,bp反应体系见表11;随后,利用lr反应(赛默飞,上海,中国)将peclh2构建到pmdc32载体上,分别得到peclh2和rnai-peclh2;
[0088]
表11:bp反应体系(5微升体系)
[0089][0090]
反应条件:16℃,反应1h;
[0091]
连接产物转化大肠杆菌dh5α,具体转化步骤如下:
[0092]
1、在冰盒上取5微升连接产物加入50微升北京全式金生物技术有限公司生产的大肠杆菌感受态dh5α中,用移液器轻轻混匀,冰浴30分钟;
[0093]
2、将转化菌液放置42℃,热激90s,取出冰浴5分钟;
[0094]
3、加入300微升lb液体培养基,37℃,180转摇1小时;
[0095]
4、4000转室温离心5分钟,弃上清,将剩余菌液重悬;
[0096]
5、将混匀的转化菌体全部涂到含有50mg/l kan的lb固体平板上,晾干,封口倒置于37℃恒温箱中,培养12~14小时;
[0097]
随机挑取抗性平板上长出的单菌落若干,加入300微升含kan(50mg/l)的lb液体培养基,37℃,180转,振荡培养4~5小时后,以菌液作模板进行pcr检测阳性克隆;
[0098]
pcr反应体系(20微升体系)见下表12:
[0099]
表12
[0100][0101]
反应条件见下表13:
[0102]
表13
[0103][0104]
反应结束后,取5微升pcr扩增产物,使用0.1%琼脂糖凝胶电泳检测,并在凝胶成像系统紫外光下拍照,条带和扩增引物大小相同可视为阳性克隆,挑选3~5个pcr阳性克
隆,委托北京擎科生物科技有限公司进行测序,确认成功构建到中间载体上,依据测序结果,将目标菌种加入等体积50%的无菌甘油,震荡摇匀,在液氮预冻后,转移至-80℃冰箱保存,或通过扩大培养,提取并保存pdnor222-peclh2质粒;
[0105]
pdnor222-peclh2质粒基因片段进行酶切lr连接反应;
[0106]
酶切反应体系(10微升体系)见下表14:
[0107]
表14
[0108][0109]
反应条件:37℃,3小时;
[0110]
pdnor222-peerf1质粒进行lr反应连接,lr反应体系(5微升体系)见下表15:
[0111]
表15
[0112][0113]
反应条件:25℃,反应2.5小时;
[0114]
连接产物转化大肠杆菌,挑取单克隆,进行测序,结果正确的单菌落即为pmdc32-peclh2和pmdc32-rnai-peclh2质粒,最终克隆得到的胡杨盐响应相关基因peclh2的过表达载体peclh2和抑制表达载体rnai-peclh2;
[0115]
三、peclh2基因的遗传转化与检测
[0116]
1.peclh2基因的遗传转化
[0117]
通过电击法,将所构建的过量表达载体(pmdc32-peclh2)和抑制表达载体(pmdc32-rnai-peclh2)转入农杆菌gv3101中,通过农杆菌介导的遗传转化转入杨树,转化步骤如下:用于遗传转化的84k杨愈伤在培养温度为23-25℃、光照为16/8h(白天/黑夜)、光照强度为50μm m-2s-1的条件下培养,含有目的表达载体的农杆菌在od600=0.6~0.8时侵染愈伤,浸染后的愈伤,放在不定芽诱导培养基(l&m,lloyd&mccown woody plant basal medium with vitamins)基本培养基上,在温度为22
±
2℃的黑暗条件下共培养3天,共培养后的叶片转移至含有添加0.5mg/l 6-苄基氨基嘌呤(6-benzyl aminopurine)(6-ba)和
0.05mg/l萘乙酸(naphthaleneacetic acid)(naa))、3mg/l潮霉素(hygromycin b)和200mg/l特美汀(timentin)的l&m上,在培养温度为23-25℃、光照为16/8h(白天/黑夜)、光照强度为50μm m-2s-1的条件下,诱导和筛选抗性不定芽,经过30~45天的诱导培养,将抗性不定芽转移至含有3mg/l潮霉素(hygromycin b)和200mg/l特美汀(timentin)的生根培养基中(1/2murashige and skoog(ms)基本培养基添加0.05mg/l iba和0.02mg/l naa),直至诱导生根,提取已生根植株叶片dna进行pcr验证;
[0118]
2、过表达和抑制表达转基因植株检测
[0119]
获得抗性的peclh2基因过表达、抑制表达84k杨和野生型植株,提取基因组dna,利用pcr扩增表达载体上抗性基因,能够扩增得到清晰条带,即为转基因植株;如图1-1和图1-2所示,分别为本发明实施例1中野生型84k杨树与过量表达和抑制表达peclh2的转基因杨树阳性植株检测图;选取转基因植株的叶片,以野生型为对照,提取总rna并反转录,进行peclh2基因定量分析,以确定转基因植株目的基因表达量,最终共获得11个过表达peclh2转基因阳性株系,分别将其命名为pc-1,pc-2,pc-3,pc-4,pc-8,pc-9,pc-14,pc-16,pc-26,pc-32;10个抑制表达rnai-peclh2转基因阳性株系,分别将其命名为rc-1,rc-2,rc-3,rc-4,rc-5,rc-6,rc-7,rc-8,rc-9,rc-10;定量引物为peclh2-rt-f(seq id no.7),见下表16;peclh2-rt-r(seq id no.8),见下表17;
[0120]
表16
[0121]
名称序列7(seq id no.1)peclh2-rt-factgtgtttgaggttgggaag
[0122]
表17
[0123]
名称序列8(seq id no.8)peclh2-rt-ftttggaggtggaacaggaag
[0124]
用rt-pcr检测转基因杨树中peclh2基因的表达水平。结果表明,10个过表达peclh2基因的转基因株系中的基因表达水平均显著高于野生型对照植株,相对表达水平是对照的3.53-93.42倍(如图2-1所示)。10个抑制表达rnai-peclh2基因的转基因株系中的表达水平均显著低于野生型对照植株,相对表达水平是对照的0.32-0.96倍(如图2-2所示)。
[0125]
四、peclh2转基因植株表型观察
[0126]
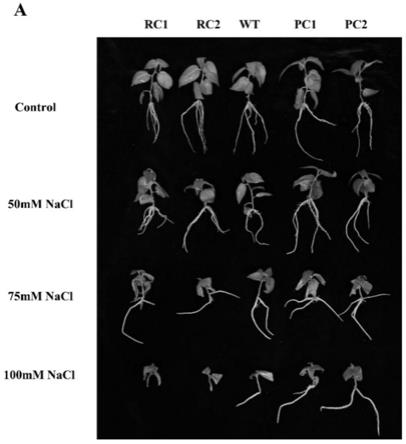
将过表达和抑制表达转基因株系84k杨树设置30个以上生物学重复,同时设置野生型84k杨树(wt)作为对照间种,培养地点为中国林业科学研究院杨树组培室,选取生长状态一致的过表达和抑制表达转基因株系,分别移入含有0mm、50mm、75mm和100mm nacl处理30天,第30天时观察各转基因杨树及对照的生长状态,统计各处理间转基因的株高、根长和鲜重;如图3-1至图3-4所示,为本发明实施例1中野生型84k杨树与过量表达和抑制表达的转基因杨树株高表型比较图,在正常条件下,过表达peclh2转基因杨树的株高、根长和鲜重分别是wt的1.2、1.08和1.2倍(图3-1至图3-4);rnai-peclh2转基因杨树的株高、根长和鲜重分别是wt的0.85、0.94和0.88倍;在50mm nacl条件下,过表达peclh2转基因杨树的株高、根长和鲜重分别是wt的1.58、1.08和2倍;rnai-peclh2转基因杨树的株高、根长和鲜重分别是wt的0.9、0.76和0.7倍;在75mm nacl条件下,过表达peclh2转基因杨树的株高、根长和鲜重分别是wt的1.81、1.06和2.3倍;rnai-peclh2转基因杨树的株高、根长和鲜重分别是wt的0.85、0.51和0.77倍;在100mm nacl条件下,过表达peclh2转基因杨树的株高、根长和鲜重
分别是wt的1.28、1.39和2.7倍;rnai-peclh2转基因杨树的株高、根长和鲜重分别是wt的0.75、0.08和0.9倍;胡杨peclh2基因在一定程度上具有提高植物耐盐性的作用。因此,综合表型和统计数据,初步推测胡杨peclh2基因在一定程度上具有提高植物耐盐性的作用。
[0127]
五、peclh2转基因相关生理指标的检测
[0128]
将培养一个月的转基因杨树组培苗移至土盆中,培养一个月进行150mm nacl处理24小时,水处理为对照;根据索莱宝生物科技有限公司过氧化物酶(pod)、超氧化物歧化酶(sod)、植物可溶性糖含量和丙二醛(mda)测试盒说明书,测定转基因杨树pod、sod和mda含量,叶绿素含量用乙醇法测定;测定结果见图4-1至图4-6所示,在盐胁迫条件下,过表达peclh2基因的植株的pod和sod活性显著高于野生型植株,而抑制表达rnai-peclh2基因的植株的pod和sod活性显著低于野生型植株;mda含量和相对电导率结果显示过表达peclh2基因杨树在盐胁迫下受到的损伤显著低于野生型植株,而抑制表达rnai-peclh2基因杨树的损伤显著高于野生型植;过表达peclh2基因杨树在盐胁迫下可溶性糖含量显著高于野生型植株,而抑制表达rnai-peclh2基因杨树的可溶性糖含量显著低于野生型植株;过表达peclh2基因杨树在盐胁迫下叶绿素含量显著低于野生型植株,而抑制表达rnai-peclh2基因杨树的可溶性糖含量显著高于野生型植株。
[0129]
以上结果表明:盐胁迫下过表达转基因84k杨树在盐胁迫下受到损伤均显著高于野生型杨树,抑制表达转基因84k杨树在盐胁迫下受到损伤均显著低于野生型,表明peclh2基因具有一定的耐盐性。
[0130]
本发明提供了一种重要的并且可能具有普适性的耐盐性基因资源,胡杨盐胁迫的耐受性为以后相关研究提供素材,同时也为植物抗逆性研究奠定基础。
[0131]
虽然以上对本发明目的构思和实施例作了详尽说明,但本领域普通技术人员可以认识到,在没有脱离权利要求限定范围的前提条件下,仍然可以对本发明做出各种改进和变换,而这种改进和变换仍然应当属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1