抗冠状病毒双特异性中和抗体与应用
1.本发明属于生物医药领域,具体涉及抗冠状病毒双特异性中和抗体与应用,特别涉及抗covid-19病毒中和抗体及其应用。
背景技术:
2.冠状病毒在系统分类上属套式病毒目(nidovirales)冠状病毒科(coronaviridae)冠状病毒属(coronavirus)。冠状病毒属的病毒是具囊膜(envelope)、基因组为线性单股正链的rna病毒。冠状病毒颗粒形状为圆形或椭圆形,在电镜下的病毒颗粒形态呈现皇冠状,广泛地存在于生物界中。冠状病毒一共分为四个种属,分别是α、β、γ和δ,sars-cov-2和sars-cov病毒以及mers-cov病毒都隶属于冠状病毒的β亚属。
3.新型冠状病毒(sars-cov-2)是一种单股正链的rna病毒,基因组约为30kb,由内部的遗传物质rna以及刺突蛋白(spike protein,s蛋白)、包膜蛋白(envelop protein,e蛋白)、膜蛋白(membrane protein,m蛋白)和核衣壳蛋白(nucleoprotein,n蛋白)等构成。其中s蛋白是形成病毒“冠状”形态的主要蛋白之一,介导sars-cov-2进入细胞,是病毒感染宿主细胞的武器。s蛋白又分为s1亚基、s2亚基、跨膜结构域和细胞质结构域,其中s1亚基又包含n端结构域(ntd)和受体结合结构域(receptor binding domain,rbd)。其中s1的rbd区可以与哺乳动物细胞上的受体ace2(血管紧张素转换酶2,angiotensin converting enzyme 2)结合,并介导sars-cov-2病毒进入细胞,病毒进入细胞后,不断增殖的sars-cov-2病毒颗粒通过胞吐作用进入细胞外液中,进而感染其他宿主细胞。因此,sars-cov-2病毒的rbd结构决定了其与潜在受体ace2结合的效率以及感染的种属特异性,是重要的中和抗体识别与开发靶点。
4.sars-cov-2感染后的主要表现为发烧或轻微咳嗽,重症患者会引发肺炎,并常伴随器官衰竭,甚至死亡。目前并无治疗该病毒的特效药物,疫苗研发、中和抗体疗法、动物血清疗法等被认为是治疗sars-cov-2的一种选择。其中,中和抗体疗法在病毒的预防和治疗中起着至关重要的作用,早在之前,就有过从康复患者和接种过疫苗的献血者身上提取多聚血清用作病毒性疾病预防剂的先例,例如乙型肝炎和狂犬病等。晶体研究发现spike的rbd区存在多个结合位点,一些病人血浆中的抗体可以与ace2竞争性结合rbd,从空间上阻断病毒侵染宿主细胞;还有一些抗体可以与rbd的其他位点结合,这些抗体为开发治疗性抗体以及抗体鸡尾酒疗法都提供了广阔的前景。但是由于sars-cov-2为rna病毒,容易在复制过程中出错,大量复制可引起多种变异,并且变异速度极快,因此经常会因为突变而出现免疫逃逸的现象,导致疫苗的保护性下降、早期研发的一些单克隆抗体药物失效或中和能力大大降低。
5.双特异性抗体(bispecific antibody,bsab)可以与两个不同抗原或同一抗原的两个不同抗原表位相结合,是一种新兴的抗体药物,与单克隆抗体不同的是它具有结合两种不同分子、细胞的能力,独有的特异性和双功能性使其一经面世就成为了抗体药物研发的热点,在肿瘤和自身免疫病治疗方面有着广泛的应用。鉴于此,为了提高抗体治疗的临床
疗效,研究和开发冠状病毒的双特异性抗体成为治疗性抗体的发展方向,有着成为针对冠状病毒的广谱性抗体药物的巨大前景,对于丰富covid-19的临床治疗和预防手段具有重要的意义。
技术实现要素:
6.本发明所要解决的技术问题是提供一种抗冠状病毒中和抗体,特别是提供一种能够有效抑制新型冠状病毒sars-cov-2的双特异性中和抗体、其制备方法与应用。所要解决的技术问题不限于如所描述的技术主题,本领域技术人员通过以下描述可以清楚地理解本文未提及的其它技术主题。
7.为解决上述技术问题,本发明首先提供了特异性结合新型冠状病毒s蛋白受体结合域的双特异性抗体,所述双特异性抗体包括:
8.a1)名称为hsa-1f的抗体,所述hsa-1f包含重链可变区和轻链可变区,所述重链可变区包含氨基酸序列分别是seq id no.1、seq id no.2和seq id no.3的hcdr1、hcdr2和hcdr3;所述轻链可变区包含氨基酸序列分别是seq id no.4、seq id no.5和seq id no.6的lcdr1、lcdr2和lcdr3;
9.a2)单链抗体(scfv),名称为sfc3 scfv,所述单链抗体sfc3 scfv由重链可变区、连接肽和轻链可变区组成,所述重链可变区包含氨基酸序列分别是seq id no.7、seq id no.8和seq id no.9的hcdr1、hcdr2和hcdr3;所述轻链可变区包含氨基酸序列分别是seq id no.10、seq id no.11和seq id no.12的lcdr1、lcdr2和lcdr3。
10.进一步地,所述双特异性抗体特异性结合新型冠状病毒s蛋白受体结合域的不同表位,所述名称为hsa-1f的抗体特异性结合新型冠状病毒s蛋白受体结合域第一结合表位,所述单链抗体sfc3 scfv特异性结合新型冠状病毒s蛋白受体结合域第二结合表位,所述第一结合表位和第二结合表位为新型冠状病毒s蛋白受体结合域的不同表位。
11.其中a2)所述单链抗体sfc3 scfv的c端可与a1)所述抗体hsa-1f的重链可变区的n端融合。
12.所述双特异性抗体名称为bi31,为特异性结合新型冠状病毒(sars-cov-2)s蛋白(刺突蛋白,spike protein)受体结合域(receptor binding domain,rbd)的不同表位(第一结合表位和第二结合表位)的双特异性中和抗体,又称抗冠状病毒双特异性中和抗体bi31或抗covid-19病毒中和抗体bi31。
13.进一步地,所述抗体hsa-1f具体可由重链和轻链构成。抗体hsa-1f的重链包括可变区(vh)和恒定区(ch1、ch2和ch3),抗体hsa-1f的轻链包括可变区(vl)和恒定区(cl)。
14.其中,hcdr1、hcdr2和hcdr3为重链可变区中的三个互补决定区(cdr),lcdr1、lcdr2和lhcdr3为轻链可变区中的三个互补决定区(cdr)。互补决定区的序列根据kabat编号系统定义。
15.所述双特异性抗体可为鼠源抗体、嵌合抗体、人源化抗体。在本发明的一个实施例中,所述双特异性抗体为人源化抗体。
16.所述人源化抗体包括igg1抗体、igg2抗体、igg3抗体、igg4抗体中的一种。
17.所述人源化抗体可包含来源于人抗体的框架区或框架区变体。
18.在本发明保护范围内,所述双特异性抗体还包括选自igg1或igg4的重链恒定区和
包含选自kappa或lambda亚型的轻链恒定区。
19.进一步地,上述双特异性抗体中:
20.a1)中所述抗体hsa-1f的重链可变区的氨基酸序列可为seq id no.13的第251-368位或与seq id no.13的第251-368位具有至少90%的同一性;a1)中所述抗体hsa-1f的轻链可变区的氨基酸序列可为seq id no.14的第1-107位或与seq id no.14的第1-107位具有至少90%的同一性;其中,氨基酸序列的不一致处可在框架区(fr)。
21.a2)中所述单链抗体sfc3 scfv的重链可变区的氨基酸序列可为seq id no.13的第1-123位或与seq id no.13的第1-123位具有至少90%的同一性;a2)中所述单链抗体sfc3 scfv的轻链可变区的氨基酸序列可为seq id no.13的第139-250位或与seq id no.13的第139-250位具有至少90%的同一性。其中,氨基酸序列的不一致处可在框架区(fr)。
22.进一步地,单链抗体sfc3 scfv的连接肽的氨基酸序列可为(ggggs)n,n可为1-6的自然数,在本发明的一个实施例中,n为3。具体地,单链抗体sfc3 scfv的连接肽的氨基酸序列具体可为ggggsggggsggggs。
23.进一步地,上述双特异性抗体中:a1)中所述抗体hsa-1f的重链的氨基酸序列可为seq id no.13的第251-698位或与seq id no.13的第251-698位具有至少80%的同一性;a1)中所述抗体hsa-1f的轻链的氨基酸序列可为seq id no.14的第1-214位或与seq id no.14的第1-214位具有至少80%的同一性。其中,氨基酸序列的不一致处可在框架区(fr)。
24.进一步地,所述双特异性抗体bi31具体可由重链和轻链构成,双特异性抗体bi31的重链由所述抗体hsa-1f的重链和所述单链抗体sfc3 scfv构成,双特异性抗体bi31的轻链由所述抗体hsa-1f的轻链构成。
25.进一步地,所述双特异性抗体bi31的重链的氨基酸序列可为seq id no.13或与seq id no.13具有至少80%的同一性;所述双特异性抗体bi31的轻链的氨基酸序列可为seq id no.14或与seq id no.14具有至少80%的同一性。其中,氨基酸序列的不一致处可在框架区(fr)。
26.上述至少80%或至少90%的同一性,可为至少80%、85%或95%的同一性。
27.本文中,同一性是指氨基酸序列或核苷酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
28.本文中,所述至少80%的同一性可为至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
29.本文中,所述至少90%的同一性可为至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
30.具有改善的亲和力和/或效价的本发明所述抗体的变体可通过采用在本领域已知的方法来获得,并包括在本发明的范围内。例如,氨基酸置换可用于获得具有进一步改善的
亲合力的抗体。或者,核苷酸序列的密码子优化也可用来改善用于产生抗体的表达系统中的翻译效率。此外,包含通过对本发明的任何核酸序列应用定向进化法而优化抗体特异性或中和活性的序列的多核苷酸也属于本发明的范围内。
31.本发明还提供了生物材料,所述生物材料可为下述b1)至b6)中的任一种:
32.b1)编码所述双特异性抗体的核酸分子;
33.b2)编码所述双特异性抗体的重链的核酸分子;
34.b3)含有b1)或b2)所述核酸分子的表达盒;
35.b4)含有b1)或b2)所述核酸分子的重组载体、或含有b3)所述表达盒的重组载体;
36.b5)含有b1)或b2)所述核酸分子的重组微生物、或含有b3)所述表达盒的重组微生物、或含有b4)所述重组载体的重组微生物;
37.b6)含有b1)或b2)所述核酸分子的细胞系、或含有b3)所述表达盒的细胞系、或含有b4)所述重组载体的细胞系。
38.其中,b5)所述的重组微生物和b6)所述的细胞系可表达所述双特异性抗体bi31。
39.上述生物材料中,所述核酸分子可为下述任一种:
40.c1)编码序列是seq id no.15的重链dna分子和编码序列是seq id no.16的轻链dna分子;
41.c2)编码序列是seq id no.15的重链dna分子。
42.在本发明的一个实施例中,所述双特异性抗体bi31的重链核苷酸序列为seq id no.15;所述双特异性抗体bi31的轻链核苷酸序列为seq id no.16;
43.所述双特异性抗体bi31的重链是由所述单链抗体sfc3 scfv的c端与所述抗体hsa-1f的重链可变区的n端融合而成,所述双特异性抗体bi31的轻链是所述抗体hsa-1f的轻链,其中:
44.seq id no.15的第1-750位为单链抗体sfc3 scfv;
45.seq id no.15的第1-369位为单链抗体sfc3 scfv的重链可变区;
46.seq id no.15的第370-414位为单链抗体sfc3 scfv的寡核苷酸接头(linker),所述linker编码所述连接肽。
47.seq id no.15的第415-750位为单链抗体sfc3 scfv的轻链可变区;
48.seq id no.15的第91-105位为单链抗体sfc3 scfv重链可变区hcdr1;
49.seq id no.15的第148-195位为单链抗体sfc3 scfv重链可变区hcdr2;
50.seq id no.15的第301-336位为单链抗体sfc3 scfv重链可变区hcdr3;
51.seq id no.15的第484-531位为单链抗体sfc3 scfv轻链可变区lcdr1;
52.seq id no.15的第577-597位为单链抗体sfc3 scfv轻链可变区lcdr2;
53.seq id no.15的第694-720位为单链抗体sfc3 scfv轻链可变区lcdr3;
54.seq id no.15的第751-2097位为抗体hsa-1f的重链;
55.seq id no.15的第751-1104位为抗体hsa-1f的重链可变区;
56.seq id no.15的第1105-2097位为抗体hsa-1f的重链恒定区;
57.seq id no.15的第826-849位为抗体hsa-1f重链可变区hcdr1;
58.seq id no.15的第901-924位为抗体hsa-1f重链可变区hcdr2;
59.seq id no.15的第1039-1071位为抗体hsa-1f重链可变区hcdr3;
60.seq id no.16的第1-321位为抗体hsa-1f的轻链可变区;
61.seq id no.16的第322-645位为抗体hsa-1f的轻链恒定区;
62.seq id no.16的第79-96位为抗体hsa-1f轻链可变区lcdr1;
63.seq id no.16的第148-156位为抗体hsa-1f轻链可变区lcdr2;
64.seq id no.16的第265-291位为抗体hsa-1f轻链可变区lcdr3。
65.本文所述载体是本领域技术人员公知的,包括但不限于:质粒、噬菌体(如λ噬菌体或m13丝状噬菌体等)、黏粒(即柯斯质粒)、病毒载体(如杆状病毒载体、逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒或疱疹病毒(如单纯疱疹病毒)等)。在本发明的一个实施例中,载体具体可为pcdna3.1(+)载体。
66.本文所述微生物可为酵母、细菌或真菌。其中,细菌可来自埃希氏菌属(escherichia),欧文氏菌(erwinia),根癌农杆菌属(agrobacterium)、黄杆菌属(flavobacterium),产碱菌属(alcaligenes),假单胞菌属(pseudomonas),芽胞杆菌属(bacillus)等;酵母可为毕赤酵母(p.pastoris)。
67.所述细胞系(宿主细胞)是指可用于导入载体的细胞,其包括但不限于:真核细胞(如酵母细胞、曲霉菌)、动物细胞(如哺乳动物细胞、昆虫细胞)或原核细胞(如大肠杆菌或枯草杆菌)。在本发明的一个实施例中,所述细胞系具体可为hek293-f细胞。
68.术语“细胞”和“细胞系”可互换使用,并且所有这类名称都包括其后代。
69.在本发明的一个实施例中,所述重组载体具体可为pcdna3.1-bi31h和/或pcdna3.1-bi31k。
70.所述重组载体pcdna3.1-bi31h是用sfc3抗体的scfv[vh-(g4s)
3-vk]片段(即sfc3scfv,核苷酸序列为seq id no.15的第1-750位)和hsa-1f重链(seq id no.15的第751-2097位)连接得到融合基因(即双特异性抗体bi31的重链基因,核苷酸序列为seq id no.15)替换pcdna3.1(+)载体的hindiii识别位点和bamh i识别位点之间的片段,保持pcdna3.1(+)载体的其他核苷酸序列不变,得到的表达双特异性抗体bi31重链的重组表达载体。
[0071]
所述重组载体pcdna3.1-bi31k是用抗体hsa-1f轻链基因(即双特异性抗体bi31的轻链基因,核苷酸序列为seq id no.16)替换pcdna3.1(+)载体的hind iii识别位点和bamh i识别位点之间的片段,保持pcdna3.1(+)载体的其他核苷酸序列不变,得到的表达双特异性抗体bi31轻链的重组表达载体。
[0072]
所述重组细胞具体可为将所述重组载体pcdna3.1-bi31h和pcdna3.1-bi31k导入宿主细胞(如hek293-f细胞)得到的表达双特异性抗体bi31的重组细胞。
[0073]
进一步地,所述重组细胞含有seq id no.15所示的双特异性抗体bi31的重链基因和seq id no.16所示的双特异性抗体bi31的轻链基因。
[0074]
本发明还提供了药物组合物,所述药物组合物包含所述双特异性抗体bi31以及一种或多种药学上可接受的载体。
[0075]
所述药学上可接受的载体可为稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、吸附载体、表面活性剂或润滑剂但不限于此。
[0076]
其中,所述药物组合物具有抑制或中和sars-cov-2活性的中和抗病毒作用。所述药物组合物用于改善、预防或治疗sars-cov-2感染引起的疾病和/或用于抑制sars-cov-2
感染。
[0077]
所述抑制或中和sars-cov-2活性包括特异性结合sars-cov-2刺突蛋白(s蛋白)rbd区域,从而使sars-cov-2失去结合受体ace2的能力。
[0078]
进一步地,本发明的药物组合物可包含第一抗体和第二抗体或其抗原结合片段,其中第一抗体为本发明的双特异性抗体bi31,而第二抗体为抑制sars-cov-2病毒感染的其他任何抗体。
[0079]
本发明还提供了缀合物(conjugate),所述缀合物包含本发明所述的双特异性抗体,以及与所述双特异性抗体连接的可检测的标记;具体地,所述可检测的标记可选自酶(例如辣根过氧化物酶或碱性磷酸酶)、化学发光试剂(例如吖啶酯类化合物、鲁米诺及其衍生物、或钌衍生物)、荧光染料(例如荧光素或荧光蛋白)、放射性核素或生物素。
[0080]
本发明还提供一种诊断试剂或试剂盒,其包含本发明所述双特异性抗体。
[0081]
本发明还提供了所述双特异性抗体bi31的制备方法,所述方法包括:分别构建含有所述双特异性抗体的重链和轻链基因的重组表达载体;将所述重组表达载体导入宿主细胞,获得稳定表达所述双特异性抗体的宿主细胞;培养所述宿主细胞,经分离纯化获得所述双特异性抗体。
[0082]
本发明还提供了下述任一项所述的应用:
[0083]
d1)所述生物材料在制备所述双特异性抗体或所述药物组合物中的应用;
[0084]
d2)所述双特异性抗体,和/或,所述生物材料,和/或,所述药物组合物在制备用于预防和/或治疗sars-cov-2感染引起的疾病的产品中的应用;
[0085]
d3)所述双特异性抗体,和/或,所述生物材料,和/或,所述药物组合物在制备用于抑制sars-cov-2感染的产品中的应用;
[0086]
d4)所述双特异性抗体,和/或,所述生物材料,和/或,所述药物组合物在制备用于抑制或中和sars-cov-2的产品中的应用;
[0087]
d5)所述双特异性抗体,和/或,所述生物材料,和/或,所述药物组合物在制备用于结合sars-cov-2的rbd蛋白的产品中的应用;
[0088]
d6)所述双特异性抗体,和/或,所述生物材料在制备用于检测sars-cov-2和/或sars-cov-2的rbd蛋白的产品中的应用;
[0089]
d7)所述双特异性抗体,和/或,所述生物材料在制备用于诊断或辅助诊断sars-cov-2感染引起的疾病的产品中的应用。
[0090]
本发明的双特异性抗体通过检测抗sars-cov-2疫苗的抗原是否含有具有正确构象的特异性表位来监测所述疫苗的质量的用途也设想处于本发明的范围内。
[0091]
所述用于检测sars-cov-2和/或sars-cov-2的rbd蛋白的产品包括利用酶联免疫吸附法、免疫荧光检测法、放射免疫法、发光免疫测定法、胶体金免疫层析法、凝集法或免疫比浊法等检测抗原抗体结合的产品。
[0092]
上述应用中,所述产品可为药物、试剂或试剂盒。
[0093]
所述药物、试剂或试剂盒含有本文任一所述双特异性抗体。所述试剂盒可为化学发光免疫试剂盒、酶联免疫检测试剂盒、胶体金免疫试剂盒、或荧光免疫试剂盒,但不限于此。
[0094]
上述应用中,所述sars-cov-2感染引起的疾病可为呼吸系统感染和/或消化系统
感染。
[0095]
所述呼吸系统感染可为呼吸道感染和/或肺部感染,所述呼吸道感染可为鼻咽炎、鼻炎、咽喉炎、气管炎和/或支气管炎,所述肺部感染可为肺炎,如为新型冠状病毒肺炎(corona virus disease 2019,covid-19,简称新冠肺炎)。所述消化系统感染可为腹泻。
[0096]
本文中,术语“中和抗体”是指一种能中和,即防止、抑制、减小、阻碍或干扰病原体引发和/或保持宿主内感染的能力的抗体。如本文所述,这些抗体可单独地或以组合形式,在经适当配制后用作预防剂或治疗剂,与活性疫苗接种联合使用,用作诊断工具或用作生产工具。
[0097]
术语“单链抗体(scfv)”是指用适当的寡核苷酸接头(linker)连接轻链和重链可变区基因,使之表达单一的多肽链,称为单链抗体(scfv)。
[0098]
术语“表位”是指能够结合抗体的抗原结合区(“互补位”)的蛋白质决定簇。
[0099]
本发明的抗体可以本领域已知的各种方法来制备,例如通过基因工程重组技术来获得。例如,通过化学合成或pcr扩增获得编码本发明抗体的重链和轻链基因的dna分子。将所得dna分子插入表达载体内,然后转染宿主细胞,在特定条件下培养转染后的宿主细胞,并表达本发明的抗体。本领域技术人员可根据需要选择本领域常规的宿主细胞、表达载体、将表达载体导入宿主细胞的方法以及抗体的分离纯化方法。
[0100]
本发明人通过对前期工作获得的抗covid-19病毒单克隆抗体进行分析,意外地发现:前期工作获得的两株靶向sars-cov-2s蛋白rbd区的鼠源单克隆抗体在体外可以以较低浓度完全阻断病毒侵染宿主细胞,并表现出了一定的协同作用,此外,通过基于bli技术的fortebio对两株单抗进行结合表位鉴定,发现两株单克隆抗体结合rbd的表位不同。在此基础上,以这两株人源化后的单克隆抗体,分别为sfc3和hsa-1f,进行双特异性抗体的构建工作,构建了类igg的双特异性抗体bi31。构建的双特异性抗体bi31包含单链抗体sfc3 scfv和完整的人源化抗体hsa-1f结构,具有高度稳定的对称结构。在体外评价时,本发明双特异性抗体bi31的亲和力大大优于改造前的亲本抗体。双特异性抗体bi31相比较亲本抗体和与亲本抗体联用都表现出了更好的中和活性,对sars-cov-2变异毒株也保留了较好的中和活性。此外,双特异性抗体bi31对与sars-cov-2同源的sars-cov病毒和mers-cov病毒也表现出了一定的中和活性。因此,本发明的双特异性抗体bi31特异性结合新型冠状病毒rbd蛋白的不同表位,能够显著提高新型冠状病毒(sars-cov-2)的中和效果,降低病毒逃逸突变产生的概率,提高抗体治疗的临床疗效,可作为制备诊断、预防、治疗新型冠状病毒引起疾病的潜在候选药物,可以丰富covid-19的治疗和预防手段,更是有着成为针对冠状病毒的广谱性抗体药物的巨大前景,对冠状病毒感染的防治,具有重要的生物学和医学意义。
附图说明
[0101]
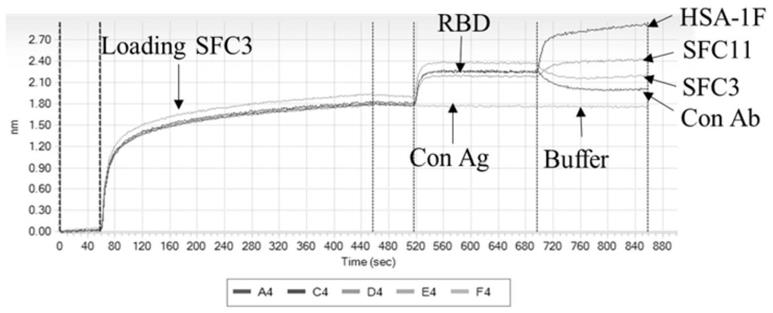
图1为fortebio研究亲本抗体sfc3和hsa-1f与sars-cov-2rbd的结合表位。
[0102]
图2为双特异性中和抗体bi31的结构示意图。
[0103]
图3为双特异性中和抗体bi31的sds-page电泳检测图。其中,图3中左图为非还原性鉴定图,右图为还原性鉴定图。
[0104]
图4为双特异性中和抗体bi31与sars-cov-2的rbd的亲和力检测。图4中a为对sars-cov-2野生型rbd的亲和力检测;图4中b为fortebio检测双特异性中和抗体bi31与
sars-cov-2野生型rbd的结合能力。
[0105]
图5为双特异性中和抗体bi31与其他冠状病毒rbd的亲和力检测。图5中a为对sars-cov的rbd的亲和力检测;图5中b为对mers-cov的rbd的亲和力检测。
[0106]
图6为利用sars-cov-2野生型假病毒系统检测双特异性中和抗体bi31和亲本抗体联合使用的中和效果。
[0107]
图7为利用假病毒系统检测双特异性中和抗体bi31以及亲本抗体联合使用对sars-cov-2突变株及sars-cov和mers-cov的中和效果。图7中a为对sars-cov-2的d614g突变株的中和结果;图7中b为对sars-cov-2的n501y突变株的中和结果;图7中c为对sars-cov-2的e484k突变株的中和结果;图7中d为对sars-cov-2的delta突变株的中和结果;图7中e为对sars-cov的假病毒中和结果;图7中f为对mers-cov的假病毒中和结果。
[0108]
附图中log(nm)表示log10(nm)。
具体实施方式
[0109]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
[0110]
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0111]
实施例1、探究亲本抗体sfc3和hsa-1f对野生型sars-cov-2rbd的结合位点
[0112]
本发明人通过对前期工作获得的抗covid-19病毒单克隆抗体进行分析,意外地发现:前期工作获得的两株靶向sars-cov-2s蛋白rbd区的鼠源单克隆抗体在体外可以以较低浓度完全阻断病毒侵染宿主细胞,并表现出了一定的协同作用,此外,通过基于bli技术的fortebio对两株单抗进行结合表位鉴定,发现两株单克隆抗体结合rbd的表位不同。在此基础上,以这两株人源化后的单克隆抗体,分别为sfc3和hsa-1f,进行双特异性抗体的构建工作,构建了类igg的双特异性抗体bi31。所述双特异性抗体bi31通过基因工程方法对亲本抗体sfc3和hsa-1f进行改造获得,可以特异性结合新型冠状病毒(sars-cov-2)s蛋白(刺突蛋白,spike protein)受体结合域(receptor binding domain,rbd)的不同表位(第一结合表位和第二结合表位),具有更好的中和活性。本实施例探究了亲本抗体sfc3和hsa-1f对野生型sars-cov-2rbd的结合位点。
[0113]
1.用hbs-ep buffer缓冲液分别将待测人源化抗体(sfc3,hsa-1f)的浓度稀释到200nm,将sars-cov-2rbd蛋白(义翘神州,40592-v08h5)稀释至400nm。
[0114]
2.用hbs-ep buffer缓冲液将anti-human igg fc capture(ahc)探针浸泡30min。
[0115]
3.设置baseline,loading antibody,baseline,association antigen,reassociation antibody程序,先用抗人抗体fc的探针捕获抗体后,与流动相抗原进行association,最后与其他抗体进行reassociation,从而探究抗体之间对sars-cov-2rbd的结合是否存在竞争关系。如图1为检测结果,人源化抗体sfc3与rbd结合后并不影响hsa-1f与rbd结合,因此两株单抗与sars-cov-2rbd的结合不存在竞争关系。
[0116]
实施例2、抗新冠病毒双特异性抗体的制备
[0117]
一、双特异性抗体bi31的结构
[0118]
利用人源化的单克隆抗体sfc3与hsa-1f制备类igg的双特异性中和抗体,命名为bi31(重链恒定区为igg1,轻链为kappa)。所述双特异性抗体bi31是在人源化抗体hsa-1f的n端(即hsa-1f重链可变区的n端)融合了sfc3的scfv(即单链抗体sfc3 scfv)。其中单链抗体sfc3 scfv是用寡核苷酸接头(linker)将人源化抗体sfc3的重链可变区(vh)和轻链可变区(vl)连接起来,使之形成单一的多肽链。构建的双特异性抗体bi31包含单链抗体sfc3 scfv和完整的人源化抗体hsa-1f结构,具有高度稳定的对称结构(双特异性抗体bi31的结构如图2所示)。
[0119]
所述双特异性抗体bi31的重链的氨基酸序列为seq id no.13;
[0120]
所述双特异性抗体bi31的轻链的氨基酸序列为seq id no.14;
[0121]
所述双特异性抗体bi31的重链核苷酸序列为seq id no.15;
[0122]
所述双特异性抗体bi31的轻链核苷酸序列为seq id no.16;
[0123]
所述双特异性抗体bi31的重链是由所述单链抗体sfc3 scfv的c端与所述抗体hsa-1f的重链可变区的n端融合而成,所述双特异性抗体bi31的轻链是所述抗体hsa-1f的轻链,其中:
[0124]
所述双特异性抗体bi31包括:
[0125]
a1)特异性结合新型冠状病毒s蛋白受体结合域第一结合表位的抗体hsa-1f,所述抗体hsa-1f包含重链可变区和轻链可变区,所述重链可变区包含氨基酸序列分别是seq id no.1、seq id no.2和seq id no.3的hcdr1、hcdr2和hcdr3;所述轻链可变区包含氨基酸序列分别是seq id no.4、seq id no.5和seq id no.6的lcdr1、lcdr2和lcdr3;
[0126]
a2)特异性结合新型冠状病毒s蛋白受体结合域第二结合表位的单链抗体(scfv)sfc3 scfv,所述单链抗体sfc3 scfv由重链可变区、连接肽和轻链可变区组成,所述重链可变区包含氨基酸序列分别是seq id no.7、seq id no.8和seq id no.9的hcdr1、hcdr2和hcdr3;所述轻链可变区包含氨基酸序列分别是seq id no.10、seq id no.11和seq id no.12的lcdr1、lcdr2和lcdr3;
[0127]
所述单链抗体sfc3 scfv的c端与所述抗体hsa-1f的重链可变区的n端融合。
[0128]
所述抗体hsa-1f的重链可变区的氨基酸序列为seq id no.13的第251-368位;
[0129]
所述抗体hsa-1f的轻链可变区的氨基酸序列为seq id no.14的第1-107位;
[0130]
所述单链抗体sfc3 scfv的重链可变区的氨基酸序列为seq id no.13的第1-123位;
[0131]
所述单链抗体sfc3 scfv的轻链可变区的氨基酸序列为seq id no.13的第139-250位;
[0132]
所述单链抗体sfc3 scfv的连接肽的氨基酸序列为(ggggs)3;
[0133]
所述抗体hsa-1f的重链的氨基酸序列为seq id no.13的第251-698位;
[0134]
所述抗体hsa-1f的轻链的氨基酸序列为seq id no.14的第1-214位;
[0135]
seq id no.15的第1-750位为单链抗体sfc3 scfv;
[0136]
seq id no.15的第1-369位为单链抗体sfc3 scfv的重链可变区;
[0137]
seq id no.15的第370-414位为单链抗体sfc3 scfv的寡核苷酸接头(linker),所述linker编码所述连接肽;
[0138]
seq id no.15的第415-750位为单链抗体sfc3 scfv的轻链可变区;
[0139]
seq id no.15的第91-105位为单链抗体sfc3 scfv重链可变区hcdr1;
[0140]
seq id no.15的第148-195位为单链抗体sfc3 scfv重链可变区hcdr2;
[0141]
seq id no.15的第301-336位为单链抗体sfc3 scfv重链可变区hcdr3;
[0142]
seq id no.15的第484-531位为单链抗体sfc3 scfv轻链可变区lcdr1;
[0143]
seq id no.15的第577-597位为单链抗体sfc3 scfv轻链可变区lcdr2;
[0144]
seq id no.15的第694-720位为单链抗体sfc3 scfv轻链可变区lcdr3;
[0145]
seq id no.15的第751-2097位为抗体hsa-1f的重链;
[0146]
seq id no.15的第751-1104位为抗体hsa-1f的重链可变区;
[0147]
seq id no.15的第1105-2097位为抗体hsa-1f的重链恒定区;
[0148]
seq id no.15的第826-849位为抗体hsa-1f重链可变区hcdr1;
[0149]
seq id no.15的第901-924位为抗体hsa-1f重链可变区hcdr2;
[0150]
seq id no.15的第1039-1071位为抗体hsa-1f重链可变区hcdr3;
[0151]
seq id no.16的第1-321位为抗体hsa-1f的轻链可变区;
[0152]
seq id no.16的第322-645位为抗体hsa-1f的轻链恒定区;
[0153]
seq id no.16的第79-96位为抗体hsa-1f轻链可变区lcdr1;
[0154]
seq id no.16的第148-156位为抗体hsa-1f轻链可变区lcdr2;
[0155]
seq id no.16的第265-291位为抗体hsa-1f轻链可变区lcdr3。
[0156]
二、双特异性抗体bi31的制备过程
[0157]
(一)、重组质粒的构建
[0158]
为了表达双特异性抗体bi31,分别制备重链表达载体和轻链表达载体:
[0159]
1、将sfc3抗体的scfv[vh-(g4s)
3-vk]片段(即sfc3 scfv,核苷酸序列为seq id no.15的第1-750位)和hsa-1f重链(seq id no.15的第751-2097位)连接得到融合基因(即双特异性抗体bi31的重链基因,核苷酸序列为seq id no.15),用该融合基因替换pcdna3.1(+)(invitrogen,v79020)载体的hindiii识别位点和bamh i识别位点之间的片段,保持pcdna3.1(+)载体的其他核苷酸序列不变,得到双特异性抗体bi31的重链表达载体,命名为pcdna3.1-bi31h。
[0160]
2、将抗体hsa-1f轻链基因(即双特异性抗体bi31的轻链基因,核苷酸序列为seq id no.16)替换pcdna3.1(+)(invitrogen,v79020)载体的hind iii识别位点和bamh i识别位点之间的片段,保持pcdna3.1(+)载体的其他核苷酸序列不变,得到双特异性抗体bi31的轻链表达载体,命名为pcdna3.1-bi31k。
[0161]
(二)、抗体的制备
[0162]
1、抗体的表达
[0163]
利用转染试剂fectopro dna transfection reagent(polyplus,116-001)将构建好的重链表达载体pcdna3.1-bi31h和轻链表达载体pcdna3.1-bi31k共转染freestyle
tm hek293-f细胞(invitrogen,r79007)。具体步骤如下:转染前一天将密度在2-3
×
106/ml左右、活度90%以上的freestyle
tm
hek293-f细胞1000rpm离心3分钟,弃上清后用freestyle 293培养基(gibco,12338-018)重悬细胞沉淀,并将细胞密度调整为1.0
×
106/ml,按30ml细胞悬液/瓶进行分装,细胞摇床中125rpm,5%co2,37℃震荡培养;第二天,进行转染复合物
的制备:将改造后的重链质粒(pcdna3.1-bi31h)取18ug,轻链质粒(pcdna3.1-bi31k)取12ug,并将其稀释于3ml freestyle 293培养基中,轻轻混匀后添加30ul的fectopro转染试剂,混匀后室温放置15min;然后将混合溶液添加至前一天准备好的freestyle
tm
hek293-f细胞中,轻轻混匀,放回细胞摇床中;转染后48小时开始监测细胞活度,在细胞活度降到80-85%时8,000rpm离心10min,收集上清液进行纯化。
[0164]
2、抗体的纯化
[0165]
用0.45μm滤膜抽滤抗体表达上清液以去除杂质,用10
×
pbs配制1
×
pbs结合缓冲液;将hitrap
tm
mabselect sure预装柱安装到akta系统,先用1
×
pbs结合缓冲液冲洗5-10个柱体积,待基线平稳,开始上样;上样完毕后,用结合缓冲液冲洗掉杂蛋白,继续用结合缓冲液冲洗5-10个柱体积,待基线水平后观察uv280是否接近零,如果不接近可手动调零;用0.1m柠檬酸盐缓冲液(ph 3.0)冲洗预装柱以洗脱抗体,uv280升到50时开始收集,uv280降到50时结束收集。
[0166]
用hitrap
tm
dedalting层析柱将hitrap
tm
mabselect sure亲和层析纯化样品进行脱盐处理,流动相为1x pbs缓冲液(ph 7.4)。首先用1x pbs缓冲液(ph 7.4)冲洗整个体系,待基线平稳后再冲洗3-5个柱体积,然后进行上样,(上样体积不大于层析柱总体积的五分之一)观察uv280值是否接近零,如不接近需要手动调零,进行缓冲液置换,流速均为2.5ml/min,uv280升到50时开始收集,uv280降到50时结束收集,若盐峰与蛋白峰值重叠,则结束置换。获得的洗脱峰即为纯化的bi31抗体,取部分样品sds-page检测和浓度检测,其余的分装冻存于-80℃。
[0167]
图3为纯化后的bi31抗体sds-page检测结果。由图3可见,纯化后的bi31抗体还原性样品有两条清晰的条带,分子量较大的条带为重链,分子量较小的条带为轻链,轻重链条带大小符合理论数值。
[0168]
3、抗体的定量
[0169]
将纯化并置换后的抗体溶液用滤膜过滤除菌,取样用nanodrop紫外分光光度计(thermo scientific)测定蛋白浓度(672μg/ml)。
[0170]
实施例3、bi31抗体及亲本抗体的特异性结合能力检测
[0171]
一、elisa检测抗体对sars-cov-2rbd蛋白的亲和力
[0172]
1、用碳酸盐包被缓冲液(ph 9.6)稀释sars-cov-2rbd重组蛋白(义翘神州,40592-v08h5)至2ng/ul,按照每孔100μl的体积加入到酶标板(corning,9018)中,每个实验孔设置3个复孔,4℃包被过夜。
[0173]
2、第二天,用pbst对过夜包被的酶标板洗板6次,加入含有2%(质量百分含量)脱脂奶粉的pbs封闭液,37℃孵育封闭2h。
[0174]
3、封闭完成后,弃去封闭液,每孔加入100μl按照2倍倍比稀释的bi31抗体溶液(起始浓度50nm),一共设置11个梯度,37℃孵育90min,然后pbst洗板6次。
[0175]
4、完成上述步骤后,取所述酶标板,每孔加入100μl的1:4000倍稀释hrp标记的抗人igg抗体(中杉金桥,zb-2304),37℃孵育1h,pbst洗板6次。
[0176]
5、向清洗好的酶标板每孔加入50μl opd底物显色液,室温下避光孵育10min。
[0177]
6、显色完成后,每孔加入50μl 1m硫酸溶液终止酶联显色反应。
[0178]
7、将上述酶标板用酶标仪492nm/630nm双波长测定光密度(od)值。
[0179]
二、fortebio检测抗体与sars-cov-2rbd的结合能力
[0180]
1.用hbs-ep buffer缓冲液将抗体(bi31)的浓度稀释到200nm,将sars-cov-2rbd蛋白(义翘神州,40592-v08h5)稀释至400nm,同时用hbs-ep buffer缓冲液将两个亲本抗体浓度分别稀释至200nm,作为实验对照。
[0181]
2.用hbs-ep buffer缓冲液将anti-human igg fc capture(ahc)探针浸泡30min。
[0182]
3.设置baseline,loading antibody,baseline,association antigen,deassociation antibody程序,先用抗人抗体fc的探针捕获抗体后,与流动相抗原进行association,最后进行deassociation,从而检测抗体对sars-cov-2rbd的结合能力的强弱。
[0183]
结果如图4所示。如图4中a所示,横坐标为蛋白摩尔浓度的对数值,纵坐标为光密度值,经检测,bi31抗体与sars-cov-2rbd重组蛋白的结合能力的ec
50
=0.011nm;图4中b为fortebio拟合的解离曲线,bi31抗体的kd值为2.45*10-9
,大大优于亲本抗体。
[0184]
实施例4、bi31抗体对sars-cov、mers-cov的rbd亲和力检测
[0185]
elisa检测bi31抗体对sars-cov、mers-cov的rbd亲和力方法同实施例3,所用rbd蛋白为商业化产品蛋白:sars-cov rbd(义翘神州,40150-v08b2)与mers-cov rbd(义翘神州,40071-v08b1)。
[0186]
检测结果如图5所示,图5中a为bi31抗体对sars-cov rbd的亲和力检测,ec
50
=244.8nm;图5中b为bi31抗体对mers-cov rbd的亲和力检测,ec
50
=206.7nm。
[0187]
实施例5、bi31抗体中和新冠病毒假病毒活性检测
[0188]
一、假病毒的制备
[0189]
1、s蛋白表达质粒的构建
[0190]
根据genbank公布的sars-cov-2基因序列(genbank号:nc_045512.2),委托上海生工生物工程有限公司合成sars-cov-2病毒s刺突蛋白基因(s基因)全长基因序列(去除跨膜区末端的19个氨基酸,核苷酸序列如seq id no.17所示),利用常规的酶切连接法将合成的s蛋白片段(seq id no.17)替换载体pcdna3.1(+)(invitrogen,v79020)的kpn i和xho i识别位点间的片段(小片段),保持pcdna3.1(+)载体的其他序列不变,得到的重组表达载体即为sars-cov-2s基因表达质粒,命名为pcdna3.1-st19。
[0191]
2、假病毒包装
[0192]
2.1假病毒包装前一天调整悬浮细胞freestyle
tm hek293-f(invitrogen公司,r79007)浓度至1
×
106/ml,接种70ml至250ml细胞瓶,37℃,150rpm过夜培养;
[0193]
2.2第二天,将42μg pnl4.3-luc-e-r-(ntcc,3767994)和14μg pcdna3.1-st19混匀,反复冻融3次,用3ml opti-mem培养基稀释质粒后再加入80ul fectopro转染试剂,上下颠倒混匀后室温放置15min,后将溶液全部移至步骤2.1的细胞中,37℃培养72h;
[0194]
2.3 72h后,用50ml离心管将细胞悬液4℃下3000rpm离心30min;将上清液分装到1.5ml ep管,每支1.2ml,存放于-80℃冰箱保存。
[0195]
3、粗测假病毒滴度
[0196]
3.1向96孔板中第二行至第八行加入50μl dmem,第1行加入50μl假病毒样品(每个样品做2-3个复孔),第二行加入25μl假病毒样品,然后将第二行混匀,取25μl加入第三行,依次向下稀释,直至第八行混匀后吸弃25μl。
[0197]
3.2 96孔板放入37℃孵箱,孵育1h。
[0198]
3.3 1h孵育结束后,将浓度4
×
105/ml的huh7细胞(ntcc,scsp-526),添加到96孔板中,每孔100μl。
[0199]
3.4将96孔板37℃孵箱培养48h。
[0200]
3.5 48h后,弃96孔板中上清液,在干净纸巾上拍干残液,每孔加入40μl 1
×
passive lysis buffer(promega,e194a,用前用水稀释至1
×
),摇床上避光摇晃20min;裂解完成后轻拍96孔板使每孔细胞脱落至裂解液中,将孔中裂解物转移到检测luciferase的检测白板中。
[0201]
3.6向检测白板中每孔加入40μl luciferase assay substrate(promega,e1501),用md公司的spectra max l检测单荧光素酶,根据reed-muench法计算假病毒滴度。经计算假病毒滴度为:1
×
105tcid
50
/ml。
[0202]
4、利用假病毒检测抗体的中和活性
[0203]
4.1稀释抗体:96孔板中第二行至第八行加入140μl dmem,第1行加入210μlmha-1f抗体(此为3个复孔的量),然后从第一行取70μl加入第二行,依次向下稀释,直至第八行,转移至另一块96孔板,共做15个稀释度,最后一个稀释度混匀后吸弃70μl。
[0204]
4.2每孔加入35μl假病毒,混匀后将每孔中的样品分至另一96孔板,1列分3列,每孔50μl,放入37℃孵箱,孵育1h。
[0205]
4.3孵育至0.5h时,可开始消化huh7细胞(ntcc,scsp-526),单细胞悬液密度调整至4
×
105/ml。
[0206]
4.4 96孔板中每孔加入100μl huh7细胞,37℃孵箱培养48h。
[0207]
4.5 48h后,弃96孔板中上清液,在干净纸巾上拍干残液,每孔加入40μl 1
×
passive lysis buffer(promega,e194a,用前用水稀释至1
×
),摇床上避光摇晃20min;裂解完成后轻拍96孔板使每孔细胞脱落至裂解液中,将每孔中的裂解物转移到检测luciferase的检测白板中。
[0208]
4.6用md公司的spectra max l检测单荧光素酶,每孔加入40μl luciferase assay substrate(promega,e1501);利用软件graphpad prism 8作图,并计算ec
50
。
[0209]
结果显示bi31抗体对sars-cov-2假型病毒具有较强的抑制活性和中和活性,可以有效中和新冠s蛋白假病毒,具有抑制sars-cov-2假病毒感染的能力,ec
50
为0.2nm(图6)。
[0210]
实施例6、抗体中和新冠病毒突变株假病毒及广谱性中和活性检测
[0211]
一、新型冠状病毒s蛋白点突变假病毒及sars-cov、mers-cov包膜s蛋白假病毒的包装
[0212]
1、利用fast mutagenesis system(fm111,transgen)对实施例5中的pcdna3.1-st19质粒进行定点突变,分别构建pcdna3.1-st19-d614g、pcdna3.1-st19-n501y、pcdna3.1-st19-e484k、pcdna3.1-st19-delta重组质粒。
[0213]
2、根据genbank公布的sars-cov刺突蛋白s基因序列(genbank号:dq412629.1)和mers-cov刺突蛋白s基因序列(genbank号:nc_019843.3),委托上海生工生物工程有限公司合成病毒s刺突蛋白基因全长基因序列,利用常规的酶切连接法将合成的s蛋白片段克隆至pcdna3.1(+)(invitrogen,v79020),所用的酶切位点为kpn i和xho i,对质粒测序验证正确后命名为pcdna3.1-sars-s、pcdna3.1-mers-s。
[0214]
3、突变株及sars-cov、mers-cov假病毒的详细包装过程参见实施例5中假病毒包装步骤。
[0215]
二、利用突变株及sars-cov、mers-cov假病毒检测抗体的中和活性
[0216]
双特异性抗体bi31中和新冠病毒s蛋白突变株及sars-cov、mers-cov假病毒的活性检测的方法同实施例5的步骤4,结果如图7所示,图7中a为bi31抗体对d614g突变株的中和检测,结果显示ec
50
=0.3nm;图7中b为bi31抗体n501y突变株的中和检测,结果显示ec
50
=1.4nm;图7中c为bi31抗体对突变株e484k的中和检测,结果显示ec
50
=110nm;图7中d为bi31抗体对delta突变株的中和检测;图7中e为bi31抗体对sars-cov的中和检测,结果显示ec
50
=7.8nm;图7中f为bi31抗体对mers-cov的中和检测,结果显示ec
50
=5.3nm。
[0217]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1