先天性肌无力小鼠模型、其构建方法及应用与流程
1.本发明涉及生物技术领域,具体而言,涉及先天性肌无力小鼠模型、其构建方法及应用。
背景技术:
2.肌无力是由肌肉、神经和代谢紊乱导致的神经肌肉类疾病(goronzy jj,weyand cm.immune aging and autoimmunity.cell mol life sci.2012;69:1615-23;lorenzoni pj,scola rh,kay cs,werneck lc.congenital myasthenic syndrome:a brief review.pediatr neurol.2012;46:141-48.)。肌营养不良、炎症性肌病、神经肌肉疾病、运动神经元疾病和重症肌无力是常见的遗传性肌无力(hellmann ma,mosberg-galili r,steiner i.myasthenia gravis in the elderly.j neurol sci.2013;325:1-5;al-chalabi a,visscher pm.motor neuron disease:common genetic variants and the heritability of als.nat rev neurol.2014;10:549-50.)。肌无力疾病的致病机理及相关治疗手段一直是研究热点。
3.lpin1(磷脂酸磷酸酶1,pap1,ec 3.1.3.4)基因编码,是一个mg2+依赖的磷脂酸磷酸酶(pap1)(harris te,huffman ta,chi a,shabanowitz j,hunt df,kumar a,et al.insulin controls subcellular localization and multisite phosphorylation of the phosphatidic acid phosphatase,lpin 1.j biol chem.2007;282:277-86.),在体内起到控制脂质合成和参与能量代谢的功能(donkor j,zhang p,wong s,o'loughlin l,dewald j,bernard p c,et al.aconserved serine residue is required for the phosphatidate phosphatase activity but not the transcriptional coactivator functions of lpin-1 and lpin-2.j biol chem.2009;284:29968-78.)。在细胞质中,lpin1蛋白作为pap1酶,将磷脂酸(pa)转化为二酰基甘油(dag),合成甘油三酯(tag)和磷脂;在细胞核中,lpin1与转录因子互作,发挥转录共激活因子的作用,调控下游基因表达(p
é
terfy m,harris te,fujita n,reue k.insulin-stimulated interaction with 14-3-3 promotes cytoplasmic localization of lpin-1 in adipocytes.j biol chem.2010;285:3857-64.)。
4.人类常染色体隐性lpin1基因突变已被确定为复发、早发横纹肌溶解症(mim#268200)的主要致病基因,这种疾病的特征是骨骼肌受损导致细胞蛋白(包括肌酸激酶和肌红蛋白)排泄到循环系统。这些研究支持了lpin1除了在脂质合成和能量代谢中的生化功能外,在周围神经和骨骼肌发育中的重要作用。
5.目前关于肌无力的临床研究,很难得到一种便于获得,先天性肌无力模型。基于此,本技术对lpin1基因突变位点进行研究,提供一种能够应用于肌无力相关治疗手段及药物的研发的小鼠模型,对相关治疗药物及治疗手段的筛选具有重要生理意义及特异性。
技术实现要素:
6.本发明的目的在于提供一种先天性肌无力小鼠模型、其构建方法及应用,能够应用于肌无力相关预防、治疗或诊断手段及药物的研发,对相关药物及手段的筛选具有重要生理意义及特异性。
7.为达到上述目的,本发明提供如下技术方案:第一方面,提供一种先天性肌无力小鼠模型的构建方法,其包括:
8.s1、以lpin1基因为目的基因构建同源重组载体,针对lpin1基因的第16和18外显子设计grna1和grna2,所述grna1和grna2分别为seq id no.1和seq id no.2;
9.s2、体外转录合成所述grna1、grna2和cas9 mrna;
10.s3、将所述grna1、grna2、cas9 mrna和同源重组载体显微注射至健康的c57bl/6j小鼠的受精卵中,获得f0代小鼠;
11.s4、将所述f0代小鼠通过杂交和/或自交的方式获得lpin1纯合突变的小鼠模型。
12.进一步地,所述同源重组载体包括2.9kb 5’同源臂、2.7kb的pm区域和3.0kb 3’同源臂。
13.进一步地,s3中还包括:
14.利用pcr对所述f0代小鼠进行基因型测序,其中,pcr检测引物序列为seq in no.3和seq in no.4。
15.进一步地,s4中还包括:
16.利用pcr对所述f0代小鼠通过杂交和/或自交的方式得到的后代小鼠进行基因型测序,其中,pcr检测引物序列为seq in no.5至seq in no.10。
17.进一步地,所述lpin1纯合突变包括i717l突变位点和r768q突变位点。
18.第二方面,提供根据所述的构建方法得到的小鼠模型或其子代。
19.第三方面,提供一种所述的构建方法或所述的小鼠模型或其子代在lpin1基因或lpin1蛋白相关领域或者免疫相关领域的应用。
20.进一步地,所述应用包括需要涉及人类细胞的免疫过程的产品开发,制造人类抗体,或者作为药理学、免疫学、微生物学和医学研究的模型系统中的应用或在生产和利用动物疾病模型,用于人源细胞移植、免疫系统重建、病原学研究和/或用于开发新的诊断策略和/或治疗策略中的应用或筛选、验证、评价或研究药物、药效研究,相关疾病药物以及抗肿瘤药物方面的用途。
21.进一步地,所述应用包括在制备预防、诊断或者治疗人类肌无力及相关并发症的药物的用途。
22.进一步地,所述应用包括在筛选预防、诊断或者治疗人类肌无力及相关并发症的药物的用途。
23.与现有技术相比,本发明的有益效果在于:本技术以小鼠运动神经系统发育调控基因lpin1为目的基因,结合crispr/cas9技术,通过同源重组载体引入突变位点,再逐代筛选获得lpin1基因点突变阳性的稳定遗传小鼠模型。本发明能够得到遗传稳定的先天性肌无力小鼠模型,其突变方式与人类基因突变一致。并验证其能够应用于肌无力相关预防、治疗或诊断手段及药物的研发,对相关药物及手段的筛选具有重要生理意义及特异性,尤其对lpin1基因突变导致的人类肌无力及并发症的研究及治疗提供极大地指导意义。
24.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。
附图说明
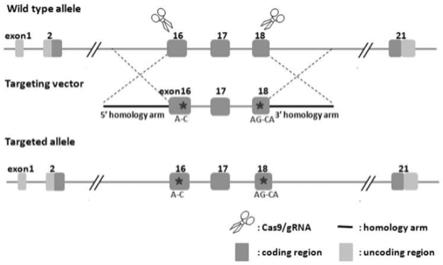
25.图1为本技术一实施例所示的lpin1基因突变点小鼠模型构建策略示意图;
26.图2为本技术一实施例所示的同源重组载体的质粒图谱;
27.图3为本技术一实施例所示的同源重组载体的酶切鉴定电泳图;
28.图4为本技术一实施例所示的f0代小鼠的pcr鉴定电泳图;
29.图5a和图5b分别为小鼠i717l和r768q位点的碱基序列;
30.图6为本技术一实施例所示的纯合突变小鼠的繁育情况;
31.图7为本技术一实施例所示的野生型小鼠和纯合突变小鼠的外观表型。
具体实施方式
32.下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
33.需要说明的是:本技术所采用的试剂、小鼠、仪器等材料、生命体或装置均从目前市面上的机构进行采购。
34.本发明所述“治疗”表示减缓、中断、阻止、控制、停止、减轻、或逆转一种体征、症状、失调、病症、或疾病的进展或严重性,但不一定涉及所有疾病相关体征、症状、病症、或失调的完全消除。
35.请参见图1,本技术提供了一种先天性肌无力小鼠模型的构建方法,其包括:
36.s1、以lpin1基因为目的基因构建同源重组载体,针对lpin1基因的第16和18外显子设计grna1和grna2,所述grna1和grna2分别为seq id no.1和seq id no.2;
37.s2、体外转录合成所述grna1、grna2和cas9 mrna;
38.s3、将所述grna1、grna2、cas9 mrna和同源重组载体显微注射至健康的c57bl/6j小鼠的受精卵中,获得f0代小鼠;
39.s4、将所述f0代小鼠通过杂交和/或自交的方式获得lpin1纯合突变的小鼠模型。
40.可选的,所述同源重组载体包括2.9kb 5’同源臂、2.7kb的pm区域和3.0kb 3’同源臂。
41.可选的,s3中还包括:
42.利用pcr对所述f0代小鼠进行基因型测序,其中,pcr检测引物序列为seq in no.3和seq in no.4。
43.可选的,s4中还包括:
44.利用pcr对所述f0代小鼠通过杂交和/或自交的方式得到的后代小鼠进行基因型测序,其中,pcr检测引物序列为seq in no.5至seq in no.10。
45.可选的,所述lpin1纯合突变包括i717l突变位点和r768q突变位点。
46.下面结合具体实施例进行说明。
47.一 设计grna
48.在基因组数据库下载目的基因lpin1的基因组数据,得到目的靶点。突变针对的转
录本(ensembl号):lpin1-201(ensmust00000067 124.5),碱基序列为:
49.aaaagcttgaagttgaagaacggccccaatgatgtggtgttcagtgtcactacccagtaccagggcacctgtcgctgcgagggcaccatctacctgtggaattgggacgacaaagtcatcatctcagatatcgatgggaccatcacaaggtgggcttgactgtggtgcggtctgcag
……
tcaaggtgaatgggttgtatctttcaggaatggctacaagtttctctattgttcggcacgtgccattgggatggcggacatgacgaggggctacctgcactgggtcaacgagaggggcacggtgcttccacagggcccgcttctgctcagcccgagcagcctcttctccgccttgcacag。
50.以lpin1基因第16号和18号外显子为靶区域,设计带有前间区邻近基序的grna序列:grna1和grna2,其基因序列分别为seq id no.1和seq id no.2具体为:
51.grna1:5
’‑
cagtcaagcccaccttgtgatgg-3’;
52.grna2:5
’‑
tgggatggcggacatgacgaggg-3’。
53.二 同源重组模板质粒的构建
54.设计重组载体插入片段,片段引物分别设计在lpin1基因第15、18外显子处,通过点突变及in-fusion cloning的方法构建同源重组载体,该载体包含2.9kb 5’同源臂、2.7kb的pm区域和3.0kb 3’同源臂,载体图谱如图2所示。采用nde l酶切鉴定同源重组载体,酶切条件为质粒5μg,nde l限制性内切酶5μl,10x buffer 5μl,加无菌去离子水37℃酶切5小时验证重组质粒,酶切结果如图3所示。
55.三 体外转录合成grna和cas9 mrna
56.在人类患者中,至少i683l&r734q双位点突变会造成患者肌无力,经过氨基酸保守性对比,鼠的i717l&r768q位点与人类上述位点保守。以grna1和grna2对应质粒为模板,选择相应的引物作pcr扩增,扩增条件为:95℃预变性5min,95℃30s,55℃退火30s,72℃延伸30s,共30个循环。通过体外转录试剂盒(ambiont7 kit)转录rna,将得到的sgrna分装,并冻存于-80℃冰箱中。
57.通过引物将t7 promoter添加到cas9 mrna的5端,运用pcr从px330上扩增出转录spcas9 mrna的模板,通过体外转录试剂盒(mmessage mmachine t7)转录cas9 mrna,分装冻存于-80℃冰箱。
58.四 显微注射
59.将体外合成的cas9 mrna、两条grna、donor dna进行混合稀释,使混合液中cas9 mrna最终质量浓度为100ng/μl,grna最终质量浓度为20ng/μl。将混合液经胞浆注射法注入到小鼠受精卵中,注射后的胚胎培养在ksom培养基中,在37℃,5%二氧化碳条件下培养。随后选取状态好的二细胞时期受精卵注射到假孕母鼠的壶腹部,详细操作程序按照《小鼠胚胎操作实验手册》中的方法进行。最后将手术缝合后的小鼠放入编号的干净的鼠笼,待小鼠苏醒后先断水断粮5小时,后正常饲喂待产。
60.五 小鼠基因型鉴定及稳定遗传品系的建立
61.共收集并注射30个小鼠受精卵,其中形成胚胎的23个。随后将23个胚胎移植到3只受孕小鼠体内。3只受孕小鼠经三周左右分娩出18只小鼠,将存活小鼠进行基因型测序。f0代同源重组阳性小鼠pcr鉴定引物序列如seq id no.3和seq id no.4所示,具体为:
62.f:5
’‑
tctggctagagcaccaaagc-3’;
63.r:5
’‑
acgtttctgccacccatgaa-3’。
64.pcr方案如下,目标扩增条带wt和mut大小均为9.8kb,碱基测序确定目的f0代小
鼠。双臂同源重组阳性的f0代小鼠为7号,长片段pcr鉴定电泳结果如图4所示。
65.本实施例的pcr反应体系及程序分别如表1和表2所示:
66.表1 f0代小鼠pcr鉴定反应体系
67.反应体系组成成分含量(μl)ddh2o13.2gxl pcr buffer22.5mm dntp2primer i(10pmol/μl)0.5primer ii(10pmol/μl)0.5gxl dna polymerase*0.8tail genomic dna1total20
68.表2 f0代小鼠pcr鉴定步骤
69.步骤温度(℃)时间备注1943min-29815sec-36215sec-4685min循环35次步骤2-45685min-612-保持温度
70.六 f1代小鼠培育及基因型鉴定
71.申请人发现,由于受精卵早期卵裂速度很快,得到的f0代小鼠为嵌合体,不一定具备稳定遗传的能力,需要进行传代以获得可稳定遗传的f1代小鼠,故选取f0代阳性小鼠与野生型c57bl/6j小鼠交配,繁育获得f1代小鼠。当然,在其他实施例中,还可以通过f0代小鼠进行自交。
72.f1代小鼠基因型可通过pcr产物直接测序方法进行判断,测序引物为见seq id no.5至seq id no.10,具体为:
73.717-f:5
’‑
aagaacggccccaatgatgt-3’;
74.717-r:5
’‑
ctcacagggcagaaggacag-3’;
75.717-测序f:5
’‑
aagaacggccccaatgatgt-3’;
76.768-f:5
’‑
ctattcaaggtgaatgggttg-3’;
77.768-r:5
’‑
gtcaatgatttcatatacacac-3’;
78.768-测序f:5
’‑
ctattcaaggtgaatgggttg-3’。
79.子代基因型根据突变位点的序列信息来判断,i717l&r768q双位点纯合突变小鼠为先天性肌无力小鼠,其测序碱基序列整理见图5a和5b,其中,图5a中,划线碱基为5arm同源臂序列,方框碱基为目的突变序列;图5b中,划线碱基为3arm同源臂序列,方框碱基为目的突变序列。
80.建立lpin1基因敲除纯合子小鼠模型后,申请人在实验室进行了大量繁育。目前纯合子lpin1基因敲除小鼠已经稳定繁育4代,纯合子小鼠繁育情况如图6所示。
81.七 纯合突变体小鼠肌无力表型分析
82.本实施例共获得10只纯合子小鼠,生存期观察研究显示所有纯合子小鼠均能长到成年并具有繁殖能力,但在出生后40天开始显示出肌无力表型,如图7所示,肌无力小鼠四肢蜷缩,五趾无力,提尾反射反应能力明显差于野生型。坐骨神经组织病理切片显示,肌无力小鼠神经细胞形态异常,提示小鼠神经源性肌病。
83.综上所述:本技术以小鼠运动神经系统发育调控基因lpin1为目的基因,结合crispr/cas9技术,通过同源重组载体引入突变位点,再逐代筛选获得lpin1基因点突变阳性的稳定遗传小鼠模型。本发明能够得到遗传稳定的先天性肌无力小鼠模型,其突变方式与人类基因突变一致。并验证其能够应用于肌无力相关预防、治疗或诊断手段及药物的研发,对相关药物及手段的筛选具有重要生理意义及特异性,尤其对lpin1基因突变导致的人类肌无力及并发症的研究及治疗提供极大地指导意义。
84.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
85.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
86.87.88.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1