一种多糖、其硫酸化产物及其在制备抗炎药物中的应用
1.本发明属于生物制药技术领域,涉及一种糖、其硫酸化产物及其在制备抗炎药物中的应用。
背景技术:
2.炎症是宿主对入侵病原体或组织损伤的有益反应,其主要目的是恢复组织内稳态。炎症在控制和消除感染方面起着重要作用,但是过度的炎性反应可能导致进一步的组织损伤,并引起慢性炎症性疾病和自身免疫病,最终导致器官功能丧失。在炎症过程中,单核细胞/巨噬细胞是参与体内炎性反应的主要功能细胞。m1型单核细胞/巨噬细胞受微环境中生物物质(如细胞因子、微生物、微生物代谢产物和其他调节剂)诱导,产生多种促炎性介质,包括诱导型一氧化氮合酶、肿瘤坏死因子tnf-α、il-1β、il-6、il-12和蛋白水解酶,构成对病原体的第一道防线。在炎症后期若促炎性m1型和抑炎性m2型巨噬细胞调节失衡,极易造成炎性反应持续,进而产生组织损伤和慢性炎症的发生。因此,寻找合适方法适度抑制巨噬细胞炎症反应有助于对炎症性疾病的治疗。
3.常用的抗炎治疗包括降低或中和促炎介质水平和/或抑制白细胞募集及其激活的策略。这些疗法包括非甾体抗炎药(nsaid)、糖皮质激素(gc)受体激动剂(合成gcs)和针对特定促炎细胞因子(如肿瘤坏死因子(tnf)-α和白细胞介素(il)-1)的抗体或抑制剂。除了化学合成的抗炎药物(如地塞米松)以外,天然产物(如多糖)及其衍生物在抑制巨噬细胞炎症反应中也具有一定效果。天然产物及其衍生物由于生产和纯化工艺较为简单,能够实现较大规模生产,具有潜在的成本优势和良好的应用潜力。
4.许多土壤类芽孢杆菌(paenibacillusedaphicus)菌株具有合成胞外多糖的能力,胞外多糖组成通常由葡萄糖、甘露糖、半乳糖、岩藻糖、鼠李糖以及葡萄糖醛酸中的几种或者全部组成,但是不同菌株所产多糖糖链的化学组成和结构以及性能均存在明显差别。中国专利106399199b公开了一种保藏编号为cctcc no.m2016542的土壤类芽孢杆菌,并发现其产生的一种胞外多糖能够调节水溶液的流变性质,具有显著的增加溶液粘度的作用,能够耐受溶液中高浓度的na
+
、k
+
、ca
2+
和mg
2+
,经过简单的加热冷却处理即可使溶液粘度数倍增加,且性质稳定,形成热可逆凝胶。
技术实现要素:
5.本发明的目的之一在于提供由保藏编号为cctcc no.m2016542的土壤类芽孢杆菌产生的一种多糖。
6.本发明所述的保藏编号为cctcc no.m2016542的土壤类芽孢杆菌已在中国专利106399199b充分公开。
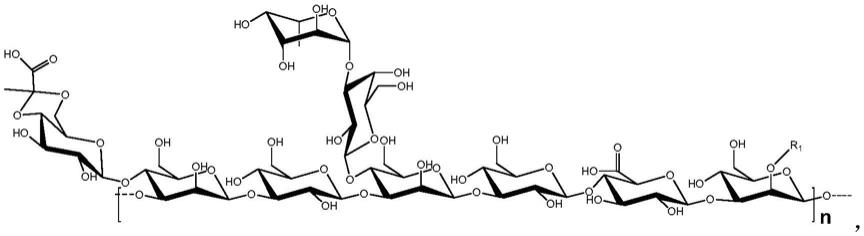
7.本发明所述的多糖,其结构式为:
[0008][0009]
其中,r1=h或coch3,重复单元数量(n)=5~500。
[0010]
本发明的目的之二在于提供上述多糖的制备方法,具体步骤如下:
[0011]
步骤1,将保藏编号为cctcc no.m2016542的土壤类芽孢杆菌接种至发酵培养基中摇床震荡培养,获得含有胞外多糖的发酵液;
[0012]
步骤2,在发酵液中加入乙醇,沉淀经过滤、干燥后得到固体粗多糖;
[0013]
步骤3,将粗多糖重新溶解于去离子水中,经过离心除去不溶性杂质,加入氯仿与正丁醇体积比为4:1的氯仿/正丁醇溶液,除去蛋白质,再依次通过阴离子交换层析和nacl溶液梯度洗脱,并透析脱盐,收集多糖组分,最后干燥得到纯化后的固体多糖。
[0014]
优选地,步骤2中,乙醇的加入量为发酵液体积的2~4倍。
[0015]
优选地,步骤3中,阴离子交换层析填料为强阴离子交换树脂或弱阴离子交换树脂,更优选为强阴离子交换树脂。
[0016]
优选地,nacl溶液梯度范围为0~1mol/l。
[0017]
本发明的目的之三在于提供一种上述多糖的硫酸化产物,即一种硫酸化多糖,其结构式为:
[0018][0019]
其中,r2=h或so3h,r3=h或coch3或so3h,且r3=h或coch3时,r2不全为h。
[0020]
优选地,硫酸化多糖的硫酸化取代度为0.5~2.0。
[0021]
本发明的目的之四在于提供上述硫酸化多糖的制备方法,具体步骤如下:
[0022]
将多糖溶于甲酰胺中,与吡啶-氯磺酸混合,50℃~85℃下加热反应,反应结束后,加入氢氧化钠溶液终止反应,依次经离心、透析、有机溶剂沉淀、干燥,制得固体硫酸化多糖。
[0023]
优选地,氯磺酸与多糖中单糖单元的摩尔比为10:1~50:1,吡啶与多糖中单糖单元的摩尔比为20:1~120:1。
[0024]
优选地,反应时间为0.5~5h,更优选为1~3h。
[0025]
优选地,反应温度为50℃~65℃。
[0026]
优选地,有机溶剂为乙醇、异丙醇或丙酮。
[0027]
本发明的目的之五在于提供上述硫酸化多糖在制备抑制巨噬细胞炎症反应药物
中的应用。
[0028]
与现有技术相比,本发明具有以下优点:
[0029]
(1)本发明的多糖由土壤类芽孢杆菌发酵获得,发酵工艺简单,多糖回收和纯化方法成熟,质量可控;
[0030]
(2)本发明的硫酸化多糖在较大浓度范围内对巨噬细胞增殖无毒害作用,且在较低浓度时即可以显著降低由脂多糖(lps)诱导的巨噬细胞胞内多种促炎介质的表达水平,显示出良好的炎症抑制活性;
[0031]
(3)本发明的硫酸化多糖生产工艺简单,收率高,炎症抑制活性高,具有良好的应用前景。
附图说明
[0032]
图1为本发明的多糖和硫酸化多糖红外吸收光谱比较图。
[0033]
图2为本发明的多糖在气相色谱质谱(gc-ms)分析中的总离子流图。
[0034]
图3为本发明的多糖在核磁共振分析中的1h、
13
c和dept-135谱图。
[0035]
图4为本发明的多糖在核磁共振分析中的cosy和tocsy谱图。
[0036]
图5为本发明的多糖在核磁共振分析中的hsqc谱图。
[0037]
图6为本发明的多糖在核磁共振分析中的hmbc谱图。
[0038]
图7为小鼠巨噬细胞raw264.7在含有不同浓度硫酸化多糖时的存活率曲线。
[0039]
图8为不同浓度硫酸化多糖抑制lps诱导的小鼠巨噬细胞raw264.7释放no、细胞内tnf-α和nf-κb转录水平的结果图。
[0040]
图9为不同浓度硫酸化多糖和地塞米松抑制lps诱导的小鼠巨噬细胞raw264.7释放no、细胞内tnf-α和nf-κb转录水平的结果图。
具体实施方式
[0041]
下面结合实施例和附图对本发明作进一步详细说明。
[0042]
实施例1
[0043]
土壤类芽孢杆菌产胞外多糖的生产、提取与纯化
[0044]
1.首先准备种子液。挑取一环生长在平皿固体培养基上的保藏编号为cctcc no.m2016542的土壤类芽孢杆菌单菌落接种至含有50ml液体培养基的250ml三角瓶中,在30℃恒温摇床中250rpm振荡培养24h,制得种子液。其中,每1l液体培养基含有:蔗糖20g,硝酸钾3g,磷酸二氢钠1g,七水合硫酸镁0.2g,硫酸亚铁0.0125g,无水氯化钙0.07g,氯化锌0.0075g,硫酸锰0.003g,ph8.0。平皿固体培养基成分与液体培养基相同,另添加2%琼脂粉。所有培养基预先经121℃高压蒸汽灭菌20min后使用。
[0045]
2.发酵产胞外多糖。将培养好的种子液按照接种量5%接种至含有50ml发酵培养基的250ml三角瓶中,在30℃恒温摇床中250rpm振荡培养72h,制得含有胞外多糖的发酵液。每1l发酵培养基含有:蔗糖30g,硝酸钾3g,磷酸二氢钠1g,七水合硫酸镁0.2g,硫酸亚铁0.0125g,无水氯化钙0.07g,ph7.0。培养基预先经121℃高压蒸汽灭菌20min后使用。
[0046]
3.胞外多糖的提取和纯化。收集50ml发酵液,加入150ml无水乙醇并剧烈震荡,然后过滤收集沉淀,将沉淀在65℃烘箱烘干得到粗多糖。取10g粗多糖溶解于1l去离子水中,
然后于6000g离心30min收集上清液。取50ml上清液加入200ml sevag试剂(氯仿:正丁醇=4:1,v/v)剧烈震荡,静置回收水相溶液,并重复此方法5次,制得不含蛋白质的多糖水溶液。然后将多糖水溶液浓度调至5g/l,取20ml多糖溶液,采用强阴离子交换树脂(所用型号为:tosoh superq-650m层析柱4.6
×
30cm)分级,以nacl溶液梯度洗脱(线性梯度范围:0~1mol/l),分步收集多糖组分,然后经透析,烘干,制得纯化的胞外多糖。
[0047]
采用该方法,粗多糖产量为11.9g/l,纯化多糖产量为6.5g/l。
[0048]
实施例2
[0049]
多糖的结构解析
[0050]
对实施例1纯化的胞外多糖进行化学结构分析。图1给出了纯化后胞外多糖(标记为eps)的傅里叶转换红外吸收光谱(ft-ir)。从图中可以看出,eps吸收曲线表现出典型的多糖特征,其中,3292.36cm-1
处的吸收峰是缔合状态下的o-h伸缩振动峰。而1602.08和1409.03cm-1
处的吸收峰分别对应coo-的反对称伸缩振动和对称伸缩振动,表明该胞外多糖中含有糖醛酸。而892.36cm-1
处的吸收峰是吡喃糖环中β-端基c-h变角振动峰,表明该多糖以β-构象为主。通过单糖组成分析可知,该胞外多糖中含有d-甘露糖、d-葡萄糖、d-葡萄糖醛酸、d-半乳糖和l-岩藻糖,摩尔比为3:3:1:1:1。
[0051]
图2为该多糖甲基化产物的气相色谱质谱(gc-ms)总离子流图,结合保留时间和质谱碎片数据,可知,共有7种甲基化产物。图中从左至右分别对应:l-fuc-(1
→
、
→
3)-d-glc-(1
→
、
→
4)-d-glc-(1
→
、
→
3)-d-gal-(1
→
、
→
3,4)-d-man-(1
→
、
→
2,3)-d-man-(1
→
和
→
4,6)-d-glc-(1
→
。可知,该多糖分子中存在含有岩藻糖末端的支链,而甘露糖和葡萄糖主要存在于主链上。
[0052]
图3为该多糖的1h、
13
c和dept-135核磁共振谱。从图中可知,δ=176.35、101.56、23.20/2.18ppm分别对应丙酮酸羧基、取代羰基和甲基的化学位移,这与
→
4,6)-d-glc-(1
→
结构吻合,表明糖链重复单元中一个葡萄糖被丙酮酸修饰并位于支链末端。异头碳化学位移102.81~105.06/4.52~5.17ppm表明该多糖单元均为β-构象,这与ft-ir结果吻合。而78.27~86.97ppm化学位移表明糖链连接存在1
→
3和1
→
4两种可能,这与gc-ms结果吻合。
[0053]
图4~6分别为该多糖的cosy、tocsy、hsqc和hmbc核磁共振谱。根据已有信息,分别对糖链重复单元中所有单糖c、h化学位移归属及连接方式进行了指认,并标记在图中。结合上述信息,得到了该胞外多糖的化学结构式如下:
[0054][0055]
其中,粗体字母a~i分别代表
→
3)-β-d-glc-(1
→
、
→
3)-β-d-glc-(1
→
、
→
4)-β-d-glca-(1
→
、β-l-fuc-(1
→
、pyruvyl
→
4,6)-β-d-glc-(1
→
、
→
3,4)-β-d-man-(1
→
、
→
3,4)-β-d-man-(1
→
、
→
3)-β-d-man-(1
→
、
→
3)-β-d-gal-(1
→
共9个单糖并对应附图中化学位移指认结果。甘露糖(h)c2位存在-oh和-ococh3两种形式,即同时存在
→
3)-β-d-man-(1
→
和
→
2,3)-β-d-man-(1
→
,因此,r1=h或coch3。
[0056]
实施例3
[0057]
取代度为2.0的硫酸化多糖的制备
[0058]
首先在冰浴上将15ml无水吡啶和5ml氯磺酸混合,室温搅拌30min。然后取纯化后的胞外多糖300mg溶于20ml甲酰胺中,缓慢加入上述氯磺酸吡啶溶液,60℃加热搅拌2h。然后用5mol/l氢氧化钠溶液终止反应并调节体系ph7.5。然后将反应液于5000g离心10min并回收上清液。随后将上清液透析脱盐并减压旋转蒸发浓缩至5ml。然后加入15ml异丙醇沉淀浓缩液中的硫酸化多糖组分,最后通过过滤回收并烘干制得硫酸化多糖。
[0059]
图1给出了该硫酸化多糖(s-eps)的ft-ir吸收光谱。与未修饰多糖(eps)相比,1220.14cm-1
处出现了典型的s=o伸缩振动峰,而804.17cm-1处的吸收峰为c-o-s伸缩振动峰。结果表明该方法成功实现了对胞外多糖原料的硫酸化修饰。总收率65%,经明胶法测定硫酸化取代度2.0。结合多糖结构和取代度可知,硫酸化多糖结构如下:
[0060][0061]
其中,r2=h或so3h,r3=h或coch3或so3h,且r3=h或coch3时,r2不全为h。
[0062]
实施例4
[0063]
取代度为1.1的硫酸化多糖的制备
[0064]
首先在冰浴上将9ml无水吡啶和3ml氯磺酸混合,室温搅拌30min。然后取纯化后的胞外多糖300mg溶于20ml甲酰胺中,缓慢加入上述氯磺酸吡啶溶液,60℃加热搅拌1.5h。然后用4mol/l氢氧化钠溶液终止反应并调节体系ph7.5。然后将反应液于5000g离心10min并回收上清液。随后将上清液透析脱盐并减压旋转蒸发浓缩至5ml。然后加入15ml无水乙醇沉淀浓缩液中的硫酸化多糖组分,最后通过过滤回收并烘干制得硫酸化多糖,总收率68%,经明胶法测定硫酸化取代度为1.1。
[0065]
实施例5
[0066]
取代度为0.5的硫酸化多糖的制备
[0067]
首先在冰浴上将6ml无水吡啶和2ml氯磺酸混合,室温搅拌30min。然后取纯化后的胞外多糖300mg溶于20ml甲酰胺中,缓慢加入上述氯磺酸吡啶溶液,60℃加热搅拌1h。然后用4mol/l氢氧化钠溶液终止反应并调节体系ph7.5。然后将反应液于5000g离心10min并回收上清液。随后将上清液透析脱盐并减压旋转蒸发浓缩至5ml。然后加入15ml丙酮沉淀浓缩液中的硫酸化多糖组分,最后通过过滤回收并烘干制得硫酸化多糖,总收率60%,经明胶法测定硫酸化取代度为0.5。
[0068]
实施例6
[0069]
硫酸化多糖对小鼠巨噬细胞毒性实验
[0070]
1.小鼠巨噬细胞raw264.7的培养。小鼠巨噬细胞均匀平铺在含有无菌dmem培养基(含10%胎牛血清和100u/ml的青霉素与链霉素)的培养皿中,在含有5%co2、37℃、饱和湿
度的细胞培养箱中培养。
[0071]
2.硫酸化多糖对巨噬细胞的毒性实验。取一定量纯化后胞外多糖和取代度2.0的硫酸化多糖于105℃烘箱烘干至恒重,然后使用pbs缓冲液依次稀释两种多糖至1、2、3、4、5mg/ml,用0.22μm无菌滤膜过滤除菌备用。待生长状态稳定的小鼠巨噬细胞raw264.7铺满96孔板后,分别加入10μl不同浓度的多糖溶液,空白对照组(ck)加入等量pbs缓冲液,继续在细胞培养箱中孵育24h。采用cck-8试剂盒测定多糖对巨噬细胞的毒性,结果见图7。结果显示,当胞外多糖浓度达到500μg/ml时,其仍然对巨噬细胞增殖产生明显的促进作用,而细胞在含有相同浓度的硫酸化多糖培养基中存活率超过95%。
[0072]
实施例7
[0073]
硫酸化多糖对lps诱导的小鼠巨噬细胞炎症反应抑制效果
[0074]
1.采用实施例6的方法培养小鼠巨噬细胞raw264.7。
[0075]
2.采用实施例6的方法稀释取代度2.0的硫酸化多糖。
[0076]
3.待生长状态稳定的小鼠巨噬细胞raw264.7铺满96孔板后,分别加入10μl不同浓度的多糖溶液并孵育1h。然后加入1μl lps溶液至终浓度为1μg/ml,继续孵育24h。采用no一步法试剂盒测定巨噬细胞产生的no含量,并以未添加lps和硫酸化多糖的样品为基准进行归一化处理,结果见图8。结果显示低剂量和高剂量硫酸化多糖均能显著降低巨噬细胞经lps诱导后的no生成。
[0077]
4.待生长状态稳定的小鼠巨噬细胞raw264.7铺满24孔板后,分别加入不同浓度的多糖溶液并孵育1h。然后加入lps溶液至终浓度为1μg/ml,继续孵育24h。然后用trizol试剂盒提取细胞总rna,并将rna逆转录成cdna。采用荧光定量实时pcr(qrt)方法以甘油醛-3-磷酸脱氢酶(gapdh)基因为参比基因,分别测定两种标志性炎症因子(tnf-α和nf-κb)基因的转录水平,归一化处理后结果见图8。结果显示低剂量和高剂量硫酸化多糖均能显著降低巨噬细胞经lps诱导后tnf-α和nf-κb两种基因的转录水平。表明硫酸化多糖对巨噬细胞的炎症反应产生了良好的抑制效果。
[0078]
实施例8
[0079]
比较硫酸化多糖与地塞米松对lps诱导的小鼠巨噬细胞炎症反应的抑制效果
[0080]
1.采用实施例6的方法培养小鼠巨噬细胞raw264.7。
[0081]
2.采用实施例6的方法稀释取代度1.1的硫酸化多糖。
[0082]
3.将地塞米松制剂用pbs缓冲液稀释至1mmol/l,用0.22μm无菌滤膜过滤除菌备用。
[0083]
4.待生长状态稳定的小鼠巨噬细胞raw264.7铺满96孔板后,分别加入10μl不同浓度的多糖溶液和地塞米松溶液并孵育1h。然后加入1μllps溶液至终浓度为1μg/ml,继续孵育24h。采用no一步法试剂盒测定巨噬细胞产生的no含量,并以未添加lps、硫酸化多糖和地塞米松的样品为基准进行归一化处理,结果见图9。结果显示低剂量和高剂量硫酸化多糖均能显著降低巨噬细胞经lps诱导后的no生成,且结果优于地塞米松组。
[0084]
5.待生长状态稳定的小鼠巨噬细胞raw264.7铺满24孔板后,分别加入不同浓度的多糖溶液和地塞米松溶液并孵育1h。然后加入lps溶液至终浓度为1μg/ml,继续孵育24h。然后用trizol试剂盒提取细胞总rna,并将rna逆转录成cdna。采用荧光定量实时pcr(qrt)方法以甘油醛-3-磷酸脱氢酶(gapdh)基因为参比基因,分别测定两种标志性炎症因子(tnf-α
和nf-κb)基因的转录水平,归一化处理后结果见图9。结果显示低剂量和高剂量硫酸化多糖均能显著降低巨噬细胞经lps诱导后tnf-α和nf-κb两种基因的转录水平,且与地塞米松比较,高剂量的硫酸化多糖具有更好的效果。表明与地塞米松相比,硫酸化多糖对巨噬细胞的炎症反应产生了更好的抑制效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1