棉花基因GhGTG1在植物耐冷胁迫方面的应用
棉花基因ghgtg1在植物耐冷胁迫方面的应用
技术领域
1.本发明涉及基因工程领域,具体地说,涉及一种棉花基因ghgtg1在植物耐冷胁迫方面的新应用。
背景技术:
2.植物在生长发育的过程中不可避免的遭遇各种非生物和生物胁迫。其中,冷胁迫是影响植物生长发育和限制地域分布的重要影响因素之一。植物在遭受连续或短暂的冷胁迫后,植物细胞内相关生理生化代谢活动受到影响,光合作用受到抑制,最终导致植物生长发育缓慢,产量降低,品质下降。植物已经发展出一系列复杂的胁迫响应机制来增强对各种非生物和生物胁迫的耐受性。诱导各种胁迫相关基因被认为是植物为增强它对胁迫因子的适应性而采用的机制之一。
3.植物处于冷胁迫条件下会导致细胞膜流动性降低,细胞失水,渗透压升高,诱导植物的应激反应,产生次生代谢物以参与生物和非生物胁迫下的保护功能。aba是植物最重要的次生代谢物之一,在植物生长发育和响应逆境胁迫等方面发挥重要作用。当植物受到外界冷胁迫时,植物中的aba含量迅速增加,导致气孔关闭和诱导应激基因表达以应对应激反应。研究发现,g蛋白偶联受体型(g protein-coupled receptor,gpcr)蛋白是aba受体。棉花基因ghgtg1的基因id为gh_a02g1206,该基因的cds全长为1407bp,分布于细胞膜。
技术实现要素:
4.针对现有技术存在的问题,本发明的目的是提供了一种棉花基因ghgtg1在植物耐冷胁迫方面的新应用,拓展基因ghgtg1的应用范围。
5.本发明的技术方案为:棉花基因ghgtg1在提高植物耐冷能力上的应用,所述棉花基因ghgtg1的cds序列如seq id no.1所示。
6.进一步地,所述应用为在植物中过表达棉花基因ghgtg1,从而提高植物耐冷能力。
7.本发明还公开了一种提高植物耐冷能力的方法,将外源基因利用植物表达载体经农杆菌介导转化到植物中获得耐冷的转基因植物;所述外源基因核苷酸序列如seq id no.1所示或与seq id no.1编码相同蛋白的简并序列。
8.本发明的优点及积极效果为:
9.本发明通过转基因技术获得的转ghgtg1基因的拟南芥纯合系对冷胁迫的耐受性显著提高以及vigs技术获得ghgtg1基因沉默棉花植株,通过冷处理后表型变化、发芽率统计、根长伸长量的比较、逆境胁迫响应基因的表达分析、离子电导率测定、离体叶片失水率测定、叶片相对含水量测定、抗氧化酶活性和氧化剂含量测定等双向验证。以上结果说明,ghgtg1在植物耐冷胁迫中扮演重要角色。
附图说明
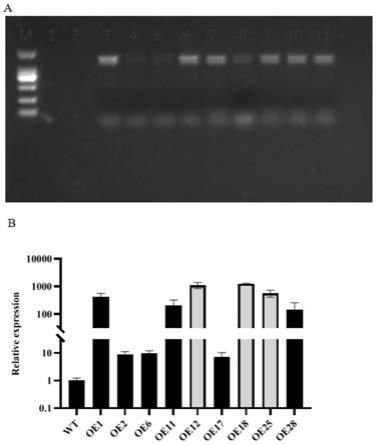
10.图1是本发明实施例提供的转ghgtg1拟南芥t1和t2代的筛选情况。a:pcr检测t1代
转基因拟南芥的转化结果,m为marker 2000,3-11为转化系,1为空白对照(h2o),2为阴性对照(wt);b:通过qrt-pcr分析t2代转基因拟南芥中ghgtg1的表达水平。
11.图2是本发明实施例提供的在0,0.5,1和2μm aba条件下野生型(wt)和转ghgtg1基因系(oe-12,oe-18和oe-25)根长及萌发率比较分析。其中a、b分别为发芽表型及发芽率数据统计,c、d分别为根长表型和根长伸长量变化。
12.图3是本发明实施例提供的在4℃和正常条件下(23℃)条件下野生型(wt)和转ghgtg1基因系(oe-12,oe-18和oe-25)根长和萌发率比较分析。其中a、b分别为发芽表型及发芽率数据统计,c、d分别为根长表型和根长伸长量变化。
13.图4是本发明实施例提供的野生型和转ghgtg1基因拟南芥在冷胁迫下的生理特性。a:冷胁迫下野生型和转基因系的表型;b:冷胁迫下野生型和转基因系存活率;c:冷胁迫下野生型和转基因系中ghgtg1基因表达量变化;d:冷胁迫下野生型和转基因系的离子电导率;
14.图5是本发明实施例提供的冷胁迫下转基因系h2o2和mda的含量示意图。
15.图6是本发明实施例提供的野生型和转基因拟南芥中抗氧化酶sod、cat活性示意图。
16.图7是本发明实施例提供的野生型和转基因拟南芥中逆境胁迫响应基因(atgols3,atlti78,atdreb2a和aterd10)的表达水平示意图。
17.图8是本发明实施例提供的冷胁迫下野生型和转基因拟南芥台盼蓝和dab染色结果示意图。
18.图9是本发明实施例提供的对棉花植株进行vigs注射后白化植株表型以及基因沉默后野生型、空载和基因沉默植株中基因表达量示意图。
19.图10是本发明实施例提供的对进行vigs注射植株进行冷胁迫处理后表型变化示意图。
20.图11是本发明实施例提供的对进行vigs注射植株生理指标的测定。a:冷胁迫前后wt、trv2:00、trv2:ghgtg1棉花植株离体叶片失水率测定;b:冷胁迫前后wt、trv2:00、trv2:ghgtg1棉花植株离子渗透率测定;c:冷胁迫前后wt、trv2:00、trv2:ghgtg1棉花植株叶片相对含水量测定;d:冷胁迫前后wt、trv2:00、trv2:ghgtg1棉花植株叶绿素含量测定;
21.图12是本发明实施例提供的对进行vigs注射植株生化指标的测定。a:冷胁迫前后wt、trv2:00、trv2:ghgtg1棉花植株cat含量示意图;b:冷胁迫前后wt、trv2:00、trv2:ghgtg1棉花植株sod含量示意图;c:冷胁迫前后wt、trv2:00、trv2:ghgtg1棉花植株h2o2含量示意图;d:冷胁迫前后wt、trv2:00、trv2:ghgtg1棉花植株mda含量示意图;
22.图13是本发明实施例提供的对进行vigs注射植株进行冷胁迫处理后dab染色结果示意图。
具体实施方式
23.下述实施例中所使用的方法如无特殊说明,均为常规方法。
24.下述实施例中所用的材料、试剂等,如无特殊说明均可从商业途径获得。
25.实施例1植物转化和过表达ghgtg1拟南芥筛选
26.通过特异性引物(f:gagctcggtacccggggatccatggcgtggggatgggggatctacgag;r:
cttgcatgcctgcaggtcgactcaatcaatagggtgtttgtcagcttggc),克隆目的基因ghgtg1,并构建pwm101-35s:ghgtg1重组载体,转化农杆菌gv3101感受态细胞,通过蘸花法浸染野生型拟南芥(col-0)。用于转化的渗透培养基包含ms 4.3g/l,蔗糖50g/l(5%),mes 0.5g/l,silwet-77 200μl/l(0.02%),6-ba 0.01mg/l,ph 5.7。t0代转基因系在含有50mg/l潮霉素的1/2ms培养基进行阳性筛选,为最大限度地提高发芽率,首先在4℃条件下春化3天打破种子休眠,后将幼苗转移至光照培养箱,条件设定为22℃,16h光照/8h黑暗。选择培养基中培养一周后,当幼苗发育至3-4片子叶时,将幼苗移栽到以土壤为生长培养基的小盆中,幼苗(t0)生长到成熟,收获t1代种子。t1代种子在潮霉素选择培养基上发芽,通过检查选择培养基中幼苗存活与死亡的分离比(3:1)鉴定单拷贝系。然后t2代种子再次在潮霉素选择培养基上萌发,通过检查选择培养基中所有幼苗存活的来鉴定单拷贝系。在t2代幼苗,通过qrt-pcr,对基因ghgtg1(f:tggtgtgaggaaggagcg;r:agggcatgggaaagtgaa)的表达进行株系筛选,得到三个高表达的纯合株系(oe-12,oe-18和oe-25)(图1),t2代幼苗生长成熟后,收获t3代种子,进行表型调查。
27.实施例2发芽率和根系伸长测定
28.检验转基因系和野生型拟南芥种子对aba和冷胁迫的耐受性。t3代种子经消毒,4℃春化,播种至分别含有浓度为0、0.5、1和2μm aba的1/2ms固体培养基,此外播有转基因纯合系及野生型拟南芥种子的1/2ms固体培养基置于4℃进行冷胁迫处理,10天后对野生型和转基因系的发芽率进行统计,结果表明进行aba处理的在0μm aba时,转基因系与野生型萌发率无显著差异,但是随着aba浓度增加,转基因系与野生型种子萌发率降低,并且转基因系的种子萌发率下降更明显(图2中a,b);进行冷胁迫处理的转基因系(oe-12、oe-18、oe-25)萌发率分别为91、86、91%,而野生型萌发率仅为57%,转基因株系萌发率显著高于野生型(图3中a,b)。
29.检验转基因系和野生型拟南芥幼苗对aba和冷胁迫的耐受性。转基因纯合系及野生型拟南芥种子经消毒,4℃春化,播种至1/2ms固体培养基,培养7天后,将幼苗移至分别含有浓度为0、0.5、1和2μm aba的1/2ms固体培养基,进行aba处理,此外移有转基因纯合系及野生型拟南芥幼苗的1/2ms固体培养基置于4℃进行冷胁迫处理,垂直生长7天后测定野生型和转基因拟南芥根长伸长量变化。结果表明,随着外施aba浓度增加,转基因系与野生型根系伸长受抑制增加,但aba对野生型根系伸长抑制相对更少(图2中c,d);进行冷胁迫处理的转基因系(oe-12、oe-18、oe-25)根长伸长量分别为0.47、0.45、0.49mm,野生型根长伸长量为0.26mm,转基因系根长伸长量显著高于野生型(图3中c,d)。
30.实施例3过表达ghgtg1拟南芥对冷胁迫耐受性的响应及离子电导率测定
31.t3纯合转基因系用70%酒精灭菌3min并用无菌水洗涤3次,之后30%次氯酸钠溶液灭菌5min并用无菌水洗涤3次。然后将灭菌的种子铺在1/2ms培养基上,在4℃下春化3天,移至22℃,16h光照/8h黑暗的光周期生长室。8天后,将幼苗移栽到含有营养土的小盆中,其中蛭石与腐殖质的混合比例为1:1。对生长4周的幼苗,在-15℃低温下处理3h,后转移至4℃处理3h,对对照组及处理组的野生型和转基因拟南芥的离子电导率进行测定,并记录野生型和转基因拟南芥的表型(图4中a)。在正常条件下,转基因系与野生型各项指标没有明显差异,然而在-15℃冷胁迫处理3h并恢复生长后,三个转基因系(oe-12、oe-18、oe-25)的存活率分别为51.2、68.9、44.5%,而野生型的存活率仅为22%(图4中b)。并且通过qrt-pcr对
冷处理后的转基因系以及野生型检测发现,3个转基因系的ghgtg1的表达水平相对于野生型有显著升高(图4中c)。
32.离子电导率(il)测定,取处理和对照组样品的转基因株系和野生型拟南芥大小一致的10片叶片,用ddh2o2冲洗,放入盛有10ml ddh2o2的无菌试管中,对照组中未放入叶片,室温下孵育12h,颠倒摇匀试管,使用电导率仪(ec)测得电导率t1,对照组为t2,而后将叶片煮沸30min,冷却至室温测得电导率t3,对照组为t4,离子电导率(il)=(t1-t2)/(t3-t4)。在正常条件下,转基因系(oe-12、oe-18、oe-25)与野生型离子渗透率较低并且无明显差异,但在冷胁迫处理后,植物叶片受损,转基因系与野生型离子渗透率都显著增加,但是转基因系离子渗透率显著低于野生型(图4中d),说明ghgtg1基因的过表达增加了植物对冷胁迫的耐受性。
33.实施例4过氧化氢酶(cat)、超氧化物歧化酶(sod)、过氧化氢(h2o2)、丙二醛(mda)的提取和测定
34.从野生型及过表达拟南芥的处理组和对照组中,收获0.1g新鲜叶样品并速冻于液氮中,-80℃保存备用。采用solarbio(solarbio,beijing,china)试剂盒,按照说明书中的具体步骤进行酶检测。在正常条件下,转基因系的sod,cat,mda和h2o2活性与野生型无显著差异。然而,对转基因系和野生型进行冷胁迫处理后,氧化剂与抗氧化剂水平都显著升高,并且,对于氧化剂sod和cat,转基因系相对于野生型显著升高(图5),对于抗氧化剂mda和h2o2,转基因株系相对于野生型显著降低(图6)。
35.实施例5细胞损伤鉴定
36.利用台盼蓝染色实验观察冷胁迫处理后植株的细胞损伤情况。采集-15℃冷胁迫处理前(0h)后(3h)转基因系(oe-12、oe-18、oe-25)与野生型拟南芥叶片,浸泡于配制好的台盼蓝溶液中,放置于沸水浴2分钟进行染色,冷却后取出被染色叶片放置于水合氯醛溶液(2.5g/ml)中进行脱色,每日更换脱色液并对实验结果拍照记录。每组三片叶片至少进行3个生物复制。dab染色实验使用南京生物工程研究所的dab显色试剂盒。按说明书配制dab显色工作液。将冷处理前后转基因系与野生型拟南芥叶片在制备的dab显色液中显色,时间控制在8-12h。显色完成后先用无水乙醇进行褪色2-3次,每次30分钟。再用70%酒精继续洗去叶色2-3次,每次30分钟。每组三个叶片重复三次。台盼蓝染色实验结果显示,在正常条件下,转基因系和野生型叶片染蓝面积较小。然而,转基因系(oe-12、oe-18和oe-25)叶片经过冷胁迫处理后的蓝色区域明显少于野生型叶片。因此冷胁迫条件下转基因株系拟南芥细胞受到的损伤比野生型小(图8中a)。dab染色显示,在正常条件下,过表达系和野生型叶片中ros积累量很少,叶片褐色外观不明显。在冷胁迫处理后,过表达与野生型拟南芥叶片都呈现褐色,但是过表达拟南芥叶片的褐色区域明显小于野生型,并且染色深度较浅,在相同冷胁迫条件下,转基因株系受到的损伤较小(图8中b)。
37.实施例6拟南芥rna提取及aba,逆境胁迫响应基因qrt-pcr分析
38.分析转基因拟南芥中逆境胁迫响应基因的表达,对生长3-4周的幼苗,进行冷胁迫处理,取对照组(0h)及处理组(-15℃3h)的野生型和转基因拟南芥的适量叶片样品;使用rna试剂盒(tiangen)提取样品总rna。利用琼脂糖凝胶电泳和nanodrop 2000分光光度计测定每个rna样品的质量和浓度。利用反转录试剂盒transcript-all-in-one first-strand cdna synthesis supermix(transgen biotech,beijing,china)将提取的rna反转录成
cdna,使用荧光染料(chamq universal sybr qpcr master mix,vazyme),以拟南芥atactin2(f:ttgtgctggattctggtgatgg;r:ccgctctgctgttgtggtg)作为内参基因,通过逆境胁迫响应基因的特异性引物,进行qrt-pcr分析。qrt-pcr反应体系:总体积为20μl,包含10μl sybr荧光染料,2μl cdna模板,6μl ddh2o2和2μl引物(上下游引物各1μl)。pcr反应程序为:95℃10min;循环阶段:95℃5s,60℃30s和72℃30s,40个循环;溶解曲线阶段:95℃15s,60℃1min,95℃30s和60℃15s。采用2
‑△△
ct
法计算相对表达量,每个样品进行3次生物学重复和3次技术重复。rt-qpcr结果显示,转基因株系经冷胁迫处理后,gols3,lti78,dreb2a和erd10的表达量在转基因株系中较高(图7)。因此,gh_a02g1206(ghgtg1)在应对冷胁迫中具有关键作用。
39.实施例7利用vigs验证gh_a02g1206(ghgtg1)在棉花抵御冷胁迫中的作用
40.提取陆地棉中棉所12rna并反转录为cdna作为模板,利用特异性引物进行pcr扩增,构建trv2:ghgtg1 vigs遗传转化载体,通过正向引物(cgagctccagttgtacgttcagtgcaa)和反向引物(cctcgagcaatgcagcatctattccaa)扩增gh_a02g1206(ghgtg1)基因,并连接到用xba1和bamh1双酶切过的trv2:00载体质粒上。将构建好的trv2:ghgtg1 vigs遗传转化载体转化到农杆菌lba4404中,以trv2:00农杆菌作阴性对照,trv2:pds农杆菌作阳性对照,进行vigs注射前需将农杆菌菌液od值上升到1.5。
41.采用陆地棉中棉所12作为vigs注射材料。种子浸泡后,转移到滤纸上进行萌发,待种子长出两片子叶后移栽到充满霍格兰养分的水培装置中。温室条件白天28℃,晚上25℃,16小时/8小时光照/黑暗循环。幼苗两片子叶平展后进行vigs注射,利用注射器将子叶背面划伤,将菌液注射满整片子叶,完成注射后将棉花置于黑暗条件下生长24小时,之后将植株转移至正常条件下培养,注射pds约10天后出现白化表型,20天后白化表型仍然明显,说明基因沉默成功,并且效果稳定(图9中a)。利用rt-qpcr检测gh_a02g1206(ghgtg1)在wt、trv2:00和trv2:ghgtg1中的表达,结果显示:ghgtg1基因在wt和trv2:00中的表达没有明显变化,但在trv2:ghgtg1植株中的表达显著降低且低于wt和trv2:00,说明基因沉默成功(图9中b)。待植株长出三片真叶后将植株转移到4℃生长室进行冷胁迫处理,并在0和12小时处理时间采集叶片样本。采样后,立即在液氮中收集叶片样本,并存储在-80℃冰箱中备用。
42.实施例8基因沉默棉花抵御冷胁迫表型鉴定
43.对wt、trv2:00、trv2:ghgtg1进行冷胁迫处理前,对照条件下,wt、trv2:00、trv2:ghgtg1长势一致。在低温胁迫处理12h后,wt与trv2:00空载体之间没有显著差异,但ghgtg1沉默基因植株遭受的伤害比wt和空载体严重(图10中a)。沉默后植株茎秆软化,植株开始出现轻微的倒转迹象,说明基因沉默后植株的抗寒性下降。
44.实施例9gh_a02g1206(ghgtg1)基因沉默棉花植株在冷胁迫条件下生理指标变化测定
45.测定冷处理0h和12h时wt、trv2:00、trv2:ghgtg1的离体叶片失水率(elwl)、叶片相对含水量(rlwl)、离子渗透性(cms)和叶绿素含量(spad)。在处理后0h和12h进行生化指标测定,其中包含超氧化物歧化酶(sod)、过氧化氢酶(cat)、过氧化氢(h2o2)和丙二醛(mda),采集冷处理0h和12h的wt、trv2:00、trv2:ghgtg1叶片样品研磨成粉末状,采用solarbio(solarbio,beijing,china)试剂盒按照说明书中的具体步骤进行酶测定。
46.正常条件下,wt、trv2:00和trv2:ghgtg1植株的离体叶片失水率(elwl)差异不显
著,但经过冷胁迫处理后,trv2:ghgtg1棉花的离体叶片失水率显著高于wt和trv2:00,说明基因沉默后,植物持水能力下降(图11中a)。冷胁迫后进行离子渗透率测定,trv2:ghgtg1植株的离子渗透率明显高于wt和trv2:00,说明冷胁迫后trv2:ghgtg1植株的细胞膜损伤更严重(图11中b)。与wt和trv2:00植株相比,经冷胁迫处理后,沉默植株的相对含水量显著降低(图11中c)。利用spad仪测定棉花叶片中叶绿素的相对含量,我们观察到,在冷胁迫下,trv2:ghgtg1植株的叶绿素含量比wt和trv2:00植株的叶绿素含量降低更多,说明冷胁迫条件下wt和trv2:00生长状况好于基因沉默植株(图11中d)。从结果我们可以看出ghgtg1沉默后植株抗抗冷胁迫能力下降。
47.对冷胁迫处理后的wt、trv2:00和trv2:ghgtg1植株进行了氧化剂和抗氧化剂活性测定。在正常条件下,trv2:ghgtg1植株的sod,cat,mda和h2o2活性与wt和trv2:00无显著差异。然而,进行冷胁迫处理后,氧化剂与抗氧化剂水平都显著升高,并且,对于sod和cat含量,trv2:ghgtg1显著低于wt和trv2:00,对于mda和h2o2,trv2:ghgtg1显著高于wt和trv2:00(图12)。结果表明当gh_a02g1206(ghgtg1)基因被沉默后对植物施加冷胁迫时,基因沉默植株遭受到伤害更为严重,gh_a02g1206(ghgtg1)基因在抗冷胁迫中发挥着重要作用。
48.实施例10dab对冷胁迫条件下gh_a02g1206(ghgtg1)基因沉默植株染色
49.采集冷处理wt、trv2:00、trv2:ghgtg1棉花植株的0h和12h叶片,利用dab染色试验验证冷胁迫下叶片受损伤情况,方法参照过表达ghgtg1拟南芥dab染色实验。dab染色显示,在正常条件下,trv2:ghgtg1和wt、trv2:00棉花叶片中ros积累量很少,叶片褐色外观不明显。在冷胁迫处理后,trv2:ghgtg1棉花植株叶片呈现褐色区域,但是wt和trv2:00植株叶片褐色不明显,说明在相同冷胁迫条件下,trv2:ghgtg1植株受损伤更严重(图13)。
50.本发明比较了野生型拟南芥(wt)及过表达ghgtg1转基因拟南芥对冷胁迫的耐受性,比较冷胁迫处理后的植株,结果显示冷胁迫下野生型拟南芥表现出明显的叶片失绿,生长发育受阻,而过表达的转基因系显示出更好的生长态势,还比较了野生型棉花(wt),空载植株(trv2:00)及基因沉默植株(trv2:ghgtg1)对冷胁迫的耐受性,结果显示冷胁迫下基因沉默形态及植株生理生化指标更差,表明该基因对植物耐冷胁迫起到显著的作用。
51.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1