一种非酒精性脂肪性肝病肝脂肪变性模型的构建方法及其应用
1.本发明属于细胞培养技术领域,具体涉及一种非酒精性脂肪性肝病肝脂肪变性模型的构建方法及其应用。
背景技术:
2.非酒精性脂肪性肝病(non-alcoholic fatty liver disease,nafld)是指除外酒精和其他明确的损肝因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,其病理进程包括有脂肪变性,非酒精性脂肪性肝病、非酒精性脂肪性肝炎及后期地肝硬化及肝细胞肝癌等。当前,虽然已有大量的研究阐述了nafld的发病、发展机制,并筛选制定了一定、有效的治疗手段,但目前针对该疾病的具体分子作用机制仍未完全阐明,且尚未有批准针对该类疾病的特效药物,因此针对nafld疾病过程及机制需进一步深入研究。而脂肪变性作为 nafld疾病早期地进展阶段及病理特征,能够贯穿与nafld疾病的每个阶段,对于其早发现、早干预能够有效地逆转nafld疾病向非酒精性脂肪性肝炎及肝硬化和肝癌等恶性阶段进展。因此,深入研究阐明nafld脂肪变性阶段疾病发生发展分子机制,从中发现并筛选有效地治疗靶点,能够从早期阶段有效地避免nafld的进展及恶化。而为了充分、有效地研究nafld肝脂肪变性,肝脂肪变性模型的构建成为了阐明该疾病发生及进展机制的有效手段。
3.而当前对于肝脂肪变性模型的构建主要包括以下几类:
4.1.动物基因构建鼠和/或饮食诱导模型,该类模型通过构建ob/ob(瘦素蛋白基因缺陷)、 db/db(瘦素蛋白受体基因缺陷)或foz/foz(alms1基因突变或缺陷)鼠,诱导形成具有肥胖,胰岛素抵抗及脂肪变性特征,并经再次高脂、高糖、高胆固醇及蛋氨酸和胆碱缺乏等饮食诱导形成的nafld或nash模型。基因构建鼠如ob/ob和db/db鼠,虽能在表型上构建出nafld的脂肪变性特征,但在nafld或nash病人的检测结果中显示,该类疾病与瘦素蛋白基因的突变或缺陷相关性较弱,因此通过突变或缺陷基因构建的模型与临床nafld 和nash疾病机制不匹配;而高脂、高糖、高胆固醇及蛋氨酸和胆碱缺乏等不同饮食诱导的模型中同样在代谢功能,基因表达及疾病表征等方面与临床nafld和nash疾病存在差异,因此用于疾病过程和机制的研究不具有特异性。
5.2.体外二维或三维培养构建模型,利用原代肝细胞或永生化肝细胞系如hepg2、huh-7 和aml-12等细胞在二维体系或三维微粒体系构建nafld模型,表征为脂肪变性及炎症表达等。虽然体外的这些模型能够构建出肝组织的复杂结构并能通过细胞间相互作用阐明脂肪肝病疾病进程的分子机制。但单纯的原代细胞在体外难以维持较长时间的培养,且在体外培养过程中原代肝细胞会随着培养时间的延长,细胞组织特异性功能发生改变,因此单纯原代肝细胞培养构建的模型用于疾病过程及机制的研究缺乏重复性及实验结果的不准确性。而永生化肝细胞,对比于正常肝细胞而言其相关基因、蛋白及代谢功能表达存在差异,所以此类细胞构建的模型与临床nafld和nash疾病同样存在差异,因此用于疾病过程
和机制的研究不具有特异性,使研究结果同样缺乏准确性。
6.同时相对于脂质代谢紊乱的肝脂肪变性研究,基于细胞构建的模型具有相对于动物模型的明显优势,如体外易于基因的干扰、药物的处理,以及较低的经费及较短的实验周期等。因此基于以上动物基因突变或缺陷、饮食及原代和永生化肝细胞模型构建的优缺点,寻找一种成型率高,重复性能好,体外原代肝细胞维持时间长功能保存完整的肝脂肪变性模型的构建方法,将为深入全面的研究肝脂肪变性或nafld进展机制奠定基础,并为临床筛选防治肝脂肪变性或nafld药物提供研究基础。
技术实现要素:
7.本发明的目的在于一种基于细胞构建的一种非酒精性脂肪性肝病肝脂肪变性模型的构建方法。
8.本发明所采取的技术方案是:
9.本发明的第一方面,提供一种非酒精性脂肪性肝病模型构建的方法,包含以下步骤:
10.s1:将原代肝细胞贴附培养;
11.s2:将肝星状细胞或人皮肤成纤维细胞消化后离心并弃去上清;
12.s3:将步骤s2所得肝星状细胞或人皮肤成纤维细胞接种至s1培养的肝细胞中诱导培养。
13.在本发明的一些实施方式中,步骤s1的具体操作为:将重悬的原代肝细胞按7.5~10.5
ꢀ×
104/cm2的密度贴附培养。
14.在本发明的一些优选实施方式中,步骤s1的具体操作为:将重悬的原代肝细胞按8.5
×ꢀ
104/cm2的密度贴附培养。
15.在本发明的一些实施方式中,所述贴附培养的容器被包被液包被。
16.在本发明的一些实施方式中,所述包被液主要成分选自胶原蛋白、明胶、多聚赖氨酸、层粘连蛋白、玻表粘连蛋白的一种或多种。
17.在本发明的一些优选实施方式中,所述胶原蛋白为鼠尾胶原i。
18.在本发明的一些实施方式中,步骤s1所述的贴附培养的培养液为包含胰岛素的低糖培养液。
19.在本发明的一些实施方式中,所述胰岛素的浓度为3.125~9.375μg/ml,优选为 6.25μg/ml。
20.在本发明的一些实施方式中,所述低糖培养液为dmem低糖培养液。
21.在本发明的一些实施方式中,所述包含胰岛素的低糖培养液中还包含添加剂,所述添加剂包含双抗、转铁蛋白、亚硒酸、bsa、亚油酸、hepes、fbs和地塞米松中的至少一种。
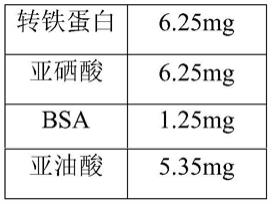
22.在本发明的一些优选实施方式中,所述包含胰岛素的低糖培养液的配方为:以dmem (低糖,1g/l)为基础培养液,其中,双抗占培养液体积为0.5~1.5%、胰岛素的浓度为 3.125~9.375μg/ml、转铁蛋白的终浓度为3.125~9.375μg/ml、亚硒酸的终浓度为3.125~9.375μg/ml、bsa的终浓度为0.625~1.875μg/ml、亚油酸的终浓度为2.675~7.925μg/ml、 hepes的终浓度为10~20mm、fbs占培养液体积为5~15%以及地塞米松的终浓度为 0.01~0.50μg/ml。
23.在本发明的一些实施方式中,所述包含胰岛素的低糖培养液的配方为:以dmem(低糖,1g/l)为基础培养液,其中,双抗占培养液体积为1%、胰岛素的浓度为6.25μg/ml、转铁蛋白的终浓度为6.25μg/ml、亚硒酸的终浓度为6.25μg/ml、bsa的终浓度为1.25μg/ml、亚油酸的终浓度为5.35μg/ml、hepes的终浓度为15mm、fbs占培养液体积为10%以及地塞米松的终浓度为0.4μg/ml。
24.在本发明的一些实施方式中,步骤s3所述的诱导培养的分化培养液为包含胰岛素的高糖培养液。
25.在本发明的一些实施方式中,所述胰岛素的浓度为3.125~9.375μg/ml;优选地,所述胰岛素的浓度为6.25μg/ml。
26.在本发明的一些实施方式中,所述高糖培养液为dmem高糖培养液。
27.在本发明的一些实施方式中,所述包含胰岛素的高糖培养液中还包含添加剂,所述添加剂包含双抗、转铁蛋白、亚硒酸、bsa、亚油酸、hepes、fbs、地塞米松和胰高血糖素中的至少一种。
28.在本发明的一些实施方式中,所述诱导培养的分化培养液配方为:以高糖dmem为基础培养液,其中,双抗占培养液体积为0.5~1.5%、胰岛素的终浓度为3.125~9.375μg/ml、转铁蛋白的终浓度为3.125~9.375μg/ml、亚硒酸的终浓度为3.125~9.375μg/ml、bsa的终浓度为0.625~1.875μg/ml、亚油酸的终浓度为2.675~7.925μg/ml、hepes的终浓度为 10~20mm、fbs占培养液体积为5~15%以及地塞米松的终浓度为0.01~0.50μg/ml以及胰高血糖素的终浓度为0.001~0.010μg/ml。
29.在本发明的一些实施方式中,所述诱导培养的分化培养液配方为:以高糖dmem为基础培养液,其中,双抗占培养液体积为1%、胰岛素的终浓度为6.25μg/ml、转铁蛋白的终浓度为6.25μg/ml、亚硒酸的终浓度为6.25μg/ml、bsa的终浓度为1.25μg/ml、亚油酸的终浓度为5.35μg/ml、hepes的终浓度为15mm、fbs占培养液体积为10%以及地塞米松的终浓度为0.4μg/ml以及胰高血糖素的终浓度为0.007μg/ml。
30.在本发明的一些实施方式中,步骤s1中所述的原代肝细胞来源于人、大鼠、小鼠或兔子。
31.在本发明的一些实施方式中,步骤s2所述的消化条件为:0.25%胰酶(含edta)室温环境下消化2~3min。
32.在本发明的一些实施方式中,步骤s3中所述的肝星状细胞或人皮肤成纤维细胞与肝细胞的数目比为1:(1~6)。
33.在本发明的一些实施方式中,步骤s3中所述的肝星状细胞或人皮肤成纤维细胞与肝细胞的数目比为1:5。
34.在本发明的一些实施方式中,其特征在于,步骤s1中所述的贴附培养条件为36~38℃; 20~28h。
35.在本发明的一些实施方式中,其特征在于,步骤s3中所述的诱导培养的条件为36~ 38℃;10~15天。
36.本发明的第二方面,提供本发明第一方面所述的方法构建的非酒精性脂肪性肝病模型在 (i)或(ii)中的应用:
37.(i)用于肝脂肪变性发病过程、机制及非酒精性脂肪性肝病疾病进程的研究;
38.(ii)筛选用于预防和治疗非酒精性脂肪性肝病和/或肝脂肪变性疾病药物中的应用。
39.本发明的第三方面,提供一种筛选非酒精性脂肪性肝病药物的方法,使用本技术第一方面所述的方法制备的非酒精性脂肪性肝病模型进行药物筛选。
40.本发明的有益效果是:
41.本发明提供一种基于细胞构建的一种非酒精性脂肪性肝病肝脂肪变性模型的构建方法,实验结果表明,在共培养诱导体系下,可以使肝细胞脂滴形成并逐渐增多融合形成大脂滴呈现脂肪沉积。肝细胞脂肪沉积的形成可作为肝脂肪变性模型。
42.相比于动物基因或饮食方法构建模型,本发明构建的模型诱导周期短,成本更加低廉且更接近于临床疾病特征;相比于单纯原代肝细胞培养及3d微球培养模式,本发明方法肝细胞体外培养持续时间较长,模型稳定、成型率高、重复性好且无需生物材料的协助。
43.通过本发明构建方法得到的模型具有典型的脂肪变性特征,且其具有广阔的应用前景,如用于肝脂肪变性或nafld疾病过程及进展机制的研究,或用于临床筛选防治肝脂肪变性或nafld药物以临床用药效果评价或预后等。
附图说明
44.图1为显微镜下肝细胞培养、分化观察。
45.图2为油红o染色检测肝细胞脂肪沉积。
46.图3为pcr检测srebp1基因表达。图3a:原代肝细胞与大鼠肝星状细胞共培养中 srebp1的表达;图3b:原代肝细胞与正常人皮肤成纤维细胞共培养中srebp1的表达。
47.图4为pcr检测模型肝细胞代谢酶相关基因表达。图4a:原代肝细胞与大鼠肝星状细胞共培养中肝细胞代谢酶cyp3a、cyp1a和cyp2e基因的表达;图4b:原代肝细胞与正常人皮肤成纤维细胞共培养中肝细胞代谢酶cyp3a、cyp1a和cyp2e基因的表达。
48.图5为显微镜下不同批次肝细胞培养、分化观察。
49.图6为油红o染色检测hepg2/huh-7与lx2共培养诱导的脂肪沉积。
具体实施方式
50.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
51.本实施例中所使用的细胞、材料和试剂等,如无特别说明,为从商业途径得到的试剂和材料。
52.dmem高糖培养基购自gbico,货号为c11995500cp;dmem低糖培养基购自gbico,货号为c11885500bt;hbss购自gbico,货号为c14175500bt;胶原酶iv购自coolaber,货号为cc3801g-1g;70目过滤网购自becton,dickinson and company,货号为352350;台盼蓝购自solarbio,货号为t8070-25g;鼠尾胶原i购自corning,货号为354236;fbs购自 gbico,货号为10099-141;双抗购自gbico,货号为15140-122;hepes购自gbico,货号为15630-080;地塞米松购自solarbio,货号为d8040;its购自cyagen,货号为itss
‑ꢀ
10201;胰高血糖素购自源
叶生物,货号为s81391-1mg;hsc-t6购自中国科学院典型培养物保藏委员会昆明细胞库;hff-1购自中国科学院上海生命科学研究院细胞资源中心。
53.实施例1大鼠原代肝细胞提取并诱导培养
54.(1)将sd大鼠(200-250g,购于南方医科大学实验动物中心)麻醉,剃毛,固定,腹部75%酒精消毒;开腹暴露肝脏、门静脉及下腔静脉;将头皮针插入门静脉,开泵引流 hbss灌流液,胶原酶iv灌流液至肝脏发白、肿胀后结束灌流,摘取肝脏,去除胆囊等组织,将摘取的肝脏放入装有胶原酶iv灌流液的培养皿中撕破肝脏表面包膜并轻轻晃动肝脏清洗出消化的肝细胞,70目滤网过滤,4℃50g离心2min;弃去上清加入分离培养基重悬,重复离心、重悬2遍,弃上清得到大鼠原代肝细胞;其中分离培养基的配方见表1,其中 its添加剂在提供高胰岛素环境的同时,试剂中的胰岛素及其他成分能够促进细胞生长、增殖,保障细胞达到最佳的生长状态。
55.表1分离培养基的成分及含量
[0056] 体积终浓度dmem(低糖)44.5ml/fbs5ml/双抗0.5ml/
[0057]
(2)将步骤(1)得到的肝细胞用贴附培养基进行重悬,进行台盼蓝染色并细胞计数,按8.5
×
104/cm2数接种于鼠尾胶原i包被的培养皿,将接种的肝细胞于37℃中孵育培养4h, pbs清洗2遍后再次加入贴附培养基于37℃中孵育培养20h;其中贴附培养基的配方见表2 和表3。
[0058]
表2贴附培养基的成分及含量
[0059] 体积终浓度dmem(低糖)43.23ml/fbs5ml/双抗0.5ml/hepes0.75ml15mm地塞米松20μl0.04μg/mlits0.5ml/
[0060]
表3 its细胞培养添加物(100x)成分及含量
[0061][0062]
[0063]
实施例2肝脂肪变性模型的构建与鉴定
[0064]
(1)共培养肝脂肪变性模型构建
[0065]
将在完全培养基(配方见表4)中密度扩增至90%左右的hsc-t6或hff-1细胞经0.25%胰酶(含edta)消化2~3min、800g离心5min、重悬并计数,按1:5比例将计数的hsc
‑ꢀ
t6或hff-1细胞加入实施例1步骤(2)中培养的原代肝细胞,加入分化培养基于37℃中诱导10d构建肝脂肪变性模型,在诱导期间用显微镜观察分化、培养情况。其中诱导培养的分化培养液配方见表5。
[0066]
表4完全培养基的成分及含量
[0067]
组分体积dmem(高糖)44.5mlfbs5ml双抗0.5ml
[0068]
表5分化培养基的成分及含量
[0069][0070]
镜下观察结果如图1所示:肝细胞内出现明亮的近圆形的颗粒沉积,随着诱导时间的持续,近圆形颗粒逐渐增多并融合成大而圆的颗粒,表明共培养下分化培养基诱导能够促进颗粒在肝细胞内形成并沉积。
[0071]
(2)肝脂肪变性模型表征鉴定
[0072]
将实施例2步骤(1)中得到的肝脂肪变性细胞经pbs清洗后,进行油红o染色,具体为:首先oro fixative固定液固定20~30min,蒸馏水洗2遍,60%异丙醇浸洗5min,后加入配制的oro stain浸染10~20min,再经水洗2~5遍直至无多余浸染液,之后再加入 mager苏木素染色液复染核1~2min,水洗2~5遍去除苏木素染液,入oro buffer 1min弃去,蒸馏水覆盖并再显微镜下观察、拍照。
[0073]
染色结果如图2所示:细胞内出现大小不一橙红色或橘红色中性脂肪颗粒,随着时间诱导时间的延长,脂滴逐渐增多并融合成较大的脂滴颗粒,表明该共培养体系诱导下肝细胞出现脂肪变性。
[0074]
(3)肝脂肪变性模型肝细胞脂肪合成相关基因鉴定
(hepg2和huh-7)出现脂肪变性一样的效果,但永生化的细胞对比于正常肝细胞而言其相关基因、蛋白及代谢功能表达存在差异,所以此类细胞构建的模型与临床nafld和nash 疾病存在差异,因此用于疾病过程和机制的研究不具有特异性,使研究结果缺乏准确性。
[0090]
上述具体实施方式对本发明作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1