一种末端脱氧核糖核苷酸转移酶TdT的纯化方法与流程
一种末端脱氧核糖核苷酸转移酶tdt的纯化方法
技术领域
1.本发明涉及酶纯化技术领域,具体地,涉及一种末端脱氧核糖核苷酸转移酶tdt的纯化方法。
背景技术:
2.dna聚合酶是必不可少的生物催化剂,负责dna复制和重组以及核酸的修复和维持。这些酶属于根据其序列同源性和系统发育关系建立的六个家族(a、b、c、d、x和y)之一。构成a家族的聚合酶参与dna修复和复制,主要成员包括大肠杆菌dna聚合酶i的klenow片段、水生栖热菌dna聚合酶以及t7 rna和dna聚合酶;此外,b和c家族的成员主要参与dna复制以及d家族聚合酶,但后者仅存在于古细菌中;另一方面,x和y家族聚合酶分别负责dna修复和跨损伤dna合成。tdt(terminal deoxyribonucleotidyl transfer ase,末端转移酶)是一种x家族聚合酶,它在ssdna引物的3’末端掺入核苷酸,而不依赖于模板的存在。
3.tdt与复制型dna聚合酶的主要不同之处在于它只需要一个单链dna起始分子来启动合成。在不存在模板的情况下,tdt催化脱氧核糖核苷酸在寡聚或聚脱氧核糖核苷酸引发剂的3-prime-oh末端聚合。基本所有的dna聚合酶都很依赖二价金属辅助因子的存在来实现催化活性,主要是mg
2+
。tdt对阳离子没有明显的偏好,mg
2+
、zn
2+
、co
2+
、和mn
2+
都可满足tdt的活性需求。不同的阳离子辅酶会使tdt有不同的活性,以datp加尾聚合为p(da)4-50为例,最终相对产率从高到低为mg
2+
》zn
2+
》co
2+
》mn
2+
。末端转移酶在mg
2+
存在的条件下,选择3
’‑
oh端单链dna为引物加成核苷酸,在co
2+
存在的条件下,选择3
’‑
oh端双链dna为引物加成核苷酸,形成多聚核苷酸尾。
4.在正常情况下,tdt仅存在于胸腺和骨髓中,在胸腺细胞中浓度最高。根据这一观察,有人假设tdt在免疫分化中发挥作用,至少在t细胞系列中如此。同时tdt存在于淋巴细胞白血病细胞中。tdt不仅在免疫系统中具有重要作用,而且对某些淋巴瘤的诊断也具有重要应用。tdt在淋巴母细胞淋巴瘤/白血病中阳性,是诊断淋巴母细胞淋巴瘤/白血病的重要依据之一。tdt在许多肿瘤、非肿瘤疾病中的表达均有指导意义,正确和充分认识tdt的表达谱,可使tdt阳性的肿瘤诊断更加精准。
5.tdt酶蛋白的常见应用有tunel及race。tunel(terminal deoxynucleotidyl transferase-mediated dutp-biotin nick end labeling,原位末端转移酶标记技术)其原理为细胞在凋亡时,会激活一些dna内切酶,这些内切酶会切断核小体的基因组dna,此时dna的3-oh即会暴露出来,在tdt的催化下其会加上标记有ftic标记的dutp(fluorescein-dutp),从而可以通过荧光显微镜或流式细胞仪进行检测。5’race原理为(rapid-amplification of cdna ends)在使用基因特异性引物(gsp)与mrna结合,并且逆转录生成特定的单链cdna后,就需要使用末端脱氧核苷酸转移酶(tdt)添加相同的字符串cdna的3’端的核苷酸,称为均聚物尾巴。其中tdt的非模板依赖性至关重要,可以催化在单链dna的3’羟基端加上dntp,两种不同的dna分子加上不同的但可以互补的即a和t、c和g的尾巴后,经过退火或复性,两种尾巴便可以借助互补作用连接在一起)。在cdna文库建立时,这种加尾
方法是使cdna插人载体中的常用方法之一。关于tdt已有许多文献报告,大部分都集中在对tdt表达量高低及相应病理情况的研究tdt的相关应用。
技术实现要素:
6.本发明的目的是克服现有技术的上述不足,提供一种末端脱氧核糖核苷酸转移酶tdt的纯化方法。
7.本发明的第一个目的是提供一种蛋白洗脱液。
8.本发明的第二个目的是提供所述的蛋白洗脱液在纯化末端脱氧核糖核苷酸转移酶tdt中的应用。
9.本发明的第三个目的是提供一种末端脱氧核糖核苷酸转移酶tdt的纯化方法。
10.本发明的第四个目的是提供一种纯化末端脱氧核糖核苷酸转移酶tdt的试剂盒。
11.为了实现上述目的,本发明是通过以下方案予以实现的:
12.一种蛋白洗脱液,所述蛋白洗脱液中含有20~25mm咪唑、20~25mm trisbase和0.4~0.5m nacl,ph为7.0~8.0。
13.优选地,所述蛋白洗脱液中含有20mm咪唑、25mm trisbase和0.5m nacl,ph为8.0。
14.所述的蛋白洗脱液在纯化末端脱氧核糖核苷酸转移酶tdt中的应用。
15.一种末端脱氧核糖核苷酸转移酶tdt的纯化方法,具体包括以下步骤:
16.s1:菌株发酵:重组菌株,发酵,收集发酵产物,收集菌体,重悬菌体,破碎菌体,收集上清液;所述重组菌株为重组有重组载体的菌株,所述重组载体为pet-28a载体的1526bp位置插有mbp-tdt片段,所述mbp-tdt片段的核苷酸序列如seq id no:1所示;
17.s2:第一次镍柱纯化:2~3倍柱体积的20~40mm咪唑平衡后,将步骤s1上清液上样,流速为5~10ml/min,上样后,使用30~40mm咪唑洗杂,洗杂流速4~10ml/min,洗杂后,使用所述的蛋白洗脱液将蛋白洗脱,得到蛋白溶液;
18.s3:tev酶切,收集步骤s2得到的蛋白溶液,采用透析方式换液;
19.所述蛋白溶液与透析溶液的体积比为80~100:5000,搅拌换液3~10h;
20.重复一次;得到第二次换液的蛋白溶液,测定蛋白浓度,用tev内切酶酶切蛋白,蛋白溶液与tev内切酶的质量比为1:10,得到酶切后的蛋白溶液;
21.s4:第二次镍柱纯化,2~3倍柱体积的试剂平衡后,将步骤s3得到的酶切后的蛋白溶液以5~10ml/min的流速上样;淋洗2~5倍柱体积;使用20~25mm咪唑洗脱,监测a280 nm吸收峰,待峰值有明显升高时收集洗脱液,得到蛋白溶液;
22.s5:q柱纯化,将步骤s4得到的蛋白溶液以3~5ml/min流速经过q柱,收集流穿液,即得到无核酸残留的tdt蛋白溶液。
23.优选地,步骤s1中,重悬菌体中,重悬试剂与菌体比例为5ml~10ml:1g。
24.更优选地,步骤s1中,重悬试剂与菌体比例为10ml:1g。
25.优选地,步骤s1中,于4~10℃、800~1000bar条件下压力破碎5~10min,收集破碎液,于4~10℃、8000~10000rpm条件下离心10~20min,收集上清液。
26.更优选地,步骤s2中,于4℃、900bar条件下压力破碎10min,收集破碎液,于4℃、12000rpm条件下离心10min,收集上清液。
27.优选地,步骤s2中,2倍柱体积的40mm咪唑平衡后,将步骤s2上清液经上样,流速为
5ml/min,上样后,使用40mm咪唑洗杂,洗杂流速4ml/min,洗杂后,使用洗脱液将蛋白洗脱,得到蛋白溶液。
28.优选地,步骤s2中,洗杂时间4~16h。
29.更优选地,步骤s2中,洗杂时间16h。
30.优选地,步骤s3中,所述蛋白溶液与透析溶液的体积比为1:50,搅拌换液3h;
31.优选地,步骤s3中,第二次换液的换液倍数为1000~10000倍,即将换液前步骤s2蛋白溶液的浓度稀释了1000~10000倍。
32.更优选地,步骤s3中,二次换液的换液倍数为5000~10000倍。
33.最优选地,步骤s3中,二次换液的换液倍数为1000倍。
34.优选地,步骤s3中,按1:10质量比例加入tev内切酶酶切,得到酶切后的蛋白溶液。
35.优选地,步骤s4中,2~3倍柱体积的试剂平衡后,将步骤s3酶切后的蛋白溶液以5ml/min的流速上样。
36.优选地,步骤s4中,淋洗3倍柱体积。
37.优选地,s4中柱料采用博格隆的ni bestarose hp,层析柱采用博格隆的bxk26/20柱。
38.更优选地,步骤s4中,所述柱料填充体积为50~70ml。
39.最优选地,步骤s4中,所述柱料填充体积为70ml。
40.优选地,步骤s4洗脱所用试剂中咪唑的浓度为20~25mm。
41.更优选地,步骤s4洗脱液中咪唑的浓度为20mm。
42.优选地,将步骤s4得到的蛋白溶液以3ml/min流速经过q柱。
43.优选地,将步骤s5中,蛋白溶液过q柱前需要稀释,稀释后的蛋白溶液中nacl的浓度为0.3~0.4m。
44.更优选地,步骤s5中稀释后的蛋白溶液中nacl的浓度为0.4m。
45.一种纯化末端脱氧核糖核苷酸转移酶tdt试剂盒,所述试剂盒中含有所述蛋白洗脱液。
46.与现有技术相比,本发明具有以下有益效果:
47.本发明的末端脱氧核糖核苷酸转移酶tdt的纯化方法,该方法针对末端脱氧核糖核苷酸转移酶tdt的纯化进行了大量研究,根据蛋白的性质探究出了最影响该蛋白收率和纯度的关键影响因素,包括蛋白洗脱液、纯化方式、洗脱收集等,所述蛋白洗脱液中含有20~25mm咪唑、10~25mm trisbase和0.4~0.5m nacl,ph为7.5~8.0;并进行了系统性的设计和优化,所提出的方案可以使菌株大量表达可溶性目的酶蛋白,并显著提升蛋白的得率和纯度,且无核酸残留;而且本发明纯化策略方便进一步等比放大,能够大规模量产,在生产高纯度、无核酸残留、品质好的末端脱氧核糖核苷酸转移酶tdt蛋白方面具有很好的应用价值。
附图说明
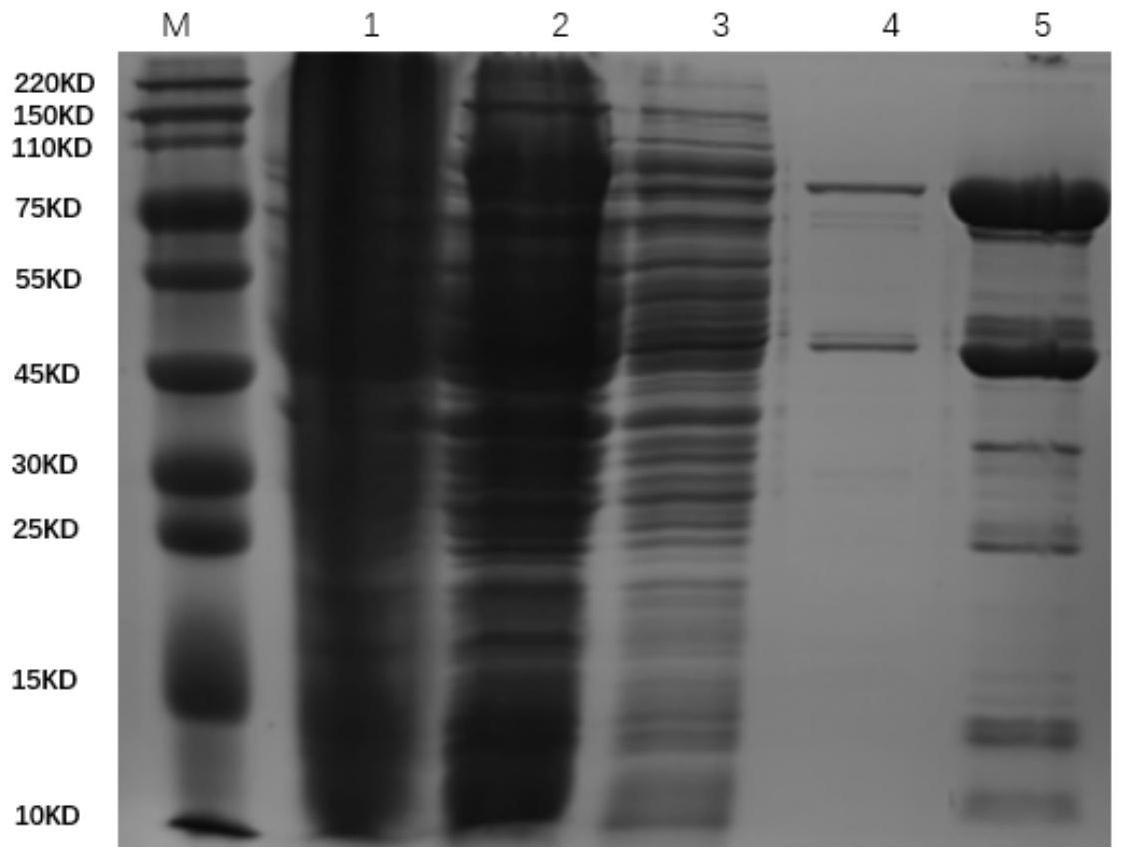
48.图1为本发明tdt的纯化方法中一次镍柱纯化结果的蛋白电泳图。lane1~5分别上清液制样(s)、样品过柱后的流穿液制样(ft)、25mm咪唑洗杂液制样(25mm)、经25mm咪唑洗杂后的40mm咪唑洗杂液制样(40mm)、500mm咪唑洗脱液制样(500mm)。其中含标签的目标蛋
白大小约90kd。
49.图2为本发明tdt的纯化方法中一次镍柱纯化中洗脱液经过tev酶切处理后的效果图。
50.图3为本发明tdt的纯化方法中一次镍柱纯化中二次镍柱纯化结果的蛋白电泳图。lane1~3分别为酶切后的上清制样(s)、20mm咪唑洗脱的目标蛋白(20mm)、500mm咪唑洗脱的杂蛋白(500mm)。
51.图4为本发明tdt的纯化方法中一次镍柱纯化中q柱纯化结果的蛋白电泳图。lane1、2依次为经过平衡液稀释后的上样液制样(s)及过q柱流出的流穿液制样(ft)。
52.图5为本发明tdt的纯化方法中纯化完毕于储存状态中的效果图。
53.图6为本发明tdt的纯化方法储存蛋白的纯度检测效果图。
54.图7为图1为本发明tdt的纯化方法的流程图。
55.图8为换液倍数采用50倍时,经过tev酶切处理后的效果图。
56.图9为tdt蛋白纯化过程中,tdt蛋白不挂镍柱,对tdt蛋白进行镍柱二次纯化的影响。
57.图10为填料体积为50ml时,对tdt蛋白进行镍柱二次纯化的影响。
58.图11为洗脱液中咪唑浓度为40mm时,对tdt蛋白进行镍柱二次纯化的影响。
59.图12为稀释后的蛋白溶液中nacl浓度分别为0.1m、0.15m、0.3m、0.5m和2m时,对q柱纯化蛋白的影响,其中,红色为a260,蓝色为a280,绿色分别为b%(2m nacl)、b1(5%0.1m nacl)、b2(7.5%0.15m nacl)、b3(15%0.3m nacl)、b4(25%0.5m nacl)。
具体实施方式
60.下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
61.样品在过柱前均需过0.4μm滤膜;镍柱在纯化完毕后,脱镍挂镍重生,重生完毕后超纯水淋洗充分后,柱料于20%乙醇中保存。q柱在纯化完毕后,使用浓度为2m的nacl淋洗充分,峰值稳定后,超纯水淋洗充分后于20%乙醇中保存。
62.实施例1菌株发酵
63.将目的基因的核苷酸序列融合到pet-28a载体上,初始重组蛋白含有mbp促溶标签,mbp标签与目的蛋白间设计有tev酶切位点。构建重组表达质粒,转化到甘油菌bl21(de3)中,得到重组菌株。所述重组菌株为重组有重组载体的菌株,所述重组载体为pet-28a载体的1526bp位置插有mbp-tdt片段。该重组载体的核苷酸序列如seq id no:1所示。将甘油菌加入培养基活化后,再加入高压灭菌处理的发酵罐中发酵。
64.发酵工艺为:22℃,ph7.0,溶氧关联搅拌设置为40%,od值13左右时加入0.5mm的iptg,以50ml/h的速度进行补料,待补料20h后,停止发酵,数据归档,进行放罐。收集发酵产物,在4℃、8000rpm下低温离心15min,收集菌泥,弃上清,菌泥湿重共计483g。取140g发酵得到的菌泥,添加700ml重悬液。充分重悬后,于4℃、900bar条件下压力破碎10min,即充分破碎完毕。收集破碎液,于4℃、12000rpm条件下离心10min,收集上清液,弃沉淀。
65.发酵罐体积为7l,液体体积为5l。
66.发酵培养基组分为:80g酵母浸粉、40g甘油、10.57g(nh4)2so4、2.89g mgso4、40gnacl和4ml消泡剂,定容至3800ml。
67.补料组分为:160g蛋白胨、80g酵母粉、160g甘油和2ml消泡剂,定容1000ml。
68.重悬液组分为:40mm咪唑、25mm trisbase、0.5m nacl和1mm cocl2,ph8.0。
69.实施例2第一次镍柱纯化
70.1.实验方法
71.将实施例1得到的上清液经过0.4μm滤膜过滤,超纯水冲洗后,再经2倍柱体积的40mm咪唑平衡方可上样,流速设置为5ml/min。上样完毕后,使用40mm咪唑充分洗杂,洗杂效果使用g250评估,洗杂至40μl蛋白洗杂液加入200μl考马斯亮蓝g250中没有明显变色为止。采用过夜洗杂,流速4ml/min,洗杂时间约16h。充分洗杂后,使用洗脱液将挂柱蛋白洗脱,得到蛋白溶液。
72.第一次镍柱纯化使用的柱料为博格隆、ni bestarose ff,层析柱采用博格隆bxk26/20,柱料填充体积为70ml。
73.洗脱液组分为500mm咪唑、25mm trisbase和0.5m nacl,ph8.0。共收集洗脱液310ml。
74.2.实验结果
75.结果如图1所示,图1为一次镍柱纯化结果的蛋白电泳图。lane1~5分别上清液制样(s)、样品过柱后的流穿液制样(ft)、25mm咪唑洗杂液制样(25mm)、经25mm咪唑洗杂后的40mm咪唑洗杂液制样(40mm)、500mm咪唑洗脱液制样(500mm)。其中含标签的目标蛋白大小约90kd。
76.实施例3 tev酶切
77.1.实验方法
78.收集实施例2得到洗脱液,充分换液。采用透析方式换液,配制2杯5l的透析溶液并于4℃预冷。将310ml实施例2收集得到洗脱液加入透析带夹紧后,放置于5l透析溶液中,搅拌换液3h后置于另外一5l透析溶液同等操作换液。换液倍数为1000倍,取出充分换液后的溶液,测定蛋白浓度计算总量,蛋白总量约为400mg(1.3mg/ml*310ml),按1/10比例加入tev内切酶,即加入40mg内切酶于蛋白溶液中,充分混匀后,过夜酶切,得到酶切后的蛋白溶液。
79.透析溶液组分为:0.5m nacl和25mm trisbase,ph8.0。
80.2.实验结果
81.结果如图2所示,经过tev酶切处理后的效果图。电泳图显示可以观察到,约90kd的条带有被酶切过的痕迹,目标蛋白和促溶标签因大小接近,都在50kd左右的条带上。
82.实施例4第二次镍柱纯化
83.1.实验方法
84.上样前,使用超纯水冲洗后,再经2倍柱体积的平衡液平衡,充分平衡后,将实施例3经过酶切后得到的蛋白溶液以5ml/min的流速上样,此处不使用过快流速,保证目标蛋白可以充分挂柱。上样线速度1.5cm/min。上样完毕后,使用平衡液淋洗2倍柱体积,淋洗完毕后,添加低浓度咪唑的洗脱液洗脱,监测a280nm吸收峰,待峰值有明显升高时收集,此收集液即为目标蛋白溶液。洗脱液约经过约2倍柱体积后,峰值有明显升高,收集洗脱液体积约
为100ml。
85.填料采用博格隆和ni bestarose hp,层析柱采用博格隆bxk26/20,柱料填充体积为70ml。
86.平衡液组分为0.5m nacl和25mm trisbase,ph8.0。
87.洗脱液组分为20mm咪唑、25mm trisbase和0.5m nacl,ph8.0。
88.2.实验结果
89.结果如图3所示,lane1~3分别为酶切后的上清制样(s)、20mm咪唑洗脱的目标蛋白(20mm)、500mm咪唑洗脱的杂蛋白(500mm)。电泳图显示可以观察到,20mm咪唑洗脱下来的目标蛋白基本肉眼观察无杂带;目标蛋白较促溶标签分子量大;同时观察到,500mm咪唑洗脱液中,基本不含目标蛋白,此纯化方式在保证纯度的同时,最大限度降低了损失率。可以将tdt蛋白和其他蛋白分开。
90.实施例5 q柱纯化
91.1.实验方法
92.上样前,使用超纯水冲洗后,再经2倍柱体积的平衡液平衡,充分平衡后,将实施例4得到的洗脱液,添加1/4洗脱液体积的平衡液平衡。收集了100ml洗脱液,则需添加25ml的平衡液。稀释后的蛋白溶液中nacl的浓度为0.4m。将溶液电导率下降至36ms/cm,稀释后的蛋白溶液以3ml/min流速经过q柱,溶液中的蛋白在此离子浓度下,不会挂柱,会直接流穿出来,收集此流穿液,即得到无核酸残留的目标蛋白。
93.填料采取博格隆q bestarose fastflow,层析柱采用博格隆bxk26/20,填料体积为20ml。
94.平衡液组分为20mm trisbase,ph8.0。
95.2.实验结果
96.结果如图4所示,图4为q柱纯化结果的蛋白电泳图。lane1、2依次为经过平衡液稀释后的上样液制样(s)及过q柱流出的流穿液制样(ft)。电泳图显示可以观察到两者纯度并无明显差异。
97.实施例6换液储存
98.1.实验方法
99.配制酶储液,配制完毕后,经高压灭菌(121℃、30min)并预冷后才可使用。将实施例5得到的蛋白溶液适当浓缩后,透析换液为酶储液,透析换液的倍数需10000倍以上。蛋白溶液浓缩后体积约90ml,共换液3次,每次均为1.5l,最后得到的体积为27ml,浓度标定后,计算得蛋白总量为81mg(3mg/ml*27ml)。存储于-20℃冰箱内待用。
100.酶储液组分为:磷酸钾缓冲液60mm(ph 7.2)、kcl 150mm、甘油50%(v/v)、dtt 1mm、triton x-100 0.5%(v/v)。
101.2.实验结果
102.结果如图5和图6所示,图5为tdt纯化完毕于储存状态中的效果图,该电泳图的目标蛋白上样量为5μg,肉眼基本无杂带。
103.图6为储存的tdt蛋白的纯度检测效果图,此步是采用hplc测试纯度,结果显示纯度在95%以上。
104.图7为tdt的纯化方法的总流程图,经过发酵收菌、一次纯化、tev酶切、二次纯化、q
柱纯化和换液储存浓度标定后,得到纯化的末端脱氧核糖核苷酸转移酶tdt。
105.对比例1低换液倍数对tev酶切效果的影响
106.1.实验方法
107.实施例2得到洗脱液收集后,换液方法及后续tev酶切步骤与实施例3相同。不同的是,换液倍数为50倍,观察低换液倍数对tev酶切效果的影响。
108.2.实验结果
109.结果如图8所示,图8为换液倍数采用50倍时,经过tev酶切处理后的效果图。可以看到,蛋白会流穿出来,且ft有明显的杂带。
110.与图2换液倍数采用1000倍时比对,换液倍数采用1000倍时蛋白流穿明显会少很多。因此tev酶切时,采用换液倍数应为1000倍以上,体系不会因为咪唑浓度过高而影响后续操作。
111.对比例2镍柱二次纯化时,tdt蛋白不挂镍柱对蛋白纯化的影响
112.1.实验方法
113.(1)纯化过程中,tdt蛋白不挂镍柱,对tdt蛋白进行镍柱二次纯化。
114.使用的填料为博格隆和ni bestarose ff,层析柱采用博格隆bxk26/20,填料体积为70ml。上样、淋洗、洗脱、监测和收集洗脱液的方法与实施例4相同。观察二次纯化时,tdt蛋白不挂镍柱对蛋白纯化的影响。
115.2.实验结果
116.结果如图9所示,图9为tdt蛋白纯化过程中,tdt蛋白不挂镍柱,对tdt蛋白进行镍柱二次纯化的影响。可以看出目的蛋白有会留穿,但是mbp标签也会随着流出。同时也发现,会有部分tdt蛋白挂柱。结合tdt蛋白性质可知,tdt蛋白理论上可以与镍柱弱结合,不能达到tdt蛋白不挂镍柱,mbp、tev酶及其他杂蛋白挂柱的分离目的。
117.对比例3镍柱二次纯化时,低柱料填充体积对蛋白纯化的影响
118.1.实验方法
119.填料采用博格隆和ni bestarose hp,层析柱采用博格隆bxk26/20,填料体积为50ml。上样、淋洗、洗脱、监测和收集洗脱液的方法与实施例4相同。
120.2.实验结果
121.结果如图10所示,柱料填充体积为50ml时,有明显目标蛋白和标签蛋白流出,目标蛋白过载流穿。
122.对比例4镍柱二次纯化时,洗脱液中高咪唑浓度对蛋白纯化的影响
123.1.实验方法
124.采用实施例4的方法上样、淋洗、洗脱、监测和收集洗脱液。不同的是,洗脱液组分中咪唑浓度为40mm。
125.2.实验结果
126.结果如图11所示,洗脱液中咪唑浓度为40mm时,有明显的杂带被洗出。因此镍柱二次纯化过程的洗脱步骤中,洗脱液的咪唑浓度不能过高,否则会将部分杂蛋白(如酶切后的mbp标签等)也洗脱一部分下来。
127.对比例5 q柱纯化时,上样液nacl浓度过高对蛋白纯化效果影响
128.1.实验方法
129.q柱纯化步骤中,稀释后的蛋白溶液中nacl的浓度分别为0.1m、0.15m、0.3m、0.5m和2m,其他步骤与实施例5相同。
130.2.实验结果
131.结果如图12所示,nacl浓度为0.5m时,洗脱液就会出现核酸峰,部分核酸会不挂柱流传出来。因此经q柱纯化的上样液需经过平衡液稀释,将体系nacl浓度降低。
132.最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1