蛋白纳米粒子的制备方法、所得蛋白纳米粒子及其应用
1.本发明涉及一种蛋白纳米粒子的制备方法,以及该方法制得的蛋白纳米粒子及该蛋白纳米粒子的应用。
背景技术:
2.近年来,蛋白纳米粒子在疾病的诊断和治疗中,尤其是肿瘤的诊断和治疗方面,显示出了广阔的应用前景。通过精确地控制蛋白纳米粒子的大小、形状、组成、硬度、表面电荷和表面修饰配体,可以调节其体内循环时间、生物分布和肿瘤内部药物的分布等情况。例如,表面修饰了peg的蛋白纳米粒子能有效躲避免疫系统的俘获,增强体内循环时间;表面修饰的配体可通过与肿瘤细胞过表达的受体等蛋白的特异性结合,使得诊断和治疗靶向肿瘤细胞(主动靶向);减少蛋白纳米粒子的尺寸能促进其更深地进入肿瘤的内部;接近中性的表面电荷能尽可能减少血液中的调理蛋白纳米粒子的吸附,从而延长其循环时间。卓有成效的研究成果直接促使一些蛋白纳米粒子药物进入临床实验。以铁蛋白纳米粒子为例,因其具有良好的生物兼容性,可发展成纳米药物和诊断试剂,从而受到普遍关注。
3.目前,可以通过化学修饰和基因融合的策略实现蛋白纳米粒子的功能化。然而,现有的制备方法一方面大多只能采用低分子量的多肽进行表面修饰,另一方面大多采用对不同的蛋白分子进行分别功能化修饰,再通过调控溶液的ph解离,之后自主装这些不同的蛋白纳米粒子,制备过程中蛋白纳米粒子易形成沉淀或失活,使得功能化蛋白纳米粒子的得率通常不高。
4.本发明人之前的研究(专利zl201010239499.3)公开了一种通过体外变复性策略制备功能化蛋白纳米粒子的方法。该方法可将分子量较大的蛋白修饰于蛋白纳米粒子表面,可避免ph调控方式引起的蛋白沉淀和失活的问题。然而,该方法在复性过程中仍然易出现多聚沉淀,所得复性产物的得率、纯度以及实际应用效果仍不理想,亟待进一步提高。
技术实现要素:
5.本发明所要解决的技术问题是为了克服现有的变复性制备功能化蛋白纳米粒子的方法中复性过程易出现多聚沉淀、复性产物得率和纯度、以及实际应用效果不佳的缺陷,而提供一种新的蛋白纳米粒子的制备方法、及所得蛋白纳米粒子及其应用。本发明的方法可消除复性过程中的沉淀,复性产物得率和纯度显著提升、实际应用效果优异,而且易于实现工业化制备。
6.本发明通过下述技术方案解决上述技术问题:
7.本发明提供了一种蛋白纳米粒子的制备方法,其包括如下步骤:将一种蛋白变性液进行离子交换层析,之后透析复性,即得;或者,将多种蛋白变性液分别进行离子交换层析,再混合,之后透析复性,即得;所述蛋白变性液中的蛋白为适用变复性方法的铁蛋白。
8.本发明中,所述铁蛋白较佳地为融合铁蛋白,更佳地为天然蛋白修饰的铁蛋白或天然肽修饰的铁蛋白。
9.本发明中,所述蛋白变性液可按本领域常规蛋白变性方法制得,如将包涵体溶于含尿素的变性液中变性制得。所述含尿素的变性液较佳地含8m尿素,更佳地含8m尿素、1mm edta、10mm dtt和50mm tris-hc1,ph为7.9。所述变性的温度较佳地为26-30℃,更佳地为28℃。所述变性的时间较佳地为10-24h,更佳地为过夜。
10.本发明中,所述蛋白变性液中的蛋白可为重组蛋白。所述包涵体可按本领域常规方法,通过破碎表达菌体提取获得。所述表达菌体可按本领域常规方法,诱导表达工程菌表达蛋白后制得。
11.本发明一优选实例中,所述蛋白纳米粒子为egf/hsa-fth1蛋白纳米粒子,所述蛋白变性液为氨基酸序列如seq id no:1所示的egf::fth1蛋白的变性液,以及氨基酸序列如seq id no:2所示的hsa::fth1蛋白的变性液。
12.其中,所述氨基酸序列如seq id no:1所示的egf::fth1蛋白可按zl201010239502.1专利中记载的方法制备,具体为将人表皮生长因子egf融合于铁蛋白重链亚基(fth1)的n端,获得融合蛋白egf::fth1。egf可与肿瘤细胞高表达的表皮生长因子受体egfr受体结合,因此可将egf作为靶向性分子来介导蛋白纳米粒子与细胞特异性的结合,用于高表达egfr受体的肿瘤细胞的成像。
13.其中,所述氨基酸序列如seq id no:2所示的hsa::fth1蛋白可参照zl201010239502.1专利中记载的方法制备,将hsa融合于fth1的n端。hsa是人血清蛋白中富含较多赖氨酸残基且结构稳定的一段蛋白结构域。将hsa修饰于蛋白表面,一方面由于其高度的稳定性能较好地避免蛋白纳米粒子在体内的快速降解,另一方面为蛋白纳米粒子提供较多的-nh2残基,为化学偶联小分子标记物或荧光成像分子提供位点,从而改善成像的灵敏度。
14.本发明中,所述离子交换层析可为阳离子交换层析或阴离子交换层析,优选阴离子交换层析。所述离子交换层析的具体操作条件可按本领域常规选择。
15.本发明一实例中,所述蛋白变性液为egf::fth1蛋白变性液和/或hsa::fth1蛋白变性液。层析柱可采用阴离子交换类层析柱,较佳地采用deae阴离子交换层析柱。洗脱液可为含氯离子的缓冲液,较佳地为含nacl的缓冲液,所述洗脱液的梯度浓度范围可为20mm至2m。洗脱液的ph可为5~14,较佳地为7。洗脱液最优选:含nacl和8m尿素的ph为7.0的20mm tris-hcl缓冲液,所述nacl的梯度浓度依次为20mm、50mm、100mm、200mm、400mm、1m和2m;收集含100mm nacl的洗脱液。每个梯度的洗脱液的用量较佳地为8-12个柱体积,更佳地为10个柱体积。
16.本发明中,所述层析后,当涉及多种蛋白变性液时,将层析后所得的各蛋白变性液按所需比例进行混合。例如,当制备所述egf/hsa-fth1蛋白纳米粒子时,可按egf::fth1蛋白和hsa::fth1蛋白的摩尔比大于或等于1,更佳地按6:4混合egf::fth1蛋白变性液和hsa::fth1蛋白变性液。
17.本发明中,所述透析复性可按本领域常规进行。
18.本发明一优选实例中,所述蛋白纳米粒子为egf/hsa-fth1蛋白纳米粒子,所述透析液为含有梯度浓度的尿素的透析液,具体如:透析液中含有50mm三羟甲基氨基甲烷(tris-oh)、50mm nacl、0.5mm edta、0.1wt%聚乙二醇(peg)、10wt%甘油、0.2mm还原型谷胱甘肽(gsh)、0.1mm氧化型谷胱甘肽(gssg),各步透析液还含有浓度依次为4m、3m、2m、0m的
尿素,ph 7.9。
19.透析复性后,可按常规进行后处理,如离心取上清液,超滤浓缩。
20.本发明还提供由本发明的方法制得的蛋白纳米粒子。
21.本发明一优选实例中,所述蛋白纳米粒子为egf/hsa-fth1蛋白纳米粒子,其是由24个亚基自行组装成中空笼状结构的高度对称的生物大分子。该egf/hsa-fth1纳米粒子具有靶向和高载荧光成像分子的双重能力,可以成功地用于肿瘤细胞的成像,其能够特异性识别egfr,所含hsa能更多提供氨基位点,使得该蛋白纳米粒子可以标记更多的荧光成像分子,从而获得较好的成像效果。所述egf/hsa-fth1蛋白纳米粒子中,egf::fth1蛋白和hsa::fth1蛋白的摩尔比大于或等于1,较佳的为6:4。所述egf/hsa-fth1蛋白纳米粒子的平均粒径较佳地为11.8nm
±
0.9nm。
22.本发明还提供本发明的蛋白纳米粒子在制备疾病诊断或治疗的制剂中的应用。
23.其中,所述疾病如肿瘤,更具体如乳腺癌。所述制剂可为靶向成像制剂或靶向药物载体,具体如以egfr为靶点的肿瘤成像制剂或肿瘤药物载体,更具体如egfr高表达的乳腺癌的成像制剂或药物载体。
24.其中,所述制剂的形式可为组合物或套装盒。在所述靶向成像制剂中,所述蛋白纳米粒子的最小剂量较佳地为1
×
10-9
mol/l。
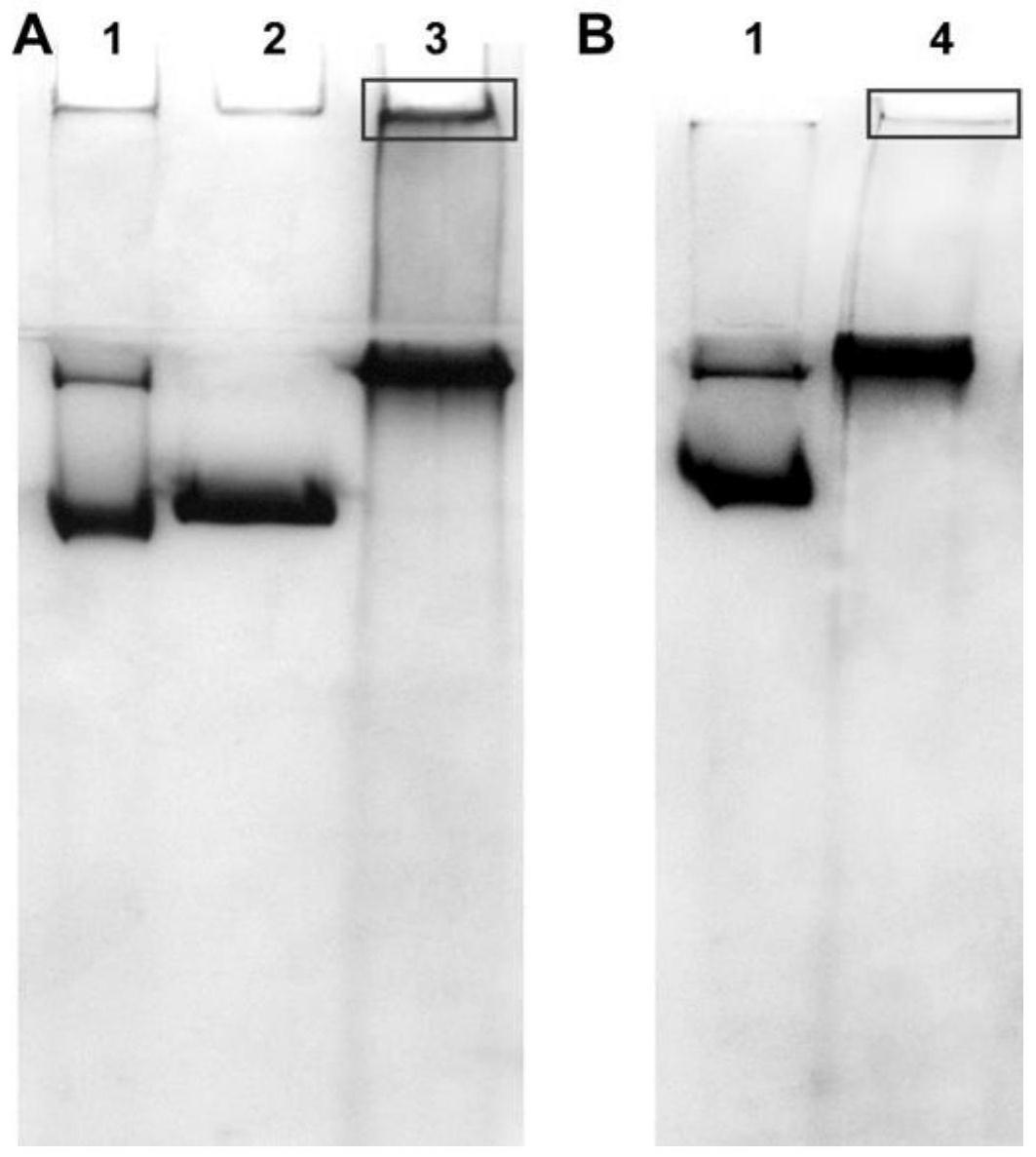
25.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较优选实例。
26.本发明所用试剂和原料均市售可得。
27.本发明的积极进步效果在于:
28.(1)本发明的方法可消除复性过程中易出现的多聚沉淀现象。并且,复性得率有预料不到的显著提高,相比现有变复性制备方法,本发明的优选方案得率可实现从20%到70%的惊人提高。
29.(2)本发明的方法所得蛋白纳米粒纯度优异,电泳图上为单一条带,胶孔中未见蛋白团聚物。
30.(3)本发明的方法所得蛋白纳米粒具有较高的标记物荷载能力,优选方案的生物素荷载量可达到90mol/mol蛋白纳米粒子。
附图说明
31.图1为实施例2的egf/hsa-fth1纳米粒子的sds-page组成分析图。泳道1为实施例2割胶纯化后的egf/hsa-fth1纳米粒子,泳道2为hsa::fth1变性液,泳道3为egf::fth1变性液。
32.图2为实施例2的egf/hsa-fth1蛋白纳米粒子的透射电镜图。
33.图3为实施例2和对比例的egf/hsa-fth1蛋白纳米粒子的native-page图,图3的a中泳道1为去铁铁蛋白,泳道2为fth1,泳道3为对比例的egf/hsa-fth1纳米粒子;图3的b中泳道1为去铁铁蛋白,泳道4为实施例2的egf/hsa-fth1纳米粒子。
34.图4为实施例2的egf/hsa-fth1蛋白纳米粒子、及阴性对照去铁铁蛋白与乳腺癌细胞结合的共聚焦显微镜荧光图。
35.图4的a和图4的b为荧光素标记的蛋白纳米粒子与mda-mb-231细胞孵育后的荧光
图(a:去铁铁蛋白,b:实施例2的egf/hsa-fth1蛋白纳米粒子)。
36.图4的c和4的d为荧光素标记的蛋白纳米粒子与mda-mb-468细胞孵育后的荧光图(c:去铁铁蛋白,d:实施例2的egf/hsa-fth1蛋白纳米粒子)。dapi:蓝色;egf/hsa-fth1蛋白纳米粒子:绿色。
具体实施方式
37.下面结合具体实施例对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
38.实施例1 egf-fth1蛋白变性液和hsa-fth1蛋白变性液的制备
39.两种质粒pet-28(+)-egf-fthi,pet-28a(+)-hsa-fth1于本实验室现存(具体制备方法参见zl201010239499.3)。其中,所述egf::fth1蛋白的氨基酸序列如seqid no:1所示,所述hsa::fth1蛋白的氨基酸序列如seq id no:2所示。大肠杆菌感受态细胞e.coli.bl21(de3)购于北京天根生化科技公司。将上述质粒转化入e.coil.bl21(de3)感受态细胞,以获得分别含有egf::fth1和hsa::fth1蛋白基因目标工程表达菌株细胞。
40.接着,在egf::fth1蛋白基因目标工程表达菌株细胞中表达egf::fth 1蛋白,而hsa::fth1蛋白表达工程菌则用于表达hsa::fth1蛋白。将所述菌株细胞培养在37℃含有卡那霉素的lb培养基中。当培养液od值为0.4~0.6时(卡那霉素浓度为50μg/ml),加入1mm iptg诱导表达3小时,温度为37℃。诱导后,离心20分钟(转速8000rpm)收集细胞沉淀。然后,超声破碎得到的细胞裂解液(超声破碎条件为:工作1s,间歇1s,30min,功率为300w)。离心15分钟(转速8000rpm)回收沉淀,用洗涤液(50mmtris-hc1,50mm nacl,1mm edta,10mm dtt,1%triton x-100,ph7.9)洗四次,分别得到egf::fth1的包涵体和hsa::fth1的包涵体。然后将egf::fth1和hsa::fth1分别溶解在含8m尿素的变性液里(50mm tris-hc1,8m尿素,1mm edta,10mm dtt,ph 7.9),28℃过夜,制得egf-fth1蛋白变性液和hsa-fth1蛋白变性液。
41.实施例2 egf/hsa-fth1蛋白纳米粒子
42.采用自填deae阴离子交换层析柱(3ml,ge公司高流速deae琼脂糖离子交换填料,cat.no.ge-17070901)分别对实施例1所得的egf-fth 1蛋白变性液和hsa-fth1蛋白变性液进行层析。
43.首先,用10倍柱体积的平衡液(20mm tris-hcl,8m尿素,ph 7)平衡deae阴离子交换层析柱。蛋白变性液上样后,用梯度洗脱液进行梯度洗脱,每个梯度洗10个柱体积,约40ml。梯度洗脱液为ph 7的20mm tris-hcl缓冲液,含8m尿素和nacl(梯度浓度依次为20mm、50mm、100mm、200mm、400mm、1m和2m)。收集nacl浓度为100mm的洗脱液,得纯化后egf::fth1蛋白变性液和hsa::fth1蛋白变性液。
44.然后,以egf::fth1蛋白和hsa::fth1蛋白的摩尔比6:4的比例混合两种蛋白变性液,蛋白总质量为5mg,体积为50ml。
45.再采用梯度透析的方法去除尿素以获得有活性的蛋白纳米粒子。各步透析液含有50mm三羟甲基氨基甲烷(tris-oh),50mm nacl,0.5mm edt a,0.1wt%聚乙二醇(peg4000)、10wt%甘油、0.2mm还原型谷胱甘肽(gsh)、0.1mm氧化型谷胱甘肽(gssg),ph 7.9,其还含有
浓度依次为4m、3m、2m、0m的尿素,并且透析液均需用0.22μm滤膜过滤。透析最后一步转入储存液中进行透析(50mm tris-hc1、50mm nacl、10wt%甘油,ph7.9)。复性前加入混合变性蛋白5mg,复性结束后过滤后可得3.5mg egf/hsa-fth1蛋白纳米粒子,由此可知复性得率为70%。
46.复性结束后,将透析袋内的复性蛋白溶液取出,离心(转速8000rpm)15分钟,得上清液。用0.22μm滤器过滤后,再用50kd超滤管对蛋白液进行超滤,浓缩到体积为1.5ml左右,制得egf/hsa-fth1蛋白纳米粒子。
47.对比例egf/hsa-fth1蛋白纳米粒子
48.除不进行离子交换层析外,其他步骤及条件与实施例2相同。复性前加入混合变性蛋白5mg,复性结束后过滤后可得1mg egf/hsa-fth1蛋白纳米粒子,由此可知复性得率为20%。
49.效果实施例1 egf/hsa-fth1蛋白纳米粒子的表征
50.将实施例2所得egf/hsa-fth1蛋白纳米粒子进行表征。表征方法及仪器参数参见文献:陈慧,高宗林,曹旭妮,anti egfr scfv::fth1/fth1纳米粒子的制备及其在哮喘治疗中的应用[j].生物工程学报,2021,37(08):2870-2877。
[0051]
图1显示了sds-page割胶纯化后的纳米粒子是由egf::fth1和hsa::fth1两种亚基组成。
[0052]
图2为透射电子显微镜tem图,结果显示egf/hsa-fth1蛋白纳米粒子正确折叠组装、且纳米粒子的平均直径为11.8nm
±
0.9nm。
[0053]
本实验结果说明,实施例2的egf/hsa-fth1蛋白纳米粒子制备成功,所制备的egf/hsa-fth1蛋白纳米粒子由上述两种亚基组成,且具有铁蛋白的特征笼状结构。
[0054]
效果实施例2蛋白团聚物比较
[0055]
将实施例2和对比例所得的egf/hsa-fth1蛋白纳米粒子,分别采用标准的非变性聚丙烯酰胺凝胶native-page电泳进行分离分析(浓缩胶为5wt%聚丙烯酰胺,分离胶为7wt%聚丙烯酰胺)。电泳电压设置为100v,电泳时间为1小时45分钟,结果如图3所示。
[0056]
由图3可见,与对比例相比(图3的a),本发明实施例2(图3的b)所得的egf/hsa-fth1纳米粒子纯度较高,电泳图上为单一条带,胶孔中未见蛋白团聚物(如图3的b中方框所示)。
[0057]
效果实施例3生物素荷载量比较
[0058]
分别将实施例2和对比例所得的egf/hsa-fth1蛋白纳米粒子进行超滤(密理博50kd超滤管),并更换标记缓冲溶液(50mm pbs、50mm nacl,ph 7),并使浓度约为1.6mg/ml,取1.2mg。称取生物素1.3mg(纳米粒子蛋白亚基摩尔数的50倍),溶于20μl标记缓冲溶液。将egf/hsa-fth1蛋白纳米粒子与生物素混合后,室温反应4小时。之后,在4℃下透析去除未反应的生物素,每12小时更换透析外液,透析3遍。
[0059]
然后,采用生物素标记量测定试剂盒(塞默飞pierce biotin quantitation kit货号:28005),根据其说明书进行检测吸光度,计算生物素的标记量。
[0060]
结果表明,本发明实施例2所得的egf/hsa-fth1蛋白纳米粒子的生物素标记量可达90mol/mol纳米粒子,对比例的生物素的标记量为36mol/mol纳米粒子。结果说明,本发明的egf/hsa-fth1蛋白纳米粒子纯度更高,活性更好,可携带生物素分子的载量更高高,提示
该蛋白纳米粒子在生物医学应用中具有荷载成像分子(或标记物)更佳的效果。
[0061]
效果实施例4肿瘤细胞成像比较
[0062]
测试蛋白粒子:实施例2所得的egf/hsa-fth1蛋白纳米粒子、去铁铁蛋白(阴性对照来自西格玛公司;去铁铁蛋白来自马脾,货号:a3660-1vl)
[0063]
乳腺癌细胞:mda-mb-231细胞、mda-mb-468细胞(购自中国科学院细胞库)
[0064]
将nhs荧光素溶解到二甲基亚砜(dmso)里配置成50mg/ml的溶液。以nhs-荧光素与蛋白纳米粒子摩尔比20:1的比例,将nhs-荧光素与蛋白纳米粒子混合,调节并控制ph在8.5左右,室温下混匀后静置1小时,中间振荡数次。反应结束后,用sephadex g-25葡聚糖凝胶柱去除未反应的nhs-荧光素。
[0065]
将培养好的乳腺癌细胞用胰蛋白酶消化下来,取1
×
104个细胞接种至放置有载玻片的24孔板中。次日贴壁后,用基础培养基洗涤两遍,加入荧光标记的蛋白纳米粒子溶液,37℃孵育3小时。之后再用ph 7.2的pbs溶液洗涤细胞3次后,4,6-二脒基-2-苯基吲哚(dapi)染色封片后用共聚焦显微镜分析,结果如图4所示。
[0066]
由图4可见,本发明实施例2所得的egf/hsa-fth1蛋白纳米粒子具有与细胞表面egfr受体结合的活性,可以作为成像试剂用于肿瘤细胞的成像。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1