一种糖胺聚糖合成酶的冻干保护剂及其应用
1.本发明涉及一种糖胺聚糖合成酶的冻干保护剂,还涉及一种糖胺聚糖合成酶的冻干制剂及其制备方法,属于生物制品技术领域。
背景技术:
2.糖胺聚糖是一类结构复杂的杂多糖家族,根据其二糖重复单元、糖苷键、硫酸化位点的不同可以分为透明质酸(ha)、硫酸乙酰肝素(hs)和肝素(heparin)、硫酸软骨素(cs)和硫酸皮肤素(ds)、硫酸角质素(ks)四大类。糖胺聚糖存在于细胞中,在细胞黏附、趋化因子信号传导、生化级联及病原体识别等方面起到关键作用,广泛用于临床药物、保健品等。糖胺聚糖的三个传统来源是动物组织提取、化学合成和酶法合成。由于糖胺聚糖的结构相似性和长度多样性,动物组织提取过程中分离纯化困难且有病毒、微生物污染的风险,如药用类肝素最初是由动物组织(牛肺组织和猪肠膜中)制备,但是,从动物组织中制备肝素药物可能会存在风险,引起许多未知的副作用,如出血、肝素诱导的血小板减少症等。而使用化学合成法合成糖胺聚糖,虽有精准控制的优点,但是合成步骤多、得率低、成本高。近年来,为了快速精准的合成结构明确、长度均一的、安全的糖胺聚糖,许多高校学者使用化学酶法合成策略来进行糖胺聚糖的合成,糖胺聚糖的化学酶法合成策略包括糖链的延长和糖链的修饰,因此糖基转移酶和用来修饰糖链的酶在化学酶法合成过程中非常重要。
3.糖基转移酶和糖链修饰酶的稳定性问题是化学酶法合成糖胺聚糖的关键,游离酶具有运输、储存困难和稳定性差等问题,难以运用于工业生产中,真空冷冻干燥技术广泛用于生物、食品和医药等各个领域,将游离酶冷冻干燥是目前酶制剂工艺中的一个重要环节。游离酶经过冷冻干燥后可长期储存、运输,加入水后可复溶再生,但是冷冻干燥过程中因温度等环境的剧烈变化,会对酶造成不同程度的损伤而失去活性,因此在冷冻干燥前一般在酶中加入适当的冻干保护剂以减轻冻干过程对酶结构的损伤,维持酶冻干后的活性。
4.迄今为止关于冻干保护剂的研究众多,例如中国专利cn102973526b授权了一种人抗凝血酶制剂冷冻干燥过程中的保护剂,其添加0.1-0.8wt.%蔗糖和0.2-1.0wt.%赖氨酸或其盐作为抗凝血酶冻干保护剂,该配方能有效保护抗凝血酶的活性,但是该冻干配方不适用于糖胺聚糖合成酶制剂。
5.中国专利cn113082200 a公开了一种肠激酶冻干制剂,其添加1wt.%精氨酸、2.0wt.%海藻糖、5.0wt.%甘露醇和0.01wt.%泊洛沙姆188作为肠激酶的冻干保护剂,肠激酶冻干制剂在冷藏和室温环境下储存一段时间后纯度保留95%以上,活性保持率均在90%以上;此外,各冻干制剂形态未发生明显变化,其复溶后未见明显可见异物。但是该冻干配方对糖胺聚糖合成酶保护效果较差。
6.中国专利cn111826427 a公开了一种pcr扩增试剂的冻干保护剂,其添加4.0wt.%海藻糖、1.0wt.%羟丙基-β-环糊精、0.1wt.%菊糖和0.01wt.%卡拉胶作为pcr扩增试剂冻干保护剂,该配方能有效降低pcr扩增反应体系在使用时形成气溶胶的可能,提高pcr的灵敏度和准确性。但是该冻干配方同样不适用于糖胺聚糖合成酶制剂。
7.中国专利cn102586217 a公开了一种肝素黄杆菌肝素酶i、ii、ii iii的冻干保存方法,其添加10-20mm氯化钙和5-10wt.%海藻糖作为冻干保护剂保护配方,使用该配方冻干后,冻干粉复水后肝素酶i的活性保护率为73.9%,肝素酶ii的活性保护率为98.8%,肝素酶iii的活性保护率为77.4%,可有效维持较高的肝素酶活性。但是使用该配方用于糖胺聚糖合成酶保护保护率较低。
8.中国专利cn104830689 a公开了一种乳酸菌冻干保护剂及其应用,其添加5-30wt.%脱脂奶粉、0.08-0.5wt.%四氢嘧啶作为乳酸菌冻干保护剂配方,该配方可有效保留乳酸菌活性、提高乳酸菌稳定性。但是该冻干保护剂是针对于微生物的保护剂配方,尚未用于酶制剂中。
9.从对现有技术的分析可知,到目前为止,还没有找到一种效果好的、适合于糖胺聚糖合成酶的冻干保护剂。
技术实现要素:
10.针对现有技术存在的不足,本发明提供了一种糖胺聚糖合成酶的冻干保护剂,该冻干保护剂以海藻糖、羟丙基-β-环糊精和四氢嘧啶为有效成分,配方简单,通过它们的协同搭配,对糖胺聚糖合成酶的保护作用显著,添加该冻干保护剂的糖胺聚糖合成酶在冻干后酶活力保护率远优于现有其他冻干保护剂,对糖胺聚糖合成酶在长期的储存和运输过程中的酶活保持率也优于其他冻干保护剂。
11.四氢嘧啶通过稳定蛋白质结构而减少外界因素对蛋白质的破坏作用,在现阶段,四氢嘧啶主要用于护肤品中,保护皮肤免受外界不良因素的影响,鲜少用于酶产品冻干过程的保护。本发明将四氢嘧啶、海藻糖、羟丙基-β-环糊精复配,意外的发现对糖胺聚糖合成酶具有很好的冻干保护作用,效果优异。本发明具体技术方案如下:
12.一种糖胺聚糖合成酶的冻干保护剂,其有效成分为海藻糖、羟丙基-β-环糊精和四氢嘧啶,海藻糖、羟丙基-β-环糊精和四氢嘧啶的质量比为3-8:1-5:0.2-2。
13.优选的,海藻糖、羟丙基-β-环糊精和四氢嘧啶的质量比为5:3:1。
14.进一步的,所述的糖胺聚糖(gags)是长线性多糖,由重复的二糖单元(即两个糖单元)组成,其分为四类,分别为:透明质酸;肝素/硫酸乙酰肝素;硫酸软骨素/硫酸皮肤素;硫酸角质素。所述糖胺聚糖合成酶为合成糖胺聚糖过程中所使用的酶,包括糖基转移酶、糖基修饰酶等。
15.本发明还提供了一种糖胺聚糖合成酶的冻干制剂,该冻干制剂的主要有效成分为糖胺聚糖合成酶和上述糖胺聚糖合成酶的冻干保护剂,除这两者之外,还含有少量的不可避免的水以及酶自身带入的其他成分。其中,糖胺聚糖合成酶的定义与前面所述一致。
16.进一步的,冻干制剂中,冻干保护剂与糖胺聚糖合成酶的质量比为84-300:1。
17.进一步的,所述糖胺聚糖合成酶的比酶活一般为2iu/mg-200iu/mg。比酶活表示单位质量的蛋白质中所具有酶的活力单位数,一般用iu/mg来表示。
18.进一步的,将糖胺聚糖合成酶、上述糖胺聚糖合成酶的冻干保护剂和溶剂混合后进行冷冻干燥,可以制得本发明糖胺聚糖合成酶冻干制剂。所述冷冻干燥的操作可以采用现有技术中报道的常规操作方式。所述溶剂主要作用是实现各成分的均匀混合,所述溶剂包括水、缓冲液等中的一种或多种,缓冲液为适合于糖胺聚糖合成酶的各种缓冲液。
19.在本发明某一具体实施方式中,提供了一种糖胺聚糖合成酶冻干制剂的制备方法,其包括以下步骤:
20.(1)将冻干保护剂和溶剂混合均匀;
21.(2)将糖胺聚糖合成酶的酶液与步骤(1)的混合物混合均匀;
22.(3)将步骤(2)的混合物预冻,然后真空冷冻干燥,得到糖胺聚糖合成酶冻干制剂。
23.进一步的,所述糖胺聚糖合成酶的酶液经过菌种发酵而得,例如可以通过菌种发酵培养、离心收菌、菌体破碎、ni-琼脂糖凝胶纯化的步骤而得,糖胺聚糖合成酶的酶液中,糖胺聚糖合成酶的纯度一般大于等于95%。
24.进一步的,糖胺聚糖合成酶在步骤(2)中的混合物中的浓度为0.05wt.%,海藻糖在步骤(2)中的混合物中的含量为3-8wt.%,羟丙基-β-环糊精在步骤(2)中的混合物中的含量为1-5wt.%,四氢嘧啶在步骤(2)中的混合物中的含量为0.2-2wt.%。“wt.%”是指每100ml液体中所含的成分的克数。
25.优选的,海藻糖在步骤(2)中的混合物中的含量为5wt.%,羟丙基-β-环糊精在步骤(2)中的混合物中的含量为3wt.%,四氢嘧啶在步骤(2)中的混合物中的含量为1wt.%。“wt.%”是指每100ml液体中所含的成分的克数。
26.进一步的,步骤(3)中,预冻在-75~-85℃下进行,时间2小时以上。真空冷冻干燥的温度为-55℃左右,时间在48h以上。
27.本发明具有以下有益效果:
28.1、本发明将海藻糖、羟丙基-β-环糊精和四氢嘧啶复配作为糖胺聚糖合成酶的冻干保护剂,配方简单,通过各组分之间的相互作用,对糖胺聚糖合成酶的冻干保护效果好,可有效减轻冻干对酶活力的损伤,冻干前后其酶活力未发生显著变化,冻干后酶活力保护率优于其它常用保护剂,并且本发明冻干保护剂还能提高糖胺聚糖合成酶在长期的运输和储存过程中的酶活稳定性。
29.2、本发明糖胺聚糖合成酶冻干制剂外观为白色疏松块状冻干粉,具有良好的复溶性,在4℃和25℃下储存90天后酶活力可保持90%以上,稳定性好,利于糖胺聚糖合成酶的运输和长期储存。
具体实施方式
30.下面将结合实施例对本发明的实施方案进行详细描述,下列实施例仅用于说明本发明,本领域技术人员将会理解,而不应视为限定本发明的范围。
31.下述实施例中,“wt.%”是指每100ml液体中所含的成分的克数。
32.实施例1
33.制备用于合成肝素和硫酸乙酰肝素的肝素合酶i纯化酶液,步骤如下:
34.1)工程菌株的构建
35.菌株bl21(de3)-gakfia的具体构建过程,可以参考文献“the second member of the bacterial udp-n-acetyl-d-glucosamine:heparosan alpha-1,4-n-acetyl-d-glucosaminyltransferase superfamily:gakfia from gallibacterium anatis”。
36.2)菌株复苏及发酵培养
37.在-80℃冰箱中取出bl21(de3)-gakfia菌株冻存管接种至lb固体培养基(含100μ
g/ml卡那霉素)中活化,挑单菌落于lb(含100μg/ml卡那霉素)种子培养基中培养(37℃,220r/min),将种子液转接至1l lb(含100μg/ml卡那霉素)液体培养基中扩大培养,培养至od约为0.6时,加入终浓度为0.5mm iptg,于22℃、220r/min条件下诱导16-20h,离心收集菌体,放置于-20℃冰箱备用。
38.3)肝素合酶i的纯化
39.将收集后的菌体使用平衡缓冲液(20mm pbs,ph=8.00;0.1m nacl;10mm咪唑)重悬,加入0.05wt.%的溶菌酶,冰浴放置30min后,置于冰上超声破碎15min(工作2s,关4s);破碎后混悬液于4℃、12000rpm/min下离心30min,收集上清,即为粗酶液。粗酶液使用0.22μm滤膜过滤后经镍柱纯化,上样后依次使用平衡缓冲液、洗杂缓冲液(20mm pbs,ph=8.00;0.1m nacl;40mm咪唑)洗掉多余的杂蛋白,最后用洗脱缓冲液(20mm pbs,ph=8.00;0.1mnacl;250mm咪唑)洗脱得到目的蛋白,得肝素合酶i纯化酶液,该酶纯度》95%,酶的比酶活为6.06iu/mg。
40.实施例2
41.制备用于合成肝素和硫酸乙酰肝素的肝素合酶ii纯化酶液,步骤如下:
42.1)工程菌株的构建
43.菌株bl21(de3)-bths1的构建方法参考专利cn113564139a。
44.2)菌株复苏及发酵培养
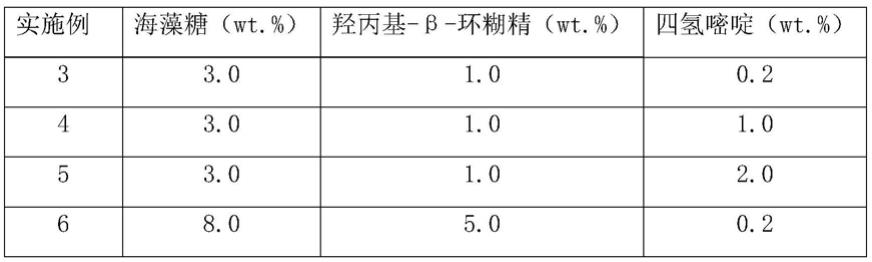
45.在-80℃冰箱中取出bl21(de3)-bths1菌株冻存管接种至lb固体培养基(含卡那霉素100μg/ml)中活化,挑单菌落于lb(含卡那霉素100μg/ml)种子培养基中培养(37℃,220r/min),将种子液转接至1l lb液体培养基(含卡那霉素100μg/ml)中扩大培养,培养至od约为0.6时,加入终浓度为0.5mm iptg,于22℃、220r/min条件下诱导16-20h,离心收集菌体,放置于-20℃冰箱备用。
46.3)肝素合酶ii的纯化
47.肝素合酶ii的纯化过程同“肝素合酶i的纯化”,得肝素合酶ii纯化酶液,该酶纯度》95%,酶的比酶活为108.3iu/mg。
48.实施例3-9
49.一种肝素合酶i的冻干制剂的制备方法,包括以下步骤:
50.1、将四氢嘧啶、海藻糖和羟丙基-β-环糊精用一定量的纯化水溶解,得冻干保护剂溶液,使用无菌滤膜过滤;
51.2、将冻干保护剂溶液与肝素合酶i纯化酶液混合,得总原料液,使肝素合酶i在总原料液中的浓度为0.05wt.%,使四氢嘧啶、海藻糖和羟丙基-β-环糊精在总原料液中的终浓度满足表1要求,水补足100wt.%。
52.表1
[0053][0054][0055]
注:“wt.%”是指每100ml液体中所含的成分的克数。
[0056]
3、将总原料液按照1ml/无菌西林瓶的量进行分装,然后放置于-80℃冰箱预冻2小时以上。
[0057]
4、将预冻好的西林瓶放置于冷冻干燥机中,抽真空,维持48小时以上,得肝素合酶i的冻干制剂。
[0058]
实施例10-16
[0059]
一种肝素合酶ii的冻干制剂的制备方法,包括以下步骤:
[0060]
1、将四氢嘧啶、海藻糖和羟丙基-β-环糊精用一定量的纯化水溶解,得冻干保护剂溶液,使用无菌滤膜过滤;
[0061]
2、将冻干保护剂溶液与肝素合酶ii纯化酶液混合,得总原料液,使肝素合酶ii在总原料液中的浓度为0.05wt.%,使四氢嘧啶、海藻糖和羟丙基-β-环糊精再总原料液中的终浓度满足表2要求,水补足100wt.%。
[0062]
表2
[0063]
实施例海藻糖(wt.%)羟丙基-β-环糊精(wt.%)四氢嘧啶(wt.%)103.01.00.2113.01.01.0123.01.02.0138.05.00.2148.05.01.0158.05.02.0165.03.01.0
[0064]
注:“wt.%”是指每100ml液体中所含的成分的克数。
[0065]
3、将总原料液按照1ml/无菌西林瓶的量进行分装,然后放置于-80℃冰箱预冻2小时以上。
[0066]
4、将预冻好的西林瓶放置于冷冻干燥机中,抽真空,维持48小时以上,得肝素合酶ii的冻干制剂。
[0067]
对比例1-8
[0068]
一种肝素合酶i的冻干制剂的制备方法,包括以下步骤:
[0069]
1、将四氢嘧啶(如果有的话)、海藻糖(如果有的话)和羟丙基-β-环糊精(如果有的话)用一定量的纯化水溶解,得冻干保护剂溶液,使用无菌滤膜过滤;
[0070]
2、将冻干保护剂溶液与肝素合酶i纯化酶液混合,得总原料液,使肝素合酶i在总原料液中的浓度为0.05wt.%,使四氢嘧啶、海藻糖和羟丙基-β-环糊精在总原料液中的终浓度满足表3要求,水补足100wt.%。
[0071]
表3
[0072]
对比例海藻糖(wt.%)羟丙基-β-环糊精(wt.%)四氢嘧啶(wt.%)19.000209.003009.045.004.0508.01.066.03.0075.03.05.085.03.00.05
[0073]
注:“wt.%”是指每100ml液体中所含的成分的克数。
[0074]
3、将总原料液按照1ml/无菌西林瓶的量进行分装,然后放置于-80℃冰箱预冻2小时以上。
[0075]
4、将预冻好的西林瓶放置于冷冻干燥机中,抽真空,维持48小时以上,得肝素合酶i的冻干制剂。
[0076]
对比例9
[0077]
一种肝素合酶i的冻干制剂的制备方法,其步骤与实施例3一致,不同的是:冻干保护剂为蔗糖和赖氨酸盐,蔗糖在总原料液中的终浓度为0.4wt.%,赖氨酸盐在总原料液中的终浓度为0.5wt.%。
[0078]
对比例10
[0079]
一种肝素合酶i的冻干制剂的制备方法,其步骤与实施例3一致,不同的是:冻干保护剂为精氨酸、海藻糖、甘露醇和泊洛沙姆188,精氨酸在总原料液中的终浓度为1wt.%,海藻糖在总原料液中的终浓度为2.0wt.%,甘露醇在总原料液中的终浓度为5.0wt.%,泊洛沙姆188在总原料液中的终浓度为0.01wt.%。
[0080]
对比例11
[0081]
一种肝素合酶i的冻干制剂的制备方法,其步骤与实施例3一致,不同的是:冻干保护剂为海藻糖、羟丙基-β-环糊精、菊糖和卡拉胶,海藻糖在总原料液中的终浓度为4.0wt.%,羟丙基-β-环糊精在总原料液中的终浓度为1.0wt.%,菊糖在总原料液中的终浓度为0.1wt.%,卡拉胶在总原料液中的终浓度为0.01wt.%。
[0082]
对比例12
[0083]
一种肝素合酶i的冻干制剂的制备方法,其步骤与实施例3一致,不同的是:冻干保护剂为氯化钙和海藻糖,氯化钙在总原料液中的终浓度为15mm,海藻糖在总原料液中的终浓度为8.0wt.%。
[0084]
实验例
[0085]
将上述实施例和对比例的冻干制剂分别放置于4℃和25℃的环境下保存0天、7天、15天、30天、60天、90天,观察冻干制剂样品的外观形态、复溶性、酶活力变化的情况,以此来评价冻干保护剂的保护作用。
[0086]
1、各指标测试方式如下:
[0087]
外观形态:肉眼观察。
[0088]
复溶性:冻干制剂加水溶解后的澄清情况。
[0089]
冻干保护率:(冻干后酶活力/冻干前酶活力)*100%。
[0090]
酶活性保持率=(冻干制剂放置后酶活力/放置前酶活力)*100%。
[0091]
各肝素合酶的酶活力定义为:在最适条件下,每小时生成1μmol产物所需的酶量,单位为iu。测定方法如下:
[0092]
肝素合酶酶活力测定反应体系如表4所示;该反应体系置于37℃水浴锅中反应4h,沸水加热5min终止反应,反应液用0.22μm的滤膜过滤后进行hplc检测,hplc检测使用ymc的氨基柱,液相系统为安捷伦液相色谱仪,单糖受体的pnp基团在紫外310nm检测波长下有特异性吸收,检测肝素合酶及其催化产物通过色谱柱分离后各组分在310nm的紫外吸收,流动相流速为0.5ml/min。hplc流动相条件见表5。
[0093]
表4.酶活反应体系
[0094][0095][0096]
glca-pnp:4-硝基苯基-β-d-葡萄糖醛酸,其作用是作为肝素寡糖合成的起始底物;
[0097]
udp-glcnac:尿苷二磷酸-n-乙酰氨基葡萄糖,其作用是为肝素寡糖的合成提供乙酰葡萄糖胺供体。
[0098]
表5.检测肝素寡糖所使用hplc分析方法
[0099]
时间/min1m磷酸氢二钾超纯水00%100%3050%40%31100%0%33100%0%450%100%
[0100]
2、实验结果:
[0101]
2.1各实施例和对比例所得冻干制剂的外观形态、复溶性以及冻干保护率情况如
下表6和7所示:
[0102]
表6
[0103][0104][0105]
表7
[0106] 外观形态复溶性冻干保护率(%)对比例1底部塌陷浑浊,有沉淀53对比例2底部塌陷浑浊46对比例3底部塌陷浑浊51对比例4疏松饼状澄清90对比例5疏松饼状澄清84对比例6疏松饼状澄清93对比例7疏松饼状澄清99对比例8疏松饼状澄清96对比例9底部塌陷浑浊35对比例10底部塌陷浑浊68对比例11疏松饼状澄清92对比例12底部塌陷浑浊68
[0107]
通过上述结果可以看出,实施例3-16的冻干制剂外观形态均为疏松白色饼状固
体,复溶性良好,且肝素合酶i、ii冻干前后酶活力无显著变化,实施例9和16较其他冻干保护剂保护效果更好,为优选方案。对比例1、2、3、9、10和12外观形态出现底部塌陷,复溶后出现白色沉淀并伴有复溶后溶液浑浊现象,且冻干保护率较低,效果差。对比例4、5、6、7、8和11外观和复溶性较好,其中对比例5冻干保护率低于90%,效果较差,对比例4、6、7、8、11冻干保护率高于90%,效果较好。
[0108]
2.2将实施例3-16和对比例4、6、7、8和11的冻干制剂在4℃储存不同时间后观察其外观形态、复溶性,结果如下表8所示:
[0109]
表8
[0110]
[0111]
[0112][0113]
从以上结果可以看出,对比例4、6、7、8和11的冻干制剂在4℃下储存后肝素合酶i的外观形态和复溶性变差,无法满足要求,而实施例3-16的冻干制剂在4℃下储存后外观和复溶性与储存前均无明显差异,稳定性好。
[0114]
2.3将实施例3-16和对比例4、6、7、8和11的冻干制剂在4℃储存不同时间后检测其酶活性保持率,其中将冻干后储存0天的酶活性保持率定义为100%,结果如下表9所示:
[0115]
表9
[0116]
[0117][0118]
从以上结果可以看出,实施例3-16的冻干制剂在4℃下储存90天后肝素合酶i、ii的酶活力保持率依然较高,在96%以上,而对比例4、6、7、8和11的冻干制剂在4℃下储存90天后肝素合酶i的酶活力保持率较低,在81%以下。
[0119]
2.4将实施例3-16和对比例4、6、7、8和11的冻干制剂在25℃储存不同时间后观察其外观形态、复溶性,结果如下表10所示:
[0120]
表10
[0121]
[0122][0123]
从以上结果可以看出,对比例4、6、7、8和11的冻干制剂在25℃下储存后肝素合酶i的外观形态和复溶性变差,无法满足要求,而实施例3-16的冻干制剂在25℃下储存后外观和复溶性与储存前均无明显差异,稳定性好。
[0124]
2.5将实施例3-16和对比例4、6、7、8和11的冻干制剂在25℃储存不同时间后检测其酶活性保持率,其中将冻干后储存0天的酶活性保持率定义为100%,结果如下表11所示:
[0125]
表11
[0126]
[0127][0128]
从以结果可以看出,实施例3-16的冻干制剂在25℃下储存90天后肝素骨架合酶i、ii的酶活力保持率较高,在97%以上,而对比例4、6、7、8和11的冻干制剂在25℃下储存90天后肝素合酶i的酶活力保持率较低,在70%以下。
[0129]
综上可知,本发明的冻干制剂外观为白色疏松块状冻干粉,加水复溶后完全澄清,未见明显异物。冻干前后酶活力未发生明显变化,冻干保护率≧95%。在4℃和25℃下储存90天后酶活力保持率高,均≧90%,符合冻干制剂标准。由此可以看出,本发明的冻干保护剂对肝素合酶有很好的保护作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1