一种长链非编码RNA及其在制备治疗骨质疏松药物中的应用
一种长链非编码rna及其在制备治疗骨质疏松药物中的应用
技术领域
1.本发明属于生物医学技术领域,具体涉及一种长链非编码rna及其在制备治疗骨质疏松药物中的应用。
背景技术:
2.骨质疏松是一种十分常见的老年性骨病,主要表现为骨量减少,骨组织微结构破坏,骨强度降低等,是骨折发生的高危诱因之一。我国目前处于人口老龄化加速进程,骨质疏松将会成为老年人健康的一大威胁。
3.lncrna是长度大于200个核苷酸的非编码rna,广泛分布于真核生物体内,在细胞分化、器官发育和疾病发生等多种生理和病理过程中发挥重要的调控作用。lncrna在骨研究领域已经得到越来越多的关注,新近报道了多种与骨形成密切相关的lncrna。yuan等发现lncrna pgc1β-ot1可以结合mir-148a-3p,促进间充质干细胞的成骨分化,同时抑制其成脂分化。li bing等研究表明,lncrna h19可以激活erk信号通路,对废用性骨质疏松起到治疗效果。此外,申请者在前期研究中亦发现,lncrna-ak016739、ak039312、ak079370均可以抑制成骨分化转录因子的表达,从而对成骨细胞分化和骨形成起抑制作用。
4.rna药物的研究始于1978年,并在近年来受到了越来越多的关注;相对于传统的通过对蛋白质的调控来控制或治愈疾病,rna药物可以从源头上遏制不良基因的表达,进而抑制疾病的发展。目前,美国fda已经批准了多个针对不同疾病的rna类药物。如fomivirsen用于治疗cmv引起的视网膜炎。mipomersen用于治疗家族性高胆固醇血症。pegaptanib治疗年龄相关黄斑变性等等。rna药物获批数量逐年增加充分证明了rna疗法的可行性,也说明了rna疗法作为新一代治疗方案正在快速发展。当前获批rna药物主要基于sirna和mirna这类短核酸,而将mrna和lncrna序列作为rna药物,具有半衰期长,专一性强的特点,目前已经成为了rna药物研究的新方向。同时,目前的rna药物主要基于类似黄斑变性、肝炎等局部疾病和类似亨廷顿病的罕见病,而针对骨质疏松症的rna药物研究,由于靶向性和给药方式的问题,目前仍鲜见报道。
技术实现要素:
5.针对现有技术中的上述不足,本发明提供一种长链非编码rna及其在制备治疗骨质疏松药物中的应用,该序列可通过靶向mir-214-3p对骨质疏松进行治疗,其具有专一性强,安全性高的特性,并将其命名为hope(human-derived osteogenic promoting element)。
6.为实现上述目的,本发明解决其技术问题所采用的技术方案是:
7.一种长链非编码rna,该rna的核苷酸序列如seq id no.1所示。
8.具体序列如下所示:cacccacagccctgcctctcagtccctgccgtcacccacagccctgcctctcagtccctgccgtcacccacagccctgcctctcagtccctgccgt;(seq id no.1)。
9.进一步地,该rna具有至少一个与mir-214-3p或mir-143-3p结合的位点。
10.进一步地,该rna为与seq id no.1所示的核苷酸序列同源性大于80%,且表达相同功能蛋白质的核苷酸序列,具体序列可以是:cacccacagccctgcctctcagtcaactacgtcacccacagccctgcctctcagtcaactacgtcacccacagccctgcctctcagtcaactacgt;(seq id no.2)
11.进一步地,该rna具有至少一个与mir-143-3p结合的位点。
12.进一步地,该rna序列可直接合成,也可通过包括体外转录、重组rna技术等方式形成。
13.上述长链非编码rna在制备诊断骨质疏松的产品中的应用。
14.上述长链非编码rna在筛选用于诊断骨质疏松的产品中的应用。
15.进一步地,该产品包括制剂、芯片、试剂或试剂盒。
16.上述长链非编码rna在制备治疗骨质疏松的rna药物中的应用。
17.上述长链非编码rna在制备治疗骨质疏松的复合药物中的应用。
18.上述rna或药物可通过递送载体经静脉注射、微创骨髓腔局部注射、皮下微针注射等方式递送至骨质疏松患者体内。
19.本发明的有益效果:
20.本发明提供了一种基于人源长链非编码rna ap001476.3设计的rna序列,其能够通过靶向mir-241-3p或mir-143-3p对骨质疏松起到治疗效果,可以作为一种rna药物。
21.本发明所公开的hope序列,既可以通过直接的rna合成方式生产,亦可以通过包括体外转录和重组rna技术等等,不需要繁复的制备工艺及流程,生成后可以直接用于rna治疗。
附图说明
22.图1为ap001476.3对骨形成的调控作用;
23.图2为ap001476.3对骨形成的调控作用;
24.图3为ap001476.3重复区(tail)对骨形成的调控作用;
25.图4为hope序列对骨形成的调控作用;
26.图5为hope对于小鼠前成骨细胞成骨分化的调控作用;
27.图6为hope对于人间充质干细胞成骨分化的调控作用;
28.图7为hope对于小鼠骨形成的促进作用。
具体实施方式
29.下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
30.首先必须声明的是,在本发明中所使用到的试剂、仪器等除非有特殊说明,其它均为市售的产品。
31.以下实施例中所使用的玻璃反应瓶是指带有多个连接头的玻璃反应瓶,其为了实现回流,连接头上分别匹配地连接有温度计、冷凝管。
32.实施例1 ap001476.3对骨形成的调控作用
33.合成ap001476.3全长基因序列,然后按常规方式将其连接到质粒pcdna3.1中,构建了ap001476.3的过表达质粒,通过对骨形成快速检测技术,检测了其对小鼠骨形成的调控作用,结果表明ap001476.3对小鼠骨形成起促进效果(图1),具体检测过程如下:
34.选取2月龄c57bl/6小鼠,将构建的质粒转染至小鼠体内,并采用颅骨皮下局部注射技术体内转染hope序列及其突变体,分别在小鼠处死前10d和3d对所有小鼠进行腹腔注射钙黄绿素(20mg/kg)。实验结束时处死小鼠后取股骨远端,经甲醛固定、梯度蔗糖/oct混合液脱水后,采用oct进行非脱钙包埋。使用冰冻切片机制成4μm厚度的股骨冰冻切片,荧光显微镜拍照,并检测ap001476.3对骨形成的影响。
35.实施例2 ap001476.3的靶点预测
36.通过rna v 22网站,对ap001476.3可以结合的骨形成相关mirna进行了筛查,结果发现ap001476.3可以结合mir-214-3p(图2)。
37.实施例3 ap001476.3功能区对骨形成的调控作用
38.构建了包含有ap001476.3重复区和非重复区序列的过表达质粒pcdna3.1,通过对骨形成快速检测技术,检测了其对小鼠骨形成的调控作用,结果表明ap001476.3的重复区对小鼠骨形成起促进效果,但非重复区则对骨形成无功能(图3)。具体检测过程如下:
39.选取2月龄c57bl/6小鼠,将构建的质粒转染至小鼠体内,并采用颅骨皮下局部注射技术体内转染hope序列及其突变体,分别在小鼠处死前10d和3d对所有小鼠进行腹腔注射钙黄绿素(20mg/kg)。实验结束时处死小鼠后取股骨远端,经甲醛固定、梯度蔗糖/oct混合液脱水后,采用oct进行非脱钙包埋。使用冰冻切片机制成4μm厚度的股骨冰冻切片,荧光显微镜拍照,并检测ap001476.3对骨形成的影响。
40.实施例4 hope序列对骨形成的调控作用
41.1、hope序列对骨形成的促进作用
42.通过分析ap001476.3重复区序列,设计了包含有多个ap001476.3和mir-214-3p结合位点的序列,并命名为“hope”(seq id no.1),同时构建了该序列分别和mir-143-3p和mir-214-3p结合位点突变的序列,将这些序列连接到过表达质粒,并通过对骨形成快速检测技术,检测了其对小鼠骨形成的调控作用,结果表明:hope序列对小鼠骨形成起促进效果,与mir-214-3p结合位点突变的hope序列对骨形成无功能,但与mir-143-3p结合位点突变的hope序列(seq id no.2)对骨形成仍然有促进作用(图4)。
43.2、hope对小鼠前成骨细胞成骨分化的调控
44.采用lipofectamine 2000转染试剂在小鼠前成骨细胞mc3t3-e1中转染hope序列,并检测前成骨细胞mc3t3-e1的成骨分化水平,具体过程如下:
45.(1)细胞培养:将对数生长期的小鼠前成骨细胞mc3t3-e1接种于细胞培养皿中,37℃,5%co2,完全培养基(α-mem添加10%fbs、100units/ml链霉素与100units/ml青霉素)培养。
46.(2)细胞转染:将mc3t3-e1前成骨细胞以1
×
105/孔的密度接种在六孔板中,将培养基换成α-mem,并使用lipofectamine 2000转染试剂对细胞进行转染,转染试剂浓度为2μl/ml,hope序列浓度为20nm。转染后6h,更换为完全培养基,48h后检测细胞成骨分化水平。
47.(3)成骨分化相关基因表达水平:取出细胞后,加trizol裂解细胞,提取rna并将其逆转录为cdna。采用qpcr检测成骨分化相关基因runx2、osterix的表达变化。
48.如图5所示,转染hope序列后,细胞的成骨分化相关基因osterix,runx2表达水平显著升高,说明hope序列促进成骨细胞分化。
49.3、hope对人间充质干细胞成骨分化的调控
50.采用lipofectamine 2000转染试剂在人间充质干细胞中转染hope序列,并检测人间充质干细胞的成骨分化水平,具体过程如下:
51.(1)细胞培养:将对数生长期的人间充质干细胞接种于细胞培养皿中,37℃,5%co2,完全培养基(rpmi1640添加10%fbs、100units/ml链霉素与100units/ml青霉素)培养。
52.(2)细胞转染:将人间充质干细胞以1*105/孔的密度接种在六孔板中,将培养基换成rpmi1640,并使用lipofectamine 2000转染试剂对细胞进行转染,转染试剂浓度为2μl/ml,hope序列浓度为20nm。转染后6h,更换为完全培养基,48h后检测细胞成骨分化水平。
53.(3)成骨分化相关基因表达水平:取出细胞后,加trizol裂解细胞,提取rna并将其逆转录为cdna。采用qpcr检测成骨分化相关基因runx2、osterix的表达变化。
54.如图6所示,转染hope序列后,细胞的成骨分化相关基因osterix,runx2表达水平显著升高,说明hope序列促进成骨细胞分化。
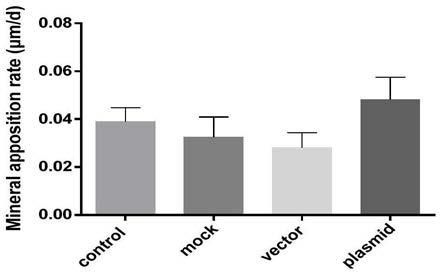
55.4、hope对于小鼠骨形成的促进作用
56.(1)选取2月龄c57bl/6小鼠,在小鼠麻醉后剃净颅骨顶部的毛发,酒精擦拭后使用胰岛素注射器将40μl hope序列局部注射到小鼠颅骨皮下,20天后处死小鼠;
57.(2)骨形成检测:分别在小鼠处死前10d和3d对所有小鼠进行腹腔注射钙黄绿素(20mg/kg)。实验结束时处死小鼠后取股骨远端,经甲醛固定、梯度蔗糖/oct混合液脱水后,采用oct进行非脱钙包埋。使用冰冻切片机制成4μm厚度的股骨冰冻切片,荧光显微镜拍照,并采用image j软件分析骨矿物沉积率和骨形成速率变化。
58.如图7所示,hope序列可以对小鼠骨形成起到促进效果,而hope突变体则并无显著促进效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1