使用免疫检查点抑制剂抗体治疗癌症的方法和组合与流程
1.本披露内容涉及用于治疗癌症的方法、组合物和组合。具体地,本披露内容涉及包括向有需要的受试者施用抗ctla-4抗体或抗原结合片段和抗pd-l1抗体或其抗原结合片段中的至少一种的方法。本披露内容还涉及包含抗ctla-4抗体或抗原结合片段和抗pd-l1抗体或其抗原结合片段中的至少一种的组合。
背景技术:
2.肝细胞癌(hcc)是全球癌症死亡的第三大原因。hcc的当前治疗范例是使用多方式疗法。对于患有早期疾病的患者,治疗基于治愈的意图,并且选择包括手术切除、肝移植和/或局部区域疗法如射频消融术(radiofrequency ablation)。不幸的是,那些没有资格接受治愈性治疗的患者接受其他姑息性局部区域疗法,其主要包括温和的经动脉栓塞术(tae),用含化疗粒子或放射性粒子或者用全身性疗法如索拉非尼、乐伐替尼、卡博替尼和雷莫芦单抗进行的经动脉栓塞术。此外,对于一些晚期患者群体,瑞戈菲尼可能是一种选择。
3.作为晚期hcc的初始治疗(一线疗法),索拉非尼表现出在生存方面的改善,这得到了全球监管部门的批准(llovet等人,n engl j med[新英格兰医学杂志]359(4):378-90(2008))。与索拉非尼相比,基于非劣效的生存结果及改善的总体缓解率(orr)和无进展生存期(pfs),乐伐替尼也被批准为晚期hcc的初始治疗(kudo等人,lancet[柳叶刀]391(10126):1163-73(2018))。瑞戈菲尼已被证明可适度延长二线hcc患者的生存。尽管有各种各样可用的新治疗选择,但晚期hcc患者的总体结局仍然很差。因此,hcc代表了显著未满足的医疗需求。本披露内容描述了解决该未满足的医疗需求的用于治疗hcc的方法、组合物和组合。
技术实现要素:
[0004]
在一方面,本文的披露内容提供了一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用:(i)治疗有效量的抗pd-l1抗体或其抗原结合片段;以及(ii)剂量为1mg/kg至10mg/kg的抗ctla-4抗体或其抗原结合片段。
[0005]
在另一方面,本文的披露内容提供了一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用:(i)治疗有效量的抗pd-l1抗体或其抗原结合片段;以及(ii)平剂量为75mg至1120mg的抗ctla-4抗体或其抗原结合片段。
[0006]
在另一方面,本文的披露内容提供了一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用剂量为5mg/kg至15mg/kg的抗ctla-4抗体或其抗原结合片段。
[0007]
在又另一方面,本文的披露内容提供了一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用平剂量为650mg至850mg的抗ctla-4抗体或其抗原结合片段。
[0008]
在另一方面,本文的披露内容提供了一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含:(i)治疗有效量的抗pd-l1抗体或其抗原结合片段;以及(ii)剂量为
1mg/kg至10mg/kg的抗ctla-4抗体或其抗原结合片段。
[0009]
在另一方面,本文的披露内容提供了一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含:(i)治疗有效量的抗pd-l1抗体或其抗原结合片段;以及(ii)平剂量为75mg至1120mg的抗ctla-4抗体或其抗原结合片段。
[0010]
在又另一方面,本文的披露内容提供了一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含剂量为5mg/kg至15mg/kg的抗ctla-4抗体或其抗原结合片段。
[0011]
在又另一方面,本文的披露内容提供了一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含平剂量为650mg至850mg的抗ctla-4抗体或其抗原结合片段。
附图说明
[0012]
图1说明了如实例1中所披露的,单独使用度伐鲁单抗和曲美木单抗以及组合使用二者的治疗的研究流程图。
[0013]
图2说明了如实例1中所述披露的himalaya研究的给药方案。
[0014]
图3说明了实例2中所披露的研究的总体设计。
[0015]
图4示出了实例2中所披露的研究的给药方案。
[0016]
图5示出了实例2中所披露的研究的每组的总体生存率(os)。
[0017]
图6示出了实例2中所披露的研究中所治疗的患者的os、生存率和总治疗持续时间。
[0018]
图7示出了无论pd-l1表达水平或病毒状态如何,都观察到了实例2中所披露的研究的缓解。图7a示出了对用度伐鲁单抗1500mg加曲美木单抗300mg进行的组合疗法(t300+d)的缓解。图7b示出了对1500mg度伐鲁单抗单一疗法(d)的缓解。图7c示出了对曲美木单抗750mg单一疗法(t)的缓解。图7d示出了对用度伐鲁单抗1500mg加曲美木单抗75mg进行的组合疗法(t75+d)的缓解。
[0019]
图8示出了实例2中所披露的研究中测量的次要终点。
[0020]
图9示出了实例2中所披露的患者群体的药效生物标志物分析的结果。
[0021]
图10示出了对实例2中所披露的研究的靶病灶相对基线的最佳缓解。
[0022]
图11示出了实例2中所披露的研究的pfs的kaplan-meier分析。
[0023]
图12示出了实例2中所披露的研究的淋巴细胞群体计数与标准(canon)-1或标准-2得分的相关性(相关系数>0.1)。
[0024]
图13示出了通过第1天和第15天的缓解对实例2中所披露的研究的患者样品进行的cd3+cd8+ki67+ t细胞分析。
[0025]
图14示出了实例2中所披露的研究中所有组的t细胞的基线丰富度或辛普森克隆形成能力(simpson clonality)没有显著差异。
[0026]
图15示出了更大的t细胞克隆扩增与缓解相关并且由更高剂量的曲美木单抗(t)驱动。
[0027]
图16示出了更大的t细胞克隆扩增与更好的os相关,并且在实例2中所披露的研究中的度伐鲁单抗+曲美木单抗(d+ t)组合组中观察到。
具体实施方式
[0028]
本披露内容涉及用于治疗癌症的方法、组合物和组合。具体地,本披露内容涉及包括向有需要的受试者施用抗ctla-4抗体或抗原结合片段和抗pd-l1抗体或其抗原结合片段中的至少一种的方法。本披露内容还涉及包含抗ctla-4抗体或抗原结合片段和抗pd-l1抗体或其抗原结合片段中的至少一种的组合。
[0029]
如根据本披露内容所使用的,除非另外指出,否则所有技术和科学术语应被理解为具有与本领域普通技术人员通常理解的相同含义。除非上下文另有要求,否则单数术语应包括复数形式,并且复数术语应包括单数形式。
[0030]
在一些实施例中,本文提供了一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用治疗有效量的抗pd-l1抗体或其抗原结合片段,以及剂量为1mg/kg至5mg/kg的抗ctla-4抗体或其抗原结合片段。
[0031]
在一些实施例中,本文提供了一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用治疗有效量的抗pd-l1抗体或其抗原结合片段,以及平剂量为75mg至1120mg的抗ctla-4抗体或其抗原结合片段。
[0032]
在一些实施例中,本文提供了一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用剂量为5mg/kg至15mg/kg的抗ctla-4抗体或其抗原结合片段。
[0033]
在一些实施例中,本文提供了一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含治疗有效量的抗pd-l1抗体或其抗原结合片段和剂量为1mg/kg至5mg/kg的抗ctla-4抗体或其抗原结合片段。
[0034]
在一些实施例中,本文提供了一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含治疗有效量的抗pd-l1抗体或其抗原结合片段和平剂量为75mg至1120mg的抗ctla-4抗体或其抗原结合片段。
[0035]
在一些实施例中,本文提供了一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含剂量为5mg/kg至15mg/kg的抗ctla-4抗体或其抗原结合片段。
[0036]
如本文所用,术语“抗体”是指能够识别并特异性结合抗原的蛋白质。普通的或常规的哺乳动物抗体包含四聚体,其通常由两对相同的多肽链构成,每对由一条“轻”链(通常具有约25kda的分子量)和一条“重”链(通常具有约50-70kda的分子量)组成。如本文所用,术语“重链”和“轻链”是指具有足够的可变结构域序列以赋予对靶抗原的特异性的任何免疫球蛋白多肽。每条轻链和重链的氨基末端部分典型地包括通常负责抗原识别的约100个至110个或更多个氨基酸的可变结构域。每条链的羧基末端部分典型地定义负责效应子功能的恒定结构域。因此,在天然存在的抗体中,全长重链免疫球蛋白多肽包括可变结构域(vh)和三个恒定结构域(c
h1
、c
h2
和c
h3
)以及c
h1
和c
h2
之间的铰链区,其中该vh结构域位于多肽的氨基末端且该c
h3
结构域位于羧基末端,并且全长轻链免疫球蛋白多肽包括可变结构域(v
l
)和恒定结构域(c
l
),其中该v
l
结构域位于多肽的氨基末端且该c
l
结构域位于羧基末端。
[0037]
在全长轻链和重链内,可变结构域和恒定结构域通常由约12个或更多个氨基酸的“j”区域连接,重链还包括约10个以上氨基酸的“d”区域。每个轻/重链对的可变区通常形成抗原结合位点。天然存在的抗体的可变结构域通常表现出由三个高变区(也称为互补决定区或cdr)连接的相对保守的框架区(fr)的相同的一般结构。来自每对的两条链的cdr通常通过框架区比对,这可以使得能够结合至特定表位。从氨基末端到羧基末端,轻链和重链可
变结构域通常都包含结构域fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。
[0038]
术语“抗原结合片段”是指完整抗体的一部分,并且/或是指完整抗体的抗原决定可变结构域。已知的是,抗体的抗原结合功能可以由全长抗体的片段来执行。抗体片段的实例包括但不限于:fab、fab
′
、f(ab
′
)2和fv片段,线性抗体,单链抗体,双体抗体,以及由抗体片段形成的多特异性抗体。
[0039]
在一些实施例中,该抗pd-l1抗体或其抗原结合片段是度伐鲁单抗。度伐鲁单抗(medi4736,)是针对人pd-l1的能够阻断pd-l1与pd1和cd80受体两者的结合的人单克隆抗体。与度伐鲁单抗相关的披露内容可以发现于美国专利号8,779,108和9,493,565中,将其通过引用并入本文。
[0040]
用于在本文提供的方法、组合物和组合中使用的度伐鲁单抗及其抗原结合片段包含重链和轻链或重链可变区和轻链可变区。在一些实施例中,用于在本文提供的方法、组合物和组合中使用的度伐鲁单抗或其抗原结合片段包含轻链可变区和重链可变区,该轻链可变区包含seq id no:1的氨基酸序列,该重链可变区包含seq id no:2的氨基酸序列。在一些实施例中,用于在本文提供的方法、组合物和组合中使用的度伐鲁单抗或其抗原结合片段包含重链可变区和轻链可变区,其中该重链可变区包含seq id no:3-5的卡巴特(kabat)定义的cdr1、cdr2和cdr3序列,并且其中该轻链可变区包含seq id no:6-8的卡巴特定义的cdr1、cdr2和cdr3序列。本领域普通技术人员将能够容易地鉴定本领域普通技术人员已知的乔西亚(chothia)定义的、abm定义的或其他的cdr定义。在一些实施例中,用于在本文提供的方法、组合物和组合中使用的度伐鲁单抗或其抗原结合片段包含如在美国专利号8,779,108和9,493,565(将其通过引用以其全文并入本文)中披露的2.14h9opt抗体的可变重链和可变轻链cdr序列。
[0041]
度伐鲁单抗轻链(lc)可变区:
[0042][0043]
度伐鲁单抗重链(hc)可变区:
[0044][0045]
度伐鲁单抗重链cdr:
[0046]
hc-cdr1:gftfsrywms(seq id no:3)
[0047]
hc-cdr2:nikqdgsekyyvdsvkg(seq id no:4)
[0048]
hc-cdr3:eggwfgelafdy(seq id no:5)
[0049]
度伐鲁单抗,轻链cdr:
[0050]
lc-cdr1:rasqrvsssyla(seq id no:6)
[0051]
lc-cdr2:dassrat(seq id no:7)
[0052]
lc-cdr3:qqygslpwt(seq id no:8)
[0053]
在一些实施例中,该抗ctla-4抗体或其抗原结合片段是曲美木单抗。用于在本文提供的方法、组合物和组合中使用的曲美木单抗及其抗原结合片段包含重链和轻链或重链
可变区和轻链可变区。在一些实施例中,用于在本文提供的方法、组合物和组合中使用的曲美木单抗或其抗原结合片段包含轻链可变区和重链可变区,该轻链可变区包含seq id no:9的氨基酸序列,该重链可变区包含seq id no:10的氨基酸序列。在一些实施例中,用于在本文提供的方法、组合物和组合中使用的曲美木单抗或其抗原结合片段包含重链可变区和轻链可变区,其中该重链可变区包含seq id no:11-13的卡巴特定义的cdr1、cdr2和cdr3序列,并且其中该轻链可变区包含seq id no:14-16的卡巴特定义的cdr1、cdr2和cdr3序列。本领域普通技术人员将能够容易地鉴定本领域普通技术人员已知的乔西亚定义的、abm定义的或其他的cdr定义。在一些实施例中,用于在本文提供的方法、组合物和组合中使用的曲美木单抗或其抗原结合片段包含或如在美国专利号6,682,736(将其通过引用以其全文并入本文)中披露的11.2.1抗体的可变重链和可变轻链cdr序列。
[0054]
曲美木单抗轻链(lc)可变区:
[0055][0056]
曲美木单抗重链(hc)可变区:
[0057][0058]
曲美木单抗重链cdr:
[0059]
hc-cdr1:gftfssygmh(seq id no:11)
[0060]
hc-cdr2:viwydgsnkyyadsv(seq id no:12)
[0061]
hc-cdr3:dprgatlyyyyygmdv(seq id no:13)
[0062]
曲美木单抗轻链cdr1
[0063]
lc-cdr1:rasqsinsyld(seq id no:14)
[0064]
lc-cdr2:aasslqs(seq id no:15)
[0065]
lc-cdr3:qqyystpft(seq id no:16)
[0066]
如本文所用,术语“血管内皮生长因子(vegf)抑制剂”意指抑制vegf和vegfr的活性的药剂。vegr和vegfr(酪氨酸激酶受体)信号传导调节血管生成,这涉及从现有血管中制造新血管。已知在癌症、退行性眼病和其他涉及炎症的病症中可发生异常的血管生成。特定的单克隆抗体可用作vegf抑制剂,并且特定的酪氨酸激酶抑制剂用作vegfr抑制剂。血管内皮生长因子(vegf)/血管内皮生长因子受体(vegfr)抑制剂用于治疗各种类型的癌症。
[0067]
术语“受试者”旨在包括人和非人动物、特别是哺乳动物。在某些实施例中,该受试者是人患者。
[0068]
在一些实施例中,本文披露的方法、组合物和组合涉及治疗受试者的肿瘤障碍和/或癌症障碍。在一些实施例中,该肿瘤是实体瘤。在一些实施例中,该癌症选自肝细胞癌(hcc)、胆管癌或胆道癌、膀胱尿路上皮癌(ubc)或胃癌。
[0069]
如本文所用,术语“实体瘤”是指通常不包含囊肿或液体区域的异常组织块。
[0070]
如本文所用,术语“治疗(treatment或treat)”是指治疗性治疗和预防性
(prophylactic或preventative)措施两者。需要治疗的受试者包括患有癌症的那些以及易于患上癌症的那些或要预防癌症的那些。在一些实施例中,本文披露的方法、组合物和组合可以用于治疗癌症。在其他实施例中,需要治疗的受试者包括患有肿瘤的那些以及易于患上肿瘤的那些或要预防肿瘤的那些。在某些实施例中,本文披露的方法、组合物和组合可以用于治疗肿瘤。在其他实施例中,肿瘤的治疗包括抑制肿瘤生长、促进肿瘤减小、或既抑制肿瘤生长又促进肿瘤减小。
[0071]
如本文所用,术语“施用(administration或administering)”是指通过任何适当的途径提供、接触和/或递送一种或多种化合物以实现所需效果。施用可以包括但不限于口服、舌下、肠胃外(例如,静脉内、皮下、皮内、肌内、关节内、动脉内、滑膜内、胸骨内、鞘内、病灶内或颅内注射)、透皮、局部、颊、直肠、阴道、鼻、眼、经由吸入以及植入物。
[0072]
本文提供了在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用剂量为5mg/kg至15mg/kg的抗ctla-4抗体或其抗原结合片段。在一些实施例中,本文提供了一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用平剂量为650mg至850mg的抗ctla-4抗体或其抗原结合片段。
[0073]
本文还提供了用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含剂量为5mg/kg至15mg/kg的抗ctla-4抗体或其抗原结合片段。在一些实施例中,本文提供了用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含平剂量为650mg至850mg的抗ctla-4抗体或其抗原结合片段。
[0074]
要向受试者施用的抗ctla-4抗体或其抗原结合片段的剂量将部分地根据受试者的体型(体重、体表或器官大小)和状况(年龄和总体健康)而变化。
[0075]
在特定的实施例中,向受试者施用一个或多个剂量的抗ctla-4抗体或其抗原结合片段,其中该剂量是5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg或15mg/kg。在一些实施例中,向受试者施用一个或多个剂量的抗ctla-4抗体或其抗原结合片段,其中该剂量是10mg/kg。
[0076]
在特定的实施例中,向受试者施用一个或多个平剂量的抗ctla-4抗体或其抗原结合片段,其中该剂量是650mg、675mg、700mg、725mg、750mg、775mg、800mg、825mg、850mg、875mg、900mg、925mg、950mg、975mg、1000mg、1025mg、1050mg、1075mg、1100mg或1120mg。在一些实施例中,向受试者施用一个或多个平剂量的抗ctla-4抗体或其抗原结合片段,其中该剂量是750mg。
[0077]
在特定的实施例中,向患有肿瘤的受试者仅一次或不频繁地施用抗ctla-4抗体或其抗原结合片段,同时仍然为该受试者提供益处。在其他实施例中,向受试者施用另外的后继剂量。可以取决于受试者的年龄、体重、临床评估、肿瘤负荷和/或其他因素(包括主治医师的判断),以不同时间间隔施用后继剂量。
[0078]
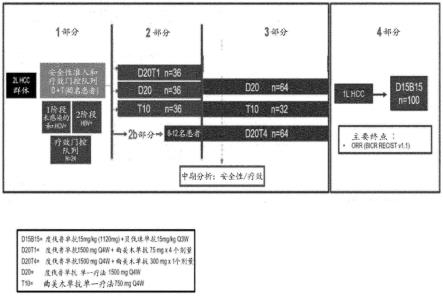
在特定的实施例中,在两周治疗期内、在四周治疗期内、在六周治疗期内、在八周治疗期内、在十二周治疗期内、在二十四周治疗期内或在一年或更长时间的治疗期内施用抗ctla-4抗体或其抗原结合片段。在某些实施例中,在三周治疗期内、在六周治疗期内、在九周治疗期内、在十二周治疗期内、在二十四周治疗期内或在一年或更长时间的治疗期内施用抗ctla-4抗体或其抗原结合片段。在某些实施例中,在两个月治疗期内、在四个月治疗期内或在六个月或更长时间的治疗期内施用抗ctla-4抗体或其抗原结合片段。
[0079]
在特定的实施例中,将抗ctla-4抗体或其抗原结合片段每周、每两周、每四周、每六周、每八周、每十周或每十二周施用一次。
[0080]
在特定的实施例中,本文提供了用于在有需要的受试者中治疗肿瘤的方法、组合物和组合,其中向该受试者以10mg/kg的剂量每四周施用一次,共七个剂量的曲美木单抗,随后向该受试者以10mg/kg的剂量每十二周施用一次曲美木单抗。在特定的实施例中,本文提供了用于在有需要的受试者中治疗肿瘤的方法、组合物和组合,其中向该受试者以750mg的剂量每四周施用一次,共七个剂量的曲美木单抗,随后向该受试者以750mg的剂量每十二周施用一次曲美木单抗。
[0081]
如本文所用,“共同施用”、“组合”或“组合疗法”是指同时或顺序施用多种化合物或药剂。第一化合物或药剂可以在施用第二化合物或药剂之前、与其同时或之后施用。第一化合物或药剂和第二化合物或药剂可以在同一天同时或顺序施用,或者可以在1天、2天、3天、4天、5天、6天、1周、2周、3周或1个月内彼此顺序施用。在一些实施例中,化合物或药剂在每种化合物或药剂发挥至少某种生理作用和/或具有剩余功效的期间共同施用。
[0082]
在一些实施例中,抗ctla-4抗体或其抗原结合片段可以与抗pd-l1抗体或其抗原结合片段组合施用。
[0083]
抗ctla-4抗体或其抗原结合片段与抗pd-l1抗体或其抗原结合片段的组合疗法剂量将部分地根据受试者的体型(体重、体表或器官大小)和状况(年龄和总体健康)而变化。在特定的实施例中,向受试者施用一个或多个剂量的抗ctla-4或其抗原结合片段作为组合疗法,其中该剂量是1mg/kg、2mg/kg、3mg/kg、4mg/kg或5mg/kg。在特定的实施例中,向受试者施用一个或多个平剂量的抗ctla-4抗体或其抗原结合片段,其中该剂量是75mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg或500mg。
[0084]
抗pd-l1抗体或其抗原结合片段的组合疗法剂量将部分地根据受试者的体型(体重、体表或器官大小)和状况(年龄和总体健康)而变化。在特定的实施例中,向受试者施用一个或多个剂量的抗pd-l1抗体或其抗原结合片段作为组合疗法,其中该剂量是15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg或25mg/kg。在特定的实施例中,向受试者施用一个或多个平剂量的抗pd-l1抗体或其抗原结合片段,其中该剂量是1110mg、1125mg、1150mg、1175mg、1200mg、1225mg、1250mg、1275mg、1300mg、1325mg、1350mg、1375mg、1400mg、1425mg、1450mg、1475mg、1500mg、1525mg、1550mg、1575mg或1600mg。
[0085]
在特定的实施例中,向患有肿瘤的受试者仅一次或不频繁地施用组合疗法,同时仍然为该受试者提供益处,该组合疗法包含抗ctla-4抗体或其抗原结合片段和抗pd-l1抗体或其抗原结合片段。在另外的实施例中,向受试者施用另外的后继剂量。可以取决于受试者的年龄、体重、临床评估、肿瘤负荷和/或其他因素(包括主治医师的判断),以不同时间间隔施用后继剂量。
[0086]
在特定的实施例中,在两周治疗期内、在四周治疗期内、在六周治疗期内、在八周治疗期内、在十二周治疗期内、在二十四周治疗期内或在一年或更长时间的治疗期内向受试者施用组合疗法,该组合疗法包含抗ctla-4抗体或其抗原结合片段和抗pd-l1抗体或其抗原结合片段。在特定的实施例中,在三周治疗期内、在六周治疗期内、在九周治疗期内、在
十二周治疗期内、在二十四周治疗期内或在一年或更长时间的治疗期内向受试者施用组合疗法,该组合疗法包含抗ctla-4抗体或其抗原结合片段和抗pd-l1抗体或其抗原结合片段。
[0087]
在特定的实施例中,向受试者每两周、每四周、每六周、每八周、每十周或每十二周一次施用组合疗法,该组合疗法包含抗ctla-4抗体或其抗原结合片段和抗pd-l1抗体或其抗原结合片段。
[0088]
在特定的实施例中,将抗pd-l1抗体或其抗原结合片段和抗ctla-4抗体或其抗原结合片段同时、分开或顺序施用。
[0089]
在特定的实施例中,向受试者施用四次组合疗法,随后每四周施用一次抗pd-l1抗体或其抗原结合片段,该组合疗法包含抗ctla-4抗体或其抗原结合片段和抗pd-l1抗体或其抗原结合片段。
[0090]
在特定的实施例中,向受试者施用一个剂量的组合疗法,随后每四周施用一次抗pd-l1抗体或其抗原结合片段,该组合疗法包含抗pd-l1抗体或其抗原结合片段和抗ctla-4抗体或其抗原结合片段。
[0091]
在特定的实施例中,施用包含抗pd-l1抗体或其抗原结合片段和抗ctla-4抗体或其抗原结合片段的组合疗法,其中该抗pd-l1抗体或其抗原结合片段是以20mg/kg的剂量施用的度伐鲁单抗,该抗ctla-4抗体或其抗原结合片段是以1mg/kg的剂量施用的曲美木单抗。
[0092]
在特定的实施例中,向受试者施用包含抗pd-l1抗体或其抗原结合片段和抗ctla-4抗体或其抗原结合片段的组合疗法,其中该抗pd-l1抗体或其抗原结合片段是剂量为1500mg的度伐鲁单抗,该抗ctla-4抗体或其抗原结合片段是剂量为75mg的曲美木单抗。
[0093]
在特定的实施例中,向受试者施用包含抗pd-l1抗体或其抗原结合片段和抗ctla-4抗体或其抗原结合片段的组合疗法,其中该抗pd-l1抗体或其抗原结合片段是剂量为1500mg的度伐鲁单抗,该抗ctla-4抗体或其抗原结合片段是剂量为300mg的曲美木单抗。
[0094]
在某些实施例中,组合治疗进一步包括施用vegfr酪氨酸激酶抑制剂(tki),其包括但不限于:阿柏西普、贝伐珠单抗、帕唑帕尼、舒尼替尼、索拉非尼、乐伐替尼、卡博替尼、瑞戈菲尼、帕纳替尼、雷莫芦单抗和凡德他尼。在某些实施例中,组合治疗进一步包括施用抗tigit抗体、莫那利珠单抗、齐墩果酸和/或奥来鲁单抗。
[0095]
本文所披露的方法、组合物和组合可以进一步与常规的癌症疗法组合以治疗患有肿瘤或携带癌细胞的受试者,这些常规的癌症疗法是例如温和的经动脉栓塞术(tae)、用含化疗粒子或放射性粒子进行的经动脉栓塞术、化疗、放射疗法、热疗法、手术(肿瘤切除)和tace(经动脉化疗栓塞术)。在特定的实施例中,方法、组合物和组合进一步包括向受试者施用tace。
[0096]
如本文所用,术语“药物组合物”或“治疗性组合物”是指当适当地向受试者施用时能够诱导所需治疗效果的化合物或组合物。在一些实施例中,本披露内容提供了药物组合物,其包含药学上可接受的载体和治疗有效量的至少一种本披露内容的抗体。
[0097]
如本文所用,术语“药学上可接受的载体”或“生理上可接受的载体”是指适合于完成或增强本披露内容的一种或多种抗体的递送的一种或多种配制品材料。
[0098]
当用于体内施用时,本披露内容的配制品应是无菌的。本披露内容的配制品可以通过各种灭菌方法(包括例如无菌过滤或放射)灭菌。在一个实施例中,将该配制品用预先
灭菌的0.22微米过滤器进行过滤灭菌。注射用无菌组合物可以按照如在“remington:the science&practice of pharmacy[雷明顿:药学科学与实践],”第21版,lippincott williams&wilkins[利平科特
·
威廉斯
·
威尔金斯出版公司],(2005)中描述的常规制药实践来配制。
[0099]
在一些实施例中,可以将抗体配制用于特定施用途径,如口服、鼻、肺、局部(包括颊和舌下)、直肠、阴道和/或肠胃外施用。如本文所用,术语“肠胃外施用”和“肠胃外施用的”是指除了肠道和局部施用以外的施用方式(通常通过注射),并且包括但不限于静脉内、肌内、动脉内、鞘内、囊内、眼眶内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注。本披露内容的适合于局部或经皮施用的配制品包括粉剂、喷雾剂、软膏剂、糊剂、乳剂、洗剂、凝胶剂、溶液、贴剂以及吸入剂。这些抗体和其他活性物可以在无菌条件下与药学上可接受的载体混合、并且与可能要求的任何防腐剂、缓冲剂、或推进剂混合(参见,例如,美国专利号7,378,110;7,258,873;以及7,135,180;美国专利申请公开号2004/0042972和2004/0042971)。
[0100]
这些配制品可以以单位剂型呈现,并且可以通过药学领域已知的任何方法制备。本披露内容的配制品中的活性成分的实际剂量水平可以变化以便于获得有效实现对于特定受试者、组合物和施用方式所需的治疗缓解而对该受试者无毒的活性成分的量(例如,“治疗有效量”)。还可以将剂量经由连续输注(如通过泵)施用。施用剂量还可取决于施用途径。例如,皮下施用可能需要比静脉内施用更高的剂量。
[0101]
在不限制本披露内容的情况下,本文出于说明目的描述了本披露内容的多个实施例。
[0102]
项目1.一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用:(i)治疗有效量的抗pd-l1抗体或其抗原结合片段;以及(ii)剂量为1mg/kg至10mg/kg的抗ctla-4抗体或其抗原结合片段。
[0103]
项目2.根据项目1所述的方法,其中将该抗ctla-4抗体或其抗原结合片段以1mg/kg的剂量施用。
[0104]
项目3.根据项目1或2所述的方法,其中将该抗pd-l1抗体或其抗原结合片段以15mg/kg至25mg/kg的剂量施用。
[0105]
项目4.根据项目1至3中任一项所述的方法,其中该抗ctla-4抗体或其抗原结合片段是曲美木单抗。
[0106]
项目5.根据项目1至4中任一项所述的方法,其中该抗pd-l1抗体或其抗原结合片段是度伐鲁单抗。
[0107]
项目6.根据项目1至5中任一项所述的方法,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段每四周施用一次。
[0108]
项目7.根据项目6所述的方法,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段每四周施用一次,共四个剂量,随后将该抗pd-l1抗体或其抗原结合片段每四周施用一次。
[0109]
项目8.根据项目1至7中任一项所述的方法,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段同时、分开或顺序施用。
[0110]
项目9.根据项目1至8中任一项所述的方法,该方法进一步包括施用经动脉化疗栓
塞术(tace)。
[0111]
项目10.根据项目1至9中任一项所述的方法,其中该肿瘤是肝细胞癌(hcc)。
[0112]
项目11.根据项目1至10中任一项所述的方法,其中该抗pd-l1抗体或其抗原结合片段是以20mg/kg的剂量施用的度伐鲁单抗,并且该抗ctla-4抗体或其抗原结合片段是以1mg/kg的剂量施用的曲美木单抗。
[0113]
项目12.一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用:(i)治疗有效量的抗pd-l1抗体或其抗原结合片段;以及(ii)平剂量为75mg至1120mg的抗ctla-4抗体或其抗原结合片段。
[0114]
项目13.根据项目12所述的方法,其中将该抗pd-l1抗体或其抗原结合片段以1000mg至1600mg的剂量施用。
[0115]
项目14.根据项目12所述的方法,其中将该抗ctla-4抗体或其抗原结合片段以75mg的剂量施用。
[0116]
项目15.根据项目12所述的方法,其中将该抗ctla-4抗体或其抗原结合片段以300mg的剂量施用。
[0117]
项目16.根据项目12至15中任一项所述的方法,其中该抗ctla-4抗体或其抗原结合片段是曲美木单抗。
[0118]
项目17.根据项目12至16中任一项所述的方法,其中该抗pd-l1抗体或其抗原结合片段是度伐鲁单抗。
[0119]
项目18.根据项目12至17中任一项所述的方法,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段每四周施用一次。
[0120]
项目19.根据项目18所述的方法,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段每四周施用一次,共四个剂量,随后将该抗pd-l1抗体或其抗原结合片段每四周施用一次。
[0121]
项目20.根据项目12至19中任一项所述的方法,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段施用一个剂量,随后将该抗pd-l1抗体或其抗原结合片段每四周施用一次。
[0122]
项目21.根据项目12至20中任一项所述的方法,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段同时、分开或顺序施用。
[0123]
项目22.根据项目12至21中任一项所述的方法,该方法进一步包括施用经动脉化疗栓塞术(tace)。
[0124]
项目23.根据项目12至22中任一项所述的方法,其中该肿瘤是肝细胞癌(hcc)。
[0125]
项目24.根据项目12至23中任一项所述的方法,其中该抗pd-l1抗体或其抗原结合片段是以1500mg的剂量施用的度伐鲁单抗,并且该抗ctla-4抗体或其抗原结合片段是以75mg的剂量施用的曲美木单抗。
[0126]
项目25.根据项目13至25中任一项所述的方法,其中该抗pd-l1抗体或其抗原结合片段是以1500mg的剂量施用的度伐鲁单抗,并且该抗ctla-4抗体或其抗原结合片段是以300mg的剂量施用的曲美木单抗。
[0127]
项目26.一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用剂量为5mg/kg至15mg/kg的抗ctla-4抗体或其抗原结合片段。
[0128]
项目27.一种在有需要的受试者中治疗肿瘤的方法,该方法包括向该受试者施用平剂量为650mg至850mg的抗ctla-4抗体或其抗原结合片段。
[0129]
项目28.根据项目26所述的方法,其中将该抗ctla-4抗体或其抗原结合片段以10mg/kg的剂量施用。
[0130]
项目29.根据项目27所述的方法,其中将该抗ctla-4抗体或其抗原结合片段以750mg的剂量施用。
[0131]
项目30.根据项目26至29中任一项所述的方法,其中该抗ctla-4抗体或其抗原结合片段是曲美木单抗。
[0132]
项目31.根据项目26至30中任一项所述的方法,其中将该抗ctla-4抗体或其抗原结合片段每四周施用一次。
[0133]
项目32.根据项目26至30中任一项所述的方法,其中将该抗ctla-4抗体或其抗原结合片段每十二周施用一次。
[0134]
项目33.根据项目26至30中任一项所述的方法,该方法进一步包括施用经动脉化疗栓塞术(tace)。
[0135]
项目34.根据项目28至33中任一项所述的方法,其中该肿瘤是肝细胞癌(hcc)。
[0136]
项目35.根据项目27所述的方法,其中该抗ctla-4抗体或其抗原结合片段是以750mg的剂量每四周施用一次,共七个剂量的曲美木单抗,随后以750mg的剂量每十二周施用一次曲美木单抗。
[0137]
项目36.一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含:(i)治疗有效量的抗pd-l1抗体或其抗原结合片段;以及(ii)剂量为1mg/kg至10mg/kg的抗ctla-4抗体或其抗原结合片段。
[0138]
项目37.根据项目36所述的组合,其中该抗ctla-4抗体或其抗原结合片段的剂量是1mg/kg。
[0139]
项目38.根据项目36或37所述的组合,其中该抗pd-l1抗体或其抗原结合片段的剂量是15mg/kg至25mg/kg。
[0140]
项目39.根据项目36至38中任一项所述的组合,其中该抗ctla-4抗体或其抗原结合片段是曲美木单抗。
[0141]
项目40.根据项目36至39中任一项所述的组合,其中该抗pd-l1抗体或其抗原结合片段是度伐鲁单抗。
[0142]
项目41.根据项目36至40中任一项所述的组合,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段向该受试者每四周施用一次。
[0143]
项目42.根据项目41所述的组合,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段向该受试者每四周施用一次,共四个剂量,随后将该抗pd-l1抗体或其抗原结合片段向该受试者每四周施用一次。
[0144]
项目43.根据项目36至42中任一项所述的组合,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段向受试者同时、分开或顺序施用。
[0145]
项目44.根据项目36至43中任一项所述的组合,其中该组合进一步包括向该受试者施用经动脉化疗栓塞术(tace)。
[0146]
项目45.根据项目36至44中任一项所述的组合,其中该肿瘤是肝细胞癌(hcc)。
[0147]
项目46.根据项目36至45中任一项所述的组合,其中该抗pd-l1抗体或其抗原结合片段是20mg/kg剂量的度伐鲁单抗,并且该抗ctla-4抗体或其抗原结合片段是1mg/kg剂量的曲美木单抗。
[0148]
项目47.一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含:(i)治疗有效量的抗pd-l1抗体或其抗原结合片段;以及(ii)平剂量为75mg至1120mg的抗ctla-4抗体或其抗原结合片段。
[0149]
项目48.根据项目47所述的组合,其中该抗pd-l1抗体或其抗原结合片段的剂量是1000mg至1600mg。
[0150]
项目49.根据项目47所述的组合,其中该抗ctla-4抗体或其抗原结合片段的剂量是75mg。
[0151]
项目50.根据项目47所述的组合,其中该抗ctla-4抗体或其抗原结合片段的剂量是300mg。
[0152]
项目51.根据项目47至50中任一项所述的组合,其中该抗ctla-4抗体或其抗原结合片段是曲美木单抗。
[0153]
项目52.根据项目47至51中任一项所述的组合,其中该抗pd-l1抗体或其抗原结合片段是度伐鲁单抗。
[0154]
项目53.根据项目47至52中任一项所述的组合,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段向该受试者每四周施用一次。
[0155]
项目54.根据项目53所述的组合,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段向该受试者每四周施用一次,共四个剂量,随后将该抗pd-l1抗体或其抗原结合片段向该受试者每四周施用一次。
[0156]
项目55.根据项目47至54中任一项所述的组合,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段向该受试者施用一个剂量,随后将该抗pd-l1抗体或其抗原结合片段向该受试者每四周施用一次。
[0157]
项目56.根据项目47至55中任一项所述的组合,其中将该抗pd-l1抗体或其抗原结合片段和该抗ctla-4抗体或其抗原结合片段向受试者同时、分开或顺序施用。
[0158]
项目57.根据项目47至56中任一项所述的组合,其中该组合进一步包括向该受试者施用经动脉化疗栓塞术(tace)。
[0159]
项目58.根据项目47至57中任一项所述的组合,其中该肿瘤是肝细胞癌(hcc)。
[0160]
项目59.根据项目47至58中任一项所述的组合,其中该抗pd-l1抗体或其抗原结合片段是1500mg剂量的度伐鲁单抗,并且该抗ctla-4抗体或其抗原结合片段是75mg剂量的曲美木单抗。
[0161]
项目60.根据项目48至59中任一项所述的组合,其中该抗pd-l1抗体或其抗原结合片段是1500mg剂量的度伐鲁单抗,并且该抗ctla-4抗体或其抗原结合片段是300mg剂量的曲美木单抗。
[0162]
项目61.一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含剂量为5mg/kg至15mg/kg的抗ctla-4抗体或其抗原结合片段。
[0163]
项目62.一种用于在有需要的受试者中治疗肿瘤的组合,其中该组合包含平剂量为650mg至850mg的抗ctla-4抗体或其抗原结合片段。
[0164]
项目63.根据项目61所述的组合,其中该抗ctla-4抗体或其抗原结合片段的剂量是10mg/kg。
[0165]
项目64.根据项目62所述的组合,其中该抗ctla-4抗体或其抗原结合片段的剂量是750mg。
[0166]
项目65.根据项目61至64中任一项所述的组合,其中该抗ctla-4抗体或其抗原结合片段是曲美木单抗。
[0167]
项目66.根据项目61至65中任一项所述的组合,其中将该抗ctla-4抗体或其抗原结合片段向该受试者每四周施用一次。
[0168]
项目67.根据项目61至65中任一项所述的组合,其中将该抗ctla-4抗体或其抗原结合片段向该受试者每十二周施用一次。
[0169]
项目68.根据项目61至65中任一项所述的组合,其中该组合进一步包括向该受试者施用经动脉化疗栓塞术(tace)。
[0170]
项目69.根据项目63至68中任一项所述的组合,其中该肿瘤是肝细胞癌(hcc)。
[0171]
项目70.根据项目62所述的组合,其中该抗ctla-4抗体或其抗原结合片段是以750mg的剂量向该受试者每四周施用一次,共七个剂量的曲美木单抗,随后以750mg的剂量向该受试者每十二周施用一次曲美木单抗。
[0172]
实例
[0173]
以下实例说明了本披露内容的具体实施例及其各种用途。阐述它们仅出于解释目的并且不应以任何方式解释为限制本披露内容的范围。
[0174]
实例1:在患有晚期肝细胞癌的受试者中以单一疗法施用的度伐鲁单抗或与曲美木单抗组合的度伐鲁单抗
[0175]
以下披露的研究是一项多中心、开放标签、分层的研究,旨在评估在患有晚期hcc的受试者中以单一疗法施用的度伐鲁单抗或与曲美木单抗组合的度伐鲁单抗的安全性、耐受性和临床活性(临床试验政府标识符号nct03298451;himalaya)。
[0176]
受试者为男性或女性,年龄≥18岁(除日本以外的所有国家/地区)或≥20岁(仅日本),经病理或通过无创成像方法确诊为晚期hcc,并保留了肝功能(child-pugh评分a级)。受试者未接受过免疫疗法,并且对索拉非尼或其他vegfr tki治疗已出现疾病进展、对其不耐受或已拒绝接受该治疗。
[0177]
图1示出了研究的总体给药方案。图2示出了研究的各组,下面将对此进行详细描述。患者接受度伐鲁单抗或曲美木单抗作为单一疗法或组合治疗,并给予其任一种基于体重的平给药方案,这取决于何时将他们纳入研究。
[0178]
1a部分:度伐鲁单抗和曲美木单抗组合疗法的安全性准入(run-in)
[0179]
如图1所示,将患有晚期未感染hcv的hcc或hcv+hcc的受试者纳入1a部分第1阶段,以使用基于风险的交错方法进行安全性准入。每4周一次(q4w)向受试者施用4个剂量的度伐鲁单抗20mg/kg和曲美木单抗1mg/kg组合疗法,随后以q4w施用度伐鲁单抗20mg/kg单一疗法,直到确认进行性疾病(pd)或满足任何其他中断标准。
[0180]
在第2阶段,在已观察到第1阶段的第一批受试者至少4周后开始招募其他患有晚期hbv+hcc的受试者。以q4w向受试者施用4个剂量的度伐鲁单抗20mg/kg和曲美木单抗1mg/kg组合疗法,随后以q4w施用度伐鲁单抗20mg/kg单一疗法,直到确认pd或满足任何其他中
断标准。
[0181]
1b部分:度伐鲁单抗和曲美木单抗组合疗法的疗效门控队列(efficacy gating cohort)
[0182]
将患有晚期hcc但未接受过免疫疗法的受试者纳入1b部分,以进行疗效门控,这些受试者对基于索拉非尼的疗法已出现疾病进展、对其不耐受或拒绝接受该疗法。将受试者(未感染、hbv感染或hcv感染)纳入疗效门控队列,以确定是否有足够的临床活性证据可确保2部分开始招募。以q4w向受试者施用4个剂量的度伐鲁单抗20mg/kg和曲美木单抗1mg/kg组合疗法,随后以q4w施用度伐鲁单抗20mg/kg单一疗法,直到确认pd或满足任何其他中断标准。在最终剂量的度伐鲁单抗和曲美木单抗组合疗法后4周以20mg/kg q4w给予第一个度伐鲁单抗单一疗法剂量(参见图2)。
[0183]
2a部分:评估度伐鲁单抗和曲美木单抗组合疗法、度伐鲁单抗单一疗法和曲美木单抗单一疗法的随机组
[0184]
如图1所示,在2a部分中基于病毒状态(未感染、hcv感染或hbv感染)和pd-l1表达,对患有晚期hcc但未接受过免疫疗法的受试者进行分层(阳性、阴性或不可评估),以评估作为单一疗法或组合的度伐鲁单抗和曲美木单抗,这些受试者对基于索拉非尼的疗法已出现疾病进展、对其不耐受或拒绝接受该疗法。将各层内的受试者以1∶1∶1随机分配到3个治疗组中的1个,每个治疗组中大约有36名受试者(大约12名受试者/病毒状态类型)(参见图2):
[0185]
·
a组:以q4w施用4个剂量的度伐鲁单抗20mg/kg和曲美木单抗1mg/kg组合疗法,随后以q4w施用度伐鲁单抗20mg/kg单一疗法,直到确认pd或满足任何其他中断标准。在最终剂量的度伐鲁单抗和曲美木单抗组合疗法后4周以20mg/kg q4w给予第一个度伐鲁单抗单一疗法剂量。
[0186]
·
b组:以q4w施用度伐鲁单抗20mg/kg单一疗法,直到确认pd或满足任何其他中断标准。
[0187]
·
c组:以q4w施用7个剂量的曲美木单抗10mg/kg单一疗法,随后每12周施用一次(q12w),直到确认pd或满足任何其他中断标准。
[0188]
对1a部分、1b部分和2a部分中的所有受试者的疗效进行评估,并根据recist v1.1对其疾病状态进行初步分析。跟踪所有受试者的生存情况直至研究结束。
[0189]
2b部分:度伐鲁单抗和曲美木单抗组合疗法的其他治疗方案的安全性准入
[0190]
如图1所示,将患有晚期hcc但未接受过免疫疗法的受试者纳入2b部分,以进行安全性准入,这些受试者对基于索拉非尼的疗法已出现疾病进展、对其不耐受或已拒绝接受该疗法。将十名受试者纳入d组,从而评估单次更高剂量的曲美木单抗与度伐鲁单抗组合:
[0191]
·
d组:施用1个剂量的度伐鲁单抗1500mg和曲美木单抗300mg组合疗法,随后以q4w施用度伐鲁单抗1500mg单一疗法,直到确认pd或满足任何其他中断标准。在最终剂量的度伐鲁单抗和曲美木单抗组合疗法后4周以1500mg q4w给予第一个度伐鲁单抗单一疗法剂量。
[0192]
一旦6名安全性可评估的受试者完成了4周的随访,就进行安全性评估。将安全性可评估的受试者定义为接受至少1个剂量的研究药物并完成至少4周的随访,或由于不良事件而在完成4周的随访之前中断治疗的受试者。
[0193]
3部分:评估度伐鲁单抗和曲美木单抗组合疗法、度伐鲁单抗单一疗法和曲美木单
抗单一疗法的随机组
[0194]
如图1所示,在3部分中基于病毒状态(未感染,hcv感染或hbv感染)和索拉非尼/vegfr tki治疗(索拉非尼/vegfr tki拒绝者与其他人),对患有晚期hcc但未接受过免疫疗法的受试者进行分层,这些受试者对基于索拉非尼或另一个已批准的vegfr tki的疗法已出现疾病进展、对其不耐受或拒绝接受该疗法。将受试者以2∶1∶2的比率随机分配到最多3个治疗组中的1个:
[0195]
·
a组:以q4w施用4个剂量的度伐鲁单抗1500mg和曲美木单抗75mg组合疗法,随后以q4w施用度伐鲁单抗1500mg单一疗法,直到确认pd或满足任何其他中断标准。在最终剂量的度伐鲁单抗和曲美木单抗组合疗法后4周以1500mg q4w给予第一个度伐鲁单抗单一疗法剂量。
[0196]
·
b组:以q4w施用度伐鲁单抗1500mg单一疗法,直到确认pd或满足任何其他中断标准。
[0197]
·
c组:以q4w施用7个剂量的曲美木单抗750mg单一疗法,随后以q12w施用,直到确认pd或满足任何其他中断情况。
[0198]
·
d组:施用1个剂量的度伐鲁单抗1500mg和曲美木单抗300mg组合疗法,随后以q4w施用度伐鲁单抗1500mg单一疗法,直到确认pd或满足任何其他中断标准。在最终剂量的度伐鲁单抗和曲美木单抗组合疗法后4周以1500mg q4w给予第一个度伐鲁单抗单一疗法剂量。
[0199]
对3部分中的所有受试者的安全性和疗效进行评估,并根据recist v1.1对其疾病状态进行初步分析。
[0200]
所有与肿瘤评估有关的终点的初步分析均基于根据recist v1.1的bicr评估。
[0201]
对靶病灶的评估分类如下:
[0202]
·
完全缓解-所有靶病灶的消失。任何病理性淋巴结(无论是靶或非靶)的短轴必须减少至<10mm(如果存在靶结节,则总和不是“0”)。
[0203]
·
部分缓解-靶病灶的直径总和减少至少30%,以基线总和直径作为参考。
[0204]
·
进行性疾病-靶病灶的直径总和增加至少20%,以研究的最小总和作为参考(这包括基线总和,条件是它是研究的最小总和)。除20%的相对增加之外,总和还必须表现出至少5mm的绝对增加。(注意:一个或多个新病灶的出现可以被认为是疾病进展。)
[0205]
·
稳定性疾病-既不是足够的收缩以符合pr,也不是足够的增加以符合pd,在研究时以直径最小的总和作为参考。
[0206]
将对非靶病灶的评估分类如下:
[0207]
·
完全缓解-所有非靶病灶的消失和肿瘤标志物水平的归一化所有淋巴结的大小都必须是非病理性的(短轴<10mm)。
[0208]
·
非完全缓解/非进行性疾病-1个或多个非靶病灶的持续和/或肿瘤标志物水平维持在正常限以上。
[0209]
·
进行性疾病-将现有非靶病灶的明确进展定义为非靶疾病中实质性恶化的总体水平,使得即使在靶疾病中存在sd或pr,总体肿瘤负荷已经增加到足以值得中断治疗。在不存在可测量的疾病的情况下,不可测量的疾病的变化幅度与对可测量的疾病声明pd所需的增加相当。实例包括胸腔积液从“痕量”增加到“大量”,淋巴管疾病从局部增加到广泛。
[0210]
实例2:度伐鲁单抗和曲美木单抗作为晚期肝细胞癌患者的一线治疗的随机化、开放标签、多中心的临床研究
[0211]
下面披露的研究是一项随机化、开放标签、多中心、全球性的临床研究,旨在评估度伐鲁单抗单一疗法和度伐鲁单抗加曲美木单抗组合疗法与索拉非尼在治疗患有hcc但未接受过免疫检查点抑制剂的患者中的疗效和安全性,这些患者对索拉非尼已出现疾病进展、对其不耐受或拒绝接受该药物。在前述披露内容中,在这项研究中使用了1500mg(大约相当于20mg/kg)的度伐鲁单抗加300mg(相当于4mg/kg)的曲美木单抗的平剂量方案。
[0212]
研究群体包括18岁或以上的患有晚期hcc、巴塞罗那临床肝癌b期(barcelona clinic liver cancer stage b)(不符合局部区域疗法的资格)或c期以及child-pugh a级肝病的患者。患者必须事先未接受过任何针对hcc的全身性疗法。根据大血管浸润(是或否)、肝病的病因(乙型肝炎病毒[确认的hbv]与丙型肝炎病毒[确认的hcv]与其他)以及体力状态(东部合作肿瘤小组[ecog]0与1)对患者进行分层。
[0213]
方法:
[0214]
共纳入332名患者(t300+d,n=75;度伐鲁单抗,n=104;曲美木单抗,n=69;t75+d,n=84)。将患者按等比率随机分为用以下治疗的各组:度伐鲁单抗1500mg单一疗法(d)、曲美木单抗750mg单一疗法(t)、度伐鲁单抗1500mg加曲美木单抗75mg
×
4个剂量的组合疗法(t75+d),随后是度伐鲁单抗q4w、度伐鲁单抗1500mg加曲美木单抗300mg
×
1个剂量的组合疗法(t300+d),随后是度伐鲁单抗q4w。在终止进一步纳入t75+d组后,将患者按等比率随机分为用d、t300+d和索拉非尼治疗的各组。每4周1次(q4w)经由静脉内(iv)输注施用度伐鲁单抗和曲美木单抗。索拉非尼经口服bid施用(参见图3和图4)。
[0215]
曲美木单抗750mg单一疗法
[0216]
于第0周开始经由iv输注以q4w施用曲美木单抗750mg,共七个剂量,然后以q12w施用,直到确认pd、不可接受的毒性或满足任何中断标准。(注意:如果患者体重减轻至≤30kg,则患者将接受基于体重的曲美木单抗10mg/kg q4w给药,直到体重增加至>30kg,此时患者将接受平剂量的曲美木单抗750mg q4w)。
[0217]
度伐鲁单抗1500mg单一疗法
[0218]
·
于第0周开始经由iv输注以q4w施用度伐鲁单抗1500mg,直到确认pd、不可接受的毒性或满足任何中断标准。(注意:如果患者体重减轻至≤30kg,则患者将接受基于体重的度伐鲁单抗20mg/kg q4w给药,直到体重增加至>30kg,此时患者将接受平剂量的度伐鲁单抗1500mg q4w)。
[0219]
度伐鲁单抗1500mg加曲美木单抗75mg
×
4个剂量的组合疗法(b组)
[0220]
·
于第0周开始施用度伐鲁单抗1500mg加曲美木单抗75mg
×
4个剂量,随后在最后一次输注组合疗法4周后开始以q4w施用度伐鲁单抗1500mg单一疗法,直到确认pd、不可接受的毒性或满足任何中断标准。(注意:如果患者体重减轻至30kg或以下(≤30kg),则患者将接受基于体重的度伐鲁单抗20mg/kg q4w和曲美木单抗1mg/kg q4w给药,直到体重增加至>30kg,此时患者将接受原定平剂量的度伐鲁单抗1500mg q4w(含或不含曲美木单抗75mg q4w))。
[0221]
度伐鲁单抗1500mg加曲美木单抗300mg
×
1个剂量的组合疗法(c组)
[0222]
·
于第0周开始施用度伐鲁单抗1500mg加曲美木单抗300mg
×
1个剂量,随后在第
一次和最后一次输注组合疗法4周后开始以q4w施用度伐鲁单抗1500mg单一疗法,直到确认pd、不可接受的毒性或满足任何中断标准。(注意:如果患者体重减轻至30kg或以下(≤30kg),则患者将接受基于体重的度伐鲁单抗20mg/kg q4w和曲美木单抗4mg/kg
×
1个剂量给药,直到体重增加至大于30kg(>30kg),此时患者将接受原来平剂量的度伐鲁单抗1500mg q4w(含或不含曲美木单抗300mg))。
[0223]
索拉非尼400mg bid疗法(d组)
[0224]
·
索拉非尼400mg(2
×
200mg片剂)口服bid,直到确认pd、不可接受的毒性或满足任何中断标准。
[0225]
结果:
[0226]
除了针对每种药剂(单独或组合)建立的安全性特征之外,未鉴定出新的安全性信号。如图5和6所示,t300+d组患者的确认的orr最高(24%)且os最长(18.73(10.78-27.27)个月)。中位数pfs(95%ci)为2.17(1.91-5.42)个月(t300+d),2.07(1.84-2.83)个月(度伐鲁单抗),2.69(1.87-5.29)个月(曲美木单抗)和1.87(1.77-2.53)个月(t75+d)(图11)。与其他ici方案相比,在所有组中,t300+d提供了最佳的益处-风险特征。此外,无论pd-l1表达水平或病毒状态如何,均观察到这些缓解(参见图7)。图8描述了该研究的次要疗效终点。
[0227]
此外,药效生物标志物分析显示具有总体缓解的患者表现出高细胞毒性(cd8
+
)计数,表明t300+d驱动了与缓解相关的cd8
+
淋巴细胞的急性扩增。这提供了独特的增殖性t细胞特征,表明该组合具有附加的生物学活性。具体地,在第15天对26个淋巴细胞群体值进行二次判别分析,发现患者最大程度地被分别与cd4+和cd8+ t细胞相关的淋巴细胞群体的两种离散组合(标准-1和标准-2)所区分。接受t300+d的患者表现出最高的标准-2评分(图9a)。线性回归分析表明,标准-2主要与cd8+ t细胞的ki67+亚群的升高有关(图12)。缓解与这些cd8+ki67+淋巴细胞在治疗早期(第15天)的扩增有关。使用t300+d观察到最高的中位计数(图9b和13),这与观察到t300+d产生最高的orr一致。
[0228]
在q4w给药第一个周期的第29天,对外周血t细胞受体(tcr)进行的分子分析表明,在第29天,t细胞克隆扩增的中位数增加似乎是t剂量依赖性的,d组和t75+d组之间没有显著差异。所有组的t细胞的基线丰富度或辛普森克隆形成能力没有显著差异(图14)。更大的t细胞克隆扩增与缓解相关,并且似乎是由更高剂量的t驱动的。具体地,所有组的应答者在第29天扩增的t细胞克隆的中位数比无应答者大(77.5对40)。与无应答者相比,用t300d治疗的应答者显示出显著增加的克隆扩增。单一疗法d或更低剂量的t组合(t75+d)中未见该趋势(图15)。此外,更大的t细胞克隆扩增与更好的os相关,并且在d+t组合组中可观察到(图16)。
[0229]
表1:可评估的样本、tcr克隆形成能力和临床结果
[0230][0231]
最后,开发了一种暴露-缓解模型,以描述uhcc患者的曲美木单抗暴露与cd8+ki67+ t细胞增殖之间的关系。使用线性和非线性回归模型评估了首次剂量后曲美木单抗谷浓度(cmin)与cd8+ki67+ t细胞计数相对基线的最大变化(cfb)之间的关系。使用逐步搜索方法评估模型截距和药物效应(emax)的协变量效应。emax模型最好地描述了cd8+ki67+ t细胞计数cfb与曲美木单抗谷浓度之间的关系。唯一具有统计学意义和良好估计的协变量效应是emax的基线cd8+ki67+ t细胞计数。基线cd8+ki67+ t细胞计数更低的患者的最大效应更高,而基线cd8+ki67+ t细胞计数更高的患者的最大效应更低。在基线cd8+的第10、中位数和第90个百分位数(分别为3、9和25个细胞/ul)时,最大效应分别相对基线变化593%、341%和77.9%。估计的半数最大有效浓度(ec50)为5.24ug/ml,远低于300mg曲美木单抗的12.9ug/ml的中位数cmin。暴露-缓解分析表明,在cd8+ki67+ t细胞增殖中观察到的饱和关系对于t300+d方案接近于emax。
[0232]
上述结果表明,单次初免剂量的曲美木单抗与每月一次的度伐鲁单抗组合可在hcc群体中产生具有临床意义的结果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1