BBX17在调控拟南芥下胚轴生长上的应用
bbx17在调控拟南芥下胚轴生长上的应用
技术领域
1.本发明涉及分子生物学技术领域,具体涉及bbx17在调控拟南芥下胚轴生长上的应用。
背景技术:
2.具有b-box结构域的一类锌指结构转录因子称为bbx,它们通过调控基因转录,与同类或其他转录因子的互作参与植物光形态建成、花发育、避荫效应、植物信号转导以及非生物和生物逆境响应等。
3.bbx17包含一个box域和一个cct域。bbx17基因在拟南芥的下胚轴生长过程中发挥着重要作用,其分子机制需进一步研究。
技术实现要素:
4.本发明的第一个目的是针对现有技术的不足,提供bbx17在调控拟南芥下胚轴生长上的应用,通过对bbx17基因过表达转基因株系的分析,获得了bbx17基因影响拟南芥下胚轴生长的分子机制。
5.为实现上述发明目的,本发明采用以下技术方案予以实现:
6.本发明提供了拟南芥基因bbx17在调控拟南芥下胚轴生长中的功能。
7.进一步地:bbx17基因在转基因株系中与野生型(wt)植株相比均过量表达。
8.进一步地:bbx17蛋白含量呈现出一种周期表达模式。bbx17基因的水平也呈现出一种周期表达模式并在晚8点(zt20)达到一个峰值。
9.进一步地:bbx17蛋白在黑暗条件下发生降解,转至白光(w)、蓝光(b)、红光(r)、远红光(fr)培养后bbx17蛋白回复表达。
10.进一步地:bbx17蛋白通过26s蛋白酶体发生降解。
11.进一步地:黑暗条件培养下bbx17-1突变体的下胚轴较之野生型(wt)植株明显缩短;35s:bbx17-3flag#16、35s:bbx17-5myc#4转基因植株下胚轴无明显变化。bbx17基因影响了拟南芥下胚轴的生长。
12.本发明的第二个目的是提供bbx17在调控拟南芥种子发芽破土时间中的应用。
13.作为优选,通过将拟南芥中bbx17基因进行突变获得至少部分功能缺失或减弱。
14.作为优选,通过培养环境中光强变化对拟南芥中bbx17基因表达量进行调控。
15.更为优选,bbx17蛋白在黑暗条件下发生降解,转至白光(w)、蓝光(b)、红光(r)、远红光(fr)培养后bbx17蛋白回复表达。
16.作为优选,通过26s蛋白酶体对拟南芥中bbx17基因进行降解,进而实现对bbx17基因表达量的调控。
17.本发明的第三个目的是提供一种改良拟南芥下胚轴长度的方法。
18.作为优选,通过将拟南芥中bbx17基因进行突变获得至少部分功能缺失或减弱。
19.作为优选,通过培养环境中光强变化对拟南芥中bbx17基因表达量进行调控。
20.作为优选,通过26s蛋白酶体对拟南芥中bbx17基因进行降解,进而实现对bbx17基因表达量的调控。
21.本发明的优点和有益效果:
22.1、利用现有的分子生物学技术,本发明筛选获得的35s:bbx17转基因株系通过荧光实时定量分析,将其与相同条件下生长的野生型(wt)植株的bbx17基因的表达量进行比较,发现转基因株系的bbx17基因表达量均增加。
23.2、通过western实验分析不同时间点35s:bbx17-5myc#4转基因株系中bbx17的蛋白含量,实验结果表明bbx17是一种光周期调控蛋白。
24.3、通过western实验分析35s:bbx17-5myc#4转基因株系经黑暗培养转至不同光处理2、4、6、8小时后bbx17蛋白含量的变化。实验表明白光(d)、蓝光(b)、红光(r)、远红光(fr)都会使bbx17蛋白恢复表达。
25.4、western实验表明,35s:bbx17-5myc#4转基因株系经蛋白酶体抑制剂mg132处理,黑暗培养后其蛋白未降解。同时,cop1-6突变体背景下的35s:bbx17-5myc转基因株系黑暗处理后bbx17蛋白降解也呈现减弱现象,证明bbx17蛋白的降解与26s蛋白酶体相关。
26.5、最后基于黑暗培养下bbx17突变体较之野生型(wt)植株下胚轴长度明显缩短,而35s:bbx17转基因株系下胚轴并无明显变化,证明bbx17基因的缺失影响拟南芥下胚轴的生长。
27.本发明的技术方案对于bbx17基因如何精确调控下胚轴的生长具有重要意义。
附图说明
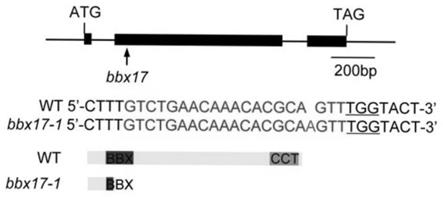
28.图1为bbx17-1突变体结构示意图。
29.图2为野生型(wt)植株和bbx17-1突变体的序列示意图;其中bbx17-1在bbx域中出现了一个点突,导致bbx域提前终止。
30.图3为bbx17-1的氨基酸序列。
31.图4(a)-(b)分别为bbx17蛋白和bbx17基因0-24h的表达水平。
32.图5(a)为35s:bbx17-5myc#4转基因株系在白光(w)、黑暗(d)、黑暗转到白光(d
→
w)中bbx17蛋白的表达情况;(b)-(d)将白光(w)生长7天的35s:bbx17-5myc#4转基因株系转到黑暗(d)中培养2天,然后分别转到白光(d
→
w)、蓝光(d
→
b)、红光(d
→
r)、远红光(d
→
fr)培养后bbx17蛋白的表达量。
33.图6(a)为将在白光(w)条件下生长7天的35s:bbx17-5myc#4转基因株系植株置于mock(-)或者mg132液(+)处理,然后取一半持续在白光(w)处理,另一半转至黑暗(d)条件下培养10h后bbx17蛋白的表达量;(b)为野生型(wt)背景下或者cop1-6突变体背景下的35s:bbx17-5myc转基因株系植株置于23℃温度、白光(w)条件下生长,培养至7日龄后,取一半继续在白光(w)条件下生长,另一半转至黑暗(d)条件下培养10h后的bbx17蛋白表达量。
34.图7(a)为黑暗条件培养下野生型(wt)植株、bbx17-1突变体以及35s:bbx17-3flag#16、35s:bbx17-5myc#4转基因植株下胚轴表型图;(b)为下胚轴表型的可视化图。
具体实施方式
35.下面结合附图和具体实施例来对本发明的技术方案进一步详细的说明。
36.上述实验中用到的试剂等购自takara,roche,tiangen,cw bio等公司。
37.实验中用到的试剂和药品说明:见《分子克隆》第三版。
38.图1为bbx17-1突变体结构示意图。
39.图2为野生型(wt)植株和bbx17-1突变体的序列示意图;其中bbx17-1在bbx域中出现了一个点突,导致bbx域提前终止。
40.图3为bbx17-1的氨基酸序列。
41.实施例1 35s:bbx17-5myc#4转基因株系在0-24h内的bbx17蛋白表达水平和bbx17基因表达水平
42.(1)转基因材料的获取
43.1)以野生型(wt)拟南芥植株的cdna为模板,扩增bbx17基因片段
44.pcr反应体系:
[0045][0046][0047]
pcr反应程序:
[0048][0049]
引物设计:
[0050][0051]
2)目的基因、载体酶切体系
[0052][0053]
37℃反应3h。
[0054][0055][0056]
37℃反应8h。
[0057]
3)目的基因与载体的连接体系
[0058][0059]
4)转化
[0060]
①
取5μl重组质粒到100μl大肠杆菌感受态细胞中,冰浴30min。
[0061]
②
42℃热激1min,立即冰浴5min后加入600μl无抗lb液体培养基,37℃,200rpm培养1h。
[0062]
③
8000rpm离心1min,吸取500μl上清,舍弃,轻吹剩余液体并将剩余液体全部转移到带有kam抗性的lb固体培养基上涂布。37℃倒置培养12h。
[0063]
5)菌液pcr
[0064]
挑取单克隆至10μl ddh20中混匀后取5μl菌液进行pcr扩增。
[0065]
pcr反应体系:
[0066][0067]
pcr反应程序:
[0068][0069][0070]
引物设计:
[0071][0072]
6)提质粒
[0073]
①
至10ml lb液体培养基(含k
+
抗性)中,37℃,200rpm培养12h。
[0074]
②
4000rpm,菌液离心10min。
[0075]
③
倒掉液体培养基,在吸水纸上吸尽残液,尽量吸干净。加入250μl buffer p1/rnase a混合液(加入0.2-0.5ml buffer p1至rnase a干粉中,吹打混匀,于2-8℃保存),高速涡旋重悬菌液。
[0076]
④
在重悬菌液中加入250μl buffer p2,轻柔的颠倒混匀充分。
[0077]
⑤
加入350μl buffer p3,轻柔地颠倒混匀。
[0078]
⑥
13000rpm,离心10min。
[0079]
⑦
上柱,8000rpm,离心2min。
[0080]
⑧
倒掉滤液,加入600μl buffer pw2,13000rpm,1min,重复两遍。
[0081]
⑨
13000rpm,2min,空离,静置16min,加入60℃ddh2o后再离心2min得到重组质粒。
[0082]
6)转农杆菌
[0083]
①
取1μl重组质粒到100μl农杆菌感受态中,电击。
[0084]
②
立即冰浴2min,加入800μl无抗lb液体培养基,28℃,200rpm,培养2-6h。
[0085]
③
取150μl菌液涂布平板,30℃倒置培养2天。
[0086]
④
挑取取单克隆菌,加入5ml lb(含k+、rif+抗性),28℃,200rpm培养12h得到农杆菌菌液。
[0087]
7)浸润法转基因
[0088]
①
农杆菌培养和收获
[0089]
将5ml菌液倒入200mlyep(添加抗生素),30℃恒温振摇过夜。当od600=1.5时,4000rpm离心10分钟,弃去上清,加入高渗浸润buffer。使农杆菌以1:1的比例重悬于高渗浸润buffer,并加入表面活性剂silwet,使其终浓度达到0.02%。
[0090]
②
将野生型(wt)拟南芥植株花絮浸没在菌液中,浸润持续5min,转化后用吸水纸吸去过多的菌液。转化后的植株,用保鲜膜覆盖避光24h后揭膜。正常生长,收取种子获得转基因株系。
[0091]
③
通过1/2ms潮霉素平板筛选得到35s:bbx17-5myc和35s:bbx17-3flag纯和转基因株系。
[0092]
(2)western
[0093]
1)实验材料获取
[0094]
将转基因株系35s:bbx17-5myc#4的种子点于土中,置于23℃温度、长日照(16h/8h,光照/黑暗)条件下生长,种子发芽后培养至9日龄,24小时每隔四小时取一次样,共7次。将取得的样迅速置于液氮冷冻,随后转至-80℃低温冰箱暂存。
[0095]
2)sds-page分离蛋白样品
[0096]
取新鲜叶片放入ep管置于液氮中,捣碎,加入50μl蛋白提取液和1mmol pmsf的混合液,放在冰上融半小时。13000rpm,4℃离心10min,取上清加12.5μl上样buffer,100℃水浴10min,水浴后适温放置30s,13000rpm 5min,取上清加样至浓缩胶孔。
[0097]
3)转膜吸附蛋白质
[0098]
将分离胶取出,用水清洗,先放在水里,防止sds污染,夹板黑色面朝下,海绵+4层滤纸+分离胶+pvdf膜+4层滤纸+海绵。100v转膜90min。
[0099]
4)封闭
[0100]
先用tbst洗几遍,在加tbstm,60rpm 1h。
[0101]
5)用一抗识别抗体(蛋白质)
[0102]
1h后加5μl一抗(鼠抗/兔抗),室温2h或4℃过夜。
[0103]
6)用二抗识别一抗
[0104]
一抗处理后先用少量tbst多次洗脱,在加tbst洗脱三次,每次5min,200rpm内。
[0105]
处理完毕后,加tbstm,将二抗(鼠源)加到tbstm液体里,tbstm:二抗=5000:1,10ml:2μl,60rpm 1h,二抗在4℃冰箱保存。
[0106]
7)显色识别二抗,检测其吸附的蛋白质表达量
[0107]
显色前先洗脱,用镊子将硝酸纤维素膜取出,在纸上角沥,浇上显色液,避光一会。
[0108]
(3)bbx17 rna表达水平分析
[0109]
1)实验材料获取
[0110]
取适量种子均匀撒到湿润的滤纸上,置于4℃冰箱黑暗处理48小时进行种子破休眠处理。之后将破休眠的种子点于土表面并压实,放置温室培养(16小时光照/8小时黑暗,23℃,10000lux),用保鲜膜覆盖,制造适宜的生长环境,保持稳定的发芽条件直至种子发芽
至两片子叶长出后揭膜。种子发芽后培养至9日龄,于长日照结束时取样于试管中,并迅速置于液氮冷冻,随后转至-80℃低温冰箱暂存。
[0111]
2)拟南芥植物rna提取
[0112]
本发明rna提取选用试剂盒法(rnaprep pure plant kit)。
[0113]
①
取上述适量植物叶片于1.5ml rnase-free ep离心管中,放入液氮中速冻,研碎后取至新的1.5ml rnase-free ep离心管中,加入450μl rl buffer冰上溶解30min,期间颠倒;
[0114]
②
将溶液转移至过滤柱cs上,12000rpm,室温离心5min,小心吸取收集管中上清液(约450μl),至新的1.5ml rnase-free ep离心管中;
[0115]
③
加入0.5倍体积的无水乙醇,吹吸混匀,转入吸附柱cr3中,12000rpm,室温离心1min,弃除收集管中的废液;
[0116]
④
加入350μl rw1 buffer,12000rpm,室温离心1min,弃除收集管中废液;
[0117]
⑤
加入80μl dnase i工作液,30℃培养箱中静置反应30min;
[0118]
⑥
重复步骤4;
[0119]
⑦
加入500μl rw buffer,静置2min,12000rpm离心1min,弃除收集管中的废液;
[0120]
⑧
重复步骤7一次;
[0121]
⑨
12000rpm,室温空离2min,将cr3柱放入一个新的rnase-free离心管中,室温敞口静置10min;
[0122]
⑩
加入50μl事先预热55℃的rnase-free ddh2o,室温静置2min,12000rpm,室温离心2min,得到即为rna溶液;
[0123]
nanodrop 2000检测rna浓度,电泳检测rna质量。
[0124]
2)rna反转录
[0125]
选用试剂盒快转法(fastquant rt kit with gdnase)进行实验操作。
[0126]
步骤一:
[0127][0128]
42℃温育3min,然后置于冰上放置5min;
[0129]
步骤二:
[0130]
[0131]
混合均匀,加到gdna去除步骤的反应液中,充分混匀,4000rpm,室温短暂离心;42℃,温育15min;95℃,温育3min之后放于冰中,迅速冷却,得到的cdna可部分稀释用于后续实验,或低温保存。
[0132]
取部分5μl cdna母液,用rnase-free ddh2o稀释10倍待用。
[0133]
3)荧光实时定量pcr
[0134]
基因相对表达量分析quantitative real-time pcr(qrt-pcr)在cfx96-real time system(bio-rad,usa)中完成。以tublin为内参基因。每个样品独立重复实验3次。
[0135]
qpcr反应体系:
[0136][0137]
qpcr反应程序:
[0138][0139]
引物设计:
[0140][0141]
上述扩增40个循环用于定量检测。经cfx96-real time system自带软件监测sybr green的荧光变化及threshold cycle(ct)值。用2(
‑△
ct)表示基因的相对表达量,分析过程在excel表中完成。图4(a)-(b)分别为bbx17蛋白和bbx17基因0-24h的表达水平;结果表明,bbx17的蛋白含量呈现出一种周期表达模式。bbx17基因的水平也呈现出一种周期表达模式并在晚8点(zt20)达到一个峰值。
[0142]
实施例2 35s:bbx17-5myc#4转基因株系中bbx17蛋白在不同光中的稳定性检测
[0143]
(1)实验材料获取
[0144]
将转基因株系35s:bbx17-5myc#4的种子点于土中,一部分植株置于23℃温度、白光(w)条件下生长7天,转至黑暗(d)条件下生长2天,然后再分别取四分之一植株至白光(d
→
w)、蓝光(d
→
b)、红光(d
→
r)、远红光(d
→
fr)中培养,每隔2h取一次样,共取5次。将取得的样迅速置于液氮冷冻,随后转至-80℃低温冰箱暂存。
[0145]
(2)不同条件下bbx17蛋白的含量检测。
[0146]
方法如实施例1所示。
[0147]
实验表明白光(d)、蓝光(b)、红光(r)、远红光(fr)都会使bbx17蛋白恢复表达。
[0148]
图5(a)为35s:bbx17-5myc#4转基因株系在白光(w)、黑暗(d)、黑暗转到白光(d
→
w)中bbx17蛋白的表达情况,同时将野生型(wt)植株在白光(w)培养作为对照;(b)-(d)将白光(w)生长7天的35s:bbx17-5myc#4转基因株系转到黑暗(d)中培养2天,然后分别转到白光(d
→
w)、蓝光(d
→
b)、红光(d
→
r)、远红光(d
→
fr)培养后bbx17蛋白的表达量;同时将野生型(wt)植株在白光(w)培养,以及35s:bbx17-5myc#4转基因株系在白光(w)、黑暗转到白光(d
→
w)培养作为对照。
[0149]
实施例3 35s:bbx17-5myc#4转基因株系经mg132处理后及cop1-6突变体背景下植株黑暗处理后bbx17蛋白的稳定性检测
[0150]
(1)实验材料获取
[0151]
(a)将转基因株系35s:bbx17-5myc#4的种子点于培养皿中,置于23℃温度、长日照(16h/8h,光照/黑暗)条件下生长,种子发芽后培养至7日龄,将植株取至mg132处理液或control液中白光(w)/黑暗(d)生长两天。将取得的样迅速置于液氮冷冻,随后转至-80℃低温冰箱暂存。
[0152]
(b)将cop1-6突变体植株和35s:bbx17-5myc#4进行杂交筛选得到纯合的实验苗cop1-635s:bbx17-5myc#4。将转基因株系35s:bbx17-5myc#4、cop1-635s:bbx17-5myc#4的种子点于培养皿中,置于23℃温度、长日照(16h/8h,光照/黑暗)条件下生长,种子发芽后培养至7日龄,将植株取一半置于黑暗(d)条件生长两天,另一半置于白光(w)生长两天。将取得的样迅速置于液氮冷冻,随后转至-80℃低温冰箱暂存。
[0153]
(2)bbx17蛋白的含量检测。
[0154]
方法如实施例1所示。
[0155]
结果表明,35s:bbx17-5myc#4转基因株系经蛋白酶体抑制剂mg132处理,黑暗培养后其蛋白未降解。同时,cop1-6突变体背景下的35s:bbx17-5myc转基因株系(cop1-635s:bbx17-5myc#4)黑暗处理后bbx17蛋白降解也呈现减弱现象,证明bbx17蛋白的降解与26s蛋白酶体相关。
[0156]
图6(a)为将在白光(w)条件下生长7天的35s:bbx17-5myc#4转基因株系植株置于mock(-)或者mg132液(+)处理,然后取一半持续在白光(w)处理,另一半转至黑暗(d)条件下培养10h后bbx17蛋白的表达量;(b)为野生型(wt)背景下或者cop1-6突变体背景下的35s:bbx17-5myc转基因株系植株置于23℃温度、白光(w)条件下生长,培养至7日龄后,取一半继续在白光(w)条件下生长,另一半转至黑暗(d)条件下培养10h后的bbx17蛋白表达量。
[0157]
实施例4黑暗条件不同基因型和野生型(wt)的下胚轴长度的差异
[0158]
(1)实验材料获取
[0159]
将种子种植在平板上,并在暗处4℃处理三天,然后在白光(w)条件下持续光照3h,然后这些种子被转移到黑暗(d)中,23℃培养7天。
[0160]
(2)数据分析
[0161]
使用图像软件测量下胚轴的长度。
[0162]
图7结果表明,黑暗条件培养下bbx17-1突变体的下胚轴较之野生型(wt)植株明显缩短;35s:bbx17-3flag#16、35s:bbx17-5myc#4转基因植株下胚轴无明显变化。bbx17基因影响了拟南芥下胚轴的生长。
[0163]
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使用相应技术方案本质脱离本发明所要求保护的技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1