一种URAT1人源化小鼠模型的构建方法及其应用
一种urat1人源化小鼠模型的构建方法及其应用
技术领域
1.本发明涉及动物基因工程和基因遗传修饰技术领域,具体而言,涉及基于一种urat1人源化动物模型的构建方法及其在医药领域中的运用。
背景技术:
2.痛风是一组嘌呤代谢紊乱所致的疾病,其临床特点为高尿酸血症及由此而引起的痛风性急性关节炎反复发作、痛风石沉积、痛风石性慢性关节炎和关节畸形,常累及肾脏,引起慢性间质性肾炎和尿酸肾结石形成。
3.痛风及高尿酸血症作为一种代谢性疾病在我国的发病率逐年递增,是影响人民健康的重大因素。分布在肾近曲小管上皮细胞上尿酸转运蛋白urat1(human urate transporter 1)和有机阴离子转运蛋白ota(organic anion transporter)的特异性抑制剂可以减少肾脏对原尿中尿酸的重吸收,从而降低病人血尿酸浓度,是高尿酸血症及痛风药物研发的热门靶点。高尿酸血症除了与痛风有关外,还与多种其它疾病的发生相关,例如与高血压、糖尿病、肥胖、胰岛素抵抗、尿路阻塞和胆石症等疾病密切相关。
4.当毛细血管中的血液流经肾小体时,经过肾小球的滤过作用生成原尿,原尿在流经肾小管时其中的大量物质又被选择性的回收到血液,分布于肾小管不同区段的上皮细胞上表达的各种各样的转运蛋白行使着物质回收功能,90%的尿酸重吸收发生在近端肾小管。肾小管上皮细胞具有方向性,位于肾小管上皮细胞基底侧膜或顶端膜的转运蛋白决定了被转运物质的走向,从血液到尿液为分泌过程,从尿液到血液为重吸收过程。urat1在肾近端小管上皮细胞中(renal proximal tubular)的分布呈方向性,负责从原尿重吸收尿酸到血液。据报道人类urat1转运蛋白负责50%左右尿酸重吸收过程。根据urat1特异性转运尿酸的特征,人们开发出针对性的抑制剂来控制尿酸的回收过程,从而调节尿酸在体内的平衡,达到治疗高尿酸血症及痛风的目的。
5.靶向人类urat1的小分子促尿酸排泄药物并不多,其中应用最为广泛的上市药为苯溴马隆(benzbromarone),其在体外实验中对hurat1的抑制率为0.13μm(ic
50
)。但苯溴马隆相关的严重不良反应中肝损害问题比较突出,药物导致了肝功能异常及谷草转氨酶、谷丙转氨酶及碱性磷酸酶升高,所以在临床上使用有所局限。目前开发新的urat1靶点抑制剂类降尿酸药物的需求非常迫切。
6.urat1抑制剂类降尿酸药物的筛选及临床前试验需要在动物模型上进行评价,但由于种属的差异,高尿酸是分类学上高等灵长类动物才出现的特征。另一方面,人类与其它物种urat1基因的差异导致不同种属的urat1蛋白对底物尿酸及特异性抑制剂的亲和力差异都很大。啮齿类动物作为应用最广泛的实验小动物模型,已成为药物研发治疗研究中不可或缺的替代模型,但鼠类urat1蛋白对尿酸的亲和力和人源urat1蛋白相比相差上千倍,小鼠中urat1蛋白在血尿酸浓度调节中发挥的作用微不足道,对于urat1靶点的抑制剂例如苯溴马隆的治疗也几乎没有响应,因此在小鼠上筛选urat1抑制剂的策略完全不可行。目前靶向人类urat1药物的动物实验需要新大陆猴或猿类等非人高等灵长类动物才能达到目
的,但由于来源稀少,价格昂贵而限制了使用。所以,没有合适的经济,易得,有效的小动物模型是urat1靶点药物研究的最大瓶颈,在动物体内建立更接近人类的生理特征的高尿酸血症疾病模型是生物医药行业的迫切需求。
7.现有技术中不存在urat1人源化小鼠,因此构建urat1人源化小鼠是对此类促尿酸代谢类药物的筛选,药效评价及药理毒理研究的迫切需求。
技术实现要素:
8.本发明的主要目的是提供一种urat1人源化小鼠模型的构建方法,将人源urat1的编码基因替换小鼠相应的基因,制备得到特异性尿酸转运受体urat1的人源化小鼠模型,具有人类的功能性基因,可用来筛选并评价以人类的urat1为靶点的促尿酸代谢药物,解决了啮齿类动物由于与人类之间种属性的差异,无法在小鼠上筛选及评价适用于人类的urat1抑制剂类药物的问题。
9.为了实现上述目的,根据本发明的一个方面,提供了一种urat1人源化动物模型的构建方法,该方法包括以下步骤:
10.(1)将背景动物细胞上的urat1基因替换成人源urat1基因;以及
11.(2)使该人源urat1基因在该背景动物细胞中表达并产生人源化urat1蛋白,同时降低或消除该背景动物细胞内的内源urat1基因的表达,从而获得该urat1人源化动物模型。
12.进一步地,该人源urat1基因编码的氨基酸序列选自:
13.a)该氨基酸序列如seq id no:1所示;
14.b)该氨基酸序列与seq id no:1所示氨基酸的序列同一性程度为至少大约为95%、96%、97%、98%或至少99%;
15.c)由核酸序列编码的氨基酸序列,该核酸序列在严格条件下,与编码seq id no:1所示的氨基酸的核苷酸序列杂交;
16.d)该氨基酸序列与seq id no:1所示的氨基酸的序列差异不超过5、4、3、2或不超过1个氨基酸;
17.和/或
18.e)该氨基酸序列具有seq id no:1所示的,包括取代、缺失和/或插入一个或多个氨基酸残基的氨基酸序列。
19.进一步地,人源urat1基因的基因序列选自:
20.a)该基因编码权利要求2中的氨基酸序列;
21.b)该基因的cds编码序列如seq id no:2所示;
22.c)在严格条件下,与seq id no:2所示的核苷酸杂交的基因序列;
23.d)与seq id no:2所示的核苷酸具有至少大约95%、96%、97%、98%或至少99%同一性程度的基因序列;
24.e)编码氨基酸的基因序列,该氨基酸与seq id no:1所示的氨基酸的同一性程度为至少大约95%、96%、97%、98%或至少99%;
25.f)编码氨基酸的基因序列,该氨基酸的序列与seq id no:1的差异不超过5、4、3、2或1个氨基酸残基;
26.和/或
27.g)编码氨基酸的基因序列,该氨基酸具有seq id no:1所示的,包括取代、缺失和/或插入一个或多个氨基酸的氨基酸序列。
28.进一步地,降低或消除该背景动物细胞内的内源urat1基因的表达是通过替换该背景动物细胞内的内源urat1基因的外显子1的中间序列而实现的。
29.进一步地,该背景动物为啮齿类动物。
30.进一步地,该啮齿类动物为小鼠、大鼠或仓鼠。
31.进一步地,该啮齿类动物为c57bl品系小鼠。
32.进一步地,该小鼠为c57bl/6小鼠。
33.进一步地,该细胞为受精卵细胞。
34.进一步地,使用基因编辑技术进行该urat1人源化动物模型的建立。
35.进一步地,该基因编辑技术为基因同源重组技术、crispr/cas9技术、锌指核酸酶技术、转录激活子样效应因子核酸酶技术和/或归巢核酸内切酶技术。
36.进一步地,使用crispr/cas9技术进行该urat1人源化动物模型的建立。
37.进一步地,该crispr/cas9技术包括以下步骤:
38.(1)提供包括人源urat1基因打靶载体、sgrna表达载体以及cas9的混合物,其中该cas9包括cas9 mrna和/或cas9蛋白;
39.(2)将该混合物显微注射至该背景动物细胞中;
40.(3)将该背景动物细胞转移至培养液中进行培养之后移植至假孕雌性背景动物体内;以及
41.(4)f0代背景动物的鉴定和筛选。
42.进一步地,使用in-fusion技术构建该人源urat1基因打靶载体。
43.进一步地,该构建方法进一步包括:将该f0代背景动物与野生型动物交配产生f1代背景动物,经基因鉴定筛选出f1代阳性背景动物。
44.进一步地,采用引物序列caggaatcgtacggacatctctat和gttcaaggtcatcaccaagggtc验证该打靶载体在该背景动物基因组5’的插入。
45.进一步地,采用引物序列tcaccatctacagcagcgagct和ggttcactcagtagagaccgcct验证该打靶载体在该背景动物基因组3’的插入。
46.进一步地,该构建方法进一步包括:将该f1代阳性背景动物相互继续扩繁,扩大种群数量,从而获得纯合子背景动物,建立稳定的urat1基因人源化动物品系。
47.进一步地,该步骤(1)的sgrna序列包含如下两条引物序列:cctgaactcctggaccgagtggg和tcggtccaggagttcaggaaagg。
48.根据本发明的另一个方面,提供了一种根据上述构建方法制备获得的非人背景动物或其子代。
49.根据本发明的另一个方面,提供了一种根据上述构建方法获得的非人背景动物或其子代在用于代谢性疾病研究、用于开发新的诊断策略和/或治疗策略中的用途。
50.根据本发明的另一个方面,提供了一种根据上述构建方法获得的非人背景动物或其子代在筛选、验证、评价和/或研究hurat1基因功能、hurat1抗体和/或针对hurat1靶点的药物中的用途。
51.在一种优选的实施方式中,筛选、验证、评价和/或研究hurat1基因功能、hurat1抗体和/或针对hurat1靶点药物的模型,例如氧嗪酸钾引起的高尿酸血症模型。
52.根据本发明的另一个方面,提供了一种根据上述构建方法获得的非人背景动物或其子代在hurat1靶向药物筛选开发、评估hurat1靶向药物有效性、hurat1靶向药物与其它药物联合降尿酸药效评价和/或hurat1靶向药物后续毒理研究中的用途。
53.进一步地,该其它药物选自以下的一种或多种:非布司他、丙磺舒、碳酸氢钠、拉布立酶、普瑞凯希和别嘌呤醇。
54.进一步地,该hurat1靶向药物为苯溴马隆、雷西那德或其他hurat1抑制剂。
55.本发明的有益效果:
56.在健全的小鼠上,将鼠源的urat1基因替换为人源的urat1基因,构建能与靶向人源urat1的小分子化合物抑制剂或前药相互作用的小鼠模型。该模型与普通小鼠相比,实现了关键靶分子的人源化改造,可用于筛选和评价针对人类基因的药物,是非常理想的临床前药物测试模型。制备的urat1人源化小鼠模型,具有人类的功能性基因,可用来筛选和评价人类urat1靶向性的促尿酸排泄药物。
附图说明
57.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的附图,而并不超出本发明要求保护的范围。
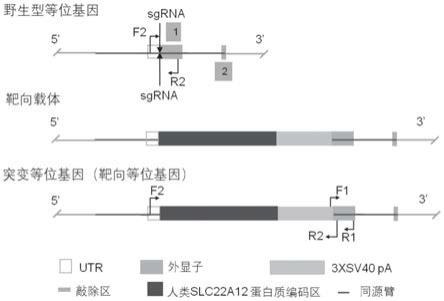
58.图1是人源化urat1构建策略图。
59.图2是pcr鉴定策略图。
60.图3是f1代小鼠urat1-ki 5’端与3’端鉴定电泳图。图3a为5’端鉴定电泳图,涉及引物f2和r2;图3b为3’端鉴定电泳图,涉及引物f1和r1。
61.图4是f1代urat1-ki测序鉴定图。
62.图5是f2代urat1-ki鉴定电泳图。
63.图6是c57bl/6背景纯合urat1ki/ki小鼠和c57bl/6wt小鼠肾脏中肾小管上皮细胞人源urat1表达免疫染色检测结果。
64.图7是氧嗪酸钾(oxonic acid potassium)造模后各组小鼠血尿酸水平图。
65.图8是苯溴马隆(benzbromarone)治疗后各组小鼠血尿酸水平图。
具体实施方式
66.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
67.本发明有预期地涵盖所有的选择余地、变体和同等物,这些可能如权利要求所定义的那样包含在现有发明领域。所属领域的技术人员将识别许多类似或等同于在此所描述的方法和物质,这些可以应用于本发明的实践中去。本发明绝非限于方法和物质的描述。
68.需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂和仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
69.除非特别说明,本发明的实践将采取细胞生物学、细胞培养、分子生物学、转基因生物学、微生物学、重组dna和免疫学的传统技术。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
70.在一定程度上,具体实施方式和/或权利要求中使用术语“包含”、“包括(including,includes)”和“具有(having,has,with)”或其变体,这些术语意在包括与术语“包含(comprising)”类似的方式。
71.在本发明的描述中,需要说明的是,术语“上”、“下”、“内”、“外”等指示的方位或位置关系为方位或位置关系,仅是为了便于描述本发明和简化描述,因此不能理解为对本发明的限制。
72.正如背景技术部分所描述的,现有技术中不存在urat1人源化小鼠,因此构建urat1人源化小鼠是对促尿酸代谢类药物的筛选,药效评价及毒理研究的迫切需求。为了解决上述问题,本发明提供了一种urat1人源化动物模型的构建方法,该方法包括以下步骤:
73.(1)将背景动物细胞上的urat1基因替换成人源urat1基因;以及
74.(2)使该人源urat1基因在该背景动物细胞中表达并产生人源化urat1蛋白,同时降低或消除该背景动物细胞内的内源urat1基因的表达,从而获得该urat1人源化动物模型。
75.在本发明中,urat1人源化动物模型实现了关键靶分子的人源化改造,并且保留了完整的小鼠代谢系统,可用于筛选和评价针对人类基因的药物,是非常理想的临床前药物测试模型。
76.在一种优选的实施方式中,该人源urat1基因编码的氨基酸序列选自:
77.a)该氨基酸序列如seq id no:1所示;
78.b)该氨基酸序列与seq id no:1所示氨基酸的序列同一性程度为至少大约为95%、96%、97%、98%或至少99%;
79.c)由核酸序列编码的氨基酸序列,该核酸序列在严格条件下,与编码seq id no:1所示的氨基酸的核苷酸序列杂交;
80.d)该氨基酸序列与seq id no:1所示的氨基酸的序列差异不超过5、4、3、2或不超过1个氨基酸;
81.和/或
82.e)该氨基酸序列具有seq id no:1所示的,包括取代、缺失和/或插入一个或多个氨基酸残基的氨基酸序列。
83.在一种优选的实施方式中,seq id no:1(np_653186.2)为人源urat1蛋白的第1-553个氨基酸。
84.其中,seq id no:1所表示的氨基酸如下所示:
[0085][0086]
在一种优选的实施方式中,人源urat1基因的基因序列选自:
[0087]
a)该基因编码权利要求2中的氨基酸序列;
[0088]
b)该基因的cds编码序列如seq id no:2所示;
[0089]
c)在严格条件下,与seq id no:2所示的核苷酸杂交的基因序列;
[0090]
d)与seq id no:2所示的核苷酸具有至少大约95%、96%、97%、98%或至少99%同一性程度的基因序列;
[0091]
e)编码氨基酸的基因序列,该氨基酸与seq id no:1所示的氨基酸的同一性程度为至少大约95%、96%、97%、98%或至少99%;
[0092]
f)编码氨基酸的基因序列,该氨基酸的序列与seq id no:1的差异不超过5、4、3、2或1个氨基酸残基;
[0093]
和/或
[0094]
g)编码氨基酸的基因序列,该氨基酸具有seq id no:1所示的,包括取代、缺失和/或插入一个或多个氨基酸的氨基酸序列。
[0095]
在一种优选的实施方式中,urat1基因名称为slc22a12,实施例具体选取转录本(nm_144585.4)的cds序列,即seq id no:2。
[0096]
其中,seq id no:2为人slc22a12cds(1662bp),具体如下所示:
[0097]
[0098]
[0099][0100]
在本发明中,术语“包含”或“包括”是开放式的描述,含有所描述的指定成分或步骤,以及不会实质上影响的其他指定成分或步骤。然而在用于描述蛋白质或核酸的序列时,所述蛋白质或核酸可以是由所述序列组成,或者在所述蛋白质或核酸的一端或两端可以具有额外的氨基酸或核苷酸,但仍然具有本发明所述的活性。
[0101]
在本发明中,术语“cds”是编码序列(coding sequence)的缩写,其是与蛋白质序列一一对应的dna序列,且该序列中间不含其它非该蛋白质对应的序列,不考虑mrna加工等过程中的序列变化。
[0102]
在一种优选的实施方式中,降低或消除该背景动物细胞内的内源urat1基因的表达是通过替换该背景动物细胞内的内源urat1基因的外显子1的中间序列而实现的。
[0103]
在一种优选的实施方式中,该背景动物为啮齿类动物。
[0104]
在一种优选的实施方式中,该啮齿类动物为小鼠、大鼠或仓鼠。
[0105]
在一种优选的实施方式中,该啮齿类动物为c57bl品系小鼠。
[0106]
在一种优选的实施方式中,该小鼠为c57bl/6小鼠。
[0107]
在一种优选的实施方式中,该小鼠还可以是c57bl/a、c57bl/an、c57bl/grfa、c57bl/kalwn、c57bl/6j、c57bl/6byj、c57bl/6nj、c57bl/10、c57bl/10scsn、c57bl/10cr和c57bl/ola的c57bl品系的其他小鼠。
[0108]
在一种优选的实施方式中,该细胞为受精卵细胞。
[0109]
在本发明中,受精卵包括但不限于c57bl/6受精卵、balb/c受精卵和fvb/n受精卵。
[0110]
在一种优选的实施方式中,使用基因编辑技术进行该urat1人源化动物模型的建立。
[0111]
在一种优选的实施方式中,该基因编辑技术为基因同源重组技术、crispr/cas9技术、锌指核酸酶技术、转录激活子样效应因子核酸酶技术和/或归巢核酸内切酶技术。
[0112]
在一种优选的实施方式中,使用crispr/cas9技术进行该urat1人源化动物模型的建立。
[0113]
在本发明中,crispr/cas9技术在设计、合成和筛选上都非常简便,而且易于操作、成本低、构建周期短并且可以成倍的提高对基因编辑的效率。为了获得本发明的效果,现有技术中有关于crispr/cas9技术的任何变化/改进均适用于本发明。
[0114]
在一种优选的实施方式中,该crispr/cas9技术包括以下步骤:
[0115]
(1)提供包括人源urat1基因打靶载体、sgrna表达载体以及cas9的混合物,其中该cas9包括cas9 mrna和/或cas9蛋白;
[0116]
(2)将该混合物显微注射至该背景动物细胞中;
[0117]
(3)将该背景动物细胞转移至培养液中进行培养之后移植至假孕雌性背景动物体内;以及
[0118]
(4)f0代背景动物的鉴定和筛选。
[0119]
在本发明中,sgrna靶序列决定了其靶向特异性和诱导cas9切割目的基因的效率。因此,高效特异的靶序列选择和设计是构建sgrna表达载体的前提。
[0120]
在一种优选的实施方式中,使用in-fusion技术构建该人源urat1基因打靶载体。
[0121]
在本发明中,in-fusion技术相比于传统酶切连接技术优点在于:(1)摆脱了酶切位点的束缚;(2)连接效率高,构建周期短,为普通酶切连接体系的200-500倍;(3)对3000bp以上的基因载体构建成功率高;(4)适用于大规模载体构建。
[0122]
在一种优选的实施方式中,该构建方法进一步包括:将该f0代背景动物与野生型动物交配产生f1代背景动物,经基因鉴定筛选出f1代阳性背景动物。
[0123]
在一种优选的实施方式中,采用引物序列caggaatcgtacggacatctctat和gttcaaggtcatcaccaagggtc验证该打靶载体在该背景动物基因组5’的插入。
[0124]
在一种优选的实施方式中,采用引物序列tcaccatctacagcagcgagct和ggttcactcagtagagaccgcct验证该打靶载体在该背景动物基因组3’的插入。
[0125]
在一种优选的实施方式中,该构建方法进一步包括:将该f1代阳性背景动物相互继续扩繁,扩大种群数量,从而获得纯合子背景动物,建立稳定的urat1基因人源化动物品系。
[0126]
在一种优选的实施方式中,该步骤(1)的sgrna序列包含如下两条引物序列:cctgaactcctggaccgagtggg和tcggtccaggagttcaggaaagg。
[0127]
根据本发明的另一个方面,提供了一种根据上述构建方法制备获得的非人背景动物或其子代。
[0128]
根据本发明的另一个方面,提供了一种根据上述构建方法制备获得的非人背景动物或其子代在制备动物模型中的用途。
[0129]
根据本发明的另一个方面,提供了一种根据上述构建方法获得的非人背景动物或其子代在用于代谢性疾病研究、用于开发新的诊断策略和/或治疗策略中的用途。
[0130]
根据本发明的另一个方面,提供了一种根据上述构建方法获得的非人背景动物或其子代在筛选、验证、评价和/或研究hurat1基因功能、hurat1抗体和/或针对hurat1靶点的药物中的用途。
[0131]
在一种优选的实施方式中,筛选、验证、评价和/或研究hurat1基因功能、hurat1抗体和/或针对hurat1靶点药物的模型,例如氧嗪酸钾引起的高尿酸血症模型。
[0132]
在本发明中,所述的筛选、验证、评价和/或研究方法不是治疗方法。该筛选、验证、评价和/或研究方法对治疗方案的效果进行检测和评价,以确定该治疗方案是否有治疗效果,即治疗效果不是必然的,只是一种可能性。
[0133]
根据本发明的另一个方面,提供了一种根据上述构建方法获得的非人背景动物或其子代在评估hurat1靶向药物筛选开发、hurat1靶向药物有效性、hurat1靶向药物与其它药物联合降尿酸药效评价和/或hurat1靶向药物后续药理毒理研究中的用途。
[0134]
在一种优选的实施方式中,该其它药物选自以下的一种或多种:非布司他、丙磺舒、碳酸氢钠、拉布立酶、普瑞凯希和别嘌呤醇。
[0135]
其中,非布司他是黄嘌呤氧化酶抑制剂,通过减少血清尿酸含量达到疗效,适用于痛风及高尿酸血症患者的长期治疗;丙磺舒抑制尿酸盐在近曲肾小管的主动再吸收,增加尿酸盐的排泄而降低血中尿酸盐的浓度;碳酸氢钠是一种碱性药物,其能够提升尿液的ph
值,促进尿酸在尿液中溶解,从而帮助尿酸从体内排出;拉布立酶可用于治疗和预防具有高危肿瘤溶解综合征的血液恶性肿瘤病人的急性高尿酸血症,尤其适用于化疗引起的高尿酸血症病人;普瑞凯希是一种重组的尿酸酶,可以将尿酸直接溶解为尿囊素排出体外;别嘌醇及其代谢产物,可抑制黄嘌呤氧化酶,使次黄嘌呤及黄嘌呤不能转化为尿酸,即尿酸合成减少,进而降低血中尿酸浓度,减少尿酸盐在骨、关节及肾脏的沉着,能够抑制尿酸合成。
[0136]
在一种优选的实施方式中,该hurat1靶向药物为苯溴马隆、雷西那德或其他hurat1抑制剂。
[0137]
下面结合实施例对本发明的技术方案进行清楚、完整地描述和说明。
[0138]
实施例
[0139]
试剂、材料和仪器
[0140]
动物组织/细胞基因组dna提取试剂盒(d1700北京索莱宝科技有限公司);2
×
rapid taq master mix(p222南京诺唯赞生物科技股份有限公司);尿酸检测试剂盒(c012-2南京建成生物工程研究所);抗人urat1抗体(200760-t08义翘神州)。显微镜玻片扫描仪(3dhistech kft)所有引物合成及测序由擎科生物科技有限公司完成。
[0141]
具体实施步骤
[0142]
1、人源urat1基因替换区域及插入的人源序列的确定
[0143]
根据人源urat1功能,选取人源基因urat1(slc22a12 cds,转录本nm_144585.4,位于人类第11号染色体)替换鼠源urat1(nm_009203.3,位于小鼠19号染色体)基因,选取的人源urat1基因编码的全长氨基酸序列(aa:1-553;seq no.1),基因全序列为seq no.2所示。
[0144]
选择小鼠urat1基因的外显子1(exon1)中部分序列被替换成“人slc22a12 cds-3*sv40 pa”组合序列模块,保留小鼠启动子序列。由于小鼠外显子1(exon1)中间序列被替换并中断,使小鼠urat1基因不能表达,从而实现人源urat1的插入和鼠源urat1的沉默。
[0145]
如图1所示,基于crispr/cas9技术,在人源化替换区域设计针对鼠源序列的sgrna(single guide rna)引物。设计并合成识别5’端靶位点和3’端靶位点,并构建sgrna表达载体,其中两端sgrna识别位点分别位于小鼠urat1基因的两端,各sgrna在urat1上的靶位点序列见表1。利用in-fusion技术构建含有“人源slc22a12 cds-3*sv40 pa”元件的打靶载体(供体载体,即人源urat1基因打靶载体),通过酶切、pcr及测序对打靶载体进行验证;同时制备cas9 mrna和/或cas9蛋白。
[0146]
表1 sgrna靶点序列
[0147]
引物名称引物序列sgrna1(匹配基因的正向链)cctgaactcctggaccgagtgggsgrna2(匹配基因的反向链)tcggtccaggagttcaggaaagg
[0148]
显微注射人源urat1基因打靶载体、sgrna表达载体以及cas9 mrna和/或cas9蛋白到小鼠受精卵中,将显微注射后的受精卵送回到代孕鼠输卵管中,等待f0小鼠出生。
[0149]
2、设计包含人源urat1基因的同源dna供体和鉴定方案
[0150]
经基因鉴定筛选出中靶小鼠(f0小鼠)。
[0151]
f0小鼠与野生型小鼠交配产生f1代小鼠,经基因鉴定筛选出阳性小鼠,测序正确的克隆经鉴定为阳性小鼠。
[0152]
人源化小鼠f1代基因型鉴定:将经基因鉴定筛选出的中靶f0小鼠与c57bl/6背景
鼠配繁,其后代小鼠为f1,对获得的f1小鼠的鼠尾基因组dna分别使用两对引物进行中靶后的两端pcr鉴定(参见图2),5’臂正向引物(f2)/3’ki反向引物(r2)分别位于打靶载体的人源片段内及5’同源臂外和hurat1基因内,如该对引物扩增产生2.1kb pcr产物,说明目标载体在小鼠基因组5’进行了有效插入;5’ki正向引物(f1)/3’臂反向引物(r1)分别位于hurat1基因序列内及小鼠urat1基因外显子(exon)2片段内,如该对引物扩增产生2.9kb pcr产物,说明目标载体在小鼠基因组3’进行了有效插入。f1代小鼠urat1-ki5’端与3’端pcr实验结果见图3,1#、2#、3#、5#、6#小鼠的人源urat1基因5’及3’鉴定均为阳性,分别发现了2.1kb pcr产物和2.9kb pcr产物,表明小鼠为正确进行基因重组的阳性小鼠。wt为野生型小鼠的对照,5’端存在非特异性3.7kb pcr产物,水为无模板对照;标记(marker)条带:10kb\8kb\6kb\5kb\4kb\3.5kb\3kb\2.5kb\2kb\1.5kb\1kb\0.75kb\0.5kb\0.25kb;5’及3’端鉴定引物如表2所示。
[0153]
表2 f1代小鼠鉴定引物
[0154][0155]
对pcr鉴定阳性的f1代小鼠克隆进行测序验证,结果如图4所示。
[0156]
表3测序鉴定所用引物
[0157]
引物名称引物序列5’序列引物(f3)ccagattaccacagagggttcc3’序列引物(r3)ctctgtaagctgccattgaggttg
[0158]
c57bl/6背景f1代鼠继续扩繁,f2代鼠尾进行urat1基因pcr鉴定,基因分型(genotyping)-f1/基因分型-r1分别位于打靶载体的3*sv40pa和鼠源外显子(exon)内,如该对引物扩增会产生411bp的pcr产物,说明目标载体在小鼠基因组进行了有效插入;基因分型-f2/基因分型-r2:引物分别位于3’utr及小鼠exon片段内,如该对引物扩增会产生521bp pcr产物,说明目标载体在小鼠基因组未有插入。f2代小鼠urat1-ki pcr鉴定实验结果见图5,11#、13#、14#、16#小鼠的人源urat1基因411bp和521bp条带鉴定均为阳性,表明小鼠为hurat1-ki/-杂合子小鼠。12#只有411bp条带,没有521bp条带,表明小鼠为hurat1-ki/ki纯合子小鼠;15#、17#为hurat1-/-小鼠,只有521bp条带产生。wt为野生型小鼠的对照,水为无模板对照;m为标记(marker)条带:1000bp\900bp\800bp\700bp\600bp\500bp\400bp\300bp\200bp\100bp;鉴定引物如表4所示,基因鉴定pcr反应体系如表5所示,基因鉴定pcr反应条件如表6所示。
[0159]
表4 urat1-ki鉴定引物
[0160][0161]
表5基因鉴定pcr反应体系
[0162][0163]
表6基因鉴定pcr反应条件
[0164][0165]
注:ki为中靶基因型;wt为野生型
[0166]
3、urat1人源化小鼠的hurat1表达及功能验证
[0167]
urat1人源化小鼠hurat1蛋白表达检测
[0168]
六周龄c57bl/6背景纯合urat1ki/ki小鼠和c57bl/6wt小鼠处死,取新鲜肾脏,用10%中性福尔马林固定,石蜡包埋,切片,做抗原修复后用能识别人源urat1蛋白的抗体(义翘神州:200760-t08)进行免疫染色。
[0169]
检测结果:如图6所示,hurat1ki/ki小鼠肾脏肾小管近端内皮侧显示阳性表达人源urat1蛋白,而对照wt小鼠不表达。表明本方法制备得到的urat1基因人源化小鼠可成功表达hurat1蛋白,且表达位置为肾小管近端上皮细胞面对管腔一侧,与urat1蛋白在人和小鼠中表达的位置一致。
[0170]
hurat人源化小鼠的尿酸指标评价
[0171]
建系获得的hurat1人源化小鼠应具有健全的尿酸代谢系统,小鼠表达的尿酸酶可以催化尿酸氧化成过氧化氢和尿囊素等物质利于尿酸的排泄,所以小鼠的本底血尿酸水平
要比人类低的多。hurat1ki/ki和wt小鼠下颌下静脉采血,分离血清后测定血尿酸浓度。结果表明hurat1ki/ki和wt小鼠本底血尿酸水平相当,并无明显升高。这一结果表明小鼠尿酸酶处理尿酸的能力完全远远大于引入hurat1蛋白引起的尿酸重吸收的升高,hurat的表达不会引起小鼠尿酸代谢系统的紊乱。
[0172]
利用尿酸酶抑制剂氧嗪酸钾(oxonic acid potassium)在小鼠体内建立高尿酸血症动物模型。氧嗪酸钾可抑制小鼠体内的尿酸酶活性,使动物体内的尿酸不能分解,从而造成机体内血清尿酸生成增多,最后形成高尿酸血症动物模型。
[0173]
hurat1ki/ki和wt小鼠每天腹腔注射300mg/kg的氧嗪酸钾,连续注射7天后下颌下静脉采血,分离血清后测定血尿酸浓度。hurat1ki/ki和wt小鼠的血尿酸浓度均有增高,hurat1ki/ki小鼠由于引入了对尿酸亲和力更高的人源urat1蛋白,具有更高的尿酸重吸收能力,在去除尿酸酶功能的情况下,造模后表现出更高的血尿酸浓度,对于降尿酸药物的药效评价更加适合。具体如图7所示。
[0174]
氧嗪酸钾造模七天后取血液测定血尿酸浓度,然后给予靶向hurat1的阳性药物苯溴马隆治疗,13mg/kg的苯溴马隆单次灌胃给药,三小时后再次取血,检测血尿酸浓度,以给药之前的小鼠尿酸浓度为100%,计算给药后的变化百分比值。
[0175]
检测结果:如图8所示,野生型小鼠血尿酸水平在苯溴马隆治疗后下降了17.9%,而urat1ki/ki小鼠在苯溴马隆治疗后下降了62.9%。由于小鼠来源的urat1对底物尿酸和人类urat1抑制剂(例如:苯溴马隆)的亲和力都比人源urat1的低,所以鼠源urat1在小鼠体内对尿酸的重吸收作用不大,用urat1抑制剂苯溴马隆治疗后,对血中尿酸的降低作用也非常有限,不能用来评估urat1靶点的药物效果。但人源化urat1小鼠对苯溴马隆的治疗有很好的应答,血尿酸水平比未治疗前降低60%以上,表明urat1人源化小鼠可以用作评价urat1靶点抑制剂或激动剂的药效及其他研究。urat1人源化小鼠模型将是基于hurat1靶点药物药效评价的重要临床前测评工具。
[0176]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0177]
以上对本发明实施例进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明仅用于帮助理解本发明的方法及其核心思想。以上实施例只是较佳的实施例中的一种,并非对本发明的限制。尽管参照前述各实施例对本技术进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1