一株缓解阴道加德纳菌引起的炎症的詹氏乳杆菌及其应用
1.本发明涉及一株缓解阴道加德纳菌引起的炎症的詹氏乳杆菌及其应用,属于微生物技术领域。
背景技术:
2.细菌性阴道炎是育龄妇女阴道分泌物异常的最常见原因,以阴道定植厌氧菌群和失去正常优势菌乳杆菌为特征,其临床表现为外阴瘙痒、出现烧灼感、大量阴道分泌物并伴有腐烂的鱼腥味。同时,细菌性阴道炎与广泛的健康问题有关,包括早产、盆腔炎、对艾滋病毒感染的易感性增加,以及其他慢性健康问题。这些并发症在育龄妇女中是一种普遍现象,仅早产就影响了所有怀孕妇女的10%以上,与此同时,还产生了高额的医疗费用。根据医学研究所的一份报告,2005年,仅在美国,早产就至少花费了262亿美元,即每个婴儿平均花费51600美元(onderdonk a b等,the human microbiome during bacterial vaginosis[j].clinical microbiology reviews,2016)。鉴于细菌性阴道炎的流行、相关并发症与昂贵的医疗问题,细菌性阴道炎代表着一个重要的全球公共卫生问题。
[0003]
健康女性阴道微生物区系主要由某些乳杆菌组成,其中以卷曲乳杆菌、格氏乳杆菌、约氏乳杆菌和詹氏乳杆菌为最常见菌种。这些存在于阴道中的乳杆菌代谢阴道上皮分泌的糖原,产生有机酸,维持阴道正常的酸性环境(ph《4.5)。而低ph值环境往往会抑制具有致病潜力的兼性和必需的厌氧微生物的生长,使这些微生物暂时从阴道环境中剥离出来。
[0004]
在患有细菌性阴道炎的妇女中则更常见的是阴道加德纳菌属、普雷沃特氏菌属等,这些厌氧菌取代乳杆菌,导致阴道正常优势菌群明显减少,阴道致病性菌群明显增加。其中,阴道加德纳菌是细菌阴道炎主要的致病菌。细菌性阴道炎与附着在生物组织上的生物膜形成有关,而生物膜的形成主要由阴道加德纳氏菌群构成,其强烈地粘附于阴道上皮细胞,形成生物膜是细菌性阴道炎建立的关键,并促进了其他细菌性阴道炎相关厌氧菌的粘附和生长。同时,以生物膜形式固着的阴道加德纳菌通常比浮游形式对抗生素的耐受性要更强,并增强了对宿主免疫防御的抵抗力。此外,临床研究证实阴道加德纳菌与阴道免疫环境紊乱密切相关。阴道加德纳菌通过黏附于阴道上皮细胞,激发宿主局部免疫应答。阴道上皮细胞受到阴道加德纳菌刺激表达toll样受体(tlr),通过核因子-κb(nf-kb)信号转导途径响应微生物病原体分子,分泌促炎细胞因子如tnf-α、il-1β,引起阴道粘膜对阴道加德纳菌免疫反应,并伴有组织炎症发生。
[0005]
国际指南推荐口服或阴道内注射甲硝唑、克林霉素或替硝唑作为标准治疗(tom
á
s m等,bacterial vaginosis:standard treatments and alternative strategies[j].int j pharm,2020)。然而,使用这些抗生素治疗与较高的失败率和复发率有关。这可能与抗生素耐药性、无法根除致病菌生物膜、未能重建酸性环境以及以乳杆菌为主共生菌群有关。因此,为了更有效地治疗细菌性阴道炎,研究替代策略是当务之急。替代战略可从微生态学角度出发,利用益生菌缓解细菌性阴道炎,其可通过竞争粘附位点、自身代谢产生的抑菌物质、抑制毒素合成或降解细胞毒性化合物自然抵抗致病菌定植与生长,安全可靠,同时改善
局部免疫反应。
[0006]
目前,已在市面上销售用于治疗细菌性阴道炎的本土益生菌产品十分有限,且产品中的活菌均不是筛选自我国健康育龄期女性阴道内的优势菌群。早在20世纪初,国内康白等人筛选出一株阴道来源乳杆菌—德氏乳杆菌dm8909并已研制成一款益生菌产品(对德氏乳杆菌dm8909菌株的微生物学研究[j].中国微生态学杂志,2001),但该菌株对细菌性阴道炎治疗作用的探讨存在局限性,仅仅从竞争排斥及单一的抑菌物质发挥阻碍病原菌是不全面的(对dm8909菌株治疗菌群失调性阴道病作用机制的研究[j].中国微生态学杂志,2001)。此外,部分专利公开涉及到优势菌-詹氏乳杆菌(cn110540945a、cn110656060a),但其所保护的菌株均仅从对阴道炎相关致病菌生长抑制及(或)益生菌致病菌体内定植两方面进行评估,由于不同乳杆菌菌株表现出不同的功能特异性,在阴道微环境中,是否有效调节宿主免疫反应仍未可知。并且,对于宿主免疫的调节直接关系到乳杆菌能否缓解阴道加德纳菌引起的炎症,进而达到缓解细菌性阴道炎的目的。因此在选用乳杆菌治疗细菌性阴道炎时,不仅需要考虑乳杆菌体外益生能力,还要考虑乳杆菌调节免疫能力。而目前这样有效的能够调节免疫能力的乳杆菌还非常少,有待进一步的挖掘和开发。
技术实现要素:
[0007]
为了解决现有技术中缺少来自中国女性阴道的优势菌株作为缓解阴道加德纳菌引起的炎症的益生菌的问题,本发明从健康女性的阴道中筛选得到了一株詹氏乳杆菌,将其作用于患有细菌性阴道炎的部位,可有效抑制加德纳菌生物膜的形成,可从源头上阻断细菌性阴道炎的发生和发展。
[0008]
本发明提供了一株詹氏乳杆菌(lactobacillus jensenii)ccfm1213,已于2021年12月17日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:62139。
[0009]
本发明提供了含有所述詹氏乳杆菌ccfm1213的微生物菌剂。
[0010]
在一种实施方式中,所述微生物制剂中詹氏乳杆菌ccfm1213的含量不低于109cfu/ml或109cfu/g。
[0011]
本发明提供了一种用于预防和/或缓解细菌性阴道炎的产品,所述产品中含有所述詹氏乳杆菌ccfm1213和/或所述詹氏乳杆菌ccfm1213的代谢产物。
[0012]
在一种实施方式中,所述产品为药品或卫生用品。
[0013]
在一种实施方式中,所述药品的成分中含有所述的詹氏乳杆菌ccfm1213以及药学上可接受的载体和/或药用辅料;或者,所述药品的成分包含所述的詹氏乳杆菌ccfm1213的代谢产物以及药学上可接受的载体和/或药用辅料;或者,所述药品中含有所述的詹氏乳杆菌ccfm1213、所述的詹氏乳杆菌ccfm1213的代谢产物以及药学上可接受的载体和/或药用辅料。
[0014]
在一种实施方式中,所述药学上可接受的载体包括微囊、微球、纳米粒和/或脂质体。
[0015]
在一种实施方式中,所述药用辅料包含赋形剂和/或附加剂。
[0016]
在一种实施方式中,所述赋形剂包含粘合剂、填充剂、崩解剂和/或润滑剂。
[0017]
在一种实施方式中,所述附加剂包含增溶剂、助溶剂、潜溶剂和/或防腐剂。
[0018]
在一种实施方式中,所述药品的剂型为粉剂、颗粒剂、胶囊剂、片剂、栓剂、丸剂和/
或口服剂。
[0019]
在一种实施方式中,所述卫生用品包括卫生湿纸巾、卫生巾、卫生护垫、卫生栓、卫生棉、阴道洗液、女士抗菌或抑菌洗剂。
[0020]
本发明提供了所述詹氏乳杆菌在制备预防和/或缓解细菌性阴道炎的产品中的应用,所述应用不以疾病的诊断和治疗为目的。
[0021]
在一种实施方式中,所述产品包括药品或卫生用品。
[0022]
在一种实施方式中,所述产品中所述詹氏乳杆菌ccfm1213的浓度不低于109cfu/ml或109cfu/g。
[0023]
在一种实施方式中,所述药品的成分中含有所述的詹氏乳杆菌ccfm1213以及药学上可接受的载体和/或药用辅料;或者,所述药品的成分包含所述的詹氏乳杆菌ccfm1213的代谢产物以及药学上可接受的载体和/或药用辅料;或者,所述药品中含有所述的詹氏乳杆菌ccfm1213、所述的詹氏乳杆菌ccfm1213的代谢产物以及药学上可接受的载体和/或药用辅料。
[0024]
在一种实施方式中,所述药学上可接受的载体包括微囊、微球、纳米粒和/或脂质体。
[0025]
在一种实施方式中,所述药用辅料包含赋形剂和/或附加剂。
[0026]
在一种实施方式中,所述赋形剂包含粘合剂、填充剂、崩解剂和/或润滑剂。
[0027]
在一种实施方式中,所述附加剂包含增溶剂、助溶剂、潜溶剂和/或防腐剂。
[0028]
在一种实施方式中,所述药品的剂型为粉剂、颗粒剂、胶囊剂、片剂、丸剂和/或口服剂。
[0029]
在一种实施方式中,所述卫生用品包括卫生湿纸巾、卫生巾、卫生护垫、卫生栓、卫生棉、阴道洗液、女士抗菌或抑菌洗剂。
[0030]
有益效果:本发明从健康的女性阴道内筛选到了一株詹氏乳杆菌ccfm1213,所述詹氏乳杆菌ccfm1213能够用于缓解由加德纳菌引起的细菌性阴道炎,具体为:
[0031]
能够在体外抑制加德纳菌生物膜的形成,表明其可能抑制加德纳菌在体内形成生物膜,降低加德纳菌起作用的可能性;
[0032]
与商业化的德氏乳杆菌dm8909以及同期筛选到的詹氏乳杆菌相比,显著改善了由加德纳菌引起的细菌性阴道炎,减轻阴道上皮细胞脱落的情况,提升阴道组织的恢复能力;调节阴道内免疫调节因子的水平,显著降低阴道内tnf-α、il-1β分泌情况和髓过氧化物酶的活性。
[0033]
本发明提供的詹氏乳杆菌ccfm1213能够被应用于制备治疗细菌性阴道炎的益生菌产品或含益生菌的女性卫生用品中,维持阴道健康,具有广阔的市场前景。
[0034]
生物材料保藏
[0035]
本发明所提供的詹氏乳杆菌ccfm1213,分类学命名为lactobacillus jensenii,于2021年12月17日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:62139,保藏地址为广州市先烈中路100号大院59号楼5楼。
附图说明
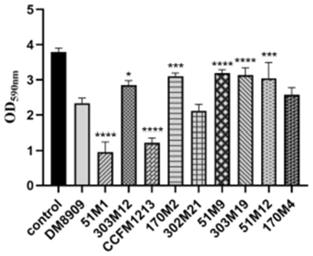
[0036]
图1为詹氏乳杆菌对阴道加德纳菌生物膜形成的影响;与阳性对照德氏乳杆菌
dm8909相比,*:p《0.05,***:p《0.001,****:p《0.0001。
[0037]
图2为詹氏乳杆菌黏附能力评价;与阳性对照德氏乳杆菌dm8909相比,***:p《0.001。
[0038]
图3为实验流程图。
[0039]
图4为阴道加德纳菌和詹氏乳杆菌在阴道中的定植图;(a)第5天和第17天bv小鼠阴道中阴道加德纳菌载量;(b)第17天bv小鼠阴道中詹氏乳杆菌载量;a、b代表第17天不同组之间的显著差异(p《0.05)。
[0040]
图5为詹氏乳杆菌对阴道免疫反应的影响;(a)髓过氧化物酶(mpo)活性水平;(b)促炎因子tnf-α的表达;(c)促炎因子il-1β的表达;与模型组比较,*:p《0.05,**:p《0.01。
[0041]
图6为小鼠阴道组织病理学评价;(a):空白对照组;(b):细菌性阴道炎模型组;(c):德氏乳杆菌dm8909组;(d):詹氏乳杆菌qjswx51m1组;(e):詹氏乳杆菌ccfm1213组;(f):詹氏乳杆菌qjswx302m21组;sep:复层鳞状上皮。
具体实施方式
[0042]
bhis培养基:胰蛋白胨10.0g/l、牛心浸粉17.5g/l、氯化钠5.0g/l、葡萄糖3.0g/l、十二水合磷酸氢二钠2.5g/l、酵母粉10.0g/l、麦芽糖1.0g/l,ph7.2~7.4;待温度凉至55℃左右,添加10%无菌胎牛血清。
[0043]
实施例1:乳杆菌体外抑制阴道加德纳菌生物膜形成能力
[0044]
在4℃下以10000
×
g离心10min,收集相应培养物浓度为108cfu/ml的乳杆菌上清液。将bhis培养基中阴道加德纳菌24h培养物调至108cfu/ml,向96孔板每孔转移100μl阴道加德纳菌悬液,加入100μl乳杆菌上清液。mrs用作空白对照。将板在37℃下孵育24h。24h生物膜形成后,用pbs洗涤3次小心去除浮游细胞,每孔加入100μl甲醇(国药集团化学试剂有限公司)固定30分钟。弃去甲醇后,生物膜用0.1%结晶紫染色5分钟。弃去结晶紫,用pbs洗涤3次,每孔加入200μl 33%冰醋酸(国药集团化学试剂有限公司)。通过酶标仪测量每个孔在570nm处的吸光度。
[0045]
所用的菌株如图1所示,除德氏乳杆菌dm8909之外,其余菌株均为采用相同方法从健康女性阴道中筛选得到的詹氏乳杆菌。
[0046]
结果如图1所示,所有菌株均表现出不同程度抑制生物膜形成的能力。德氏乳杆菌dm8909作为商品菌株,能有效地抑制阴道加德纳菌生物膜形成,od
590 nm
由3.80降至2.34(p《0.05)。以德氏乳杆菌dm8909抑制生物膜能力为参比,詹氏乳杆菌ccfm1213、qjswx51m1对阴道加德纳菌生物膜形成的抑制效果显著,抑制率为67.71%、74.66%。而抑制生物膜形成优于德氏乳杆菌dm8909的另一株菌詹氏乳杆菌qjswx302m21与德氏乳杆菌dm8909的抑制作用无显著差异,两株菌抑制率分别为44.13%、38.35%。其余菌株抑制率介于15.87%到32.03%之间。由于詹氏乳杆菌ccfm1213、qjswx51m1在体外显示出较高的抑制阴道加德纳菌生物膜形成能力,因此,选择詹氏乳杆菌ccfm1213、詹氏乳杆菌qjswx51m1进一步研究其在体内的作用,同时,以詹氏乳杆菌qjswx302m21为阴性对照,德氏乳杆菌dm8909为阳性对照菌株。
[0047]
[0048]
实施例2:詹氏乳杆菌的黏附能力
[0049]
在之前的研究中已经报道过乳杆菌的粘附能力有助于在阴道环境中定植,抑制病原菌入侵,调节宿主局部免疫防御反应,因而对乳杆菌的粘附能力进行评价。
[0050]
体外粘附能力的检测:
[0051]
将生长融合至80%的hela细胞消化,将无菌盖玻片放置在6孔培养板中,加入2ml/孔的细胞完全培养悬液(1
×
105个/ml),37℃条件下放入5%co2培养箱中培养,待细胞贴壁后,弃去培养基,加入2ml/孔的乳杆菌悬液(1
×
108cfu/ml),随后孵育2h。结束后,用磷酸盐缓冲液清洗以除去未黏附的乳杆菌,甲醇固定20min后进行革兰氏染色,显微镜观察。随机选取20个视野进行评价,计录100个细胞所黏附的细菌数目,并以每个hela细胞黏附细菌数表示,即为黏附指数。
[0052]
这3个菌株对hela细胞的粘附能力不同(图2)。詹氏乳杆菌ccfm1213的黏附能力较强,为27.1个/细胞,显著高于德氏乳杆菌dm8909,为17.1个/细胞(***p《0.01),而qjswx51m1、qjswx302m21的粘附能力与德氏乳杆菌dm8909无显著性差异。由于詹氏乳杆菌ccfm1213在体外表现出高黏附能力,推测可能其在体内具有较好的定植能力。
[0053]
实施例3:詹氏乳杆菌ccfm1213在缓解细菌性阴道炎中的应用
[0054]
实验动物及菌株:
[0055]
spf级balb/c小鼠,雌性,7周龄、体重18-20g,购于北京维通利华实验动物技术有限公司(生产许可证号scxk(京)2012-0001)。
[0056]
阴道加德纳菌采用阴道加德纳菌atcc 14018,购买于广东省微生物研究所菌种保藏中心gdmcc。
[0057]
实验方案和分组:
[0058]
表1.小鼠实验分组情况
[0059][0060]
根据体重随机将小鼠分成6组,参照表1,所有组小鼠整个实验过程中正常饲养。
[0061]
细菌性阴道炎模型组和干预组都需经历连续5天(0-4天)的阴道加德纳菌的侵染(侵染的具体操作手法为用枪头吸取阴道加德纳菌的菌悬液20μl(菌悬液的浓度为108cfu/ml),缓缓注入小鼠阴道内,将小鼠倒立,停留1-2分钟,放入笼中)。益生菌干预组分别再用德氏乳杆菌dm8909、詹氏乳杆菌ccfm1213、qjswx51m1、qjswx302m21连续干预12天(第5-17天)。所有干预的具体操作手法为,用枪头吸收相应乳杆菌菌悬液20μl(浓度为109cfu/ml),缓缓注入小鼠阴道内,将小鼠倒立,停留1-2分钟,放入笼中。实验周期为20天(第-3~17天)。在侵染结束(第5天)和干预结束(第17天)分别用枪头每次吸取50μl磷酸缓冲溶液对小鼠阴道吹吸进行取样,最终采集300μl阴道灌洗液对阴道加德纳菌和乳杆菌载量进行测定。同时,在第17天,对所有实验小鼠进行处死并剥离阴道组织用于后续实验组织病理学分析,测定髓过氧化物酶活性、炎症因子(tnf-α、il-1β)分泌,此外,吸取10μl阴道灌洗液用于评
判阴道上皮细胞脱落情况。
[0062]
实验结果:
[0063]
①
小鼠阴道中阴道加德纳菌和乳杆菌定植载量
[0064]
表2.阴道细菌实时定量pcr检测种特异性引物
[0065][0066]
首先,根据使用说明,使用土壤快速dna旋转试剂盒(mp biomedical,美国)和qiaquick gel提取试剂盒(qiagen,德国)提取阴道灌洗液中的dna。随后,使用qpcr对阴道加德纳菌和格氏乳杆菌进行了定量检测。根据细菌16s rrna序列选择引物。反应混合物(10μl)包括5μl的2
×
itaq
tm universalgreen supermix(bio-rad,美国),1μl的模板dna(10ng/μl),0.5μl的正反向引物(各10μm)和3μl的双蒸水。
[0067]
热循环条件为:初始变性95℃,30s;随后95℃,5s和60℃,30s,此条件循环40次。另一个步骤,95℃,10s,从65℃增加到95℃,每5s增加0.5℃,以建立熔解曲线。确定阈值周期值(ct),并根据标准曲线(log copies/μl与ct值)计算拷贝数。每个样本都进行了一式三份的检查。实时定量pcr所涉及詹氏乳杆菌、阴道加德纳菌引物参见如上(表2)。从图4a结果显示除空白对照组外的所有组在第5天均可在小鼠体内检测到约7lg拷贝数/μl阴道加德纳菌(模型组为7.15lg拷贝数/μl,dm8909组为7.65lg拷贝数/μl,詹氏乳杆菌qjswx51m1组为6.83lg拷贝数/μl,詹氏乳杆菌ccfm1213组为7.02lg拷贝数/μl,詹氏乳杆菌qjswx302m21组为6.53lg拷贝数/μl),这表明阴道加德纳菌成功定植。对于空白对照组,在整个实验期间未检测到阴道加德纳菌。益生菌干预数天后,ccfm1213组阴道加德纳菌定植量显着降低至6.02lg拷贝数/μl。与模型组相比,德氏乳杆菌dm8909没有显著减少阴道加德纳菌定植(p》0.05)。詹氏乳杆菌qjswx302m21抑制阴道加德纳菌的能力比詹氏乳杆菌ccfm1213弱,从7.11lg拷贝数/μl降低到6.20lg拷贝数/μl(p《0.05)。
[0068]
同时,检测了在干预阶段益生菌定植(图4b)。詹氏乳杆菌ccfm1213与詹氏乳杆菌qjswx51m1、qjswx302m21在第17天的定植量分别为7.10lg拷贝数/μl、5.81lg拷贝数/μl、6.31lg拷贝数/μl。表明詹氏乳杆菌定植可以在一定程度上抑制体内阴道加德纳菌的生长,其中詹氏乳杆菌ccfm1213抑制最为显著。
[0069]
②
阴道加德纳菌诱导上皮细胞脱落情况
[0070]
如表3,模型组上皮细胞脱落严重(36.9
±
3.7个/视野),而空白对照组每个视野下约7.8个细胞。与模型组相比,德氏乳杆菌dm8909可显著缓解上皮脱落情况(p《0.05)。ccfm1213组的上皮脱落情况为20.3个/视野,减少上皮细胞脱落的效果明显优于dm8909组(p《0.05),而相比于模型组,302m21组的阴道上皮细胞脱落没有显著减少。
[0071]
表3.阴道加德纳菌诱导上皮细胞脱落
[0072][0073]
注:a,b,c,d表示组间差异(p《0.05)
[0074]
③
小鼠阴道组织中免疫调节因子tnf-α、il-1β分泌情况和髓过氧化物酶活性
[0075]
结果如图5a所示,与对照组相比,模型组髓过氧化物酶活性水平显著升高,从64.83u/l上升至83.04u/l(p《0.01),说明阴道加德纳菌导致大量中性粒细胞聚集在阴道组织中。德氏乳杆菌dm8909没有显著降低该酶的活性。詹氏乳杆菌ccfm1213阴道给药可显著抑制髓过氧化物酶活性,为67.80u/l(p《0.05)。图5b和图5c分别显示了阴道组织中促炎因子tnf-α和il-1β的浓度。结果表明,与对照组相比,模型组小鼠阴道组织分泌大量tnf-α和il-1β,浓度分别为131.14pg mg-1
、78.69pg mg-1
。益生菌干预后,德氏乳杆菌dm8909和詹氏氏乳杆菌qjswx51m1、qjswx302m21与模型组相比没有显著调节促炎因子。詹氏乳杆菌ccfm1213显著降低了阴道组织中促炎细胞因子tnf-α和il-1β(分别为95.60pg mg-1
,p《0.01和54.79pg mg-1
,p《0.05)的表达,抑制率分别27.1%和30.4%。
[0076]
④
小鼠阴道组织病理学分析
[0077]
通过对小鼠阴道组织进行he染色,可以有效评估各组别小鼠阴道织的炎症情况。
[0078]
实验结束时,处死小鼠并切除阴道。一部分阴道组织用于组织病理学检查。阴道组织用4%多聚甲醛固定,石蜡包埋,切片成5mm厚切片,苏木精伊红染色(h&e)。阴道组织样本在病理切片扫描仪(panoramic midi,3dhistech ltd,budapest,hungary)下放大20倍进行观察。
[0079]
如图6所示,空白对照组阴道上皮光滑连续,组织结构完整,未见炎性细胞浸润。模型组阴道黏膜上皮连续性差,表层细胞糜烂,形成孔洞,黏膜下间质充血,大量炎性细胞浸润到上皮和间质中。在适当的益生菌阴道给药一段时间后,德氏乳杆菌dm8909组的炎症细胞浸润比模型组少,但上皮层存在轻度表面糜烂。其余三个益生菌干预组中,詹氏乳杆菌qjswx302m21对小鼠阴道组织恢复程度较模型组并无明显改善。与空白对照组相比,詹氏乳杆菌qjswx51m1阴道上皮层不同部位仍有浅表糜烂、阴道上皮不连续、炎症细胞浸润等现象。詹氏乳杆菌ccfm1213表现出与詹氏乳杆菌qjswx302m21相反的效果,例如恢复上皮连续性、少量炎症细胞浸润。詹氏氏乳杆菌ccfm1213干预后小鼠阴道组织的恢复优于德氏乳杆菌dm8909组。
[0080]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1