一种益生菌组合物及其制备方法与流程
1.本发明涉及生物领域,更具体的涉及抗过敏领域,主要是涉及一种益生菌组合物及其制备方法。
背景技术:
2.过敏性疾病(allergic disease)又称变态反应性疾病,包括过敏性鼻炎、过敏性结膜炎、支气管哮喘、特应性皮炎、荨麻疹、食物过敏等,在世界各地均很常见,并且发病率逐年增高,已成为一种普遍的公共健康问题,据估计世界上有30%~40%的人口正遭受过敏性疾病的困扰;而且,过敏性疾病的发生率正逐年增加,造成了巨大的医疗负担。过敏性疾病的影响因素包括产前接触微生物、分娩方式、饮食、药物使用以及接触宠物和家畜等,与人类现代生活方式有着直接的关系。采用相关变应原疫苗进行脱敏治疗是治疗过敏性疾病的最佳手段,而对于尚未研制出疫苗的过敏症状,最主要的治疗方式是采用药物治疗来控制(即对症用药);但是,药物治疗并不能改变过敏性疾病的进程,因而也就不能从根本上达到治愈的效果。随着肠道菌群紊乱与过敏性疾病的关系得到流行病学和实验的证实,以及人们在肠道菌群对黏膜免疫系统发育成熟、对免疫系统调节作用方面的深入研究,临床上应用益生菌药物治疗和预防过敏性疾病受到广泛的重视,这在目前全世界过敏性疾病逐渐增加的情况下,具有非常重要的现实意义,也有非常广阔的前景。
3.已有多项研究显示益生菌对过敏性疾病有一定的预防和治疗效果。使用含有保加利亚乳杆菌(lactobacillus bulgaricus,108cfu
·
ml-1)、嗜热链球菌(streptococcus thermophilus,108cfu
·
ml-1)和副干酪乳杆菌亚种cncmi-1518的益生菌发酵乳(pfm)喂饲5周龄的balb/c小鼠,使用ova对小鼠致敏,发现小鼠抗ova特异性ige水平显著降低,而抗ova特异性igg和总分泌型iga(s-iga)没有发生变化。pfm能调节th2反应向th1反应转变,增加il-10和ifn-γ水平。将含有鼠李糖乳杆菌lock0900(l.rhamnosuslock0900)、鼠李糖乳杆菌lock090833和干酪乳杆菌lock0919的混合益生菌(lmix)定植于近交系balb/c小鼠(8周龄),3周之后用重组桦树花粉致敏原蛋白betv1致敏小鼠,最终结果显示lmix定植能提高肠道上皮的屏障作用并降低对betv1的敏感性;血清中抗原特异性ige、igg1和igg2a水平明显降低,同时却提高了血清中总iga水平和tgf-β水平。此外,通过ova敏感小鼠模型研究发现益生菌能够降低血清中ova-ige和ova-igg1水平,降低脾脏th2细胞因子的释放并改善腹泻症状;而且通过16srrna分析发现起主要作用的益生菌是粪球菌属和立克菌属。而且,临床试验显示,益生菌对过敏性鼻炎、ad、哮喘和食物过敏等疾病具有一定的治疗效果;对过敏性疾病有效的益生菌一般为鼠李糖杆菌、嗜酸乳杆菌、双歧杆菌等;益生菌单一菌种和混合益生菌都能起到治疗的作用。
4.目前的研究可以初步确定,益生菌抑制过敏的主要功能包括:促进抗原的降解,改变其免疫原性,从而减少抗原对机体的刺激。调节促炎和抗炎因子的分泌,调控免疫系统的功能。调节菌群结构,使其恢复正常状态。恢复肠道的通透性,减轻肠道局部黏膜的炎症。通过分泌生物活性物质或抑制其粘附至肠黏膜表面,来降低致病菌对肠道黏膜的侵袭。在调
节免疫功能的角度上分析,益生菌调节机体免疫系统主要基于以下几点:平衡thl/th2细胞的数量。促进thl细胞介导的细胞因子的分泌。降低ige的分泌量。增强树突状细胞对抗原的耐受性。激活nk细胞。促进toll样受体的功能。产生足够的分泌型iga等作用效果。
5.但是目前采用益生菌特别是联合用药用于过敏治疗的研究还不够多,可提供的选择还不够丰富,值得进一步的研究。
技术实现要素:
6.本发明克服现有技术的缺陷,提供一种治疗过敏的药物组合物,特别是用于治疗过敏性鼻炎。
7.防己具有祛风除湿、利水消肿作用和抗过敏的作用。因此,从防己中筛选并获得了具有抗过敏作用的多肽,fj-1和fj-2,其中fj-1的序列seq id no:1所示。
8.本发明进一步的,提供一种益生菌冻干粉。
9.进一步的,所述益生菌冻干粉的制备方法为:
10.将-80℃保藏的鼠李糖乳杆菌gg菌种接种于mrs培养基中,37℃培养18h,传代培养2次得到活化的菌种种子液;
11.在发酵罐中装入70%发酵培养基,接种5%(v/v)种子液,拌转速80r/min,37℃,恒ph6.0,无通气自然发酵15h,在发酵过程中,监测ph值,流加12.5%氨水作为中和剂维持ph在6.0;
12.发酵培养基组成如下:葡萄糖25.0g,酵母粉20.0g,kh2po
4 2.5g,mgso4·
7h2o 2.0g,柠檬酸三铵2.5g,ch3coona
·
3h2o 6.25g,tween80 1.0ml,蒸馏水1000ml,ph 6.2;121℃灭菌15min;
13.将发酵液于8000rpm高速离心机中离心5min,弃去上清,收集菌泥。在菌泥中,按复合保护剂及菌泥的体积比1:3进行添加,其中复合机保护剂配方及重量份数为脱脂奶粉2份,海藻糖5份,蔗糖1份,葡萄糖5份,明胶3份,甘氨酸0.1份,水20份;混合均匀后得含有保护剂的微生物悬液;
14.将含保护剂的微生物悬液于-4℃预冻-12h后置于真空冷冻干燥机中冷冻24h得益生菌冻干粉,真空冷冻的条件为:真空度5pa、冷肼温度-60℃、时间18h。
15.本发明另外一方面,提供一种含有益生菌以及抗过敏多肽的冻干粉,所述冻干粉的制备方法为将-80℃保藏的鼠李糖乳杆菌gg菌种接种于mrs培养基中,37℃培养18h,传代培养2次得到活化的菌种种子液;
16.在发酵罐中装入70%发酵培养基,接种5%(v/v)种子液,拌转速80r/min,37℃,恒ph6.0,无通气自然发酵15h,在发酵过程中,监测ph值,流加12.5%氨水作为中和剂维持ph在6.0;
17.发酵培养基组成如下:葡萄糖25.0g,酵母粉20.0g,kh2po4 2.5g,mgso4
·
7h2o 2.0g,柠檬酸三铵2.5g,ch3coona
·
3h2o 6.25g,tween80 1.0ml,蒸馏水1000ml,ph 6.2;121℃灭菌15min;
18.将发酵液于8000rpm高速离心机中离心5min,弃去上清,收集菌泥。在菌泥中,按复合保护剂、菌泥、fj-1多肽的体积比1:3:0.2进行添加混匀,其中复合机保护剂配方及重量份数为脱脂奶粉2份,海藻糖5份,蔗糖1份,葡萄糖5份,甘氨酸0.1份,水20份,混匀;混合均
匀后得含有保护剂的微生物悬液;
19.将含保护剂的微生物悬液于-4℃预冻-12h后置于真空冷冻干燥机中冷冻24h得益生菌冻干粉,真空冷冻的条件为:真空度5pa、冷肼温度-60℃、时间18h。
20.本发明进一步的,提供一种治疗过敏性鼻炎的药物组合物,所述药物组合物中含有所述的益生菌冻干粉。
21.本发明进一步的,提供一种治疗过敏性鼻炎的药物组合物,所述药物组合物中含有所述的益生菌以及抗过敏多肽的冻干粉。
22.进一步的,本发明还提供益生菌冻干粉在制备治疗过敏性鼻炎的药物组合物中的用途。
23.进一步的,本发明还提供益生菌以及抗过敏多肽的冻干粉在制备治疗过敏性鼻炎的药物组合物中的用途。
24.进一步的,本领域技术人员可以使用本领域中已知的任何方式施用本发明的药物组合物,包括但不限于口服、经鼻、胃肠外、局部、经皮或直肠的施用途径。本发明的药物组合物优选适用于口服或局部施用的剂型,例如,片剂、胶囊(包括硬胶囊、软胶囊)、丸剂、溶液、粉末或粒料、悬浮液、贴片等,组合物中还可以添加微晶纤维素作为辅料。本发明的药物可采用本领域中公知的方法制为相应剂型。
25.此外,作为本实施例的可替代实现方式,上述微晶纤维素等药用辅料还可以替换为其他常用辅料,本发明中所述的“常规辅料”是指药学上可接受的材料、组合物或媒介物,例如液体或固体填充剂、稀释剂、赋形剂(如可可脂和栓蜡)、溶剂或包装材料。药学上可接受的载体是与组合物的其他成分、与施用的模式相容的并且对患者无害。药学上可接受的载体可以是水性或非水性的。常规辅料包括胶质,例如明胶;淀粉,例如玉米淀粉、马铃薯淀粉;糖,例如乳糖、葡萄糖和蔗糖;纤维素材料及其混合物,例如羧甲基纤维素钠、乙基纤维素和醋酸纤维素。可用作药学上可接受的载体的材料包括但不限于,西黄蓍胶粉、麦芽、滑石粉、油(如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油、大豆油等)、醇类(如丙二醇、乙醇、甘油、山梨糖醇、甘露醇、聚乙二醇等)、酯类(如油酸乙酯、月桂酸乙酯、琼脂)、缓冲剂(如氢氧化镁、氢氧化铝、硼酸和硼酸钠以及磷酸盐缓冲液)、褐藻酸、无热源的水、等渗盐水、林格氏液。
26.有益效果
27.本发明提供一种益生菌组合物,所述益生菌组合物主要含有益生菌和抗过敏多肽,所述抗过敏多肽是从防己中筛选鉴定获得的。所述多肽通过细胞脱颗粒测定鉴定了其具有抗过敏特性,将所述多肽和益生菌制备成为冻干粉之后,可以有效的在过敏小鼠模型中实现治疗效果,具有很好的应用前景。
附图说明
28.图1组胺的含量结果图
29.图2β-氨基己糖苷酶释放率结果图
具体实施方式
30.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完
整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
31.实施例1抗过敏多肽的筛选及鉴定
32.防己10g,研成粉末,使用pbs溶解,随后分别用胰蛋白酶和碱性蛋白酶分别进行酶解,采用不同截留分子量超滤离心管分别收集滤过和未滤过溶液,得到5种不同分子量范围的防己粗寡肽,采用透明质酸酶抑制率作为筛选靶标,鉴定了其中fj-c组分具有最高的96.4%的透明质酸酶抑制率,选择该组分,继续进行sephadex-g15和sephadex-g50纯化后,再采用反相高效液相色谱(rp-hplc)纯化得到2个小肽fj-1和fj-2,将二个小肽进行质谱分析,得到其中fj-1的序列为psahitiaicagvn。将所述小肽委托上海生工进行合成,备用。
33.实施例2fj-1多肽细胞脱颗粒测定其抗过敏性
34.组胺是由组氨酸脱氢酶脱羧形成,储存在正常肥大细胞中的分泌颗粒中,主要通过特异性组胺受体发挥其生物学效应,当肥大细胞受过敏原刺激后,随着脱颗粒分泌到胞外,引发过敏反应。组胺仅存在于嗜碱性粒细胞和肥大细胞中,可把组胺释放量作为衡量肥大细胞脱颗粒强弱的重要标志物。
35.(1)敏化细胞:调整p815小鼠肥大细胞瘤细胞密度为2
×
105个/ml,取48孔板,每孔加190μl细胞悬液和10μl终浓度为0.5μg/ml anti-dnp-ige,培养箱(37℃,5%co2)孵育过夜。(2)刺激细胞:次日弃培养液,用pbs洗涤敏化后的细胞3遍,空白对照组和模型组每孔加190μl tyrode’s缓冲液,试验组每孔加190μl溶于tyrode’s缓冲液的样品溶液,样品终浓度为50,200,500μg/ml,继续培养1h。样品孵育1h后,空白对照组加10μl tyrode’s缓冲液,模型组和试验组加10μl终浓度为0.5μg/ml dnp-bsa刺激敏化细胞1h,收集细胞上清液于1.5ml ep管中。(3)检测β-氨基己糖甘酶(β-hex)释放率:参照bansod等的方法,计算β-hex释放率%=m1上清液中β-hex的od值/(m1上清液中β-hex的od值+m2细胞裂解液中β-hex的od值)。(4)检测上清液中组胺释放量:裂解处理细胞,收集上清液,根据组胺试剂盒说明书,检测上清液中组胺的含量。
36.结果如图1所示,空白对照组p815细胞上清液中组胺浓度为(0.20
±
0.02)ng/ml;dnp-bsa刺激后上清液中组胺浓度为(0.90
±
0.05)ng/ml,显著高于空白对照组(p<0.01);50,200,500μg/ml多肽肽和dnp-bsa共同孵育后,上清液中组胺浓度分别为(0.71
±
0.03),(0.40
±
0.04),(0.36
±
0.03)ng/ml,显著低于仅用dnp-bsa刺激后上清液中的组胺浓度。
37.如图2所示,dnp-bsa刺激后,p815细胞β-氨基己糖苷酶释放率(44.52
±
2.14)%,显著高于空白对照组的(7.90
±
0.82)%,而50,200,500μg/ml多肽和dnp-bsa共同孵育后,β-氨基己糖苷酶释放率显著降低,最低到了(13.41
±
0.88)%(p<0.01)。综上所述,fj-1多肽显著抑制p815细胞中组胺和β-氨基己糖苷酶分泌,且浓度为200μg/ml达到显著抑制。
38.实施例3鼠李糖乳杆菌益生菌冻干粉的制备
39.将-80℃保藏的鼠李糖乳杆菌gg菌种接种于5ml mrs培养基中,37℃培养18h,传代培养2次得到活化的菌种种子液;
40.在发酵罐中装入70%发酵培养基,接种5%(v/v)种子液,拌转速80r/min,37℃,恒ph6.0,无通气自然发酵15h,在发酵过程中,监测ph值,流加12.5%氨水作为中和剂维持ph在6.0;
41.发酵培养基组成如下:葡萄糖25.0g,酵母粉20.0g,kh2po
4 2.5g,mgso4·
7h2o 2.0g,柠檬酸三铵2.5g,ch3coona
·
3h2o 6.25g,tween80 1.0ml,蒸馏水1000ml,ph 6.2;121℃灭菌15min;
42.将发酵液于8000rpm高速离心机中离心5min,弃去上清,收集菌泥。在菌泥中,按复合保护剂及菌泥的体积比1:3进行添加,其中复合机保护剂配方及重量份数为脱脂奶粉2份,海藻糖5份,蔗糖1份,葡萄糖5份,明胶3份,甘氨酸0.1份,水20份;混合均匀后得含有保护剂的微生物悬液。
43.将含保护剂的微生物悬液于-4℃预冻-12h后置于真空冷冻干燥机中冷冻24h得益生菌冻干粉,真空冷冻的条件为:真空度5pa、冷肼温度-60℃、时间18h。
44.实施例4鼠李糖乳杆菌益生菌和抗过敏多肽fj-1混合冻干粉的制备
45.将-80℃保藏的鼠李糖乳杆菌gg菌种接种于5ml mrs培养基中,37℃培养18h,传代培养2次得到活化的菌种种子液;
46.在发酵罐中装入70%发酵培养基,接种5%(v/v)种子液,拌转速80r/min,37℃,恒ph6.0,无通气自然发酵15h,在发酵过程中,监测ph值,流加12.5%氨水作为中和剂维持ph在6.0;
47.发酵培养基组成如下:葡萄糖25.0g,酵母粉20.0g,kh2po4 2.5g,mgso4
·
7h2o 2.0g,柠檬酸三铵2.5g,ch3coona
·
3h2o 6.25g,tween80 1.0ml,蒸馏水1000ml,ph 6.2;121℃灭菌15min;
48.将发酵液于8000rpm高速离心机中离心5min,弃去上清,收集菌泥。在菌泥中,按复合保护剂、菌泥、fj-1多肽的体积比1:3:0.2进行添加混匀,其中复合机保护剂配方及重量份数为脱脂奶粉2份,海藻糖5份,蔗糖1份,葡萄糖5份,甘氨酸0.1份,水20份,混匀;混合均匀后得含有保护剂的微生物悬液。
49.将含保护剂的微生物悬液于-4℃预冻-12h后置于真空冷冻干燥机中冷冻24h得益生菌冻干粉,真空冷冻的条件为:真空度5pa、冷肼温度-60℃、时间18h。
50.实施例5过敏模型实验
51.sd大鼠50只随机分为正常对照组、模型组、益生菌冻干粉组、益生菌和抗过敏多肽fj-1混合冻干粉组及阳性药对照组5组,每组10只。益生菌冻干粉组、益生菌和抗过敏多肽fj-1混合冻干粉组每天用冻干粉1mg/g,以无菌生理盐水溶解后灌胃3周;正常对照组、模型组及阳性药对照组均予无菌生理盐水灌胃3周。
52.建立ova致敏模型:3周后模型组、益生菌冻干粉组、益生菌和抗过敏多肽fj-1混合冻干粉组及阳性药对照组开始建立ova致敏模型:第1天用含10μg ova及1mg al(oh)3的无菌生理盐水0.5ml腹腔注射进行基础致敏,第15天用含10μg ova的无菌生理盐水0.5ml腹腔注射强化致敏,强化致敏后第1天开始每天1次用50μl的2mg/ml ova滴鼻,连续应用15d,对大鼠进行激发。正常对照组则在上述时间用无菌生理盐水进行假致敏和假激发。
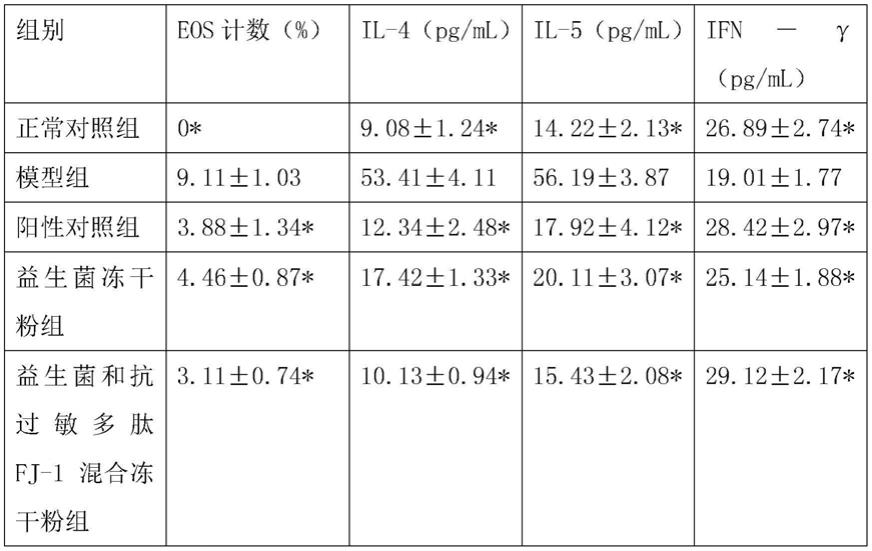
53.各组大鼠最后1次激发24h后,将大鼠用3%戊巴比妥钠(40mg/kg)腹腔注射麻醉,剪开腹部皮肤,暴露腹主动脉,用一次性注射器(预先1:25肝素湿润)抽取腹主动脉血8ml,立即注入抗凝管中,静置2h后3000r/min离心15min,分离血清。采用elisa法检测试验各组大鼠血清il-4、il-5、ifn-γ水平。微型小棉棒伸入大鼠鼻腔轻擦鼻甲表面3次,制作涂片,he染色,光镜下观察并行分泌物嗜酸性粒细胞(eos)计数。结果如表1所示。
54.表1各组大鼠鼻腔分泌物eos、il-4、il-5、ifn-γ水平比较
[0055][0056]
*:p<0.05,与模型组比较。
[0057]
各组大鼠鼻腔分泌物eos、血清il-4、il-5、ifn-γ水平比较结果如表1所示,模型组大鼠的鼻腔分泌物eos计数明显增多,高于正常对照组(p<0.05)。益生菌冻干粉组以及益生菌和抗过敏多肽fj-1混合冻干粉组和阳性药对照组大鼠的鼻腔分泌物eos计数比模型组明显减少,最低的抗过敏多肽fj-1混合冻干粉组为(3.11
±
0.74)%(p<0.05)。模型组大鼠血清il-4、il-5水平增加,高于正常对照组(p<0.05);ifn-γ水平降低,低于正常对照组(p<0.05)。益生菌冻干粉组以及益生菌和抗过敏多肽fj-1混合冻干粉组和阳性药对照组il-4、il-5水平降低,与模型组比较,差异有统计学意义,其中抗过敏多肽fj-1混合冻干粉组对应的il-4为(10.13
±
0.94)pg/ml,il-5为(15.43
±
2.08)pg/ml(p<0.05);益生菌冻干粉组以及益生菌和抗过敏多肽fj-1混合冻干粉组和阳性药对照组ifn-γ水平增加,高于模型组,并且ifn-γ为(29.12
±
2.17)pg/ml(p<0.05)。以上结果表明,fj-1多肽能够显著的促进益生菌在抗过敏中的作用,可以有效的用于过敏性鼻炎的有效治疗。
[0058]
从以上说明本发明所属技术领域的当业者将能够理解本发明在不改变其技术思想或必备特征的情况下可以以其他具体形式实施。与此相关,以上所述的实施例在所有方面都是预示性的,必须理解为非限定性的。本发明的范围应解释为,与上述详细说明相比,后述专利请求范围的含义和范围,以及由其等效概念导出的任何变更或变形形式都包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1