一种构建新型冠状病毒疫苗的核苷酸序列及其应用的制作方法
1.本发明涉及生物基因技术领域,具体涉及一种构建新型冠状病毒疫苗的核苷酸序列及其应用。
背景技术:
2.冠状病毒为rna病毒,分为α、β、γ和δ四个属,其中,新型冠状病毒(severe acute respiratory syndrome coronavirus 2,sars-cov-2)为β属的一种新型冠状病毒,有包膜,颗粒呈圆形或椭网形,常为多形性,直径60-140nm。s蛋白是新型冠状病毒的主要蛋白之一,其编码基因用于病毒分型,通过s-蛋白与人ace2互作的分子机制,来感染人的呼吸道上皮细胞,因此新型冠状病毒对人有很强的感染力。这种由新型冠状病毒引起的肺部感染,被称为新型冠状病毒肺炎。n蛋白包裹病毒基因组,可作为诊断抗原。根据对sars-cov-2的研究,其对热敏感,56℃30min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒,氯己定则不能有效灭活病毒。
3.新型冠状病毒感染的肺炎患者的临床表现以发热、乏力、干咳为主要表现,少数患者伴有鼻塞、流涕、腹泻等症状,会出现缺氧低氧状态。重症病例多在一周后出现呼吸困难,严重者快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍。值得注意的是,重症、危重症患者病程中可为中低热,甚至无明显发热。部分患者起病症状轻微,可无发热,多在1周后恢复。多数患者预后良好,少数患者病情危重,甚至死亡。目前尚无针对新型冠状病毒肺炎的有效预防和治疗手段,研制有效的预防性和/或治疗性疫苗是除了物理隔离以外预防和/或缓解疫情的有效手段。以sars-cov-2病毒表面蛋白spike(刺突蛋白)即s蛋白为抗原的疫苗,包括核酸疫苗,亚单位疫苗和病毒载体疫苗,其s蛋白的表达水平、蛋白结构决定了疫苗的有效性。
4.目前已经有关于新型冠状病毒疫苗的相关研究,如专利cn111218459b公开了一种以人5型复制缺陷腺病毒为载体的新型冠状病毒疫苗,可在短时间内诱导机体产生细胞及体液免疫反应,具有良好的免疫保护效果。该专利中的新冠疫苗为病毒载体疫苗。专利cn111778264a公开了一种基于新型腺病毒载体sad23l和/或ad49l的新型冠状病毒肺炎covid-19疫苗,能够在动物体内诱导产生高水平的体液和细胞免疫,在动物免疫之后没有发现副作用的出现。
5.现有的新型冠状病毒疫苗种类较少,因此亟需一种表达量高,免疫力强的核酸疫苗用于预防和/或治疗新型冠状病毒。
技术实现要素:
6.针对上述不足,本发明提供了一种构建新型冠状病毒疫苗的核苷酸序列。本发明通过对sars-cov-2冠状病毒的s蛋白基因进行密码子优化,导入分泌型缺陷型腺病毒载体,包装得到相应重组腺病毒。该重组腺病毒能够在体内表达sars-cov-2病毒s蛋白,且含有分泌肽,因此该重组腺病毒疫苗在体内表达后,能被分泌至细胞外,更有效地激活体液免疫及
细胞免疫,从而提高对新型冠状病毒sars-cov-2的预防和/或治疗效果。
7.为了实现上述发明目的,本发明的技术方案如下:
8.一方面,本发明提供了一种构建新型冠状病毒疫苗的核苷酸序列。
9.具体地,所述的核苷酸序列为seq id no:1所示的核苷酸序列。
10.具体地,所述的核苷酸序列根据编码sars-cov-2病毒s蛋白(sars-cov-2病毒表面蛋白spike)结构域11-685位氨基酸序列的野生型序列经密码子优化得到,所述的野生型序列为seq id no:2所示的核苷酸序列。
11.另一方面,本发明提供了一种载体,所述的载体包含上述核苷酸序列。
12.具体地,所述的载体包括但不限于质粒、病毒、噬菌体、rna。
13.进一步具体地,所述的载体为病毒载体,优选为复制缺陷型腺病毒载体。
14.进一步具体地,所述的复制缺陷型腺病毒为e1和/或e3区完全缺失和/或部分缺失的c亚类的5型腺病毒。
15.进一步具体地,所述的复制缺陷型腺病毒还包含分泌肽的编码序列,所述的分泌肽的编码序列为seq id no:3所示的核苷酸序列。
16.进一步具体地,所述的复制缺陷型腺病毒内装cmv启动子和bgh基因polya序列。
17.又一方面,本发明提供了上述核苷酸序列或载体在制备新型冠状病毒疫苗中的应用。
18.又一方面,本发明提供了一种新型冠状病毒疫苗,所述的疫苗包含上述核苷酸序列或载体。
19.又一方面,本发明提供了上述核苷酸序列、载体或新型冠状病毒疫苗在制备预防和/或治疗sars-cov-2病毒相关疾病的药物中的应用。
20.与现有技术相比,本发明的积极和有益效果在于:
21.本发明通过对sars-cov-2病毒s蛋白的编码核苷酸序列进行优化,并将其制备成腺病毒疫苗,安全性较好,且与野生型序列相比,本发明所述的新型冠状病毒疫苗能够极大地提高抗原蛋白的基因转录和表达,且具有更高效的体液及细胞免疫反应。
附图说明
22.图1为体外表达检测结果图。
23.图2为免疫原性检测结果图。
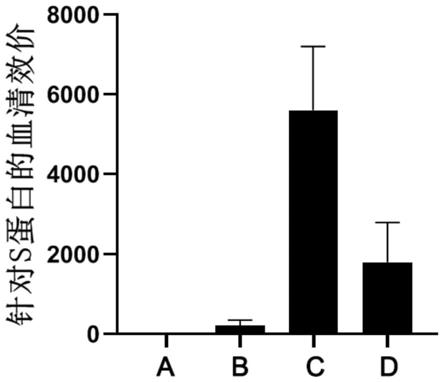
24.图3为针对sars-cov-2s1的体液免疫检测结果图。
25.图4为针对sars-cov-2s-rbd的体液免疫检测结果图。
26.图5为针对sars-cov-2s蛋白肽池的细胞免疫检测结果图。
27.图6为针对sars-cov-s1蛋白的细胞免疫检测结果图。
28.图7为哺乳动物体内,针对sars-cov-2s1的体液免疫检测结果图。
29.图8为哺乳动物体内,针对sars-cov-2s-rbd的体液免疫检测结果图。
具体实施方式
30.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明
具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
31.实施例中未注明具体技术或条件者,均按照本领域内的文献所描述的技术或条件(如参考j.萨姆布鲁克等著,黄培堂等译的《分子克隆实验指南》,第三版,科学出版社)或者按照产品说明书进行。
32.1.除非特别指明,本文中的“sars-cov-2”均指“新型冠状病毒”。
33.2.除非特别指明,本文中的“s蛋白”均指“sars-cov-2病毒表面蛋白spike(刺突蛋白)”。
34.3.实验所用试剂或材料
35.(1)pshuttle载体与病毒骨架质粒pbhglox(delta)e1,3cre购自microbixbiosystems,货号为pd-01-64。
36.(2)293细胞购自atcc,货号为crl-1573。
37.(3)balb/c小鼠购自广东省实验动物中心。
38.实施例1:sars-cov-2病毒s蛋白编码核苷酸序列优化及腺病毒载体构建
39.1.对编码sars-cov-2病毒s蛋白结构域11-685位氨基酸序列的野生型核苷酸序列进行优化,野生型核苷酸序列如seq id no:2所示(野生型核苷酸序列从ncbi网站
40.https://www.ncbi.nlm.nih.gov/nuccore/nc_045512.2?report=fasta&from=21563&to=25384得到),优化后的核苷酸序列如seq id no:1所示,针对该基因进行全基因合成,同时在上述核苷酸序列前添加分泌肽的编码序列,所述的分泌肽的编码序列如seq id no:3所示。
41.2.构建重组质粒:
42.将上述合成的优化后的核苷酸序列及野生型核苷酸序列,分别经smai与hindiii酶切、t4连接酶连接、转化构建至pshuttle质粒载体,并经测序确认重组质粒构建成功。
43.实施例2:疫苗构建
44.将实施例1构建成功的重组质粒,与病毒骨架质粒pbhglox(delta)e1,3cre共同转染至293细胞中以包装重组腺病毒。病毒的收集采用挑空斑的方式:在培养液中加入低溶点琼脂糖,转染后一般在第10-21d可以在显微镜下看到小的空斑。空斑形成后将空斑与琼脂糖一起挑起,放入1ml新鲜培养基中过夜。通常挑取3-6个空斑不等,然后比较滴度,使用滴度最高的一个空斑进行后续实验。将收集的病毒加入新鲜293细胞培养液中进行病毒少量扩增,至细胞再次出现空斑,收集细胞及上清,反复冻融三次收集病毒。以此病毒为p1代病毒,以p1代病毒感染293细胞,连续进行三代感染,至p4代进行病毒的大量扩增,待空斑形成后收集病毒并对病毒进行体外纯化和浓缩。纯化后获得的病毒即为新型冠状病毒sars-cov-2疫苗。sars-cov-2疫苗包含本发明优化后的sars-cov-2病毒s蛋白编码核苷酸或野生型sars-cov-2病毒s蛋白编码核苷酸,和缺陷型腺病毒。缺陷型腺病毒为e1及e3区完全缺失的c亚类的5型腺病毒,不能在普通的人体细胞内复制。其中,本发明优化后的sars-cov-2病毒s蛋白编码核苷酸制备的重组腺病毒命名为ad/s1疫苗,野生型sars-cov-2病毒s蛋白编码核苷酸制备的重组腺病毒命名为ad/s1-wt疫苗,经测序验证均制备成功。
45.对比例1
46.采用专利cn202011103983.3实施例1制备得到的sars-cov-2冠状病毒疫苗作为对
比例1,其编码sars-cov-2病毒s蛋白结构域的核苷酸序列如seq id no:4所示。
47.实验例1:体外表达验证
48.取a549细胞,以2
×
105个细胞量接种到12孔板中,37℃5%co2培养24h后,每孔以moi50接种实施例2制备得到的ad/s1疫苗、wt/s1疫苗及对比例1制备的疫苗病毒,37℃5%co2培养48h,收集细胞上清,提取蛋白,进行western bloting检测s蛋白的表达。检测结果如图1所示。
49.由图1可知,本发明制备得到的sars-cov-2病毒s蛋白编码核苷酸优化后的ad/s1疫苗,相比野生型核苷酸制得的wt/s1疫苗及对比例1制备得到的疫苗,其s蛋白的表达量更高。
50.实验例2:免疫原性检测
51.将实施例2制备得到的ad/s1疫苗、wt/s1疫苗及对比例1制备的疫苗进行小鼠体内免疫原性测试,将试验对象balb/c小鼠按照下表1所示分组进行实验。
52.表1
[0053][0054]
其检测结果如图2所示。
[0055]
由图2可知,本发明制备得到的sars-cov-2病毒s蛋白编码核苷酸优化后的ad/s1疫苗,相比野生型核苷酸制得的wt/s1疫苗及对比例1制备得到的疫苗,其诱导的免疫原性最高。因此采用本发明制备得到的sars-cov-2病毒s蛋白编码核苷酸优化后的ad/s1疫苗用于后续开发。
[0056]
实验例3:小鼠体内疫苗抗体效价检测
[0057]
对实施例2制备得到的ad/s1疫苗进行小鼠体内抗体效价检测。
[0058]
将试验对象balb/c小鼠按照下表2所示分组进行实验。
[0059]
表2
[0060]
[0061]
1.取血清利用elisa检测疫苗对s1和rbd抗原的体液免疫效价
[0062]
具体方法为:小鼠麻醉后眼眶静脉采血。3000rpm,10min离心取上层血清,用于后续elisa检测。实验步骤为常规elisa间接法操作步骤。其中,包被抗原为sars-cov-2s1或rbd蛋白,浓度为10μg/ml。此外,待测血清由400倍起,按2倍递增稀释,直至51200倍稀释度制备血清稀释梯度。最后,以检测孔od值为阴性对照孔od值2.1倍及以上为阳性。根据阳性孔的最高稀释度作为待检血清的效价。
[0063]
检测结果见图3和图4。图3和图4表明,本发明制备得到的sars-cov-2病毒s蛋白编码核苷酸优化后的ad/s1疫苗,针对sars-cov-2s1的体液免疫和sars-cov-2s-rbd的体液免疫均具有较强的抗体效价。
[0064]
2.细胞免疫
[0065]
断颈处死小鼠取小鼠脾脏,采用常规方法分离小鼠脾脏淋巴细胞,以进行后续细胞免疫检测。细胞免疫检测采用mouse ifn-gamma elispot kit(达科为,221005),基本检测方法依照试剂盒说明书进行。其中,淋巴细胞悬液为5
×
105cells/孔,实验孔刺激物分别为10μg/ml的sars-cov-2s1蛋白或10ng/ml的sars-cov-2s蛋白多肽池(mabtech,3629-1)。最后,对每孔的斑点数进行统计分析。
[0066]
检测结果见图5和图6。图5和图6表明,本发明制备得到的sars-cov-2病毒s蛋白编码核苷酸优化后的ad/s1疫苗,针对sars-cov-2s蛋白肽池的细胞免疫和sars-cov-s1蛋白的细胞免疫均具有较强的抗体效价。
[0067]
实验例4:哺乳动物体内疫苗抗体效价检测
[0068]
对实施例2制备得到的ad/s1疫苗进行哺乳动物体内抗体效价检测。
[0069]
将试验对象恒河猴按照以下方式进行实验:
[0070]
(1)实验动物来源:湖北天勤生物科技有限公司随州分公司。
[0071]
(2)给药方式:肌肉注射。
[0072]
(3)疫苗原液浓度:1
×
10
11
vp/ml。
[0073]
(4)剂量:5
×
109vp。
[0074]
(5)免疫程序:d0和d20进行免疫,d20、d40、d60取血清检测疫苗对rbd和s1抗原的体液免疫效价。
[0075]
(6)体液免疫效价检测方法:同实验例3检测方法。
[0076]
检测结果见图7和图8。图7和图8表明,本发明制备得到的sars-cov-2病毒s蛋白编码核苷酸优化后的ad/s1疫苗,在哺乳动物体内,针对sars-cov-2s1和sars-cov-2s-rbd的体液免疫具有较强的抗体效价。
[0077]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1