一种检测油菜品种的SNP分子标记组合及其应用的制作方法
一种检测油菜品种的snp分子标记组合及其应用
技术领域
1.本发明涉及油菜育种领域,尤其是涉及一种检测油菜品种的snp分子标记组合及其应用。
背景技术:
2.油菜,十字花科作物,是中国第一大油料作物,也是产油效率最高的油料作物之一。油菜品种的真实性和纯度检测一直是质量管理和品种开发中最重要的技术之一。近年来,市场上的油菜品种不断增多,但是在种子市场上同名异物及同物异名的情况时有发生,甚至一些不合格种子混入市场,造成巨大的经济损失。因此,对品种进行快速准确鉴定,对于假种辨别和产权纠纷具有重要作用。油菜产量性状的杂种优势显著,f1代产量可以超过其中亲值的30%-60%,因此油菜杂种优势的研究得到国内外的广泛关注。相关技术中,油菜杂交品种研制主要采用细胞质雄性不育(cms)、细胞核雄性不育(gms)、自交不亲和(si)和化学杀雄等途径,在杂交制种中,由于不育系败育不彻底,田间除杂不彻底、温度光照等环境因素影响,导致不育系还可能产生微量花粉,使杂交种中混入假杂种;如油菜波里马细胞质雄性不育系的育性对温度反应较敏感,在温度变化较大的情况下易产生微量花粉,并以自交方式产生不育假杂种,对油菜杂交制种影响较大。为了更好地进行杂交种纯度鉴定需要建立一套准确、快速、高效、低成本的体系,这在油菜杂交种生产中具有重要的实际意义。
3.相关技术中,油菜材料品种和纯度鉴定主要依赖于:(1)形态学鉴定,其通常采用田间种植和观察统计、考种分析的方法,是根据幼苗、株型、根、叶、花、花粉、种子等组织或器官的大小、形状、颜色等肉眼可见到的外观形态来鉴定作物的品种,但其缺点也很明显,易受环境和栽培条件影响,准确度和稳定性差。(2)生化标记鉴定,如同工酶和贮藏蛋白sds-page电泳技术,是从生理、生化代谢角度分析雄性不育与正常可育植物花药中物质和能量代谢方面的差异,其实验耗时长,检测特异性、灵敏度和分辨力低;不同检测实验室的数据结果很难相互比较验证。(3)dna分子标记,包括rflp标记、rapd标记、aflp标记和ssr标记法,其中rapd分子标记对pcr反应条件敏感可靠性不够,rflp和aflp分子标记则操作繁琐成本较高,标记数目和多态性有限,而ssr标记法检测方法自动化程度和通量低。
4.为了解决上述技术问题,本发明筛选出一套共19个snp分子标记,基于douglas array tape平台的kasp标记检测方法,用于不同油菜品种和遗传材料纯度的快速准确鉴定,具有广泛的应用价值。
技术实现要素:
5.本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种检测油菜品种的snp分子标记组合,该snp分子标记组合能够检测油菜品种材料的纯度和真实性。
6.本发明还提出了扩增上述snp分子标记组合的引物组。
7.本发明还提出了一种油菜品种真实性鉴定的方法。
8.本发明还提出了一种油菜品种纯度鉴定的方法。
9.本发明还提出了snp分子标记组合或扩增其分子标记组合的引物组在油菜品种真实性鉴定中的应用。
10.本发明还提出了snp分子标记组合或扩增其分子标记组合的引物组在鉴定或辅助鉴定油菜品种纯度鉴定中的应用。
11.本发明还提出了一种鉴定油菜品种纯度的试剂盒。
12.本发明还提出了一种snp引物组或鉴定油菜品种纯度的试剂盒在油菜品种选育中的应用。
13.本发明还提出了一种基因芯片,包括上述引物组。
14.本发明的第一方面,提供一种检测油菜品种的snp分子标记组合,所述snp分子标记组合包括bngps1001.k1、bngps1002.k1、bngps1003.k1、bngps1004.k1、bngps1005.k1、bngps1006.k1、bngps1007.k1、bngps1008.k1、bngps1009.k1、bngps1010.k1、bngps1011.k1、bngps1012.k1、bngps1013.k1、bngps1014.k1、bngps1015.k1、bngps1016.k1、bngps1017.k1、bngps1018.k1和bngps1019.k1,其中:所述bngps1001.k1位于如seq id no.1所示的核苷酸序列的第73位,多态性为c或g;所述bngps1002.k1位于如seq id no.2所示的核苷酸序列的第120位,多态性为a或c;所述bngps1003.k1位于如seq id no.3所示的核苷酸序列的第95位,多态性为a或g;所述bngps1004.k1位于如seq id no.4所示的核苷酸序列的第110位,多态性为t或c;所述bngps1005.k1位于如seq id no.5所示的核苷酸序列的第77位,多态性为t或c;所述bngps1006.k1位于如seq id no.6所示的核苷酸序列的第159位,多态性为t或c;所述bngps1007.k1位于如seq id no.7所示的核苷酸序列的第36位,多态性为a或g;所述bngps1008.k1位于如seq id no.8所示的核苷酸序列的第162位,多态性为t或c;所述bngps1009.k1位于如seq id no.9所示的核苷酸序列的第54位,多态性为t或c;所述bngps1010.k1位于如seq id no.10所示的核苷酸序列的第136位,多态性为a或g;所述bngps1011.k1位于如seq id no.11所示的核苷酸序列的第51位,多态性为t或c;所述bngps1012.k1位于如seq id no.12所示的核苷酸序列的第126位,多态性为a或t;所述bngps1013.k1位于如seq id no.13所示的核苷酸序列的第92位,多态性为a或c;所述bngps1014.k1位于如seq id no.14所示的核苷酸序列的第128位,多态性为t或c;所述bngps1015.k1位于如seq id no.15所示的核苷酸序列的第125位,多态性为a或g;所述bngps1016.k1位于如seq id no.16所示的核苷酸序列的第168位,多态性为a或c;所述bngps1017.k1位于如seq id no.17所示的核苷酸序列的第120位,多态性为a或g;所述bngps1018.k1位于如seq id no.18所示的核苷酸序列的第156位,多态性为a或c;所述bngps1019.k1位于如seq id no.19所示的核苷酸序列的第169位,多态性为a或c。
15.根据本发明的一些实施例,所述bngps1001.k1分子标记的多态性为c或g,位于chra01.14854916;所述bngps1002.k1分子标记的多态性为a或c,位于chra02.8647321;所述bngps1003.k1分子标记的多态性为a或g,位于chra03.15124575;所述bngps1004.k1分子标记的多态性为t或c,位于chra04.10128580;所述bngps1005.k1分子标记的多态性为t或c,位于chra05.19857248;所述bngps1006.k1分子标记的多态性为t或c,位于chra06.1164270;所述bngps1007.k1分子标记的多态性为a或g,位于chra07.13975640;所
述bngps1008.k1分子标记的多态性为t或c,位于chra08.17358907;所述bngps1009.k1分子标记的多态性为t或c,位于chra09.6960350;所述bngps1010.k1分子标记的多态性为a或g,位于chra10.12603630;所述bngps1011.k1分子标记的多态性为t或c,位于chrc01.11240966;所述bngps1012.k1分子标记的多态性为a或t,位于chrc02.2344794;所述bngps1013.k1分子标记的多态性为a或c,位于chrc03.49565868;所述bngps1014.k1分子标记的多态性为t或c,位于chrc04.36218099;所述bngps1015.k1分子标记的多态性为a或g,位于chrc05.2276809;所述bngps1016.k1分子标记的多态性为a或c,位于chrc06.3107911;所述bngps1017.k1分子标记的多态性为a或g,位于chrc07.41044405;所述bngps1018.k1分子标记的多态性为a或c,位于chrc08.27511997;所述bngps1019.k1分子标记的多态性为a或c,位于chrc09.40412295。
16.根据本发明的一些实施例,所述snp分子标记位点的物理位置是在甘蓝型油菜参考基因组(brassica napus 4.0)上的物理位置。
17.本发明的第二方面,提供一种扩增所述snp分子标记组合的引物组。
18.根据本发明的一些实施例,所述引物组包含primer allele x、primer allele y和通用引物;其中,所述bngps1001.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.20、seq id no.21、seq id no.22所示;所述bngps1002.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.23、seq id no.24、seq id no.25所示;所述bngps1003.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.26、seq id no.27、seq id no.28所示;所述bngps1004.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.29、seq id no.30、seq id no.31所示;所述bngps1005.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.32、seq id no.33、seq id no.34所示;所述bngps1006.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.35、seq id no.36、seq id no.37所示;所述bngps1007.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.38、seq id no.39、seq id no.40所示;所述bngps1008.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.41、seq id no.42、seq id no.43所示;所述bngps109.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.44、seq id no.45、seq id no.46所示;所述bngps1010.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.47、seq id no.48、seq id no.49所示;所述bngps1011.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.50、seq id no.51、seq id no.52所示;所述bngps1012.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.53、seq id no.54、seq id no.55所示;
所述bngps1013.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.56、seq id no.57、seq id no.58所示;所述bngps1014.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.59、seq id no.60、seq id no.61所示;所述bngps1015.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.62、seq id no.63、seq id no.64所示;所述bngps1016.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.65、seq id no.66、seq id no.67所示;所述bngps1017.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.68、seq id no.69、seq id no.70所示;所述bngps1018.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.71、seq id no.72、seq id no.73所示;所述bngps1019.k1分子标记的引物组中primer allele x、primer allele y和通用引物的序列分别如核苷酸序列seq id no.74、seq id no.75、seq id no.76所示。
19.根据本发明的一些实施例,所述snp分子标记的引物组为kasp引物组。
20.根据本发明的一些实施例,所述snp分子标记的引物组中primer allele x引物和primer allele y引物连接有不同的荧光基团标签序列。
21.根据本发明的一些实施例,所述荧光基团标签序列选自fam和hex。
22.根据本发明的一些实施例,所述snp分子标记的引物组中primer allele x引物和primer allele y引物的5’端分别加上序列标签a和序列标签b,用于显示荧光信号;优选的,所述序列标签a:gaaggtgaccaagttcatgct(seq id no.77);序列标签b:gaaggtcggagtcaacggatt(seq id no.78)。
23.本发明的第三方面,提供一种油菜品种真实性鉴定的方法,包括:s1、检测待测油菜品种和标准品种的snp分子标记组合,获得基因型数据;s2、根据所述基因型数据确定待测油菜品种的真实性,所述待测油菜品种真实性的计算方法为:将待测油菜品种的基因分型结果与标准油菜品种材料基因分型结果进行对比,计算一致率,一致率的计算公式为:一致率=1-(标记结果不一致数/总分子标记数)
×
100%。
24.根据本发明的一些实施例,所述标记结果不一致是指是待测油菜品种与标准油菜品种在snp分子标记位点的基因分型结果不同。
25.根据本发明的一些实施例,所述一致率可以用于判断油菜品种的真实性。
26.根据本发明的一些实施例,所述油菜品种包括甘蓝型油菜品种。
27.本发明的第四方面,提供一种油菜品种纯度鉴定的方法,包括:s1、检测待测核心亲本和f1杂交后代种群的上述的snp分子标记组合,获得基因型数据;s2、根据步骤s1的所述基因型数据确定待测f1杂交后代种群的纯度,所述纯度的计算方法为:纯度=1-(f1杂交后代中假杂种株数/f1杂交后代)
×
100%。
28.根据本发明的一些实施例,所述f1杂交后代中假杂种株是指与母本聚为一簇的单株。
29.本发明的第五方面,提供一种油菜品种鉴定的方法在油菜选育中的应用。
30.本发明的第六方面,提供snp分子标记组合在油菜品种真实性鉴定中的应用本发明的第七方面,提供snp分子标记组合在油菜育种中的应用。
31.本发明的第八方面,提供一种鉴定油菜品种纯度的试剂盒。
32.本发明的第九方面,提供一种snp引物组或鉴定油菜品种纯度的试剂盒在油菜品种鉴定或选育中的应用。
33.本发明的第十方面,提供一种基因芯片,包括上述引物组。
34.在本发明一些实施例中,至少具有如下有益效果:本发明筛选的19个snp分子标记为共显性标记,其特异性、灵敏度和分辨力高,该snp分子标记不受环境条件影响,且检测结果准确、重复性和稳定性好;采用本发明提供的基于douglas array tape平台的kasp标记检测方法,具有自动化程度高、通量高、速度快、试剂用量少和检测成本低等优点,有广泛的应用性。
附图说明
35.下面结合附图和实施例对本发明做进一步的说明,其中:图1为本发明实施例1的snp分子标记筛选流程图。
36.图2为bngps1006.k1分子标记在96个甘蓝型油菜材料中的基因型分型示意图。
37.图3为bngps1008.k1分子标记在94个甘蓝型油菜材料中的基因型分型示意图。
38.图4为bngps1005.k1分子标记在56个油菜材料中的基因型分型示意图。
39.图5为bngps1006.k1分子标记在56个油菜材料中的基因型分型示意图。
具体实施方式
40.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
41.在实施方式中未注明具体技术或条件的,按照本领域内的文献所描述的技术和条件,或者按照产品说明书进行。所用试剂或仪器未标明生产产商的,均为可通过正规渠道商购获得的常规产品。
42.实施例1 与油菜品种纯度相关snp标记的筛选与引物设计1. 与油菜品种纯度相关snp分子标记的筛选本发明是通过收集本实验室已验证过的多种来源和用途的高分型质量的甘蓝型油菜snp标记,根据扩增稳定、染色体均匀分布的筛选原则,获得一批候选snp标记,其具体筛选流程如图1所示。
43.本发明利用snp标记位点的序列信息,在ncbi上找到snp标记位点在甘蓝型油菜参考基因组(brassica napus 4.0)上的物理位置。利用这些snp位点开发了相应的分子标记,并利用在线引物设计网站batchprimer3对其进行引物设计,然后选择94份甘蓝型油菜多样性材料进行kasp反应验证,检测获得这些标记的分型质量(gentrain score)、拷贝数、多态性pic值(polymorphic information content,多态性信息值)以及基因型检出率;从检测
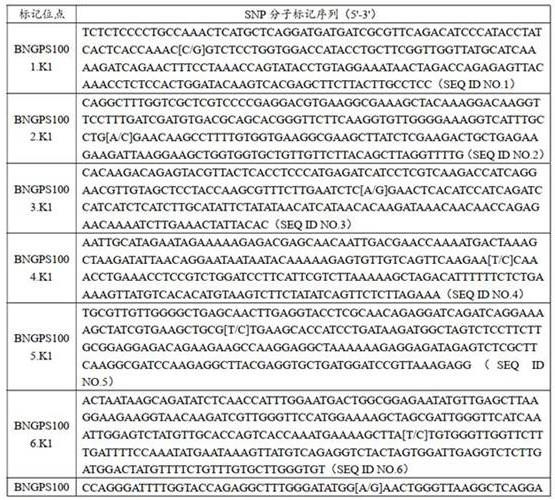
验证的snp标记中,每条染色体挑选出1个标记,共19个高质量、单拷贝、高多态性的snp标记,用于不同来源的油菜品种和遗传种群纯度的鉴定。19个snp分子标记的序列信息如表1所示。
44.表1:
19个用于油菜品种和遗传材料纯度鉴定的snp分子标记的物理和遗传位置如表2所示。
45.表2:2. 引物的设计利用batch primer 3对snp位点进行kasp引物设计。每个kasp标记由三条引物组成,包括两条等位基因特异性引物x(allele-specific primer x;primer_x)和y(allele-specific primer y;primer_y)以及一条通用引物c(common primer;primer_c)。19个用于油菜品种和纯度鉴定的snp分子标记的等位基因型和kasp引物序列见表3。
46.表3:
实施例2 snp分子标记的kasp引物验证方法1. 试验材料的基因组dna提取采用ctab法分别提取待测油菜的种子的dna,提取的dna数量和质量需符合pcr扩增的要求,即dna无降解,dna溶液的紫外光吸光度od
260
与od
280
的比值宜介于1.70~2.0之间,dna的浓度在30ng/μl以上,dna总量至少为2μg,提取完成后将每粒种子的dna统一稀释至30ng/μl,4℃保存备用。
47.2. 采用kasp技术进行基因分型以步骤1中的dna为模板,加入上述snp引物组合中的每一组引物混合液和pcr预混
液,采用array tape基因型分型平台的nexar系统进行pcr扩增体系的自动组装,pcr扩增体系如下表4所示。
48.表4:其中,kasp master mix由英国lgc公司提供,包含了荧光探针a、荧光探针b、淬灭探针a和淬灭探针b、rox内参染料,kleartaq dna聚合酶,dntp和mgcl2,其中荧光探针a带有的荧光基团fam,荧光信号表现为蓝色,荧光探针b带有的荧光基团hex,荧光信号表现为红色,淬灭探针带有的淬灭基团为bhq。
49.采用array tape基因型分型平台的soellex系统进行pcr扩增,扩增条件如下:94℃预变性15分钟;第一步扩增反应,94℃变性20秒,57℃~65℃退火并延伸60秒,10个循环,每个循环退火及延伸的温度降低0.8℃;第二步扩增反应,94℃变性20秒,57℃退火并延伸60秒,30个循环。
50.pcr反应完成后用array tape基因型分型平台进行反应体系荧光信号扫描,并根据荧光信号的颜色获得待测油菜品种在所述引物组合对应的snp标记位点的基因型。
51.在snp分子标记基因型分型检测中,样品的基因型分成3簇,分别为x簇、y簇以及杂合基因型簇,其中:x簇表示样品在这个snp分子标记位点含有纯合x等位基因,在基因分型图中标为红色,位于图形左上角;y簇表示样品在snp分子标记位点含有纯合y等位基因型,基因分型图中标为蓝色,位于图形右下角;杂合基因型簇表示样品在这个snp分子标记位点含有x和y杂合等位基因型,基因分型图中标为紫色,位于图形靠近中间位置。
52.实施例3 19个snp标记位点kasp引物组在油菜品种真实性检测中的应用1、试验材料随机挑取待测油菜种子96粒和真实性鉴定标准样品种子1粒,采用实施例2的dna提取方法提取基因组dna。并将每粒种子的基因组dna统一稀释至30ng/μl,4℃保存备用。
53.选择实施例1中19个snp位点的特异性引物组进行检测,其中特异性引物primer_x和特异性引物primer_y的5’端分别加上序列标签a和序列标签b:序列标签a:gaaggtgaccaagttcatgct(seq id no.77);序列标签b:gaaggtcggagtcaacggatt(seq id no.78)。
54.序列标签a和序列标签b适用于英国lgc公司kasp master mix(pcr预混液),引物
合成后,用10mm tris-hcl(ph为8.3)溶解三条引物至100μm,分别取18μl的两条正向引物溶液,45μl的反向引物溶液和69μl 10 mm的tris-hcl溶液(ph为8.3),混合成150μl引物混合液备用。
55.2、采用kasp技术进行基因分型kasp反应测试:kasp反应测试在lgc snpline基因分型平台上进行。pcr扩增反应使用的扩增体系为:30ng/μl模板dna 1.5μl;pcr预混液1.5μl;引物混合液0.042μl,其中两条正向引物的终浓度均为0.504nm,反向引物的终浓度为1.26nm。pcr扩增在水浴热循环仪中完成,touchdown pcr反应条件为:94℃预变性15分钟;第一步扩增反应,94℃变性20秒,65℃~57℃退火并延伸60秒,10个循环,每个循环退火及延伸的温度降低0.8℃;第二步扩增反应,94℃变性20秒,57℃退火并延伸60秒,26个循环。反应完成后利用扫描仪对kasp反应产物进行荧光数据读取,获得待测油菜种子和真实性鉴定标准样品对应bngps1001.k1~bngps1019.k1的snp标记位点的基因分型结果,结果如表5-1和表5-2所示,从表中可以看出,本发明针对19个snp分子标记设计的kasp引物组扩增效率高,能够有效检测样品在19个snp位点的基因型数据。
56.3.油菜品种种子真实性计算根据96个待测油菜种子和真实性鉴定标准样品种子在编号为bngps1001.k1~bngps1019.k1的snp标记位点的基因分型结果计算真实性(即一致率):一致率=1-(标记结果不一致数/总分子标记数)
×
100%,其中“标记结果不一致数”是指待测样品与标准样本在编号为bngps1001.k1~bngps1019.k1 snp标记位点的基因分型结果不同的基因型数目,如待测样品1与标准样品在编号为bngps1003.k1、bngps1005.k1、bngps1006.k1、bngps1007.k1、bngps1008.k1、bngps1016.k1和bngps1018.k1的分子标记的基因型结果不同,则“标记结果不一致数”为7,“总分子标记数”为19,一致率为:1-(7/19)
×
100%=63.16%,判断待测样品1为非相同品种,若一致率为100%则判断为相同品种。
57.表5-1:
表5-2:
表5-1和表5-2中,“n”表示未检测到,在计算一致率时需要将其筛选出来再计算。
58.4. 典型的snp分子标记基因型分型图以bngps1006.k1和bngps1008.k1分子标记位点为参考,对上述96个甘蓝型油菜材料基因型分型,其基因型分型图分别如图2和图3所示。
59.图2为bngps1006.k1分子标记在96个甘蓝型油菜材料中的基因型分型示意图,图2中红色簇(图2左上角圆点)表示样品在bngps1006.k1分子标记位点含有纯合x等位基因型(t:t),蓝色簇(图2右下角圆点)表示样品在bngps1006.k1分子标记位点含有纯合y等位基因型(c:c),紫色簇(图2中间圆点)表示样品在这个bngps1006.k1分子标记位点含有x和y杂合等位基因型(t:c)。从图2中可以看出,bngps1006.k1分子标记的基因型分型质量佳,纯合和杂合簇分型好、紧凑,位点为单拷贝且检出率高。
60.图3为bngps1008.k1分子标记在94个甘蓝型油菜材料中的基因型分型示意图,图3中红色簇(图3左上角圆点)表示样品在bngps1008.k1分子标记位点含有纯合x等位基因型(t:t),蓝色簇(图3右下角圆点)表示样品在bngps1008.k1分子标记位点含有纯合y等位基因型(c:c),紫色簇(图3中间圆点)表示样品在这个bngps1008.k1分子标记位点含有x和y杂合等位基因型(t:c)。从图3中可以看出,bngps1008.k1分子标记的基因型分型质量佳,纯合和杂合簇分型好、紧凑。
61.实施例3 19个snp标记位点kasp引物组在油菜品种纯度检测中的应用1、试验材料利用本发明19个snp标记对30份核心亲本和26份f1后代群体油菜种子材料进行纯度鉴定,采用实施例2的dna提取方法提取核心亲本和f1后代群体材料的dna。并将每粒种子的dna统一稀释至30ng/μl,4℃保存备用。
62.选择实施例1中19个snp位点的特异性引物组进行检测,其中特异性引物primer_x和特异性引物primer_y的5’端分别加上序列标签a和序列标签b:序列标签a:gaaggtgaccaagttcatgct(seq id no.77);序列标签b:gaaggtcggagtcaacggatt(seq id no.78),序列标签a和序列标签b适用于英国lgc公司kasp master mix(pcr预混液),引物合成后,用10mm tris-hcl(ph为8.3)溶解三条引物至100 μm,分别取18μl的两条正向引物溶液,45μl的反向引物溶液和69μl 10 mm的tris-hcl溶液(ph为8.3),混合成150ul引物混合液备用。
63.2、采用kasp技术进行基因分型kasp反应测试:kasp反应测试在lgc snpline基因分型平台上进行。pcr扩增反应使用的扩增体系为:30ng/μl模板dna 1.5μl;pcr预混液1.5μl;引物混合液0.042μl,其中两
条正向引物的终浓度均为0.504nm,反向引物的终浓度为1.26 nm。pcr扩增在水浴热循环仪中完成,touchdown pcr反应条件为:94℃预变性15分钟;第一步扩增反应,94℃变性20秒,65℃~57℃退火并延伸60秒,10个循环,每个循环退火及延伸的温度降低0.8℃;第二步扩增反应,94℃变性20秒,57℃退火并延伸60秒,26个循环。反应完成后利用扫描仪对kasp反应产物进行荧光数据读取,根据荧光信号颜色获得30份核心亲本和26份f1后代群体油菜样品在编号为bngps1001.k1~bngps1019.k1的snp标记位点的基因分型结果,其中纯度的计算方法为:纯合率=1-(f1杂交后代中假杂种数/f1杂交后代)
×
100%。结果如表6-1和表6-2所示。
64.表6-1:
表6-2:
从表6-1和6-2中可以看出本发明筛选出来的19个snp分子标记基因型分型质量佳,可以将30个父母本和26个f1后代区别开,其中f1后代-004与母本聚为一簇,进而可以判定f1后代-004为假杂交种,该种群的f1后代杂交中假杂种比例为3.85%,其纯合率为96.15%。
65.4. 典型的snp分子标记基因型分型图分别以bngps1005.k1和bngps1006.k1分子标记位点为参考标记,对待测30个核心亲本和26个f1后代(共计56个样本)进行基因型分型,其基因分型图如图4和图5所示。
66.图4为bngps1005.k1分子标记在56个油菜材料中的基因型分型示意图,图4中红色簇(图4左上角)表示父本基因型,共有13个,蓝色簇(图4右下角)表示样品表示母本基因型,共计18个,紫色簇(图4中间)表示样品在这个f1后代杂合等位基因型,共计25个。从图4中可以看出,bngps1005.k1分子标记的基因型分型质量佳,亲本和f1后代杂合簇分型好、紧凑,位点为单拷贝且检出率高,并且用这套标记可以将26个f1后代与30个亲本完全区分开。
67.图5为bngps1006.k1分子标记在56个油菜材料中的基因型分型示意图,图5中红色簇(左上角)表示父本基因型,共有13个,蓝色簇(右下角)表示样品表示母本基因型,共计18个,紫色簇(中间)表示样品在这个f1后代杂合等位基因型,共计25个。从图5中可以看出,bngps1006.k1分子标记的基因型分型质量佳,亲本和f1后代杂合簇分型好、紧凑,位点为单拷贝且检出率高,并且用该标记可以将26个f1后代与30个亲本完全区分开。
68.综上,通过设计kasp引物组,采用本发明的snp分子标记对油菜亲本和f1杂合后代进行区分,亲本和f1后代杂合簇分型好、紧凑,位点为单拷贝且检出率高,各分子标记检测出来的结果一致性好。
69.综上所述,本发明筛选了一套共19个高质量和高多态性的snp标记,并提供了一种快速、高效、低成本、精准检测油菜品种和纯度的方法。
70.(1)本发明筛选出一套共19个高质量和高多态性的snp标记,可用于不同油菜品种
鉴定;同时可以对遗传家系群体纯度鉴定,区别后代非杂交种,具有广泛的应用性。
71.(2)本发明提供了一种基于kasp标记的snp检测方法,该kasp标记检测方法简单、快捷,检测成本低,适用于不同的检测仪器设备。
72.(3)本发明提供了一种基于douglas array tape平台的kasp标记检测方法。douglas array tape平台自动化程度高、通量高、速度快,试剂用量少,检测成本低。
73.(4)本发明提供的油菜品种和纯度检测方法基于snp标记法,具有snp标记法的所有固有优点。标记为共显性标记,特异性、灵敏度和分辨力高;标记不受环境条件影响,能够使用种子或任何类型的植物组织,检测结果准确、重复性和稳定性好;不同检测实验室和不同的数据结果可以相互比较验证。
74.上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1