一种同源重组基因用于诊断和治疗生育缺陷的应用
1.本发明涉及分子生物学和疾病基因研究和诊断领域。具体的,本发明涉及同源重组基因,以及所述基因在用于诊断和评估减数分裂相关疾病特别是生育缺陷或不育的风险中的应用。
背景技术:
2.减数分裂是有性生殖生物体中二倍体祖细胞分裂成单倍体配子的过程,错误的减数分裂会导致配子产生异常,从而导致生育缺陷或不育。在减数分裂过程中,同源染色体必须配对,联会并进行交叉重组,以确保它们的正确分离。重组是由spo11切割产生的程序性dsb启动的。spo11随后在核酸内切酶mre11的作用下以复合物的形式与一段长度为12-25bp的寡核苷酸链一起被移除,之后dsb末端被核酸外切酶进一步切除以产生3
′
末端dna单链。这种单链dna(ssdna)受到rpa(replication protein a)复合物为主的单链dna结合蛋白的保护,rad51及其减数分裂特异性同源物dmc1随后取代rpa并介导单链入侵,形成d-loop。在d-loop形成后,减数分裂dsbs将随后被修复,根据这一修复过程中所形成的中间产物的不同,程序性dsb的修复又被分为dna合成依赖的单链退火(synthesis-dependent strand annealing,sdsa)途径和dhj(double holiday-junction)途径。
3.减数分裂重组酶rad51和dmc1促进核蛋白纤维搜索和入侵其同源染色体,调控了同源重组的中心步骤,而调控dmc1/rad51-ssdna核蛋白纤维的机制有待阐明。spidr/kiaa0146最初被认为是一种支架蛋白,其功能是促进核内rad51的组装,并通过blm解旋酶调节交叉与非交叉产物的比例,以促进同源重组(homologous recombination,hr)效率并决定特定的hr途径。此外,spidr在体细胞中与其他重组分子如fignl1(fidgetin-like 1),swsap1和sws1相互作用,被鉴定为一种有效的重组因子。然而,它在减数分裂同源重组中的作用尚不清楚。
4.本领域还需要对减数分裂的分子机制更深入的认识,由此获得对减数分裂相关疾病特别是生育缺陷或不育进行检测或对其风险的诊断或预测的方法和试剂盒,乃至对相关疾病进行治疗的方法和药物。
技术实现要素:
5.本技术的发明人首次发现名为spidr的支架蛋白有助于促进dmc1/rad51-ssdna核蛋白丝的形成,在减数分裂重组中具有核心作用,同时,发明人发现spidr对哺乳动物的减数分裂乃至其生育的影响是性别依赖的,即spidr的缺乏或缺陷对不同性别的哺乳动物的减数分裂乃至其生育的影响是不同的。另外,发明人还发现dna损伤检验点激酶chk2的缺失可以恢复spidr突变雌性的生育能力,但不能恢复spidr突变雄性的生育能力。本发明由此提供了诊断和预测在不同性别哺乳动物中减数分裂相关疾病特别是生育缺陷或不育的风险的方法或试剂盒。本发明还提供了治疗不同性别哺乳动物中减数分裂相关疾病特别是生育缺陷或不育的方法。
6.具体的,本发明提供了通过检测受试个体的spidr来诊断不同性别哺乳动物中减数分裂相关疾病特别是生育缺陷或不育的方法。在本发明的其中一个方面,本发明提供了通过检测受试个体的spidr来预测不同性别哺乳动物中减数分裂相关疾病特别是生育缺陷或不育的风险的方法。在本发明的其中一个方面,提供了检测受试个体的spidr的试剂在用于制备诊断和预测不同性别哺乳动物中减数分裂相关疾病特别是生育缺陷或不育的风险的试剂盒的用途。
7.spidr(scaffold protein involved in dna repair),即参与dna修复的支架蛋白。编码lrrc46的spidr基因在哺乳动物中非常保守。其中,人的spidr基因gene id是23514;小鼠的spidr基因gene id是224008。
8.在本发明提供的通过检测受试个体的spidr来诊断不同性别哺乳动物中减数分裂相关疾病特别是生育缺陷或不育的应用(包括方法和相关试剂盒)中,对受试个体的spidr是否出现异常进行检测,其中包括比较受试者的spidr的基因或其调控因子的活动,或spidr蛋白的表达,或是与一般或特定群体中正常人的所述基因或蛋白的情况进行比较,出现显著变化的,就判断存在异常。
9.在本发明的其中一个方面,本发明提供的诊断生育缺陷的方法中包括检测spidr基因的步骤。
10.用于本发明的检查基因的方法是本领域通常用于基因的检测的方法,没有特别限定。例如,可列举出质谱法、微阵列法、测序法、利用pcr(聚合酶链反应)等碱基序列扩增法的检测法等。
11.另外,使用对各基因特异性的引物进行pcr时获得的pcr产物的检测可通过通常用于检测和定量pcr产物时的任意方法来进行。例如,可通过电泳来检测,可以通过使用sybr green等荧光嵌入剂的实时pcr来检测,也可以通过单分子荧光分析法(single molecule fluorescence analysis)来检测。
12.能够作为用于检测基因的引物或探针使用的多核苷酸,只要是能够与包含该基因的部分区域或其互补链杂交的多核苷酸,则没有特别限定。多核苷酸的设计可采用该技术领域中众所周知的方法中的任一者来进行。例如,利用公知的基因组序列数据和通用的引物设计工具,能够简便地设计。作为该引物设计工具,例如有网络上能够利用的primer3等。另外,公知的基因组序列数据通常能够在作为国际性的碱基序列数据库的ncbi中获得。
13.在本发明的其中一个方面,本发明提供的诊断生育缺陷的方法中包括检测spidr蛋白的步骤,例如检测所述蛋白的表达情况(包括是否存在,以及相对正常或标准是否存在表达减少的现象)或其活性。
14.在本发明的其中又一个方面,所述方法中包括通过免疫测定spidr蛋白的表达的步骤。例如通过特异性识别所述蛋白的抗体进行免疫荧光或蛋白质印迹来检测spidr的表达。又例如通过检测所述蛋白的mrna的存在或其数量来检测spidr的表达,例如通过rt-pcr检测样品中编码spidr的mrna的量。
15.在本发明的其中又一个方面,所述方法中包括测定spidr蛋白的活性的步骤。
16.本发明还提供了诊断和预测不同性别哺乳动物中减数分裂相关疾病特别是生育缺陷或不育的风险的试剂盒或仪器(包括基因芯片),其包括检测受试个体的spidr的试剂。
17.在本发明的其中又一个方面,所述试剂盒或仪器包括检测spidr蛋白的表达或活
性的试剂。例如,所述试剂盒或仪器包括免疫测定的试剂,例如通过特异性识别所述蛋白的抗体进行elisa或蛋白质印迹来检测spidr的表达的试剂。又例如,所述试剂盒或仪器包括通过检测所述蛋白的mrna的存在或其数量来检测所述spidr的表达的试剂,例如通过rt-pcr检测样品中编码spidr的mrna的量的试剂。
18.在本发明的其中又一个方面,所述试剂盒或仪器包括检测spidr基因的试剂。
19.在本发明的其中一个方面,在上述本发明的方法和试剂盒或仪器中,所述用于检测样品中的遗传标记的试剂包括用于检测spidr的引物或探针,或是检查spidr的试剂,如特异性抗体或检测所述蛋白的mrna的试剂等。
20.本发明提供的方法和试剂盒是基于发现spidr对哺乳动物的减数分裂乃至其生育的影响是性别依赖的,因此本发明提供的方法或试剂盒所做的诊断和预测对不同性别的哺乳动物是不同的。因此,在本发明提供的方法中,还包括检测受试个体的性别。在本发明提供的试剂盒中,还包括检测受试个体的性别的试剂。用于检测受试个体的性别的方法和试剂是本领域公知的,例如包括检测受试个体的性别特异性蛋白质或基因,如性染色体上的特异性核酸序列等。
21.在本发明中,还提供了检测spidr的试剂在制备如前所述的本方面的诊断或预测哺乳动物个体的生育缺陷例如不孕障碍的试剂盒或仪器中的用途。所述用于检测spidr的试剂包括用于检测spidr基因的引物或探针,或是检查spidr的蛋白的试剂,如特异性抗体或检测所述蛋白的mrna的试剂等。
22.本方面还提供了治疗或避免哺乳动物个体的生育缺陷的方法,其包括对具有spidr的缺陷如spidr基因的突变的个体进行治疗。
23.在本发明的其中一个方面,提供了通过调节spidr和/或chk2来治疗或降低雌性哺乳动物的减数分裂相关疾病特别是生育缺陷或不育的风险的方法。
24.chk2(cell cycle checkpoint kinase 2),即细胞周期检查点激酶2。chk2是编码chk2的基因。其中,人的chk2基因gene id是11200;小鼠的chk2基因gene id是50883。
25.在本发明的其中一个方面,提供了spidr和/或chk2调节因子在用于制备治疗或降低雌性哺乳动物的减数分裂相关疾病特别是生育缺陷或不育的风险的药物中的用途。
26.在本文中,蛋白符号不用斜体,并全部大写;基因符号使用斜体。例如spidr为蛋白质,编码该蛋白质的基因写为spidr。有时在本文中蛋白符号也不全部大写。例如有时本文中“spidr”表示spidr蛋白质。有时在本文中基因符号也不使用斜体。例如有时本文中“spidr基因”或“spidr基因”表示编码spidr蛋白质的基因spidr。
附图说明
27.图1显示雄性及雌性小鼠生育都需要spidr的参与。spidr缺陷小鼠crispr-cas9编辑基因组系统的示意图。(b)spidr
+/+
和spidr-/-雄鼠睾丸中spidr的表达量。β-actin作为内参。(c)spidr
+/+
和spidr-/-雄鼠睾丸的形态学。在pd42时,spidr-/-睾丸明显小于wt。(d)成年小鼠睾丸与体重的比率。与wt相比,spidr-/-的睾丸重量与体重的比率显著降低。(e)spidr-/-雄性小鼠不育。(f)成年睾丸切片的h&e染色。spidr-/-小鼠睾丸或附睾中缺乏精子细胞或成熟精子。(g)6月内,每只雌鼠窝仔数的累计数量。(h)spidr
+/+
和spidr-/-卵巢的组织学。2月龄spidr-/-雌鼠的卵泡比野生型小鼠少。4月龄时,缺陷小鼠的卵巢几乎完全丧失
发育中的卵泡。6个月时,spidr-/-卵巢失去正常形态。
28.图2显示spidr是减数分裂过程中不可缺少的。(a)spidr
+/+
和spidr-/-精母细胞染色体的sycp1和sycp3的免疫荧光染色代表图。spidr-/-敲除小鼠精母细胞出现粗线期阻滞。(b)spidr
+/+
和spidr-/-减数分裂各个时期精母细胞的比例。通过计算每个阶段的精母细胞数除以成年睾丸中精母细胞总数来确定。(c)spidr
+/+
和spidr-/-精母细胞染色体的sycp3和γh2ax的免疫荧光染色代表图:细线期、偶线期、粗线期和双线期。在spidr-/-精母细胞中,γh2ax在粗线期常染色体周围持续存在,表明dsb修复缺陷。(d)(e)spidr
+/+
和spidr-/-精母细胞染色体的sycp3和mlh1的免疫荧光染色代表图如(d)所示,并对图像中的荧光点进行量化如(e)所示。spidr-/-精母细胞中未检测mlh1的信号。(f)(g)spidr
+/+
和spidr-/-精母细胞染色体的sycp3和msh4的免疫荧光染色代表图如(f)所示,并对图像中的荧光点进行量化如(g)所示。spidr-/-精母细胞中msh4荧光点减少。
29.图3显示spidr将rad51和dmc1招募至ssdna上。(a-d)在细线期、偶线期、粗线期对精母细胞进行sycp3和rad51/dmc1免疫染色。spidr
+/+
和spidr-/-精母细胞的代表图如(a和c)所示。spidr-/-精母细胞中rad51/dmc1荧光点计数减少。图像荧光点的量化如(b和d)所示。(e)从过表达这三种蛋白的293t细胞提取物中对spidr和rad51/dmc1进行共免疫沉淀分析。(f)(g)酵母双杂交:spidr(1-500aa)与rad51/dmc1/blm相互作用(f),而spidr(501-933aa)与dmc1/blm相互作用(g)。spidr作为诱饵,rad51/dmc1/blm作为猎物。细菌溶液的稀释度从左向右增加。
30.图4显示将spidr-/-卵母细胞中减数分裂过程出现缺陷。胚胎17.5天spidr
+/+
和spidr-/-的减数分裂各个时期的卵母细胞。(b)通过计算每个阶段的卵母细胞数除以卵巢中的卵母细胞总数来确定spidr
+/+
和spidr-/-各个时期的卵母细胞比例。(c-h)spidr
+/+
和spidr-/-卵母细胞染色体的sycp3(红色)和rad51/dmc1/mlh1(绿色)免疫染色的代表图。spidr-/-卵母细胞中rad51/dmc1/mlh1荧光点计数减少。(d、f和h)是对图像荧光点的量化。
31.图5显示敲除spidr导致雌鼠卵巢受损。(a和b)来自e13.5雌性小鼠的spidr
+/+
(a)和spidr-/-(b)卵巢切片的代表图。(c)卵母细胞计数显示,减数分裂起始的e13.5时期spidr
+/+
和spidr-/-中的卵母细胞数量相似。(d和e)来自e15.5雌性小鼠的spidr
+/+
(d)和spidr-/-e)卵巢切片的代表图。(f)卵母细胞计数显示在刚进入粗线期的e15.5时期spidr
+/+
和spidr-/-中的卵母细胞数量相似。(g和h)来自pd1雌性小鼠的spidr
+/+
(g)和spidr-/-(h)卵巢切片的代表图。(i)卵母细胞计数显示出生后1天spidr-/-卵巢包含的卵泡明显少于spidr
+/+
卵巢。所有切片均计数mvh阳性细胞。对每个切片进行计数,并求和以计算每个卵巢的卵母细胞总数。
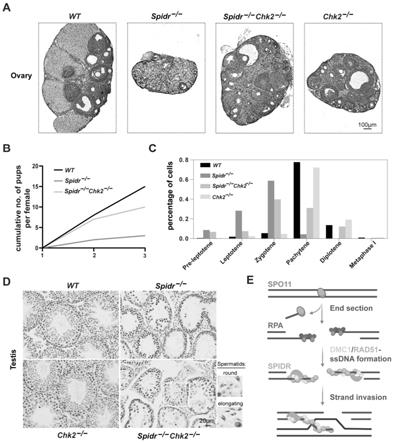
32.图6显示chk2缺失挽救spidr缺陷小鼠的生育能力。(a)卵巢的组织学分析显示成年spidr-/-chk2-/-与spidr-/-不同,卵巢具备不同发育阶段的卵泡。(b)3个月龄内每只雌性小鼠的窝仔数的累计数量。(c)wt、spidr-/-,spidr-/-chk2-/-和chk2-/-减数分裂各个时期的精母细胞。通过计算每个阶段的精母细胞数除以成年睾丸中精母细胞总数来确定。(d)成年睾丸切片的h&e染色显示spidr-/-chk2-/-雄鼠曲细精管中偶尔出现圆形和细长的精子细胞。(e)减数分裂重组期间spidr功能的模式图。
具体实施方式
33.下面将结合实施例进一步说明本发明的实质内容和有益效果,该实施例仅用于说明本发明而非对本发明的限制。
34.实施例1材料与方法
35.spidr和chk2基因敲除小鼠的产生:
36.小鼠spidr基因位于16号染色体的反义链上,有两个转录本,其中spidr-201编码一个完整的蛋白。委托中国科学院动物研究所采用crispr/cas9系统,通过敲除2号外显子至3号外显子的基因组dna片段,构建了b6d2f2遗传背景的spidr基因敲除小鼠。创始人用聚合酶链反应(pcr)进行基因分型,然后进行dna测序分析。所有实验方案均经山东大学伦理委员会批准。
37.小鼠chk2基因有6个转录本。根据chk2基因的结构,其第3外显子-6外显子chk2-201(ensmust00000066160.2)转录本被推荐为敲除区。chk2在c57bl/6jgpt遗传背景下的敲除小鼠也使用crispr/cas9构建系统创始人通过聚合酶链反应(pcr)进行基因分型,然后进行dna分析测序分析。所有的实验方案都得到了山东大学伦理委员会批准。
38.基因鉴定:
39.从小鼠尾巴中提取基因组dna进行pcr扩增进行基因鉴定。用于spidr基因鉴定的引物如下:突变型等位基因为5
‘‑
gga acc aga ggc cag ata gcc cag aga c-3’和5
‘‑
cca ctt ctt gga gga gtt gag ctt tgt gca agg tga caa at-3’,产生653bp的片段;野生型等位基因为5
‘‑
gga acc aga ggc cag ata gcc cag aga c-3,产生657bp的片段。
40.用于chk2基因鉴定的引物如下:突变型等位基因为5
′‑
gga ctt ttg gga tgg cat ttg aa-3
′
和5
′‑
gca tag cac tta ggt cag gat taa acc-3
′
,产生287bp的片段;野生型等位基因为5
′‑
gcc ctt gat tgt ctt ctt act gct gt-3
′
和5
′‑
tcc gag gag aga agc aac cgtta-3
′
,产生316bp的片段。
41.收集组织及组织学分析
42.对小鼠进行安乐死后即刻取睾丸和卵巢,用4%多聚甲醛(p1110,北京,solarbio)固定24h。脱水后,将它们包埋在石蜡中。制作5μm组织切片固定在载玻片上。将切片脱蜡、水化后,用苏木精-伊红染色,脱水切片后进行组织学分析。
43.免疫细胞学和抗体
44.将精母细胞和卵母细胞染色体铺展。免疫印迹抗体制备:小鼠抗spidr多克隆抗体由武汉戴安生物技术有限公司制备。
45.用于免疫荧光的主要抗体如下:兔抗sycp1(1:500稀释;abcam#ab15090),鼠抗sycp3(1:500稀释;abcam#ab97672),兔抗rpa2(1:200稀释;abcam#ab76420),兔抗rad51(1:200稀释;thermo fisher science#pa5-27195),鼠抗γh2ax(pser139)(1:300稀释。abcam#ab58666)。用alexa fluor 488或594偶联的二抗(1:500稀释;abcam#ab150080、#ab150077、#ab150113和#ab150116)在室温下孵育1小时。用含dapi(abcam#ab104139)的抗荧光淬灭剂封片。
46.western blotting
47.将小鼠睾丸分离出来后,用pbs洗涤。使用invent试剂盒(invent#sd001/sn-002)提取总蛋白。蛋白变性后,在10%sds聚丙烯酰胺凝胶中等量上样并电泳,将条带转移到
pvdf(millipore,usa)上。用biorad chemidoc mp成像系统和image lab软件(bio-rad,usa)检测和分析条带。免疫印迹的主要抗体包括抗actin(1:5000稀释;cell signaling technology,#66009-1-ig)和抗spidr(1:1000稀释)。
48.rt-pcr
49.从野生型小鼠睾丸分选细胞中提取总rna。用primescript rt试剂盒(takara)合成cdna。定量pcr中使用tb green premix ex taq(takara),特异性正反向引物如下:actin引物5
‘‑
ggc tgt att ccc ctc cat cg-3’和5
‘‑
cca gtt ggt aac aat gcc atg t-3’。spidr引物5
‘‑
ca g cag ttg aga cgg gga a-3’和5
‘
atc ctt ctc cac act tga gcc-3’。pcr程序:95℃变性10min,然后95℃变性30s,60℃退火30s,72℃延伸30s共25个循环,最后72℃延伸5min。
50.质粒及免疫共沉淀
51.用rt-pcr从小鼠睾丸rna中扩增出编码spidr、rad51、dmc1的全长cdna。将全长cdna克隆到pcdna3.1哺乳动物表达载体中。使用添加10%胎牛血清和1%青霉素和链霉素的dmem培养基,在37℃,5%co2的孵箱中培养hek 293t。按照制造商的方案,使用脂质体3000(invitgen)进行细胞转染。在细胞蛋白提取液中加入等量的抗体和igg,在4℃孵育过夜。孵育后,加入protein a/g琼脂糖珠吸附2h来分离免疫复合物,按比例加入蛋白上样缓冲液,95℃煮沸变性,上样至10%tris-glyine mini gel(invitrogen)。
52.酵母双杂交技术
53.将小鼠spidr的cdna亚克隆到pgbkt7载体上作为诱饵质粒。将小鼠rad51、dmc1的cdna分别亚克隆到pgadt7载体中作为猎物质粒。诱饵质粒和猎物质粒共转化至y2h gold菌株,并在ddo,tdo/3at(5mm),qdo培养基上测定其相互作用。
54.免疫组织化学
55.e13.5、e15.5、pd1卵巢组织采用免疫组化染色。
56.图像采集
57.用共聚焦显微镜(andor dragonfly spinning disc confocal microscope driven by fusion software)对染色体扩散进行成像,并用imaris软件进行图像处理。组织学标本用荧光显微镜(bx52,olympus)采集,图像处理软件采用photoshop(abode)和imagej(v.1.52a)。
58.统计分析
59.采用graphpad prism 8.0.1统计软件进行统计分析。两组间的数据差异采用非配对学生t检验。误差线代表均值
±
标准差。样本量在图中描述。p值小于0.05作为统计显著差异的标准。
60.实施例2 spidr基因敲除小鼠表现为不育
61.利用crispr/cas9基因编辑技术缺失了遗传背景为b6d2f2小鼠的spidr基因2-3号外显子,获得了spidr缺陷(spidr-/-)小鼠(图1a)。spidr
+/-小鼠体格健康,产下的小鼠具有预期基因型的孟德尔比率。spidr-/-小鼠是存活的。用spidr
+/+
和spidr-/-雄性睾丸的总蛋白提取物进行免疫印迹证实,spidr被成功敲除(图1b)。虽然新生spidr-/-小鼠体重正常,没有明显的肉眼可见形态缺陷,但雌雄小鼠都是不育的。6周龄的spidr-/-雄性的睾丸比wt动物的要小得多(图1c)。spidr-/-小鼠的成年睾丸重量比wt动物减少3-4倍(图1d)。雄性表现为
不育(图1e)。对spidr-/-小鼠的睾丸进行组织学分析,显示精子发生过程受损,在生精小管中没有减数分裂后的圆形或长形精子出现(图1f,上图),并且在敲除小鼠的附睾中未发现精子(图1f,下图)。
62.此外,发现spidr-/-雌性也表现出生育缺陷。雌性spidr-/-小鼠的生育测试表明,这些小鼠在3个月前的生育力明显低于wt小鼠,3个月后它们完全不育,而wt雌性小鼠的幼崽数量如预期的那样逐渐增加(图1g)。卵巢形态学研究表明,在spidr-/-中,2月龄小鼠卵巢中的卵母细胞比spidr
+/+
卵巢中的卵母细胞少。在大约4个月龄时,spidr-/-卵巢几乎完全丧失了卵泡。6月龄时,spidr-/-卵巢完全丧失正常形态,并呈纤维化(图1h)。
63.这些结果表明spidr在对于雄性及雌性生育力都是必需的。
64.实施例3 spidr缺失的雄性显示粗线期停滞,dsb修复缺陷,联会异常
65.鉴于spidr与减数分裂相关,接下来调查了减数分裂中hr是否需要spidr。首先在减数分裂前期i对染色体进行了sycp1和sycp3的免疫染色,这是联会复合体(sc)的组成部分,是在同源染色体之间形成的三重蛋白质结构。spidr-/-雄鼠中未检测到双线期细胞,表现为粗线期阻滞(图2a)。进一步对spidr
+/+
和spidr-/-睾丸中减数分裂不同阶段的精母细胞的百分率进行计数,发现spidr-/-精母细胞未能超过粗线期,只有4%的精母细胞达到粗线期。这与spidr
+/+
精母细胞中达到粗线期的20%的精母细胞形成了鲜明的对比(图2b)。
66.通过观察γh2ax的定位来评估减数分裂dsb的修复,发现γh2ax信号在细线期的spidr
+/+
和spidr-/-精母细胞之间是相似的,这表明spidr缺失对dsb的形成没有影响。在wt粗线期细胞中,这些信号在常染色体上消失,而在xy小体上出现明亮的信号。然而,spidr-/-雄性的粗线期细胞中常染色体附近仍有可见的γh2ax信号,而在wt精母细胞中则没有明显的信号,这表明spidr-/-雄鼠中出现dsb修复缺陷(图2c)。
67.实施例5 spidr-/-雄鼠中缺乏交叉复合体和hr中间体
68.在spidr缺陷的雄鼠中,少数精母细胞仍能进展到粗线期。利用标记交叉位点的mlh1/hei10的抗体,发现在wt粗线期每个细胞大约可以检测到20-30个mlh1/hei10荧光点,而在spidr-/-粗线期精母细胞中没有观察到信号(图2d,e)。
69.接下来,对msh4进行免疫染色,以研究spidr缺失对减数分裂重组前几个阶段的影响。检测到spidr-/-精母细胞中msh4荧光点的数量比wt减少了~2倍(图2f,g)。看见,spidr-/-精母细胞中重组中间体的形成缺陷,以致不能形成交叉。
70.实施例6 spidr招募重组酶rad51和dmc1至ssdna
71.使用rad51和dmc1的免疫荧光染色来评估spidr缺失对早期同源重组步骤的影响。与wt相比,spidr-/-精母细胞的rad51荧光点减少了~4倍,dmc1的荧光点减少了~3倍(图3a-d)。推测与rpa结合的切割dna中间体增加是由于rad51和dmc1在ssdna上的低效率装载。
72.为了确定spidr是否能与dmc1/rad51复合物相互作用,在293t细胞中进行了免疫共沉淀(图3e)。结果显示myc-rad51和myc-dmc1与flag-spidr能够结合。还通过酵母双杂观察到spidr与rad51和dmc1之间存在相互作用。于是尝试确定spidr中负责其与rad51和dmc1交互的区域。通过酵母双杂,发现spidr的n端(1-501aa)介导了spidr-rad51的相互作用,这与293t细胞中与rad51相互作用的spidr区域相同(图3f)。同时,发现spidr-dmc1的相互作用部分是由spidr的c端(501-933aa)介导的,这部分区域在体细胞中与blm相互作用(图3g)。与wt相比,spidr-/-雄性精母细胞中blm荧光的没有显示缺陷,这与在体细胞中观察到
的有很大不同。
73.综上结果和数据表明,spidr在减数分裂重组中通过不同的区域招募rad51和dmc1,而不是blm。
74.实施例6 spidr-/-卵母细胞表现为更轻微的减数分裂缺陷
75.在胚胎17.5天,spidr-/-雌鼠具有减数分裂各个时期的卵母细胞和正常的联会(图4a)。然而,与在雄性中观察到的很少有spidr-/-精母细胞进入粗线期的发现相似,发现只有约7%的spidr-/-卵母细胞在e17.5达到粗线期,而有~50%的spidr
+/+
卵母细胞达到粗线期(图4b),这表明雌性敲除鼠中减数分裂进展具有明显缺陷。为了研究spidr对rad51和dmc1的募集作用对于雌性的减数分裂进程是否必不可少,在胚胎卵母细胞中对rad51和dmc1进行了免疫荧光染色。spidr-/-卵母细胞在偶线期的rad51和dmc1荧光点数与wt相比减少了约2倍(图4c-f)。
76.然而与精母细胞相比,卵母细胞中的减少程度更轻。在spidr-/-卵母细胞中可检测到mlh1荧光点,数量约为wt的70%(图4g,h)。尽管重组酶rad51和dmc1显著减少,但卵母细胞中交叉仍能形成。这些发现表明spidr中能够发生较少但是正常的交叉,这些细胞可以发育成卵泡,决定了生育力。
77.另外,申请人评估了出生后的原始卵泡池。从出生后一天(pd1)的小鼠中剥离出卵巢用小鼠mvh抗体免疫染色,观察到spidr-/-中卵母细胞数量急剧减少(图5g-i)。然而在减数分裂起始胚胎第13.5天及减数分裂刚进入粗线期的第15.5天,spidr
+/+
和spidr-/-中存在相当数量的生殖细胞(图5a-f)。这表明,卵母细胞不能顺利进入粗线期可能是突变小鼠中原始卵泡池耗尽的原因。由于pfp的消耗,出生后第8天的初级卵泡数显着减少,在出生后15天几乎耗尽,周龄3-5w的spidr-/-雌性小鼠具有明显较少的卵泡。
78.实施例6 spidr-/-chk2-/-雌性而不是雄性小鼠是可育的
79.敲除dna损伤检验点激酶chk2可以部分挽救hr分子突变小鼠的卵泡丢失的程度。发明人观察到,与spidr-/-小鼠的卵巢不同,spidr-/-chk2-/-小鼠成年卵巢中不同发育阶段的卵泡都被部分挽救(图6a)。并且,spidr-/-chk2-/-雌性比spidr-/-雌性能够产生更多的后代(图6b)。
80.与雌性不同的是,雄性spidr-/-chk2-/-的睾丸没有表现出明显的挽救。对各个时期精母细胞的数目进行计数,结果发现spidr-/-chk2-/-的减数分裂进程较spidr-/-继续向前推进(图6c)。在曲细精管中,这些逃脱检验点的精母细胞发育成圆形精子及长形精子(图6d)。
81.综上所述,chk2在spidr缺陷小鼠中对卵母细胞和精母细胞的清除都至关重要,但具有性别依赖性。
82.本发明首次发现名为spidr的支架蛋白有助于促进dmc1/rad51-ssdna核蛋白丝的形成,这在减数分裂重组中具有核心作用,如所提出的模型所示(图6e),正确的同源重组需要dmc1/rad51在单链dna上的有效组装和稳定。
83.本发明还首次发现,虽然雄性和雌性的dmc1/rad51的组装都需要spidr,但敲除spidr在小鼠中产生了性别依赖性的表型:雄性的减数分裂进程被完全阻止,精子无法形成;而雌性的减数分裂进程仅被部分阻止,在卵母细胞中形成了交叉位点,这使得卵母细胞能够发育成原始卵泡,支持雌性直到3月龄的生育力。spidr-/-对生育功能的影响依赖于性别,这种差异是因为雌性的检验点与比雄性相比不那么严格,因此减数分裂的错误在卵子
发生中是可以被容忍的,但在精子发生中是不能被容忍的。
84.发明人还首次发现,dna损伤检验点激酶chk2的丢失可以恢复spidr突变雌性的生育能力,但不能恢复spidr突变雄性的生育能力。本研究证明,chk2可以被定义为有效消除异常卵母细胞而不是精母细胞的减数分裂dna损伤检验点。
85.本发明由此提供了诊断和预测在不同性别哺乳动物中减数分裂相关疾病特别是生育缺陷或不育的风险的方法或试剂盒。本发明还提供了治疗不同性别哺乳动物中减数分裂相关疾病特别是生育缺陷或不育的方法。
86.上面是对本发明进行的说明,不能将其看成是对本发明进行的限制。除非另外指出,本发明的实践将使用有机化学、聚合物化学、生物技术等的常规技术,显然除在上述说明和实施例中所特别描述之外,还可以别的方式实现本发明。其它在本发明范围内的方面与改进将对本发明所属领域的技术人员显而易见。根据本发明的教导,许多改变和变化是可行的,因此其在本发明的范围之内。
87.如无特别表示,本文中出现的温度的单位“度”是指摄氏度,即℃。
88.本说明书中提到的参考文献通过全文引用在本技术中进行公开。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1