一种与大鲵体色性状相关的TYR基因分子标记及其应用的制作方法
一种与大鲵体色性状相关的tyr基因分子标记及其应用
技术领域
1.本发明属于分子育种技术领域,具体涉及一种与大鲵体色性状相关的tyr基因分子标记及其应用。
背景技术:
2.动物体色是具有丰富多样性的一类表型特征,尤其在两栖动物中,多变的体色在个体拟态、逃避捕食、择偶及体温调节等方面均发挥重要作用,已成为进化和遗传领域的研究热点。20世纪中后期以来,利用现代生态学、遗传学和分子生物学的研究方法,通过研究人类肤色,小鼠和斑马鱼等模式生物体色和毛发的着色模式及潜在的分子遗传机制,研究人员鉴定出了大量与体色性状相关联的基因及其基因型。这些研究成果,为研究非模式生物(如:大鲵)体色形成的遗传机制提供了候选基因,使这一课题的研究成为可能。
3.大鲵(andrias davidianus)是世界上现存体型最大的两栖动物,也是我国的特有的二级保护动物。在漫长的进化及人工驯养过程中,大鲵形成了多种不同的体色表型,使其成为研究两栖动物体色多态性和分子遗传机制的优良材料。然而目前关于大鲵体色的研究十分有限,在染色体组操作技术、选择育种、功能基因等方面尚属空白。同时,大鲵种群存在一定的种质退化问题,缺少高性能的养殖新品种或新品系。考虑到大鲵具有重要的理论研究和社会经济价值,利用分子标记技术培育大鲵不同体色新品种或新品系已势在必行。
4.酪氨酸酶(tyrosinase,tyr)是黑色素生物合成过程重要的限速酶之一。研究表明,tyr基因的突变或酶的失活,可引起黑色素代谢紊乱,最终导致机体组织异常表达,使猫、大鼠及人类表现出白化特征(imes等,2006;blaszczyk等,2005)。然而针对大鲵这一稀有物种,tyr基因相关的分子遗传学研究较少。
技术实现要素:
5.针对现有技术中的不足,本发明的目的是提供一种与大鲵体色性状相关的tyr基因分子标记及其应用。
6.目前,该物种尚无可参考的基因组序列信息。因此,基因序列的获得及功能鉴定为关键。
7.(a)利用rt-pcr、race和dna测序技术,对候选基因进行克隆、测序。
8.(b)利用实时定量荧光pcr技术对候选基因进行不同组织及不同体色表达谱分析。
9.(c)利用bioedit等生物学软件对不同体色候选基因序列进行snp位点分析。
10.系统分析大鲵体色多样性特征,研究体色性状相关候选基因的分子遗传特征,对候选基因进行表达谱差异分析。分析候选基因snp多态性及其体色性状的关系,为标记辅助育种筛选有效的分子标记。
11.为达到上述目的,本发明的解决方案是:
12.一种与大鲵体色性状相关的tyr基因分子标记的应用。
13.进一步地,tyr基因的核苷酸序列如seq id no.1所示。
14.进一步地,tyr基因编码的蛋白质序列如seq id no.2所示。
15.进一步地,tyr基因克隆引物的上下游序列分别如seq id no.3和seq id no.4所示。
16.tyr基因采用实时荧光定量pcr技术在野生型大鲵体色不同组织中表达的应用。
17.进一步地,不同组织包括肌肉、皮肤、心脏、肝脏、脾、肺、胃、胰脏、生殖腺和肠道。
18.tyr基因采用实时荧光定量pcr技术在大鲵不同体色皮肤组织中的表达应用。
19.进一步地,大鲵不同体色皮肤包括黄色皮肤、黄底镶嵌黑色皮肤、黑底镶嵌黄色皮肤、灰色皮肤和虎斑色皮肤。
20.进一步地,tyr基因实时荧光定量pcr引物的上下游序列分别如seq id no.5和seq id no.6所示。
21.由于采用上述方案,本发明的有益效果是:
22.(1)经济效益
23.本发明利用snp分子标记技术分析体色性状相关基因的遗传多样性,进行候选基因snp位点与体色性状的关联性分析,为大鲵体色的定向选育提供有效的分子标记。在实际应用中,可以促进大鲵不同体色群体到品系的形成,进一步建立性状可稳定遗传的体色品系和新品种,解决大鲵种质退化问题,提供理论依据和指导作用,促进大鲵养殖产业健康蓬勃发展。
24.(2)社会效益
25.本发明以不同体色大鲵为研究对象,参考国内外动物体色多样性研究领域获得的科研成果,利用科学的功能基因研究方法,选择可靠的候选基因,采用准确的snp分子标记技术,研究候选基因在不同特色大鲵群体中的遗传多样性;应用race技术对重要候选基因进行克隆,结合生物信息学方法,分析基因的dna序列特征,预测基因cds区编码的蛋白质序列的二级结构和三级结构;结合qrt-pcr技术,进行候选基因表达谱分析。不但有助于了解大鲵体色多样性形成的分子遗传基础,同时,有助于为大鲵体色的定向选育提供有效的分子标记。这些研究不但为进一步揭示大鲵体色多样性形成的遗传机制及细胞代谢机制奠定基础,且为非模式生物经济性状相关基因研究提供了可供参考的科学试验方法。
26.本发明以不同体色中国大鲵为研究对象,(1)调查目前大鲵养殖群体及野生群体体色的多态性特征;(2)利用dna末端快速扩增技术(rapid amplification of cdna ends,race)对酪氨酸酶基因(tyrosinase)的cds区(coding sequences,cds)全长进行克隆,结合生物信息学方法,分析基因的dna序列特征及编码的蛋白质的二级结构和三级结构特征,总结候选基因的分子特征;(3)结合实时荧光定量pcr(real-time pcr,qrt-pcr)技术构建候选基因组织表达谱,分析候选基因的遗传特征。(4)采用单核苷酸多态(single nucleotide polymorphism,snp)分子标记技术,结合生物信息学分析方法,对候选基因在不同体色群体的多态性进行检测,并进行多态性位点与体色表型之间的关联性分析,选择有效的体色定向育种的snp标记。这些研究不但为进一步揭示大鲵体色形成的生物学基础、遗传机制及体色性状的适应性变化机制奠定基础,且为非模式生物经济性状相关基因研究提供了可供参考的科学试验方法,因此,本发明不仅具有重要的理论和方法学意义,也有重要的生产应用价值。
附图说明
27.图1为现有技术中黑色素合成的信号通路图。
28.图2为本发明的不同体色大鲵图(a:黄色为主色,简称黄色;b:黄色为主色,分布黑斑;c黑色为主色,分布黄斑;d黑色为主色,分布少量黄斑;e1-e2野生型体色:灰色或虎斑色)。
29.图3为本发明的tyr基因pcr扩增产物m:dna marker(dl2000);1:tyr基因克隆图。
30.图4为本发明的6个物种的tyr cds区核苷酸序列比对图。
31.图5为本发明的中国大鲵tyr基因编码蛋白分子结构特征预测图。
32.图6为本发明的tyr基因在不同组织中的相对表达量图。
33.图7为本发明的tyr基因在不同体色大鲵皮肤组织中的相对表达量图。
34.图8为本发明的不同体色个体tyr基因序列比对图。
35.图9为本发明的不同体色皮肤组织tyr蛋白序列序列比对图。
36.图10为本发明的tyr基因实时定量扩增曲线图。
37.图11为本发明的tyr基因溶解曲线图。
具体实施方式
38.本发明提供了一种与大鲵体色性状相关的tyr基因分子标记及其应用。应用snp分子标记技术,分析候选基因在不同体色大鲵群体的多态性。采用cdna末端快速扩增技术来克隆候选基因的cdna全长序列。
39.具体地,本发明成功克隆了大鲵tyr基因的cdna全长序列,对大鲵灰色皮肤、黄色和黑底镶嵌黄斑的个体皮肤组织中tyr基因进行了相关生物信息学分析,发现不同体色大鲵个体tyr核苷酸序列基本一致,但在黄色体色个体的tyr基因存在核苷酸插入,导致氨基酸序列中断,表明大鲵tyr基因可能在灰色体色形成过程有重要的作用,为进一步探讨大鲵黑色素的代谢机理和体色形成机制奠定基础。
40.1.主要材料和试剂
41.(1)主要仪器
42.微量移液器(10μl、100μl、200μl、1000μl)(eppenderf公司)、line9660 qpcr仪(bioer)、电泳仪及微型水平电泳槽(bio-rad)、漩涡震荡仪(江苏海门其林医用仪器厂)、电热恒温水槽(上海一恒科技公司)、超低温冰箱(sim)、恒温培养箱(thermo scientific)、梯度pcr仪(bio-rad公司)、gene genius型凝胶成像系统(syngene公司)、低温高速离心机(eppenderf公司)、常温离心机(fqrce 1418,labnet公司)、电泳仪及微型水平电泳槽(美国bio-rad公司)、生化培养箱(lrh-150b型,广东医疗器械厂)、超净工作台(cj-1s,天津泰斯特公司)、架盘天平(金马jpt-10,上海岑达公司)、电热鼓风干燥箱(cs101,重庆恒达)、漩涡混合器(江苏海门其林医用仪器厂)、电热恒温水槽(上海一恒科技公司)、超低温冰箱(美国sim公司)。
43.(2)主要试剂
44.各种限制性内切酶、t4连接酶等均购自mbi,pcr system(mbi),dna片段快速回收试剂盒(biodec-tech),小提质粒抽提试剂盒(vigrous)。
45.2.材料与方法:
46.试验动物与样品采集
47.(1)选取体色为黑色的成年商品大鲵3只(两公一母),麻醉处理后无痛宰杀取其肌肉、皮肤、心脏、肝脏、脾、肺、胃、肠、胰脏、生殖腺(卵巢/精巢)等10个组织样品,-80℃冷冻保存备用。
48.(2)选取体色为黄色(黄色站体表面积》90%,见图2中a),以下简称yl;黄色为基础体色,体表分布少量黑色斑纹(黄色站体表面积50-90%,见图2中b),以下简称y(b);黑色为基础体色,体表分布较多黄色斑块(黄色站体表面积10-50%,见图2中c),以下简称b(y);黑色为基础体色,体表分布少量黄色斑块(黄色站体表面积《10%,见图2中d),以下简称b(sy);灰色或者浅色体色及虎斑色体色(见图2中e1、e2),以下简称gy。以上体色大鲵共15只,分别手术法采集其尾部皮肤组织约0.5cm2左右,采样结束后进行伤口清洗并涂抹碘伏消毒液(安捷高科,中国山东)。
49.实施例1:
50.tyr基因克隆、测序
51.1》rna提取及反转录
52.取待研究的细胞或组织样,根据invitrogen公司trizol试剂说明书,按照每个60mm细胞培养皿加入1ml trizol的用量裂解细胞5min,加0.2ml酚氯仿剧烈震荡15s,冰上放置3-5min,4℃、12000rpm离心15min。小心吸取上层清液移至新的1.5ml ep管中,加0.5ml异丙醇,混匀后冰上放置10min,4℃、12000rpm离心10min,弃上清,加1ml75%乙醇洗涤沉淀,4℃、12000rpm离心5min,至于冰上待乙醇挥发完全后加入20μl depc水溶解沉淀,即为总rna。对其进行定量测定,选取a260/280比值在1.8-2.0之间且浓度较高者用于实验。取2μg rna按照revertaid firststrand cdna synthesis kit试剂盒说明书进行反转录反应。得到的cdna可直接用于后续反应,也可置于-20℃保存。
53.2》引物设计与合成
54.参考中国大鲵tyr基因的相关序列,使用primerquest(http://sg.idtdna.com/primerquest/home/indexprimer)软件设计pcr及qpcr引物,相关信息见表1。引物由南京金斯瑞生物科技公司合成。
55.表1 tyr基因克隆引物及其与内参基因实时荧光定量引物
[0056][0057]
注:p1:tyr基因克隆引物;p2:tyr基因实时荧光定量pcr引物;p3:gapdh基因实时荧光定量pcr引物。
[0058]
3》目的基因的pcr扩增
[0059]
pcr反应体系为25μl:2.5μl 10
×
taqbuffer,2.5mm mgci2,2.5mm dntp,1u taqdna polymerase(加拿大fermentas公司),10μm上游引物和下游引物。tyr基因pcr反应程序:94℃预变性4min,35个循环(94℃,30s,52℃,90s,72℃,120s,72℃延伸10min)。
[0060]
4》大肠杆菌(dh5α)感受态细胞的制备
[0061]
(1)挑取经平板培养的大肠杆菌(dh5α)单个菌落接种于5ml液体lb培养基中,37℃,220rpm振荡过夜培养。
[0062]
(2)以1:50的比例,取适量菌液于装有lb培养基锥形瓶中,37℃,220rpm振荡扩大培养。
[0063]
(3)当菌液od600达到0.5-0.6时(约需2-3h),将菌液置于冰上,缓慢摇动使其充分冷却。
[0064]
(4)将冷却的菌液分装至预冷过的50ml离心管中,4℃,5000rpm离心10min,收集管底菌体细胞,菌液较多时,可重复集菌。
[0065]
(5)弃上清液,加入30ml预冷的灭菌去离子水,轻轻吹打菌液,使其悬浮,4℃,5000rpm离心10min。
[0066]
(6)重复(5)中操作一次。
[0067]
(7)弃上清液,加入30ml预冷的10%甘油,轻轻吹打菌液,使其悬浮,4℃,5000rpm离心10min。
[0068]
(8)重复(7)中操作一次。
[0069]
(9)弃上清液,加入适量10%甘油,轻轻吹打,悬浮菌液。分装至1.5ml离心管中,-70℃保存备用。
[0070]
5》目的基因pcr产物纯化及t载体连接
[0071]
将pcr产物于1%琼脂糖凝胶中电泳鉴定并用回收试剂盒回收后连入pbs-t载体。反应体系如下:
[0072][0073]
混匀后16℃过夜,连接产物转化感受态细胞,次日提取质粒后按照设计酶切位点连入相应骨架载体,酶切鉴定并用小提试剂盒提取备用。
[0074]
6》连接产物的转化(电转化法)
[0075]
使用电转化法转化连接产物。除特殊说明外,各步骤均为冰上操作。
[0076]
(1)从-70℃冰箱取出感受态细胞,冰上解冻。
[0077]
(2)将4.5μl连接产物缓慢加入感受态细胞中,吸打混匀。
[0078]
(3)取出预冷的电转化杯,将步骤(2)中的混合物吸入电转化杯中,使其位于电极之间。
[0079]
(4)仔细将电极杯两侧及底部快速擦干,放入电转化仪。选择或设置合适的电击程序(电压2500伏),进行电击转化。
[0080]
(5)在电转化杯中加入约200μl lb液体培养基,吹打数次,用移液器将培养基和转化产物吸出,加入装有lb液体培养基的1.5ml离心管中,37℃,150rpm振荡培养1h,复苏细胞。
[0081]
7》阳性克隆的筛选
[0082]
按配方配置固体(sb)培养基,高压灭菌处理后,加入氨苄青霉素,倒板(厚度约3mm),待其凝固后,在表面均匀地涂抹x-gal(40μl)和iptg(7μl),静置1h,备用。
[0083]
(1)电击转化菌液200μl,涂板。
[0084]
(2)将涂好的培养皿正面朝上放置,37℃培养约1h后,倒置培养过夜。
[0085]
(3)将培养皿放入4℃冰箱,待显色完全后,挑取阳性克隆。
[0086]
(4)随机挑选长势良好的白色单菌落,在装有lb培养基的1.5ml离心管中,37℃,220rpm振荡扩大培养。共挑阳性克隆约3000个左右。
[0087]
8》质粒提取
[0088]
使用质粒提取试剂盒提取质粒。
[0089]
(1)取1.5ml菌液,10000rpm离心1min,弃上清。重复一次。
[0090]
(2)加入250μl溶液i(试剂盒自带),吹打悬浮沉淀至无明显可见的细胞。
[0091]
(3)加入250μl溶液ⅱ(试剂盒自带),混合均匀至反应液清亮,静置2min。
[0092]
(4)加入350μl溶液ⅲ(试剂盒自带),颠倒离心管至出现白色沉淀。
[0093]
(5)13000rpm离心10min。
[0094]
(6)将上清液转移至离心柱中,室温10000rpm离心1min。
[0095]
(7)弃流出液,加入500μl hb缓冲液,10000rpm离心1min,以去除残留的蛋白质。
[0096]
(8)弃流出液,加入700μl洗脱缓冲液,10000rpm离心1min,弃流出液。
[0097]
(9)重复步骤(8)一次。
[0098]
(10)13000rpm离心2min。
[0099]
(11)将离心柱放入一新离心管中,加入40μl溶解缓冲液,静置2min,13000rpm离心1min,将质粒沉淀到管底。
[0100]
9》酶切鉴定与侧序
[0101]
使用ecorⅰ酶酶切鉴定质粒提取物。选择酶切鉴定正确的质粒,送南京金斯瑞生物科技公司测序。
[0102]
10》tyr基因cds区生物信息学分析
[0103]
表2生物信息学软件及其功能
[0104][0105]
实施例2:
[0106]
实时定量荧光pcr分析tyr基因在大鲵的不同组织中表达
[0107]
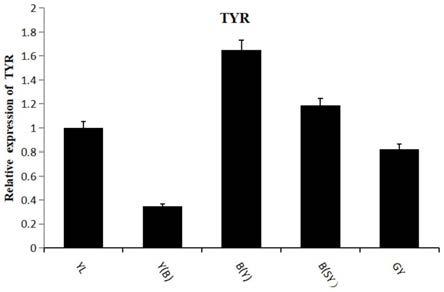
1》总rna提取及反转录
[0108]
用tizol一步法分别提取大鲵肌肉、皮肤、心脏、肝脏、脾、肺、胃、胰脏、肾脏、生殖腺(卵巢/精巢)、肠道组织总rna并反转录为cdna,具体实验步骤同实施例1。
[0109]
2》引物设计与合成
[0110]
使用测序所得中国大鲵tyr基因cds区序列,使用primerquest(http://sg.idtdna.com/primerquest/home/indexprimer)在线软件设计实时荧光定量引物,其相关信息见表1。引物由南京金斯瑞生物科技公司合成。
[0111]
3》反应体系及条件
[0112]
反应体系为:每个pcr反应管中加入1μl cdna,10nm/μl dntp 1μl,目的基因上游引物和下游引物各0.75μl,sybr green qpcr master mix(德国roche公司)14.5μl。pcr反应程序为:40个循环(94℃,1min;94℃,18s;62℃,18s;72℃,20s),85℃读板。以gapdh作为内参基因,并有一个不加模板的反应作为空白对照,每个反应设置三次重复。
[0113]
4》试验数据分析
[0114]
使用excel软件对试验数据进行分析,以各目的基因的ct值减掉相应gapdh的ct值,得出目的基因的δct,使用power(2,-δδct)公式计算目的基因的相对表达量。用spss18.0软件对试验数据进行分析。试验结果以“平均数
±
标准误”表示。
[0115]
实施例3:
[0116]
实时定量荧光pcr分析tyr基因在不同体色大鲵尾部皮肤组织中的表达
[0117]
1》总rna提取及反转录
[0118]
用tizol一步法分别提取体色为yl、y(b)、b(y)、b(sy)和gy的大鲵尾部皮肤组织总rna并反转录为cdna,具体实验步骤同实施例1。
[0119]
2》引物设计与合成
[0120]
同实施例1。
[0121]
3》反应体系及条件
[0122]
同实施例1。
[0123]
4》试验数据分析
[0124]
同实施例1。
[0125]
实施例4:
[0126]
tyr基因在不同体色中的单核苷酸多态性(single nucleotide polymorphism,snp)分析
[0127]
总rna提取及反转录同实施例1。
[0128]
引物设计与合成同实施例1。
[0129]
目的基因的pcr扩增同实施例1。
[0130]
目的基因pcr产物的纯化同实施例1。
[0131]
pcr产物与pemg-teasy载体的连接同实施例1。
[0132]
大肠杆菌(dh5α)感受态细胞的制备同实施例1。
[0133]
连接产物的转化(电转化法)同实施例1。
[0134]
阳性克隆的筛选同实施例1。
[0135]
质粒提取同实施例1。
[0136]
酶切鉴定同实施例1。
[0137]
测序同实施例1。
[0138]
序列比对同实施例1。
[0139]
使用bioedit软件对测序所得序列进行同源性比对,找出该基因的snp位点,结合序列对应的体色类型,分析snp位点与体色之间的对应关系。
[0140]
结果与分析:
[0141]
大鲵皮肤组织总rna提取及检测同实施例1。
[0142]
tyr基因pcr扩增与克隆、测序:
[0143]
以皮肤组织cdna为模板,用设计的tyr基因引物进行touchdown pcr扩增(图3)。结果显示pcr产物与预期片段一致。将tyr基因扩增产物测序。
[0144]
tyr基因序列及其生物信息学分析:
[0145]
1》tyr基因序列特征
[0146]
使用orf finder分析中国大鲵的tyr基因序列结构,发现该基因的cds序列长1605bp。tyr基因cds区核苷酸序列(seq id no.1)如下。
[0147]
tyr基因cds区核苷酸序列(长度:1605bp):
[0148]
atgctgatgctgctagtggtgtgcttactgctaggagccctgccctccctagctcagttccccaggtcctgtgccacggcccaggcattgattagtaaggagtgctgcccttcttgggggggagatggctccccctgtggccagctctcaggacgaggcagctgccaggacatcgtgctatcccaggctcccaatgggccccaatttcccttctctggggtggacgaccgagaggactggccggctgtcttctacaaccgtacctgccattgcacgccaggcttcacaggcttcaactgtggggagtgctggttcgggcgtgaggggccgggctgtgcagtgccaaggctgcaggtaaggcgcagcatcacagagctcagccctgctgagagcagtaagtttctagcctacctgactctagccaaacgcagcaccagccctgactatgttatcgccactggcacctacgcgcagatgggcaatggctccaatccgctcttcgccaacatcagtgtttatgacctgtttgtttggttgcattactatgtatcccgggatagcctgcttcccagccctgcagaccagccgcaggtctggagggacatagactttgcccacgaggcacctgccttcctgccctggcaccggctctacctgctgctctgggagcgtgaaatccagaagatggctggtgacccagacttcaccatcccctactgggactggagggatgcccaggactgcgaggtctgcagcgaccagcttatgggagcccggcacccctctgtgcccaatatgctcagcccggcatcattcttctcctcatggcagatcatctgtagcagaccagaagaatacaacaatctacagactctgtgcaatggcacagaagaaggacctatactaagaaaccccggcaatcaagataaagccagggttctgaggctcccaacttcagaggaggtggaattttgtgtaagtcttacacagtatgacactgagccaatgaaccgatctgctaatttgagctttagaaacacattggaaggttttgccgatccaagtactggaatagcaggaaatggatctctgagcagtttacataattccctgcatgtctttatgaatggctcaatgtccaccgttcaaggatctgctaatgatccaatttttgtgcttcatcattcgtttgtcgatagtatatatgaacaatggcttagaagacatcaacctttattagatgcttatccagaagcaagtgctccaattgggcacaatcgggattactacatggtaccctttattccaatatacagaaatggtgaattctttgtccagtcaaaggaattgggatatgactatgcctatttagtagatccaggccctggctcctttcgagactttatgatgccctacctagagcaagcaagtcagatatggcagtggctggtcgcagcagctttgattggtggtttaattactgctgtgattgctagccttgtcgctctggtctgtaggaaaaagcggcagagactgccagaagagaggcgacctttgctcatggaagctgaagactatcgtgacacctatcaaacacatttgtaa。
[0149]
2》tyr基因cds区序列的同源性分析:
[0150]
用ncbi数据库中blastn程序(http://blast.ncbi.nlm.nih.gov/blast)进行中国
大鲵tyr序列同源比对,结果显示中国大鲵tyr与红腹蝾螈(genebank登录号:lc076439.1)、绿海龟(genebank登录号:xm_007063131.1)、西部锦龟(genebank登录号:xm_005304066.2)、中华鳖(genebank登录号:ab024280.1)、恒河鳄(genebank登录号:xm_019525403.1)核苷酸序列同源性分别为77%、73%、73%、72%、71%。与人(genebank登录号:np_000363.1)、鼠(genebank登录号:np_035791.1)、红腹蝾螈(genebank登录号:bau51618.1)、美西钝口螈(genebank登录号:aoa49894.1)、中华鳖(genebank登录号:xp_006118436.1)氨基酸序列同源性分别为66%、64%、77%、78%、69%。
[0151]
使用bioedit软件对中国大鲵tyr基因cds区核苷酸序列与红腹蝾螈(genebank登录号:lc076439.1)、绿海龟(genebank登录号:xm_007063131.1)、西部锦龟(genebank登录号:xm_005304066.2)、中华鳖(genebank登录号:ab024280.1)、恒河鳄(genebank登录号:xm_019525403.1)的核苷酸序列进行多重序列比对(见图4)。
[0152]
3》tyr基因编码蛋白氨基酸序列功能结构域预测
[0153]
利用smart(http://smart.embl-heidelberg.de/)对蛋白质的结构域进行预测,结果表明中国大鲵tyr基因cds部分序列编码的534个氨基酸残基,包括酪氨酸酶结构域(177-408氨基酸)和egf_lam结构域(234-521氨基酸)等功能结构域(见图5)。
[0154]
tyr基因蛋白序列(534个氨基酸)(seq id no.2):
[0155]
mlmllvvclllgalpslaqfprscataqaliskeccpswggdgspcgqlsgrgscqdivlsqapngpqfpfsgvddredwpavfynrtchctpgftgfncgecwfgregpgcavprlqvrrsitelspaesskflayltlakrstspdyviatgtyaqmgngsnplfanisvydlfvwlhyyvsrdsllpspadqpqvwrdidfaheapaflpwhrlylllwereiqkmagdpdftipywdwrdaqdcevcsdqlmgarhpsvpnmlspasffsswqiicsrpeeynnlqtlcngteegpilrnpgnqdkarvlrlptseevefcvsltqydtepmnrsanlsfrntlegfadpstgiagngslsslhnslhvfmngsmstvqgsandpifvlhhsfvdsiyeqwlrrhqplldaypeasapighnrdyymvpfipiyrngeffvqskelgydyaylvdpgpgsfrdfmmpyleqasqiwqwlvaaaligglitaviaslvalvcrkkrqrlpeerrpllmeaedyrdtyqthl。
[0156]
表3核酸编码表
[0157][0158]
4》tyr基因表达谱分析
[0159]
实时定量结果显示(见图6),tyr基因在皮肤组织中mrna的表达量最高(0.000643
±
0.000107),在胰腺、性腺、胃、肺、脾脏、肝脏、肠、肌肉、心脏组织中的表达量依次递减,分别为0.000144
±
2.4e-05、0.000108
±
1.79e-05、6.1e-07
±
1.02e-07、3.33e-07
±
5.55e-08、2.81e-07
±
4.69e-08、2.8e-07
±
4.67e-08、5.86e-08
±
9.76e-09、1.75e-08
±
2.92e-09、1.13e-08
±
1.89e-09,且与皮肤组织中的表达量差异极显著(p《0.01)。tyr基因实时定量扩增曲线及相关的原始数据见图10,溶解曲线及相关的原始数据见图11。
[0160]
5》不同体色皮肤组织中tyr基因mrna表达量分析
[0161]
实时定量结果显示(见图7),tyr基因在b(y)型体色大鲵皮肤组织中mrna的表达量最高(0.000692
±
0.000173),其次为b(sy)型体色,tyr基因mrna的表达量为(0.000497
±
8.28e-05),yl型和gy型体色皮肤组织中tyr基因mrna的表达量分别为0.000419
±
6.99e-05、0.000344
±
4.3e-05,y(b)型体色皮肤组织中tyr基因的表达量最低,为0.000146
±
2.43e-05。各数据之间的差异显著性如图7所示。tyr基因实时定量扩增曲线及相关的原始数据见图10,溶解曲线及相关的原始数据见图11。
[0162]
6》tyr基因单核苷酸多态分析
[0163]
本发明扩增了大鲵灰色皮肤、黄底镶嵌黑色皮肤,黑底镶嵌黄色皮肤、黄色个体皮肤组织中tyr基因共1651bp(包括cds区1605bp)的核苷酸序列,利用blustal w程序对获得序列进行多重序列比对,结果见图8。结果显示不同体色大鲵个体tyr核苷酸序列基本一致,发生在黄色体色个体的tyr存在3个核苷酸插入位点,导致氨基酸序列中断(见图9)。
[0164]
最后应说明的是:以上仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对
前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1