一种微管蛋白抑制剂普那布林异构体杂质的制备方法及其应用
1.本发明属于药物化学技术领域,涉及一种微管蛋白抑制剂普那布林异构体杂质(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮的制备方法及其应用。
背景技术:
[0002]
普那布林(plinabulin)是在从海洋焦曲霉菌中分离得到的天然产物phenylahistin结构基础上,经构效关系研究合成出的二酮哌嗪类微管蛋白抑制剂。普那布林是作用于α和β微管亚单位之间位点的微管抑制剂,其作用位点接近于秋水仙碱作用位点,但不在秋水仙碱结合位点的凹槽上。临床一期研究发现,普那布林具有良好药效学、药动学及安全性性质,plinabulin和docetaxel联合用药可明显提高plinabulin生物利用度且二者互不干扰,实验推荐用于二期临床研究的最佳剂量为30mg/m2plinabulin与75mg/m2docetaxel联合用药,用于治疗非小细胞肺癌,2015年在国内启动全球多中心三期临床实验。目前该药物开发公司万春药业正在积极推进普那布林中美nda双报。同时,普那布林在临床上显现出对于中性粒细胞减少症(cin)的良好效果,在2020年9月份先后获得中国nmpa和美国fda的突破性疗法认定。
[0003]
在原研专利wo2005/07790中,对普那布林合成工艺进行了描述,在最后一步缩合反应时会产生苯环位置双键异构体,而该异构体杂质会影响产品的纯度。由于该异构体杂质产生量不是太多,想要拿到纯度高且量大异构体杂质做对照品很难,同时,因该异构体杂质结构与产物分子相近,极性也相近,且溶解性差,用硅胶薄层层析法发现异构体拖尾且rf与产物重合,无法用硅胶柱层析分离,而质量研究中需要极其关注杂质研究,因此制备规模化异构体杂质对照品成为该品种杂质研究及质量分析的一个关键点,而本发明的方法就很好的解决了这个问题。
技术实现要素:
[0004]
本发明的目的在于提供一种普那布林异构体杂质(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮的制备方法及其应用,具体涉及高纯度杂质的制备方法和纯化工艺,得到产物纯度大于95%以上,甚至可制备得99.0%以上纯度化合物,可作为普那布林杂质研究的对照品应用。
[0005]
为实现上述发明目的,本发明采用以下技术方案予以实现:
[0006]
普那布林异构体杂质(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮i及其药学上可接受的盐,其特征在于,杂质i结构如下:
[0007][0008]
本发明还提供了普那布林异构体杂质(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮i的制备方法,包括如下步骤:以(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮为原料,在有机溶剂a中,采用200-450nm光源照射下发生反应,待反应达到平衡后,浓缩溶液得黄色固体,采用有机溶剂b与水重结晶得到(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮。
[0009]
进一步地,在上述技术方案中,有机溶剂a选自甲醇、乙醇、乙腈、丙酮、四氢呋喃、二氧六环、dmf或dma中的一种或多种。
[0010]
进一步地,在上述技术方案中,有机溶剂a选自丙酮、四氢呋喃或两者混合溶剂。
[0011]
进一步地,在上述技术方案中,原料在有机溶剂配置成浓度为4.0-50.0mg/ml。
[0012]
进一步地,在上述技术方案中,浓度为4.0-30.0mg/ml。
[0013]
进一步地,在上述技术方案中,光源波长范围为320-420nm。
[0014]
进一步地,在上述技术方案中,有机溶剂b选自乙腈、甲醇、二氧六环中的一种或多种,重结晶后产品hplc纯度>95.0%。
[0015]
进一步地,在上述技术方案中,有机溶剂b选自乙腈,重结晶后产品hplc纯度>99.0%。
[0016]
本发明还提供了普那布林异构体杂质i及其药学上可接受的盐作为杂质对照品的应用。由于该异构体杂质及其药学上可接受的盐,纯度较高,可满足作为杂质对照品应用。
[0017]
研究表明,普那布林异构体杂质抗肿瘤活性不如普那布林,其作为普那布林质量研究过程中的杂质研究对照品、制备工艺过程控制以及安全性评价中应用具有明显优势。
[0018]
发明有益效果
[0019]
针对plinabulin有关物质研究过程中的异构体杂质对照品难获得、难纯化的问题,本发明提供了普那布林异构体杂质i及其药学上可接受盐的制备及纯化方法,该方法所用光照方法及重结晶溶剂是经过大量实验筛选获得,具有所用光照波长设备和溶剂易获得、方法操作简单、收率高、重现性好等特点。
[0020]
该方法所筛选的重结晶溶剂组合可避免多次结晶带来的溶剂损耗,得到产物纯度大于95.0%以上,甚至可以制备99.0%以上纯度异构体杂质,可作为普那布林质量研究过程中的杂质研究对照品、制备工艺过程控制以及安全性评价中进行应用。
[0021]
同时,本发明研究过程中发现,普那布林异构体杂质制备过程中,升高温度对其生成转化率作用不大,其次在其光照达到平衡后,延长反应时间对转化率影响不大,同时反应液浓度过高会降低其转化速率。研究表明,普那布林异构体杂质抗肿瘤活性不如普那布林,其作为普那布林质量研究过程中的杂质研究对照品、制备工艺过程控制以及安全性评价中应用具有明显优势。
附图说明
[0022]
图1为实施例1中(3z,6z)-3-苯亚甲基-6-((5-叔丁基-1h-咪唑-4-基)亚甲基)哌嗪-2,5-二酮(plinabulin)hplc谱图;
[0023]
图2为实施例2中(3z,6e)-3-苯亚甲基-6-((5-叔丁基-1h-咪唑-4-基)亚甲基)哌嗪-2,5-二酮hplc谱图;
[0024]
图3为实施例2中(3z,6e)-3-苯亚甲基-6-((5-叔丁基-1h-咪唑-4-基)亚甲基)哌嗪-2,5-二酮1h nmr谱图;
[0025]
图4为实施例2中(3z,6e)-3-苯亚甲基-6-((5-叔丁基-1h-咪唑-4-基)亚甲基)哌嗪-2,5-二酮
13
c nmr谱图;
[0026]
图5为实施例2中(3z,6e)-3-苯亚甲基-6-((5-叔丁基-1h-咪唑-4-基)亚甲基)哌嗪-2,5-二酮质谱图。
具体实施方式
[0027]
实施例1
[0028]
(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮的制备
[0029][0030]
氮气保护下,在反应瓶内加入5.0g(32.85mmol)5-(叔丁基)-1h-咪唑-4-甲醛和35mldmf,再加入13.02g(65.7mmol)n,n-二乙酰基哌嗪-2,5-二酮和16.05g(49.28mmol)碳酸铯,室温下避光搅拌反应20h。将反应液倾入(500ml)冰水中,抽滤滤饼依次用水(100ml*2)、石油醚/乙酸乙酯8/1(400ml)洗,滤饼用乙醇和二氯甲烷超声分散,滤去不溶物,减压浓缩,无水乙醇带水。乙酸乙酯(200ml)打浆,得棕黄色固体(z)-1-乙酰基-3-((5-(叔丁基)-1h-咪唑-4-基)亚甲基)哌嗪-2,5-二酮4.16g,收率43.62%。1h nmr(500mhz,dmso-d6)δ:12.37(s,1h),12.02(s,1h),7.85(s,1h),7.05(s,1h),4.31(s,2h),2.51(s,3h),1.39(s,9h)。
[0031]
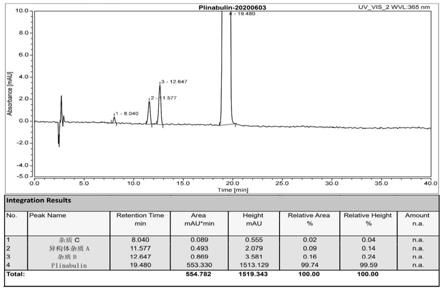
氮气保护下,在反应瓶内加入4.16g(14.33mmol)(z)-1-乙酰基-3-((5-(叔丁基)-1h-咪唑-4-基)亚甲基)哌嗪-2,5-二酮和60ml dmf,加入苯甲醛1.67g(15.76mmol)和碳酸铯7.0g(21.50mmol),50℃下避光反应8小时。将反应液倒入200ml冰水中,有黄色固体产生,过滤,滤饼100ml水洗,50ml乙酸乙酯打浆,过滤干燥得黄色固体4.50g,收率84.43%,hplc测试365nm纯度99.74%,其中异构体(3e,6z)-3-苯亚甲基-6-(5-叔丁基-1h-咪唑-4-基)氘代亚甲基)哌嗪-2,5-二酮为0.09%。1hnmr(500mhz,dmso-d6)δ:12.31(s,1h),12.22(s,1h),10.00(s,1h),7.84(s,1h),7.52(d,j=8hz,2h),7.39(t,j=8hz,2h),7.32(t,j=8hz,1h),6.86(s,1h),6.73(s,1h),1.37(s,9h)。
[0032]
hplc方法条件:
[0033]
仪器:高效液相色谱仪配备二极管阵列检测器。
[0034]
色谱柱:ymc-pack pro c18 250
×
4.6mm,5μm。
[0035]
流动相a:乙腈溶液。
[0036]
流动相b:1%冰醋酸水溶液。
[0037]
检测波长:254nm;365nm。
[0038]
流速:1.0ml/min。
[0039]
进样量:10μl。
[0040]
柱温:30℃。
[0041]
运行时间:40min。
[0042]
流动相比例:流动相a/流动相b=40/60。
[0043]
实施例2
[0044]
(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮的制备
[0045][0046]
在500ml玻璃反应瓶内,加入实施例1中纯度为99.74%(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮1.0g和100ml四氢呋喃,室温条件下搅拌溶解,在365nm紫外灯(300w)照射下搅拌72小时,反应过程中取样hplc监测,待(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮剩余45%时反应达到平衡,将反应液减压浓缩至干得黄色固体1.03g。对固体尝试采用各种溶剂结晶。部分溶剂因其溶解度较好不易于析晶,如dmf、dma、dmso等;部分溶剂因溶解度差又不利于结晶,如乙酸乙酯、二氯甲烷、正己烷、甲基叔丁基醚等。经筛选几种适合结晶且易得溶剂,进行结晶纯化试验,如下表所示,试验过程中注意避光操作。
[0047]
[0048][0049]
其中甲醇、二氧六环和乙腈单独使用对异构体纯化有效果,当与水作为混合溶剂时,可很好提高异构体杂质纯度。而经过筛选乙腈效果最好,其与水的混合溶剂将异构体杂质提高到99.9%以上纯度,且溶剂用量较少,总收率达到31.9%,该化合物可作为杂质对照品使用。1hnmr(500mhz,dmso-d6)δ:12.29(s,1h),12.05(s,1h),10.73(s,1h),7.83(s,1h),7.54(d,j=7.6hz,1h),7.28(t,j=7.4hz,1h),7.23(t,j=7.3hz,1h),6.79(s,1h),6.52(s,1h),1.38(s,9h);
13
cnmr(125mhz,dmso-d6)δ:157.36,155.40,139.96,134.34,134.28,130.67,130.27,127.38,127.32,127.16,123.76,119.72,31.88,30.62;ms(esi):m/z337.17[m+h]
+
。
[0050]
实施例3
[0051]
(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮的制备
[0052]
称取纯度为99.74%(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮300mg加入到100ml玻璃反应瓶中,加入50ml乙腈,室温条件下搅拌溶解,黑色密闭环境中,使用365nm紫外灯(300w)照射下搅拌72小时,取样用hplc监测反应,(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮剩余43%,将反应液减压浓缩至干得黄色固体,将黄色固体100ml乙腈加热回流状态下溶解,保持温度滴加50ml纯化水,滴加完毕保持10min,自然降至室温搅拌析晶3小时,有淡黄色固体析出,过滤干燥得淡黄色固体93mg,收率为31%,hplc测试产物纯度为99.87%。
[0053]
实施例4
[0054]
(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮的制备
[0055]
称取纯度为99.74%(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮300mg加入到100ml玻璃反应瓶中,加入60ml丙酮,室温条件下搅拌溶解,黑色密闭环境中,使用365nm紫外灯(300w)照射下搅拌72小时,反应过程中取样hplc监测反应,(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮剩余56%,将反应液减压浓缩至干得黄色固体,将黄色固体用100ml乙腈加热回流状态下溶解,保持温度滴加50ml纯化水,滴加完毕保持10min,自然降至室温搅拌析晶3小时,有淡黄色固体析出,过滤干燥得淡黄色固体96.5mg,收率为32.1%,hplc测试产物纯度为98.73%。
[0056]
实施例5
[0057]
(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮的制备
[0058]
称取纯度为99.74%(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮300mg加入到100ml玻璃反应瓶中,加入60ml1,4-二氧六环,室温条件下搅拌溶解,黑色密闭环境中,使用365nm紫外灯(300w)照射下搅拌72小时,反应过程中取样hplc监测反应,(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮剩余52%,将反应液减压浓缩至干得黄色固体,将黄色固体100ml乙腈加热回流状态下溶解,保持温度滴加50ml纯化水,滴加完毕保持10min,自然降至室温搅拌析晶3小时,有淡黄色固体析出,过滤干燥得淡黄色固体100.2mg,收率为33.4%,hplc测试产物纯度为98.34%。
[0059]
实施例6
[0060]
(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮的制备
[0061]
称取纯度为99.74%(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮300mg加入到100ml玻璃反应瓶中,加入60ml1,4-二氧六环,室温条件下搅拌溶解,黑色密闭环境中,使用254nm紫外灯(300w)照射下搅拌120小时,反应过程中取样hplc监测反应(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮剩余61%,将反应液减压浓缩至干得黄色固体,将黄色固体用100ml乙腈加热回流状态下溶解,保持温度滴加50ml纯化水,滴加完毕保持10min,自然降至室温搅拌析晶3小时,有淡黄色固体析出,过滤干燥得淡黄色固体98.3mg,收率为32.8%,hplc测试产物纯度为95.82%。
[0062]
实施例7
[0063]
(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮在黄光下的反应活性测试。
[0064]
称取纯度为99.74%(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮50mg加入到25ml玻璃反应瓶中,加入10ml四氢呋喃,室温条件下搅拌溶解,在黑色密闭环境中,使用589.0nm黄光灯(300w)照射下搅拌72小时,取样hplc检测(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮占比为2.13%,证明plinabulin对黄光较为敏感,但转化率较低。
[0065]
实施例8
[0066]
(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮在可见光下的反应活性测试。
[0067]
称取纯度为99.74%(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮50mg加入到25ml玻璃反应瓶中,加入10ml四氢呋喃,室温条件下搅拌溶解,日光灯(300w)氛围下照射下搅拌72小时,取样用hplc检测,(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮占比为18.7%,证明plinabulin对可见光敏感,但转化率较低。
[0068]
实施例9
[0069]
(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮在
避光条件下的反应活性测试。
[0070]
称取纯度为99.74%(3z,6z)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮50mg加入到25ml玻璃反应瓶中,加入10ml四氢呋喃,室温条件下搅拌溶解,避光条件下搅拌72小时,取样hplc检测,(3z,6e)-3-[(5-叔丁基-1h-咪唑-4-基)亚甲基]-6-(苯亚甲基)-2,5-哌嗪二酮占比为0.10%,证明plinabulin溶液避光条件下比较稳定,不能转化为异构体。
[0071]
实施例10
[0072]
nci-h460细胞增殖抑制实验
[0073]
1)细胞培养及受试化合物准备
[0074]
人大细胞肺癌细胞nci-h460置于含10%热灭活fbs(胎牛血清)、2mm左旋谷氨酰胺、100u/ml青霉素和100g/ml链霉素rpmi-1640培养基中,37℃和5%co2细胞培养箱中培养。每两天换液一次,细胞80%融合后,胰酶消化,传代,保持细胞在良好的对数生长期。所有待测样品均溶解于dmso中。
[0075]
2)检测方法:
[0076]
处于对数生长期的nci-h460细胞以5000个/孔(180μl/孔)接种于96孔板,培养24h后,加入待测样品(终浓度如表所示),每个样品设3个复孔。溶剂对照组dmso用量以受试组所用的最大剂量的计算比例为准。药物作用72h后,每孔加入50%(m/v)冰冷三氯乙酸(tca)固定细胞,srb染色后,加入150μl/孔tris溶液,于酶标仪上测定540nm处od值,计算所测试化合物对nci-h460细胞株ic
50
值。测试数据如下:
[0077]
表1本发明化合物对nci-h460细胞增殖抑制试验
[0078][0079]
注:nci-h460为人肺癌细胞株,plinabulin为阳性对照。对照组为未加样品dmso;空白组为未加dmso和样品。
[0080]
表1数据显示化合物pln-a在抑制nci-h460肺癌细胞增值方面的活性显著低于plinabulin。
[0081]
实施例11
[0082]
bxpc-3细胞增殖抑制试验
[0083]
通过srb分析方法测定本发明化合物对胰腺癌肿瘤细胞bxpc-3生长抑制率。
[0084]
1)细胞培养及受试化合物准备
[0085]
人胰腺癌细胞bxpc-3置于含10%热灭活fbs(胎牛血清)、2mm左旋谷氨酰胺、100u/ml青霉素和100g/ml链霉素dmem培养基中,37℃和5%co2细胞培养箱中培养。每两天换液一
次,细胞80%融合后,胰酶消化,传代,保持细胞在良好的对数生长期。所有待测样品均溶解于dmso中并0.22μm过滤除菌。
[0086]
2)检测方法:
[0087]
处于对数生长期bxpc-3细胞分别以4,000个/孔(180μl/孔)接种于96孔板,培养24h后,加入不同浓度待测样品(终浓度为50nm、25nm、12.5nm、6.25nm、3.12nm和1.56nm),每个浓度设4个复孔。溶剂对照组dmso用量以受试组所用最大剂量0.1%为准。药物作用72h后,每孔加入50%(m/v)冰冷三氯乙酸(tca)固定细胞,srb染色后,加入150μl/孔的tris溶液,于酶标仪上测定540nm处od值,计算所测试化合物对bxpc-3细胞株ic
50
值。测试结果如下:
[0088]
表2本发明化合物对bxpc-3细胞增殖抑制试验
[0089][0090]
注:bxpc-3为人胰腺癌细胞株,plinabulin为阳性对照,对照组为未加样品dmso;空白组为未加dmso和样品。
[0091]
表2数据显示化合物pln-a在抑制bxpc-3胰腺癌细胞增殖方面明显不如plinabulin活性好。
[0092]
本发明化合物在bxpc-3胰腺癌细胞以及nci-h460肺癌细胞抑制方面活性研究结果以及初步药学研究结果,发现本发明plinabulin异构体杂质在抗肿瘤活性方面明显不如plinabulin活性高。因此控制好该异构体杂质含量,并对其进行结构确证和详细研究,才能更好保证plinabulin的质量。
[0093]
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1