一种高效的tRNA甲基化酶抑制剂筛选方法
一种高效的trna甲基化酶抑制剂筛选方法
技术领域
1.本发明涉及生物医药技术领域,具体涉及一种高效的trna甲基化酶抑制剂筛选方法。
背景技术:
2.小分子药物筛选是药物发现的基础,药物发现过程经历了体内表型筛选、组织和器官表型筛选、基于分子靶点的筛选以及体外表型筛选等发展过程。20世纪初,随着合成和药物化学的发展,基于整体动物的表型筛选得到了迅速发展;50~60年代,由于对酶和酶动力学研究的不断深入,基于组织和器官的表型筛选得到了迅速发展;70年代,酶动力学的方法学研究延伸应用到受体药理学,受体药理学逐渐成为药物发现的热点研究领域;80年代后期,分子生物学和基因组学的发展开启了基于分子靶点的药物发现时代;20世纪90年代,组合化学迅速发展,极大地促进了高通量筛选的发展。近年来,随着细胞生物学、分子药理学、病理生理学和计算机技术等学科的发展与交叉,药物作用机制被不断阐明,促使药物筛选由整体动物水平转变为体外水平的检测实验。
3.先导化合物的发现是药物创新的源头,能否发现新颖且成药性好的先导化合物,直接关系到一个药物创新项目的成败,高通量筛选是先导化合物发现的主要手段之一。通过初步筛选出先导化合物后,研究者将基于结构导向等抑制剂设计理念,优化合成一系列衍生物,改善和设计新型骨架化合物。
4.其中,虚拟筛选、相似性搜索结合生物活性测定,荧光偏振技术等药物初步筛选方法被广泛应用。例如,荧光偏振技术应用于m6a修饰fto蛋白小分子抑制剂筛选,通过分析荧光偏振值,发现了非甾体抗炎药甲氯芬那酸(ma)可用于抑制fto的去甲基化。然而,荧光偏振技术等筛选方法存在着弊端,例如,由于化合物颜色干扰或其他原因,可能会出现一些假阳性化合物也会导致荧光偏振值偏低。除此之外,基于结构的虚拟筛选更是被广泛使用。虚拟筛选通过大分子靶点的三维结构和上百万个小分子的对接,将预测结果打分进行排列,排在前0.1~2.5%的小分子进行下一步的分析和实验验证。虚拟筛选的优点是只需取打分靠前的化合物进行测试。但虚拟筛选也存在着其不确定性,首先,虚拟筛选需要受体的三维结构,且受体具有柔性;其次,虚拟筛选打分存在不确定性,因此往往会漏掉一些潜在的化合物。再者,在数据库中选择多大部分的化合物能得到活性小分子也存在不确定性,也存在较大可能导致选择失败。
5.表观遗传学是指基于非基因序列改变所致的基因表达水平变化,是遗传物质dna或染色质的修饰,但这种修饰并不会改变原有的核苷酸序列。近年来,rna修饰逐渐成为研究热点,越来越多的研究发现,rna上的转录后修饰异常被揭示与肿瘤等疾病的发生发展密切相关,研究最多的rna表观遗传修饰主要包括m1a,m5c,m6a,m7g等。随着这些表观遗传修饰可逆的规律以及参与修饰过程的关键因子逐步被揭示,目前,dna甲基化抑制剂(dnmt抑制剂)和组蛋白去乙酰化酶抑制剂(hdac抑制剂)已部分投入临床使用并取得一定疗效,但rna修饰相关的表观遗传药物研究目前处于初级阶段,开发针对rna修饰的表观遗传药物以用
于异常rna修饰的逆转具有较好的前景,是一种潜在的癌症治疗策略。因此,建立高通量药物筛选模型靶向rna修饰过程筛选能抑制rna修饰相关等小分子先导化合物,对于后续药物研发至关重要。
6.本发明公开的一种高效的trna甲基化酶抑制剂筛选方法,相比于荧光偏振技术等上述目前已存在的高通量筛选先导化合物方法,通过在体外构建并优化rna相关表观遗传修饰反应(如体外甲基化反应)体系,通过体系中加入待筛选化合物进行反应,结合dot blot技术使用特定抗体直接可视化药物筛选结果,提供了一种简便有效,低成本且特异性强的一种高效的trna甲基化酶抑制剂筛选方法。通过本发明揭示的高效先导化合物用于后续进一步细胞,分子等体内实验验证,对促进其功能、机制研究与药物发现研究具有重要意义。
7.用标记的特异性抗体对组织切片或细胞标本中某些化学成分的分布和含量进行组织和细胞原位定性、定位或定量研究的技术称为免疫组织化学(ihc)或者免疫细胞化学(icc)。免疫组化具有特异性强、灵敏度高、定位准确等特点。
8.以往,对组织或细胞中rna中的甲基化水平进行检测,常广泛使用液相色谱-串联质谱法(lc-ms/ms)等方式定量检测甲基化修饰水平;也有相关文献通过northwestern blot实验使用相关修饰特定抗体,半定量检测rna甲基化修饰水平的变化等。另外,体外甲基化反应后,甲基化酶活性和甲基化修饰水平的改变常通过检测甲基化产物sah的水平进而定量。以上方法均具有其可行性,但他们均需在检测筛选结果前期从反应后溶液中提取rna并进行相应处理,步骤较为繁琐。dot blot是生物学实验中常用的检测和分析方法,可做半定量分析,耗时短操作简便。将待测样品滴加到纤维素膜(或尼龙膜、nc膜)上,然后通过烘烤或紫外线照射来固定样品,用探针进行杂交,然后清洗(除去未接合的探针),放射自显影,通过显影斑点的有无及颜色的深浅来判断是否有目标产物。在操作流程中,关键步骤是加样如果加样时操作失误,可能会使得反应物在膜上扩散,使显影后的区域呈现出非斑点状,影响实验结果的美观,还会因为样品的分散,干扰结果分析,也会影响到结果分析的准确性。严重的样品扩散会导致样品孔之间交叉污染,直接导致实验结果的不准确或实验失败。多管吸印仪能减少实验过程的失误,提高成功率,但会使得操作步骤繁琐,引入更多误差因素。
9.本发明项通过dot blot技术,直接有效地转移rna体外甲基化反应溶液至尼龙膜,通过特异的抗原抗体反应半定量检测在不同小分子化合物影响下,rna甲基化修饰水平的改变。这不仅大大简化了繁琐的配胶,电泳,转膜等实验操作,同时也有效避免了该过程中rna的降解,减少了实验误差,操作较为方便,有一定的推广价值,有利于后续针对不同化合物库进行大批量的小分子抑制剂筛选。
技术实现要素:
10.本发明的目的在于提出一种高效的trna甲基化酶抑制剂筛选方法,以解决现有技术中所存在的一个或多个技术问题,至少提供一种有益的选择或创造条件。为实现上述技术目的,本发明技术方案如下:
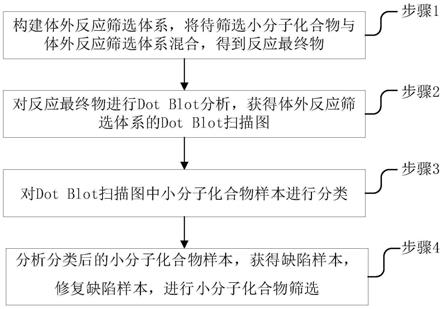
11.一种高效的trna甲基化酶抑制剂筛选方法,所述方法包括以下步骤:
12.构建带有his标签的质粒获得重组质粒,将重组质粒转化进入感受态细胞中;将带
有感受态细胞的菌液涂布到固体培养基中,孵育过夜,加入iptg,诱导蛋白表达;纯化获得的蛋白;配制甲基化缓冲液和trna-phe gaa储存液,混合前述纯化后的蛋白、甲基化缓冲液和trna-phe gaa储存液、甲基供体sam,rna酶抑制剂rnasin,无酶水获得酶反应复合物;在孔板的每孔中加入trna甲基化酶抑制剂和酶反应复合物,震荡斡旋,混匀离心后在pcr仪中孵育,之后加热使酶失活,之后置于冰上;每孔加入10x ssc溶液,得到反应最终物。
13.对每孔中的反应最终物进行dot blot分析,扫描dot blot的膜片获得体外反应筛选体系的dot blot扫描图,每个孔中的反应最终物对应一个trna甲基化酶抑制剂或者空白对照,每个孔中的反应最终物作为一个样本,dot blot的膜片可以是纤维素膜或尼龙膜、nc膜。
14.一种高效的trna甲基化酶抑制剂筛选方法,所述方法还包括对dot blot扫描图中小分子化合物样本进行分类和分析分类后的小分子化合物样本,获得缺陷样本,修复缺陷样本,进行小分子化合物筛选。
15.其中,对dot blot扫描图中小分子化合物样本进行分类的子步骤为:
16.通过边缘检测算子对灰度化的dot blot扫描图进行边缘检测,边缘检测得到的边缘曲线将扫描图分为多个封闭区域,使所有封闭区域中积大于0.8x的封闭区域构成封闭集合a,x为孔板底部开孔的大小,获得对照样品的灰度值为gbg;背景区域指没有加入任何试剂的膜片区域或者trna甲基化酶抑制剂的空白对照孔;
17.封闭区域集合a={gryi},i<n,n为膜上测试点的数量,gryi为膜上第i个点;获取封闭区域集合a中所有封闭区域中孔板对应膜片区域的像素点灰度值的极值,最大值gmax与最小值gmin与平均值gavg,gmin∈[0,255],gmax∈[0,255],gavg∈[0,255],gmax>gavg,gmin<gavg;
[0018]
设置第一条件和第二条件:
[0019]
第一条件:如果abs(gavg-gmin)>abs(gavg-gmax)则设置第一灰度阈值为gmin+(gmax-gavg),否则设置第一灰度阈值为(gmin+gmax
×
gmin/gavg);封闭区域中所有像素的灰度值的算术平均值超过第一阈值;
[0020]
第二条件:封闭区域的边缘长度arc>log
10
(cd)
×
exp(d/2);
[0021]
其中,cd为封闭区域的圆正度,cd=s
×
4π/(d/2)2,式中d为dot blot孔板底部开孔的直径,s为封闭区域的面积,π取3.14,log10()为以10为底的对数函数,exp()为以自然对数为底的指数函数;
[0022]
步骤3.1,初始化空集合第一集合upa和第二集合dwa,把封闭区域集合a中符合第一条件或者第二条件的封闭区域并放入第一集合upa,把封闭区域集合a中同时不符合第一条件和第二条件的封闭区域放入第二集合dwa;
[0023]
步骤3.2,输出第一集合upa和第二集合dwa。
[0024]
进一步地,分析分类后的小分子化合物样本,获得缺陷样本,修复缺陷样本,进行小分子化合物筛选的子步骤为:
[0025]
步骤4.1,遍历第一集合upa中的封闭区域,如果封闭区域内像素的灰度值的最大值与最小值的差值大于2gavg,且封闭区域内存在空泡则把当前封闭区域标记为需要执行修复操作;
[0026]
其中空泡指试剂没有覆盖的区域或者试剂不足或过量导致反应没有正常发生的
区域;判断是否存在空泡的方法为对选定的封闭区域进行边缘识别,根据获得的边缘线得到封闭区域内的子区域,如果所有所述子区域的总面积大于0.1x且子区域的像素的灰度值均小于g2avg;
[0027]
遍历第二集合dwa中的封闭区域,检测封闭区域的几何中心点到当前封闭区域边缘最远的距离是否大于sqrt(g2max-gmin)
×
d/2,如果符合则跳则把当前封闭区域标记为需要执行修复操作;其中g2max为当前封闭区域中像素的灰度值最大值,g2avg为当前封闭区域中像素的灰度值的平均值;
[0028]
dot blot检测会被溶剂影响和其他因素影响,反应物在膜上可能不能均匀分布,样本点样表现出来的斑点不均匀,使得简单应用imagej程序图像识别自动分析膜上的斑点不准确,因此需要对每个trna甲基化酶抑制剂的斑点进行处理,剔除干扰的不均匀斑点并尝试修复,如果不能修复则需要手工鉴别。
[0029]
步骤4.2,对标记为需要执行修复操作的封闭区域进行修复操作,具体为;
[0030]
步骤4.2.1,对封闭区域进行边缘识别,根据获得的边缘线得到封闭区域内的封闭子区域,一个子区域的几何中心点到所在封闭区域的几何中心点的欧氏距离dx,封闭区域的几何中心点到一个子区域边缘的最大值smax和最小值smin,取得最大值的点pmax和最小值的点pmin;
[0031]
步骤4.2.2,如果smax>sqrt(dx
×
pmin)
×
exp(smax/smin)且d(pmax,pmin)>mean(dx)则把封闭子区域从当前封闭区域剔除,剔除封闭子区域指把封闭子区域从当前封闭区域中移除,不参与后续步骤的统计;d(pmax,pmin)为获得点pmax和点pmin的直线距离,sqrt()为取平方根操作,exp()为以自然对数为底的指数函数,mean(dx)为取所有封闭子区域的几何中心点到封闭区域的几何中心点的距离的平均值;
[0032]
步骤4.2.3,重复步骤4.2.2直到封闭区域内的封闭子区域被遍历完成。
[0033]
步骤4.3,第一集合upa和第二集合dwa中灰度值小于抑制剂阈值的封闭区域对应的trna甲基化酶抑制剂为有效,具体为:
[0034]
选定一个有效样本,有效样本可以来自同一个膜上对照的有效trna甲基化酶抑制剂也可以选自封闭集合a中的封闭区域,使有效样本中的像素灰度值的最大值为gcmax,使有效样本中的像素灰度值的中位数为gcmed,如果一个封闭区域的像素点的灰度值最大值大于gcmax且封闭区域的像素点的灰度值的中位数大于gcmed+gmin,则标记此封闭区域的对应反应最终物中的trna甲基化酶抑制剂无效,如果此封闭区域在步骤4.2中被标记为无效子区域则判定此封闭区域的trna甲基化酶抑制剂的dot blot测试无效;如果膜片上有反应最终物的位置但不包括在封闭区域集合a中的封闭区域,即步骤3中没有被边缘检测到的区域或者此反应最终物的位置不包含在封闭区域集合a中的任意封闭区域,则膜片上有反应最终物的位置对应的trna甲基化酶抑制剂有效。
[0035]
dot blot测试无效的样本需要重新配制溶液或者人工判断,有可能是斑点的色斑分布不均,偏离中心点太远,或者溶剂/稳定剂选择不合适。
[0036]
一种高效的trna甲基化酶抑制剂筛选系统,所述系统包括:
[0037]
图像截取模块:用于获取dot blot扫描图;
[0038]
数据处理模块:用于对dot blot扫描图中小分子化合物样本进行分类,分析分类后的小分子化合物样本获得缺陷样本,修复缺陷样本,进行小分子化合物筛选。
[0039]
第三方面,本发明提供一种计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现本发明第一方面提供的所述方法的步骤。
[0040]
第四方面,本发明提供一种电子设备,包括:存储器,其上存储有计算机程序;处理器,用于执行所述存储器中的所述计算机程序,以实现本发明提供的所述方法的步骤。
[0041]
与现有技术相比,本发明具有以下有益的技术效果:
[0042]
本发明中使用的体外反应筛选体系,所需的纯化蛋白通过单质粒多基因共表达策略获得,高效地实现了在单个质粒中对酶复合物中的酶与辅酶共表达,实现了有效结合及共同作用,有利于还原两者天然条件下形成的构象,以及更好地实现其催化功能。之前常用的双质粒共表达系统,需要将2个外源基因分别构建到不同载体中,再将2个载体在大肠杆菌中的共同表达来实现2个外源基因的共表达,而使用单质粒多基因共表达多顺反子系统,只要成功将外源基因成功连接到表达载体中就能稳定传代,且不需要2种抗生素同时存在,在蛋白表达过程中不须考虑太多因素。
[0043]
本发明首次将优化好的微量体外甲基化反应体系及dot blot技术结合,成功建立了一个微量高效的化合物筛选模型,可以直观且快速地筛选出对甲基化反应有抑制作用的化合物。与以往需要精确定量甲基化水平常用的高效液相色谱技术相比,我们建立的筛选模型不需要使用昂贵复杂的仪器,成本低,操作简单易学,结果分析有较好的灵敏度,具有一定的推广应用价值。
附图说明
[0044]
为了使本领域的技术人员更好地理解本发明的技术方案,下面通过对结合附图所示出的实施方式进行详细说明,本发明的上述以及其他特征将更加明显,本发明附图中相同的参考标号表示相同或相似的元素,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图,在附图中:
[0045]
图1为本发明提供的一种高效的trna甲基化酶抑制剂筛选方法的流程图;
[0046]
图2为一个实施例的dot blot实验结果扫描图。
具体实施方式
[0047]
为了使本发明的目的、技术方案及优点更加清晰,以下结合附图及实施例,对本发明进行进一步详尽说明。此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
[0048]
同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明上述内容做出的一些非本质的改进和调整均属于本发明的保护范围。下述示例具体的工艺参数等也仅是合适范围内的一个示例,即本领域技术人员可以通过本文的说明做合适的范围内选择,而并非要限定于下文示例的具体数值。
[0049]
以下示例性地说明本发明提供的一种高效的trna甲基化酶抑制剂筛选方法。如图1所示为一种高效的trna甲基化酶抑制剂筛选方法的流程图,下面结合图1来阐述根据本发明的实施方式的一种高效的trna甲基化酶抑制剂筛选方法,所述方法包括以下步骤:
[0050]
构建带有his标签的质粒获得重组质粒,将重组质粒转化进入感受态细胞中;将带有感受态细胞的菌液涂布到固体培养基中,孵育过夜,加入iptg,诱导蛋白表达;纯化获得的蛋白;配制甲基化缓冲液和trna-phe gaa储存液,混合前述纯化后的蛋白、甲基化缓冲液和trna-phe gaa储存液、甲基供体sam,rna酶抑制剂rnasin,无酶水获得酶反应复合物;在孔板的每孔中加入trna甲基化酶抑制剂和酶反应复合物,震荡斡旋,混匀离心后在pcr仪中孵育,之后加热使酶失活,之后置于冰上;每孔加入10x ssc溶液,得到反应最终物。
[0051]
对每孔中的反应最终物进行dot blot分析,扫描dot blot的膜片获得体外反应筛选体系的dot blot扫描图,每个孔中的反应最终物对应一个trna甲基化酶抑制剂或者空白对照,每个孔中的反应最终物作为一个样本,dot blot的膜片可以是纤维素膜或尼龙膜、nc膜。
[0052]
一种高效的trna甲基化酶抑制剂筛选方法,所述方法还包括对dot blot扫描图中小分子化合物样本进行分类和分析分类后的小分子化合物样本,获得缺陷样本,修复缺陷样本,进行小分子化合物筛选。
[0053]
进一步地,对dot blot扫描图中小分子化合物样本进行分类的子步骤为:
[0054]
通过边缘检测算子对灰度化的dot blot扫描图进行边缘检测,边缘检测得到的边缘曲线将扫描图分为多个封闭区域,使所有封闭区域中积大于0.8x的封闭区域构成封闭集合a,x为孔板底部开孔的大小,获得对照样品的灰度值为gbg;背景区域指没有加入任何试剂的膜片区域;
[0055]
封闭区域集合a={gryi},i<n,n为膜上测试点的数量,gryi为膜上第i个点;获取封闭区域集合a中所有封闭区域中孔板对应膜片区域的像素点灰度值的极值,最大值gmax与最小值gmin与平均值gavg,gmin∈[0,255],gmax∈[0,255],gavg∈[0,255],gmax>gavg,gmin<gavg;
[0056]
设置第一条件和第二条件:
[0057]
第一条件:如果abs(gavg-gmin)>abs(gavg-gmax)则设置第一灰度阈值为gmin+(gmax-gavg),否则设置第一灰度阈值为(gmin+gmax
×
gmin/gavg);封闭区域中所有像素的灰度值的算术平均值超过第一阈值;
[0058]
第二条件:封闭区域的边缘长度arc>log
10
(cd)
×
exp(d/2);
[0059]
其中,cd为封闭区域的圆正度,cd=s
×
4π/(d/2)2,式中d为dot blot孔板底部开孔的直径,s为封闭区域的面积,π取3.14,log10()为以10为底的对数函数,exp()为以自然对数为底的指数函数;
[0060]
步骤3.1,初始化空集合第一集合upa和第二集合dwa,把封闭区域集合a中符合第一条件或者第二条件的封闭区域并放入第一集合upa,把封闭区域集合a中同时不符合第一条件和第二条件的封闭区域放入第二集合dwa;
[0061]
步骤3.2,输出第一集合upa和第二集合dwa。
[0062]
进一步地,分析分类后的小分子化合物样本,获得缺陷样本,修复缺陷样本,进行小分子化合物筛选的子步骤为:
[0063]
步骤4.1,遍历第一集合upa中的封闭区域,如果封闭区域内像素的灰度值的最大值与最小值的差值大于2gavg,且封闭区域内存在空泡则把当前封闭区域标记为需要执行修复操作;
[0064]
其中空泡指试剂没有覆盖的区域或者试剂不足或过量导致反应没有正常发生的区域;判断是否存在空泡的方法为对选定的封闭区域进行边缘识别,根据获得的边缘线得到封闭区域内的子区域,如果所有所述子区域的总面积大于0.1x且子区域的像素的灰度值均小于g2avg;
[0065]
遍历第二集合dwa中的封闭区域,检测封闭区域的几何中心点到当前封闭区域边缘最远的距离是否大于sqrt(g2max-gmin)
×
d/2,如果符合则跳则把当前封闭区域标记为需要执行修复操作;其中g2max为当前封闭区域中像素的灰度值最大值,g2avg为当前封闭区域中像素的灰度值的平均值。
[0066]
dot blot检测会被溶剂影响和其他因素影响,反应物在膜上可能不能均匀分布,样本点样表现出来的斑点不均匀,使得简单应用imagej程序图像识别自动分析膜上的斑点不准确,因此需要对每个trna甲基化酶抑制剂的斑点进行处理,剔除干扰的不均匀斑点并尝试修复,如果不能修复则需要手工鉴别。
[0067]
步骤4.2,对标记为需要执行修复操作的封闭区域进行修复操作,具体为;
[0068]
步骤4.2.1,对封闭区域进行边缘识别,根据获得的边缘线得到封闭区域内的封闭子区域,一个子区域的几何中心点到所在封闭区域的几何中心点的欧氏距离dx,封闭区域的几何中心点到一个子区域边缘的最大值smax和最小值smin,取得最大值的点pmax和最小值的点pmin;
[0069]
步骤4.2.2,如果smax>sqrt(dx
×
pmin)
×
exp(smax/smin)且d(pmax,pmin)>mean(dx)则把封闭子区域从当前封闭区域剔除,剔除封闭子区域指把封闭子区域从当前封闭区域中移除,不参与后续步骤的统计;d(pmax,pmin)为获得点pmax和点pmin的直线距离,sqrt()为取平方根操作,exp()为以自然对数为底的指数函数,mean(dx)为取所有封闭子区域的几何中心点到封闭区域的几何中心点的距离的平均值;
[0070]
步骤4.2.3,重复步骤4.2.2直到封闭区域内的封闭子区域被遍历完成。
[0071]
步骤4.3,第一集合upa和第二集合dwa中灰度值小于抑制剂阈值的封闭区域对应的trna甲基化酶抑制剂为有效,具体为:
[0072]
选定一个有效样本,有效样本可以来自同一个膜上对照的有效trna甲基化酶抑制剂也可以选自封闭集合a中的封闭区域,使有效样本中的像素灰度值的最大值为gcmax,使有效样本中的像素灰度值的中位数为gcmed,如果一个封闭区域的像素点的灰度值最大值大于gcmax且封闭区域的像素点的灰度值的中位数大于gcmed+gmin,则标记此封闭区域的对应反应最终物中的trna甲基化酶抑制剂无效,如果此封闭区域在步骤4.2中被标记为无效子区域则判定此封闭区域的trna甲基化酶抑制剂的dot blot测试无效;如果膜片上有反应最终物的位置但不包括在封闭区域集合a中的封闭区域,即步骤3中没有被边缘检测到的区域或者此反应最终物的位置不包含在封闭区域集合a中的任意封闭区域,则膜片上有反应最终物的位置对应的trna甲基化酶抑制剂有效。
[0073]
dot blot测试无效的样本需要重新配制溶液或者人工判断,有可能是斑点的色斑分布不均,偏离中心点太远,或者溶剂/稳定剂选择不合适。
[0074]
一种高效的trna甲基化酶抑制剂筛选系统,所述系统包括:
[0075]
图像截取模块:用于获取dot blot扫描图;
[0076]
数据处理模块:用于对dot blot扫描图中小分子化合物样本进行分类,分析分类
后的小分子化合物样本获得缺陷样本,修复缺陷样本,进行小分子化合物筛选。
[0077]
实施例1
[0078]
本发明提供了一种高效的trna甲基化酶抑制剂筛选方法。根据本发明的实施例,体外trna m7g甲基化反应包括以下三大部分,具体步骤如下:
[0079]
第一部分:重组单质粒策略用于trna m7g甲基化酶复合物mettl1/wdr4的诱导、表达与纯化。
[0080]
s1.构建带有his标签的petduet
tm-1-hmettl1-his-hwdr4质粒,将重组质粒转化进入感受态细胞bl21(de3)中,将菌液均匀涂布到含氨苄青霉素的固体培养基中,37℃孵育过夜,挑取单克隆菌至6ml lb培养基中培养。
[0081]
s2.将上述6ml菌液加入600ml lb培养基中37度摇床摇菌2~3h,待od值达0.4~0.6,加入终浓度为200μm的iptg,20℃过夜诱导蛋白的表达。
[0082]
s3.petduet
tm-1-hmettl1-his-hwdr4重组蛋白的纯化:
[0083]
a.收集菌体:4000rpm离心10min收集菌液,用15ml预冷的bacteria lysis buffer重悬细菌沉淀。
[0084]
b.超声破碎细菌(冰浴,超声30s,间隔30s)20min,12000rpm 4℃离心30min,收集含有目的蛋白的上清液。
[0085]
c.目的蛋白与ni-nta琼脂糖柱的结合:提前用20ml预冷的bacteria lysis buffer洗涤50%ni-nta琼脂糖柱,将上述含有目的蛋白的上清液加入洗净后的琼脂糖柱中,4℃翻转孵育3小时。
[0086]
d.去除未结合的其他蛋白:加入低浓度的咪唑缓冲液洗涤柱子,颠倒混匀后4000rpm离心5min,弃上清。
[0087]
e.洗脱目的蛋白:琼脂糖柱中加入400μl预冷的elution buffer,4℃翻转使目的蛋白充分洗脱,重复3次,离心收集所有的洗脱液。
[0088]
f.透析:将洗脱液加入透析装置中,透析过夜。收集透析后的蛋白,-80℃储存备用。
[0089]
s4.通过sds-page和western blot检测和验证纯化后蛋白,使用mettl1抗体和wdr4抗体验证纯化后的蛋白。将成功诱导和纯化后的mettl1-wdr4蛋白,检测蛋白浓度后,于-80℃保存后续备用。
[0090]
第二部分:待筛选的小分子化合物与体外trna m7g甲基化反应体系混合。
[0091]
s5.配制10x甲基化缓冲液于-20℃保存(500mm tris-hcl ph7.4,50mm mgcl2,10mm dtt,500mm nacl)。从贝信生物公司购买合成的trna-phe gaa,根据试剂说明书溶解配制成储存液。
[0092]
s6.取出fda approved drug screening library(96-well)-z248691-l1300小分子化合物库,此化合物库小分子储存浓度为2mm,将其振荡混匀后,分别取4μl到新的96孔板中,加36μl的dmso混匀,得到稀释为200um的trna甲基化酶抑制剂,分别转移至新的96孔板,再从稀释板中各孔中取2μl至新的96孔板,做好标记。
[0093]
s7.以筛选其中化合物库l1300其中88个小分子化合物为例:取出从贝信生物公司购买合成的trna-phe gaa,第一部分纯化得到的mettl1/wdr4重组蛋白以及甲基供体sam,rna酶抑制剂rnasin,无酶水等试剂,下表为体外甲基化反应中单个化合物反应孔中各反应
物所需量,依照下表配制92个化合物反应孔所需的反应总量,于冰上混合。
[0094]
组成体积终浓度10x甲基化缓冲液2μl1x纯化的mettll1/wdr4蛋白
‑‑‑
0.6μg/孔sam5μl20μmrnasin0.1μl0.2u/μltrna-phegaa
‑‑‑
2pmol无酶水to a final of 18μl
‑‑‑
总量18μl
‑‑‑
[0095]
s8.混匀s7中配制好的总管,使用排枪,分别在s6中含2μl不同小分子化合物的96孔板每孔中加入18μl酶反应复合物,震荡斡旋,混匀离心后,将此96孔板转移至pcr仪中,28~37℃中孵育3小时,反应完成后,95℃加热5min使酶失活,终止trna体外m7g甲基化反应。
[0096]
第三部分:dot blot分析小分子化合物对trna m7g体外甲基化反应的影响
[0097]
s9.将上述96孔板中20μl甲基化反应产物于95℃变性5min,随后立即置于冰上。
[0098]
s10.上述溶液中每孔加入30μl 10x ssc溶液,混匀,使得终体积为50μl。同时,提前裁剪适宜大小的滤纸和尼龙膜并做好标记,用无酶水浸湿尼龙膜后,再转移至10x scc溶液中浸润15min,使膜充分激活。随后,安装好96孔bio-dot仪器备用,连接真空泵,检查装置气密性。若气密性好,则装置较安静,无大的气流声。
[0099]
s11.使用排枪,每孔加入200μl 10x溶液,将scc溶液转移至尼龙膜进行预杂交,打开真空泵,待膜完全干燥。
[0100]
s12.将上述的总的50μl含trna的反应溶液混匀,并转移至对应孔中,打开真空泵。
[0101]
s13.膜完全干燥后,每孔加入200μl 10x scc,再次打开真空泵抽吸孔中的液体,待干燥后,打开装置,立即将膜转移至紫外交联仪中,选择参数energy 2400,正反面交联各3次后,将膜放入5%牛奶中进行封闭。
[0102]
s12.封闭1h后,将尼龙膜转移至配制好的m7g抗体溶液中(1:3000in 5%bsa),4℃摇床过夜。隔日,洗膜后加入相应的二抗(anti-mouse,1:5000in 5%bsa),室温下孵育1h,洗膜后进行曝光。
[0103]
s14.小分子化合物对该trna体外甲基化反应的抑制效果可通过曝光显示的斑点强度体现。抑制效果越强的化合物,对应孔的斑点强度越弱。
[0104]
实验结果:原始数据见图2。
[0105]
实验结论:
[0106]
图2的dot blot结果的斑点强度显示了88个化合物对trna m7g体外甲基化反应的抑制效果。结果说明,该板中88个化合物中,化合物(a11)为筛选所需的目的药物,其余87个化合物对trna m7g体外甲基化反应的抑制效果不大,均不是筛选所需的目的药物。
[0107]
所述基于一种高效的trna甲基化酶抑制剂筛选系统可以运行于桌上型计算机、笔记本、掌上电脑及云端服务器等计算设备中。所述一种高效的trna甲基化酶抑制剂筛选系统,可运行的系统可包括,但不仅限于,处理器、存储器。本领域技术人员可以理解,所述例子仅仅是一种高效的trna甲基化酶抑制剂筛选系统的示例,并不构成对一种高效的trna甲基化酶抑制剂筛选系统的限定,可以包括比例子更多或更少的部件,或者组合某些部件,或
者不同的部件,例如所述一种高效的trna甲基化酶抑制剂筛选系统还可以包括输入输出设备、网络接入设备、总线等。
[0108]
所称处理器可以是中央处理单元(central processing unit,cpu),还可以是其他通用处理器、数字信号处理器(digital signal processor,dsp)、专用集成电路(application specific integrated circuit,asic)、现场可编程门阵列(field-programmable gate array,fpga)或者其他可编程逻辑器件、分立门或者晶体管逻辑器件、分立硬件组件等。通用处理器可以是微处理器或者该处理器也可以是任何常规的处理器等,所述处理器是所述一种高效的trna甲基化酶抑制剂筛选系统运行系统的控制中心,利用各种接口和线路连接整个一种高效的trna甲基化酶抑制剂筛选系统可运行系统的各个部分。
[0109]
所述存储器可用于存储所述计算机程序和/或模块,所述处理器通过运行或执行存储在所述存储器内的计算机程序和/或模块,以及调用存储在存储器内的数据,实现所述一种高效的trna甲基化酶抑制剂筛选系统的各种功能。所述存储器可主要包括存储程序区和存储数据区,其中,存储程序区可存储操作系统、至少一个功能所需的应用程序(比如声音播放功能、图像播放功能等)等;存储数据区可存储根据手机的使用所创建的数据(比如音频数据、电话本等)。此外,存储器可以包括高速随机存取存储器,还可以包括非易失性存储器,例如硬盘、内存、插接式硬盘,智能存储卡(smart media card,smc),安全数字(secure digital,sd)卡,闪存卡(flash card)、至少一个磁盘存储器件、闪存器件、或其他易失性固态存储器件。
[0110]
尽管本发明的描述已经相当详尽且特别对几个所述实施例进行了描述,但其并非旨在局限于任何这些细节或实施例或任何特殊实施例,从而有效地涵盖本发明的预定范围。此外,上文以发明人可预见的实施例对本发明进行描述,其目的是为了提供有用的描述,而那些目前尚未预见的对本发明的非实质性改动仍可代表本发明的等效改动。
[0111]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示意性实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
[0112]
尽管已经示出和描述了本发明的实施例,本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1