多种呼吸道病毒核酸质谱检测的引物组合、试剂盒及检测方法与流程
1.本发明涉及分子生物学检测技术领域。更具体地,涉及一种多种呼吸道病毒核酸质谱检测的引物组合、试剂盒及检测方法。
背景技术:
2.能够引起人类呼吸道感染的病原体种类多样,病毒是一个重要致病因素,约有80%的呼吸道感染由呼吸道病毒引起的。这一系列病毒种类繁多,其中最常见,最具有代表性的包括:正黏病毒科(orthomyxoviridae)的流感病毒(influenzaviruses,ifvs),副黏病毒科(paramyxoviridae)的呼吸道合胞病毒(respiratory syncytial virus,rsv),副流感病毒(parainfluenzaviruses,pivs),人偏肺病毒(humanmetapneumovims,hmpv),小rna病毒科(picornaviridae)的人鼻病毒(huamnrhinoviruses,hrvs),冠状病毒科(coronaviridae)的人冠状病毒(human coronaviruses,hcovs),腺病毒科(adenoviridae)的腺病毒(adenoviruses,advs),以及细小病毒科(parvoviridae)的人博卡病毒(human bocavirus,hbovs)。虽然呼吸道病毒的种类繁多,但其感染有着类似的特点。首先,呼吸道病毒的传染性都很强,非常容易在人群聚集的场所,如学校、医院传播。其次,呼吸道病毒感染引起的症状不特异,大多呈现为上呼吸道感染的症状,如普通感冒、咽喉炎等。第三,人群对于呼吸道病原体普遍易感,病毒变异速度快,由疫苗获得的免疫力并非长久有效,呼吸道感染容易反复发生。尤其2019新型冠状病毒传染性强,传播速度快,特别是免疫力低下者,如老年人,免疫抑制,基础病患者,有时更容易形成继发感染,对肺部及其他器官造成重大损伤,发展成重症,甚至危及生命。
3.对呼吸道病毒进行核酸检测,目前的主要方法是荧光定量rt-pcr方法。但是由于荧光通道的限制,一次只能检测1-2种病毒,而且每次的样本检测通量低,不利于临床快速准确大规模的进行病例筛查;ngs高通量测序也是检测病毒的一种重要技术,通过全测序可以实现病毒及亚型的准确鉴定,但是实验操作复杂,整体流程时间长,样本检测成本升高。因此对于呼吸道病原体的检测,必须要综合考虑检测重数与检测通量。
技术实现要素:
4.本发明的一个目的在于提供一种用于多种呼吸道病毒核酸质谱检测的引物组合及包含这些引物组合的检测试剂盒,提高对呼吸道病毒的筛查诊断能力。
5.本发明的另一个目的在于提供一种利用上述试剂盒进行多种呼吸道病毒核酸质谱检测的方法。该方法使得呼吸道病毒检测特异性强,灵敏度高。
6.为达到上述目的,本发明采用下述技术方案:
7.第一方面,本发明提供一种用于多种呼吸道病毒核酸质谱检测的引物组合,包括48条扩增引物和24条质量探针延伸引物,其中,扩增引物的核苷酸序列如seq id no.1-48所示,具体见表1;质量探针延伸引物的核苷酸序列如seq id no.49-72所示,具体见表2。
8.表1扩增引物序列
9.[0010][0011]
表2质量探针延伸(mpe)引物序列
[0012]
sequence alignment editor软件进行序列比对,主要对比关键基因,如sars-cov-2的n,orf1ab等,选择种内保守,种间特异的靶基因进行检测(见表3),并选取人rnasep和hbb为内参。
[0053]
采用primer3在线网页进行多重的pcr引物设计。具体扩增引物见上面的表1。选定检测突变位点,采用基因位点分型系统软件(融智生物科技(青岛)有限公司)进行质量探针延伸(mpe)引物设计,具体见上面的表2。设计完成的pcr引物和mpe引物,分别由生工生物工程(上海)股份有限公司进行质粒合成和引物合成。
[0054]
表3病原体对应检测的靶基因
[0055][0056]
实施例2检测方法建立
[0057]
1.质粒稀释。
[0058]
使用水对质粒干粉进行稀释到100ng/ul,并用nanodrop进行准确定量。根据质粒序列来计算质粒中含有拷贝数。在实验中使用的有多种浓度,分别有105copies/μl,104copies/μl,103copies/μl,102copies/μl,101copies/μl,100copy/μl。
[0059]
2.引物稀释和混合。
[0060]
配置pcr引物混合液:将实施例1的pcr引物序列送生工合成后,使用水将干粉溶解
成100μm的储存液。储存液取出混合,配置成每个位点引物终浓度0.5μm-5μm范围的引物混合液。
[0061]
配置mpe引物混合液:将实施例1的质量探针延伸引物序列送生工合成后,使用水将干粉溶解成500μm的储存液。将引物储存液取出混合,配置成每个位点引物终浓度5μm-15μm范围的引物混合液。
[0062]
3.rt-pcr反应
[0063]
(1)利用核酸检测试剂盒(病原微生物)(qt-sj12-rts)配置rt-pcr体系,具体见表4。
[0064]
表4 rt-pcr体系配置表
[0065]
试剂组分体积(μl)rt-pcr酶1rt-pcr缓冲液12.5pcr引物混合液5模板6.5total25
[0066]
(2)按表5运行rt-pcr程序。
[0067]
表5 rt-pcr温控反应程序
[0068][0069]
(3)反应结束后,取出5μl扩增产物进行后续实验反应。
[0070]
4.虾碱性磷酸酶(sap)去磷酸化处理
[0071]
(1)利用核酸检测试剂盒(病原微生物)(qt-sj12-rts)配置sap反应体系。按表6配置sap反应液。
[0072]
表6 sap体系配置表
[0073]
[0074][0075]
表6 sap体系配置表
[0076]
(2)将2μl sap反应液加入到上一步取出的5μl扩增产物中,放置到pcr仪上运行sap去磷酸化反应。
[0077]
表7 sap温控反应程序
[0078]
反应温度时间37℃40min85℃5min4℃hold
[0079]
5.mpe质量探针延伸
[0080]
(1)利用核酸检测试剂盒(病原微生物)(qt-sj12-rts)配置mpe反应体系。按表8配置mpe反应液。
[0081]
表8 mpe体系配置表
[0082]
试剂组分体积(μl)mpe酶0.6mpe缓冲液1.4e_ddntpmix1mpe引物混合液1total4
[0083]
(2)将4μl mpe反应液加入到上一步的7μl去磷酸化产物中,放置到pcr仪上运行mpe反应。
[0084]
表9 mpe温控程序
[0085][0086]
6.树脂脱盐纯化和靶板点样。
[0087]
(1)在每个反应孔中加入14μl去离子水。
[0088]
(2)把装有树脂的八连管轻轻翻转过来扣在样品板上,保证树脂孔与样品的每个孔对齐。然后轻敲树脂管,使树脂落入样本板的孔中。
[0089]
(3)将带有树脂的样品板放置在翻转混匀仪中,20rpm混匀30min。
[0090]
(4)混匀结束后,样品2000rpm离心1min,取上清液2μl与等体积基质液混合。
[0091]
(5)取混合液1μl点在靶板上。
[0092]
7.靶板采集和数据分析。
[0093]
(1)按照quantof 1仪器使用说明,把基质和样本共结晶的靶板加载到仪器中,真空度达到要求后(ba gauge优于2e-6torr),进行数据采集。仪器的采集模式为线性正离子模式,重要的参数设定为:accelerate voltage:20kv、mass range:3000-11000da、laser frequency:3000hz、shots/spectrum:800、激光能量:24uj。
[0094]
(2)采集完成后,点击分析,软件会给出每个样本每个位点的延伸,可以查看样本的检测结果。重要的参数设定为:snr:4.0。
[0095]
实施例3特异性实验
[0096]
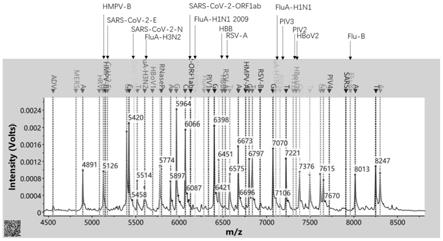
1.引物组合无模板扩增验证引物特异性。首先使用水代替样本模板,参见实施例2运行rt-pcr反应到树脂脱盐纯化的实验全流程,这一步是验证多重pcr扩增引物和多重mpe引物之间没有二聚体,无非特异性扩增延伸产物,保证引物设计的特异性。实验结果见图1。
[0097]
2.使用混合质粒验证引物特异性。每个病原体对应的一组pcr设计引物和mpe引物,理论上只有该阳性质粒存在时,才能有延伸结果。因此分别加入单重病原体质粒,浓度是10^5copies/μl,验证结果除了对应位点有延伸产物,其他位点无产物检出。
[0098]
3.使用其他病原体验证引物特异性。能够导致呼吸道感染的还有细菌(肺炎链球菌,肺炎克雷伯菌等),肺炎支原体,衣原体等。本次实验使用了纯菌培养的肺炎支原体提取核酸,验证测试了没有任何靶标检出,因此保证了其他病原微生物不会非特异性地报出错误的检测结果。
[0099]
实施例4灵敏度、精密度和准确度实验
[0100]
(1)灵敏度验证
[0101]
分别使用水对实施例1制备的单个质粒进行10倍浓度梯度稀释,浓度分别为105copies/μl,104copies/μl,103copies/μl,102copies/μl,101copies/μl,100copy/μl。六个浓度的质粒模板分别进行扩增和延伸。绝大部分位点在102copies/μl能全部检出,而且有一半的位点在10copies/μl时仍有明显扩增。其中sars-cov-2-n仅在105copies/μl及以上浓度时有扩增,为了提高n的反应效率,进行了引物浓度优化。最后结果是20种病毒的检测下限在10-100copies/μl之间。具体见表10。
[0102]
表10各病原体位点的检测下限
[0103]
[0104][0105]
(2)精密度验证
[0106]
使用混合质粒浓度100copies/μl,每次实验3个重复,连续2周共完成5次重复实验,24个产物都能检出,检测结果稳定。见图2。
[0107]
(3)准确性验证
[0108]
对收到的3份已提取好的核酸样本,并已用荧光qpcr方法鉴定到为adv,flua和flub阳性样品,采用本发明实施例2的方法进行检测,结果是阳性全部检出,且flua阳性能成功定位到h3n2亚型。结果见图3-图6。
[0109]
实施例5样本检测
[0110]
从医院获取2份流感阳性的咽拭子样本,采用凯杰病毒提取试剂盒(viral rna mini kit(52904))进行核酸提取,依照实施例2的方法进行了呼吸道病毒核酸质谱检测。
[0111]
结果1号样本flua-h1n12009阳性,见图7和图8。2号样本-rsv-b阳性,见图9。说明引物组准确性好,特异性高。
[0112]
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发
明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1