一种血浆外泌体提取试剂、富集方法、提取试剂盒及其应用与流程
1.本发明公开了一种血浆外泌体提取试剂,具体的公开了一种血浆外泌体提取试剂、富集方法、提取试剂盒及其应用。
背景技术:
2.外泌体,是一种直径约30-150nm的双层脂膜囊泡状结构的分泌小体。大多数的真核细胞通过分泌作用都可以形成外泌体,细胞通过外泌体可以传递信号分子,包括蛋白质、脂类、以及核酸。在细胞间信号传导中,外泌体还可通过配体-受体识别作用,特异性结合靶细胞。目前外泌体提取方法主要有以下几种:超速离心法、磁珠免疫法、超滤法。
3.1.超速离心法是最常使用的外泌体提取方法。主要操作步骤如下:(1)低速离心(300xg)去除细胞;(2)高速离心(16,500xg)去除细胞碎片;(3)过0.22μm滤膜除去体积较大的分泌小体;(4)超速离心(120,000xg)沉淀外泌体。
4.超速离心方法的缺点:耗时,整个提取过程至少需要8-24小时;提取效率低,有文献报道,超速离心的外泌体提取效率仅为10%;设备要求高,常规实验室不具备超速离心的条件。
5.2.磁珠沉淀法:此方法通过偶联外泌体特异性抗体的磁珠与样本进行孵育,表达相应抗原的外泌体会被磁珠捕获并沉淀下来。外泌体表面有其特异性标记物(如cd63、cd9蛋白),用包被抗标记物抗体的磁珠与外泌体囊泡孵育后结合,即可将外泌体吸附并分离出来。
6.磁珠沉淀方法的缺点:费用高,磁珠偶联抗体价格贵,一般仅能针对微量样本,不适用于大体积样本的外泌体提取;提取效率低,由于磁珠标记抗体的特异性,只能提取特异性表达相应抗原的外泌体,限制了该方法提取的效果;
7.3.超滤法:超滤膜也可用于分离外泌体。根据外泌体的大小,从蛋白质和其他大分子中分离外泌体。超滤法的缺点:该方法通常需要结合超速离心,并且由于过滤膜的粘附,可能会损失外泌体,并且过滤时的压力和剪切力,可能会使外泌体变形受损。
技术实现要素:
8.针对上述情况,本发明公开了一种血浆外泌体提取试剂、富集方法、提取试剂盒及其应用。
9.本发明的技术方案如下:
10.一种血浆外泌体提取试剂,所述提取试剂包括非离子多聚物、硫化物、加入或者不加入盐。
11.进一步的,上述一种血浆外泌体提取试剂,所述非离子多聚物选自peg、多聚赖氨酸、多聚赖氨酸peg、dss、pvp、硫酸葡聚糖中的一种或者多种;所述硫化物选自tcep、dtt、巯基乙醇中的一种或者多种;所述盐为氯化钠、氯化钾、氯化钙、氯化镁、氯化锰、磷酸一氢钠、磷酸二氢钠的一种或多种。
12.进一步的,上述一种血浆外泌体提取试剂,所述的peg分子量为5000-20000道尔顿,具体可以为5000道尔顿、8000道尔顿、10000道尔顿、20000道尔顿;所述pvp的分子量为10000-40000道尔顿,具体可以为10000道尔顿、25000道尔顿、38000道尔顿;所述的硫酸葡聚糖分子量为3000-50000道尔顿,具体可以为5000道尔顿、10000道尔顿、25000道尔顿、40000道尔顿;所述多聚赖氨酸的分子量为3万-30万道尔顿,具体可以为3万-7万道尔顿、7万-15万道尔顿、15万-30万道尔顿;所述多聚赖氨酸peg为polylysine peg conjμgate,分子量为2000或者是polylysine peg conjμgate,分子量为5000。
13.进一步的,上述一种血浆外泌体提取试剂,所述非离子多聚物在试剂中的最终质量浓度为10-50%。
14.进一步的,上述一种血浆外泌体提取试剂,所述硫化物在试剂中的最终浓度范围为0.1-10mg/ml。
15.进一步的,上述一种血浆外泌体提取试剂,所述盐在试剂中的最终浓度范围为5mm-500mm。
16.进一步的,使用上述血浆外泌体提取试剂富集外泌体的方法,包括以下步骤:
17.1)按常规方法获得血浆样本,加入生理盐水或者磷酸盐缓冲溶液处理样本;加入体积为样本体积的0.5-2倍,充分混匀;
18.2)向步骤1)所得的生物样品中加入蛋白酶k溶液,加入体积为步骤1)最终体积的0.01-0.1倍,充分混匀后30-40℃处理;然后加入血浆外泌体提取试剂,加入体积为上述总体积的0.1-2倍。
19.3)将步骤2)所得的溶液混合均匀,放置2-8℃环境下静置1-60分钟。
20.4)将步骤3)所得的溶液将样品于低速下离心5000-10000g,离心时间为5-30分钟,所得沉淀为外泌体。
21.优选的,所述常规方法为:
22.1)将血液样品进行预处理,采集血液进行抗凝处理,室温静置1h或者2-8℃静置过夜;
23.4℃,3000xg离心5-10分钟,上层的透明黄色液体即为血浆,小心转移上清至新的离心管中;
24.4℃,10000xg离心20分钟,去除残留碎片;将上清转移到新的离心管中,注意不要吸到底部的沉淀;
25.加入生理盐水或者磷酸盐缓冲溶液处理处理样本;加入体积为样本体积的0.5-2倍,充分混匀。
26.一种血浆外泌体提取试剂盒,包括上述血浆外泌体提取试剂。
27.进一步的,上述血浆外泌体提取试剂盒,还包含有蛋白酶k。
28.进一步的,上述血浆外泌体提取试剂在提取小鼠或者大鼠血浆外泌体中的应用。
29.与现有技术相比,本发明具有如下的有益效果:
30.本发明公开的技术方案与传统的超高速离心相比,样本中的外泌体所受到的压力较小,可以保持较完整的形态;本方案在传统非离子聚合物peg的基础上添加了多聚赖氨酸一种带正电荷的氨基酸聚合物、poly-lysine peg conjμgate、以及硫化物tcep或者dtt,使得提取过程所需要的时间更短、所需要的样本起始量更低、提取效率更高,提取成本低。通
过本方案获得的血浆外泌体可适用于多种下游实验,如rna分析、高通量测序、细胞共培养等。
附图说明
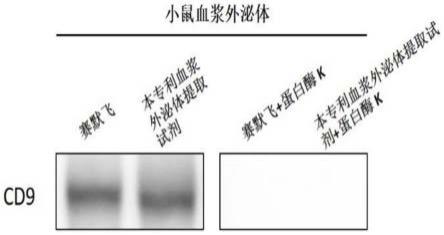
31.图1为实施案例1中western blot验证结果;
32.图2为实施案例1中粒径分布图;
33.图3为实施案例1中nta电影图片;
34.图4为实施案例2中外泌体提取效果图;
35.图5为实施案例2中血浆外泌体rna提取总量结果。
具体实施方式
36.下述实施例中所使用的试验方法如无特殊说明,均为常规方法。
37.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径获得。
38.不同聚合程度的聚合物均购自tci公司。cd9抗体购自abcam公司。赛默飞公司产品为总外泌体分离试剂盒(来自血浆)(4484450),其操作完全按照随产品提供的说明书进行。实施例1和2中的血浆外泌体提取试剂的配方如下表1所示。
39.表1实施例1和2中的血浆外泌体提取试剂的配方
[0040][0041][0042]
实施例1
[0043]
小鼠血浆外泌体提取以及相关检测
[0044]
1.制备血浆
[0045]
1)在采血管中预先加入一定比例的抗凝剂,采集完血液后,将采血管缓慢颠倒混匀,混匀的全血室温静置1h或者2-8℃静置过夜;
[0046]
2)4℃,3000xg离心5-10分钟,上层的透明黄色液体即为血浆,小心转移上清至新的离心管中,注意切勿吸出下面的红细胞成分。
[0047]
3)收集到的血浆可直接用于后续提取外泌体实验或分装后于-80℃冰箱保存。
[0048]
2.准备样品
[0049]
1)将血浆(新鲜样品或已于25℃水浴解冻好的冷冻样品)冰上放置;
[0050]
2)4℃,2000xg离心20分钟,去除残留细胞及碎片;
[0051]
3)将上清转移到新的离心管中(注意不要吸到底部沉淀);
[0052]
4)4℃,10000xg离心20分钟,去除残留碎片。
[0053]
5)将上清转移到新的离心管中,注意不要吸到底部的沉淀,冰上放置直至使用。
[0054]
3.提取外泌体(使用蛋白酶k处理)
[0055]
通过蛋白酶k可以去除血浆中的大多数蛋白,但是一定程度也可能会造成外泌体表面蛋白的降解,如果这对于实验有影响,可以选择不进行蛋白酶k处理。
[0056]
1)根据实验需求,吸取适量离心后的血浆到新的离心管,加入0.5倍体积的1xpbs;
[0057]
2)涡旋充分混匀;
[0058]
3)加0.05倍体积的蛋白酶k。例如,初始的血浆体积为100ul,需加入5ul蛋白酶k;
[0059]
4)涡旋混匀,37℃孵育10分钟。
[0060]
5)加入0.2倍体积(总体积=血浆+pbs)的提取试剂;
[0061]
6)上下颠倒混匀或者通过移液器吹打混匀,直至成为均一的溶液;
[0062]
注:加入提取试剂后,溶液会出现云雾状的浑浊现象。
[0063]
7)2-8℃孵育30分钟;
[0064]
8)孵育结束后,4℃,10000xg离心5分钟;
[0065]
注:小鼠血浆,孵育后10000xg离心30分钟。
[0066]
9)用移液器小心吸去上清液,尽量吸取干净。管底的沉淀即为提取的外泌体;
[0067]
10)(可选步骤)10000xg离心30s,去除残留的提取试剂;
[0068]
11)小心吸取并丢弃上清液体,然后按照“重悬外泌体”步骤进行操作。
[0069]
4.提取外泌体(未使用蛋白酶k处理)
[0070]
1)根据实验需求,吸取适量离心后的血浆到新的离心管,加入0.5倍体积的1xpbs;
[0071]
2)涡旋充分混匀;
[0072]
3)加入0.2倍体积(总体积=血浆+pbs)的提取试剂;
[0073]
4)上下颠倒混匀或者通过移液器吹打混匀,直至成为均一的溶液;
[0074]
注:加入提取试剂后,溶液会出现云雾状的浑浊现象。
[0075]
5)室温下,孵育10分钟;
[0076]
6)孵育后,4℃,10000xg离心5分钟。
[0077]
7)用移液器小心吸去上清液,尽量吸取干净。管底的沉淀即为提取的外泌体。
[0078]
8)(可选步骤)10000xg离心30s,沉降残留的提取试剂。
[0079]
9)小心吸取并丢弃上清液体,然后按照“重悬外泌体”步骤进行操作。
[0080]
5.重悬外泌体
[0081]
1)可以使用1xpbs或者其他类似的缓冲溶液,通过移液器将沉淀充分吹打混匀;
[0082]
2)将分离得到的外泌体保存在2℃至8℃,最长保存1周,或≤-20℃长期保存。
[0083]
6.提取外泌体检测结果
[0084]
1)提取血浆外泌体表面的标志性蛋白cd9的检测。
[0085]
从小鼠血浆中提取的外泌体。100ul血浆最终得到的外泌体沉淀,加入ripa裂解液,充分吹打涡旋裂解沉淀,然后后加入6
×
蛋白上样缓冲溶液。10%sds-page电泳检测,每孔上样10μl。5%脱脂牛奶封闭30分钟,一抗(cd9抗体,abcam)4℃孵育过夜,二抗(goat anti-mouse igg,hrp conjugate)室温孵育1h,ecl发光显色,结果如图1所示。由图1可以看出,利用本发明的外泌体提取和纯化的方法制备得到的外泌体能够检测到的标志性蛋白具有良好的特异性,无非特异性杂质蛋白干扰检测,与赛默飞达到一致效果。蛋白酶k在外泌体提取实验中需要根据后续实验需求选择是否使用。
[0086]
2)提取血浆外泌体的粒径检测
[0087]
从小鼠血浆中提取的外泌体。100ul血浆最终得到的外泌体沉淀,加入50-100ul pbs缓冲液,充分重悬外泌体,进行nta检测。nta结果显示外泌体粒径总体大小均分布在100nm附近,本发明中提取的血浆外泌体与赛默飞提取效果基本无差别。其中当不加蛋白酶k处理时,本发明中提取的外泌体(图2中上图中央)粒径分布要略优于赛默飞(图2中上图左侧)。图3为提取血浆外泌体(小鼠)样本nta电影图片。更加充分展示本发明中提取的血浆外泌体粒径总体粒径大小分布与赛默飞无差别。仪器型号:zetaview pmx 110(particle metrix,meerbusch,germany)。
[0088]
实施例2
[0089]
提取大鼠血浆外泌体以及相关检测
[0090]
1.样本处理、外泌体提取与重悬操作方法与实施例1相同。
[0091]
图4结果显示相同样本量的情况下,本发明提取的外泌体沉淀量与进口对照无差别。
[0092]
2.血浆外泌体(大鼠)rna提取总量对比。
[0093]
样本处理、外泌体提取与重悬操作方法与实施例1相同。
[0094]
大鼠血浆外泌体总rna提取,trizol法。
[0095]
1)根据外泌体沉淀量加入适量的裂解液,充分吹打混匀裂解。
[0096]
2)将上述trizol裂解液转入新的离心管中,在室温下放置5分钟。
[0097]
3)在上述离心管中,按照每1mltrizol裂解液加入0.2ml氯仿的量加入氯仿,充分震荡混匀15秒,室温下放置2-3分钟,12000g,2-8℃离心15分钟。
[0098]
4)取上层水相于新的离心观众,按照每1ml trizol裂解液加入0.5ml异丙醇的量加入异丙醇,室温下放置10分钟,12000g,2-8℃离心10分钟。
[0099]
5)弃上清,按照每1ml trizol裂解液加入1ml 75%乙醇进行洗涤,涡旋混匀,7500g,2-8℃离心5分钟,弃上清。
[0100]
6)让沉淀rna自然干燥,用无核酸酶的水溶解rna沉淀。
[0101]
7)使用nanodrop检测提取rna的浓度,并计算总量。
[0102]
结果如图5显示,选取400ul大鼠血浆经过蛋白酶k处理后,分别使用赛默飞和本发明血浆外泌体提取试剂盒,所得外泌体继续提取rna并测定总量。结果表明本发明中提取的血浆外泌体的总rna提取总量要高于赛默飞,更有利于下游实验。
[0103]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在
不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
[0104]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1