茄二十八星瓢虫致死基因HvSrp54k及其应用
茄二十八星瓢虫致死基因hvsrp54k及其应用
技术领域
1.本技术涉及茄二十八星瓢虫防治技术领域,特别是涉及一种茄二十八星瓢虫致死基因hvsrp54k及其应用。
背景技术:
2.茄二十八星瓢虫henosepilachna vigintioctopunctata属于鞘翅目瓢虫科,是茄科和葫芦科蔬菜上的重要害虫,危害范围极广,且部分地区危害较为严重。当前,茄二十八星瓢虫的防治主要依赖于化学杀虫剂,但是过量使用化学农药会使害虫产生抗药性,同时也会杀伤天敌以及传粉昆虫等有益生物,迫切需要研制防治茄二十八星瓢虫的环境友好型方法。
3.rna干扰(rna interference,rnai)是指在进化过程中高度保守的、由双链rna(double-stranded rna,dsrna)诱发的、同源mrna高效特异性降解的现象。以rnai为基础的rnai抗虫技术,通过干扰控制害虫发育或重要行为的关键基因,阻碍害虫正常的生长和繁殖,甚至直接导致害虫死亡,从而达到害虫防控的目的。dsrna在生物体内普遍存在,在环境中易降解,因此无毒、无残留,是一种新型绿色环保的害虫防控方法,展现出了广阔的应用前景。而获得高效安全的致死靶标基因是利用rnai技术进行害虫防治的关键。近2年,本技术人建立了茄二十八星瓢虫饲喂法rnai的技术体系,在茄二十八星瓢虫中鉴定得到了几个致死能力较高的靶标基因,如hvvatpase b、hvrps18和hvrpl13、hvsnf7、hvvatpase a和hvvatpase e、hvlwr、hvαcopi和hvγcopi等。随着茄二十八星瓢虫基因组和转录组测序的深入研究,以及对rnai抗性决定因素和抗性机制有了更多的了解,研究发现更多的其他rnai致死靶标基因将有助于基于rnai技术的茄二十八星瓢虫防控的发展。
技术实现要素:
4.本技术的目的是提供一种新的茄二十八星瓢虫致死基因hvsrp54k及其应用。
5.本技术采用了以下技术方案:
6.本技术的第一方面公开了一种茄二十八星瓢虫致死基因hvsrp54k,该基因hvsrp54k为seq id no.1所示序列。
7.需要说明的是,本技术的基因hvsrp54k是在茄二十八星瓢虫基因组和转录组序列中新发现的影响其发育的基因,通过沉默该基因hvsrp54k,能够高效致死茄二十八星瓢虫,为茄二十八星瓢虫的绿色防控提供了一种新的方案和途径。
8.本技术的第二方面公开了一种防治茄二十八星瓢虫的dsrna,该dsrna靶向沉默本技术的茄二十八星瓢虫致死基因hvsrp54k。
9.本技术的一种实现方式中,本技术的dsrna为seq id no.2所示序列。
10.优选的,dsrna的5’端和/或3’端还具有启动子序列。
11.优选的,启动子序列为t7启动子序列。
12.优选的,t7启动子序列为seq id no.3所示序列或其反向互补序列。
13.需要说明的是,seq id no.2所示序列的dsrna只是本技术的一种实现方式中,能够有效沉默基因hvsrp54k的dsrna序列;在本技术的发明构思基础上,不排除还可以设计出其他的能够沉默本技术的基因hvsrp54k的dsrna序列,在此不做具体限定。
14.本技术的第三方面还公开了一种重组质粒,该重组质粒中含有本技术的茄二十八星瓢虫致死基因hvsrp54k,或者含有本技术的dsrna或其表达基因。
15.需要说明的是,本技术的重组质粒,由于含有本技术的茄二十八星瓢虫致死基因hvsrp54k,或者本技术的dsrna或其表达基因;能够用于制备沉默基因hvsrp54k的dsrna或其他抑制基因hvsrp54k表达的产品。
16.本技术的第四方面还公开了一种细胞,该细胞含有本技术的茄二十八星瓢虫致死基因hvsrp54k,或者含有本技术的dsrna或其表达基因,或者含有本技术的重组质粒。
17.需要说明的是,本技术的细胞,例如在含有本技术的重组质粒的情况下,能够通过培养、表达获得沉默基因hvsrp54k的dsrna,或其制备他抑制基因hvsrp54k表达的产品。
18.本技术的第五方面还公开了本技术的茄二十八星瓢虫致死基因hvsrp54k或其抑制表达剂,或者本技术的dsrna,或者本技术的重组质粒,或者本技术的细胞,在制备防治茄二十八星瓢虫的产品中的应用。
19.本技术的第六方面还公开了本技术的茄二十八星瓢虫致死基因hvsrp54k或其抑制表达剂,或者本技术的dsrna,或者本技术的重组质粒,或者本技术的细胞,在制备抑制茄二十八星瓢虫生长的产品中的应用。
20.本技术的第七方面还公开了本技术的茄二十八星瓢虫致死基因hvsrp54k或其抑制表达剂,或者本技术的dsrna,或者本技术的重组质粒,或者本技术的细胞,在制备促进茄二十八星瓢虫死亡的产品中的应用。
21.需要说明的是,通过沉默本技术的基因hvsrp54k,能够高效致死茄二十八星瓢虫;因此,本技术的茄二十八星瓢虫致死基因hvsrp54k或其抑制表达剂,或者本技术的dsrna,或者本技术的重组质粒,或者本技术的细胞,能够用于制备防治茄二十八星瓢虫、抑制茄二十八星瓢虫生长或促进茄二十八星瓢虫死亡的产品。其中,茄二十八星瓢虫致死基因hvsrp54k的抑制表达剂,例如可以是本技术的dsrna,也可以是其他已经公开的同源基因的抑制表达剂。
22.本技术的第八方面还公开了一种防治茄二十八星瓢虫的试剂盒,该试剂盒中含有本技术的茄二十八星瓢虫致死基因hvsrp54k或其抑制表达剂,或者本技术的dsrna,或者本技术的重组质粒,或者本技术的细胞。
23.需要说明的是,本技术的试剂盒含有本技术的茄二十八星瓢虫致死基因hvsrp54k,可以用于制备沉默基因hvsrp54k的dsrna或其他抑制基因hvsrp54k表达的产品,起到防治茄二十八星瓢虫的作用;或者直接含有茄二十八星瓢虫致死基因hvsrp54k的抑制表达剂,可以直接用于防治茄二十八星瓢虫;或者,试剂盒中含有本技术的dsrna,也可以直接用于防治茄二十八星瓢虫;或者,试剂盒中含有本技术重组质粒,可以用于制备沉默基因hvsrp54k的dsrna或其他抑制基因hvsrp54k表达的产品;或者,试剂盒中含有本技术的细胞,通过培养细胞表达本技术的dsrna,其培养液直接用于防治茄二十八星瓢虫,或提取纯化后用于防治茄二十八星瓢虫。
24.本技术的有益效果在于:
25.本技术的茄二十八星瓢虫致死基因hvsrp54k,是新发现的影响其发育的基因,通过沉默该基因hvsrp54k,能够高效致死茄二十八星瓢虫,为茄二十八星瓢虫的绿色防控提供了一种新的方案和途径。
附图说明
26.图1是本技术实施例中体外合成的dsgfp和dshvsrp54k的电泳图;
27.图2是本技术实施例中取食dshvsrp54k对茄二十八星瓢虫1龄幼虫基因hvsrp54k的沉默效率影响统计结果;
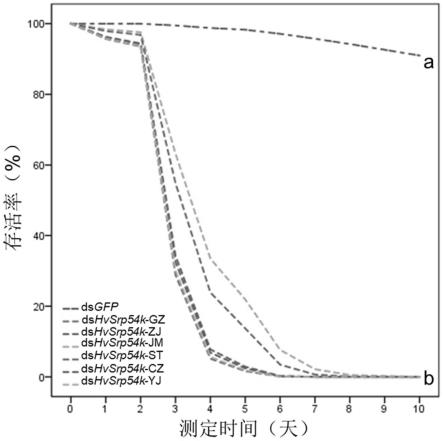
28.图3是本技术实施例中取食菌液表达的dshvsrp54k对不同地理种群茄二十八星瓢虫存活率的影响的统计结果。
具体实施方式
29.信号识别粒子(signal recognition particle,srp)可催化哺乳动物细胞内质网靶向蛋白(bernstein et al.,1989),其中srp54k编码信号识别颗粒蛋白54k,参与靶向内质网的蛋白质形成,具有7s rna结合活性、内质网信号肽结合活性和gtpase活性,并参与srp依赖的共翻译蛋白靶向和膜易位。先前的研究显示,srp54k基因在昆虫的生长发育和代谢过程中发挥了重要作用。
30.基于以上研究和认识,本技术对茄二十八星瓢虫的基因组和转录组进行文库构建和测序,利用现有昆虫的srp54k基因与茄二十八星瓢虫的测序结果进行同源比对分析,获得茄二十八星瓢虫的hvsrp54k基因;并利用饲喂法rnai,评价hvsrp54k基因是否可以作为茄二十八星瓢虫防控的高效靶标基因;最终得到一种新的能够高效致死茄二十八星瓢虫的基因,即seq id no.1所示序列的茄二十八星瓢虫致死基因hvsrp54k。
31.下面通过具体实施例对本技术作进一步详细说明。以下实施例仅对本技术进行进一步说明,不应理解为对本技术的限制。
32.实施例
33.一、材料与方法
34.1.1供试虫源
35.茄二十八星瓢虫实验室种群于2018年4月采集自广州华南农业大学校园温室内的龙葵叶片上,继代饲养于广东省生物农药创制与应用重点实验室,饲养材料为茄子叶片;茄二十八星瓢虫5个田间种群于2021年7月采集自广东省5个地区的龙葵上。茄二十八星瓢虫和叶片均放入带有滤纸和保湿棉球的培养皿中,置于人工气候箱,温度25
±
1℃,湿度70%~80%,光周期14l:10d。
36.1.2.总rna提取和cdna第一链的合成
37.使用trizol法对茄二十八星瓢虫的不同发育阶段样品进行rna提取(invitrogen,united states)。使用1%琼脂糖凝胶电泳检测rna质量并使用仪器nanodrop onec分光光度计(thermo fisher scientific,waltham,ma united states)测定rna浓度,所有样本rna的od
260
/od
230
在1.8~2.2之间。使用试剂盒primescript
tm rt reagent kit with gdna eraser(perfect real time,takara,rr047a),根据说明书将总rna反转录合成cdna,所有的cdna稀释10倍用于后续实验。
38.1.3取食试剂盒合成dsrna的rnai效应
39.1.3.1 dsrna的体外合成
40.对茄二十八星瓢虫的基因组和转录组进行文库构建和测序,利用现有昆虫的srp54k基因与茄二十八星瓢虫的测序结果进行同源比对分析,获得茄二十八星瓢虫的hvsrp54k基因,即seq id no.1所示序列。
41.seq id no.1:
[0042]5’‑
atggtgttagctgatttaggtcgtaaaattacgactgccttgcagtcattaagcaaagcaactatcataaatgaagatgtcctcaatggaatgctcaaagagatatgtgctgctttgctcgaagctgatgttaacattcgtttagtcaaaaaacttagagaaaatgtgagagctgtaatagattttgaggaaatggctggggggctcaacaagagaagaatgatacaaagtgcagttttcaaagaacttgtgaagcttgtagatcctgctgttaagccttaccagcctacaaaagggaagcacaatgttattatgtttgtaggattacaaggatctggtaaaacaaccacatgtacaaaacttgcttaccattatcagaagaaaaactggaaatcttgtttagtgtgtgcagatacattcagagcaggtgcttatgatcaagtaaaacagaattgtacaaaagcgagaataccattttacggaagttacactgaagtagatccagttgttatagcacaagatggagtggaaatgttcaaaaaagaaggtttcgagataataattgttgataccagcggtaggcataagcaagaagaagcgttgttcgaggagatgttggcggtatctaatgctgtgagacctgacaatatcatttttgtaatggacgccacaataggtcaggcttgcgaagcgcaagctagggctttcaaggaaaaagtagatgtaggatcagtcataatcacaaaattagacggccacgctaagggtggtggtgcccttagtgcggttgccgctacaagcagtccaattatctatataggtacgggagagcacatagacgatttagaaccattcaaaactaaaccctttatcagtaaacttttgggtatgggagatattgaaggtctcattgataaagttaatgaattgaaattagaagataatgaagagttattagaaaaaattaaacacggacaatttacattgcgagacatgtacgagcagtttcagaacattatgaaaatgggaccattctcacaaattatgggtatgattccgggattcagtcaagacttcatgacaaaaggtagtgaacaagaatcaatggctagattaaaaaaactgatgacaatcatggacagtatgaatgatggcgaattggacaacagggatggtgccaagctcttctcaaaacaaccaggaaggacagtcagggtcgctcaaggagctggtgtaacagagcgcgaagttaaagaattaatttcacagtacacgaaatttgctgctgtcgttaagaaaatgggcggtatcaaaggtctcttcaaaggcggagacatggcgaaaaacgtgaatccagctcaaatggcaaaactcaatcagcaaatggcaaagatgatggatcccagagtgctgcaacagatgggtggaatgaacggtttacagaacatgttgaggcaactacaatctggcgccgccggaggactgggtggtttaggcaatcttatgaacaattttgggggcaaatag-3’[0043]
根据seq id no.1所示序列的hvsrp54k基因,利用e-rnai网站(https://www.dkfz.de/signaling/e-rnai3//)设计靶向沉默hvsrp54k基因的dsrna的特异性引物,并在特异性上下游引物的5’端各增加一段seq id no.3所示序列的t7启动子序列。采用相同的方案,针对gfp质粒设计特异性引物作为对照;同样的,在上下游引物的5’端各增加一段seq id no.3所示序列的t7启动子序列。靶向沉默hvsrp54k基因的dsrna的特异性引物标记为dshvsrp54k引物,针对gfp质粒设计的特异性引物标记为dsgfp引物,引物序列如表1所示。所有引物由上海生工合成。
[0044]
seq id no.3:5
’‑
taatacgactcactataggg-3’。
[0045]
表1特异性引物
[0046][0047]
利用dshvsrp54k引物和dsgfp引物对反转录合成的cdna或gfp质粒进行pcr扩增,扩增产物用于合成dsrna。具体如下:
[0048]
dshvsrp54k和dsgfp的pcr反应体系:ddh2o 35μl、2
×
pcr taq mastermix 50μl、cdna或gfp质粒5μl、上游引物(10μm)5μl、下游引物(10μm)5μl。
[0049]
pcr反应条件:94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸1min,35个循环;72℃延伸10min。
[0050]
反应完成后使用1%琼脂糖凝胶电泳检测上述2种pcr产物,然后使用dna纯化回收试剂盒(universal dna purification kit,tiangen,china)回收,作为合成dsrna的模版。
[0051]
本例具体使用megascript
tm t7试剂盒(thermo fisher scientific,waltham,ma,usa),根据说明书步骤合成dsrna。
[0052]
dsrna的合成体系:10
×
reaction buffer 5μl、atp solution 5μl、gtp solution 5μl、ctp solution 5μl、utp solution 5μl、pcr回收产物1μg、enzyme mix 5μl,用rnase-free water补足50μl。
[0053]
上述体系混匀后,置于37℃4h。
[0054]
反应结束后加入2.5μl的turbo dnase去除残留的模版dna和单链rna,然后纯化dsrna,具体如下:首先将上述dsrna转移至1.5ml离心管中,加入280μl的nuclease free water至300μl。然后,加入相同体积的苯酚和氯仿,即150μl苯酚+150μl氯仿,混匀,4℃,13000rpm,15min。然后转移上清液到一个新的离心管中,加入300μl氯仿,混匀,4℃,13000rpm,10min。再转移上清液到一个新的管子中,加入30μl醋酸钠(ph5.8,3m)和750μl无水乙醇,混匀后放置-80℃,1.5h或者过夜放置。静置过后再离心,13000rpm,4℃,15min,去除上清液,尽量吸除干净。再用1ml的75%乙醇冲洗,悬浮沉淀,然后7500rpm,4℃,10min。最后弃除上清,在室温放置8-10min,用50μl的ddh2o溶解dsrna后,置于-80℃冰箱中保存,分别得到靶向沉默基因hvsrp54k的dsrna,标记为dshvsrp54k,和gfp质粒的dsrna,标记为dsgfp。
[0055]
使用1.5%琼脂糖凝胶电泳检测dsrna质量并使用仪器nanodrop onec分光光度计(thermo fisher scientific,waltham,maunited states)测定dsrna浓度。琼脂糖凝胶电泳检测结果如图1所示,图1中,第一泳道为marker,第二泳道为dsgfp的电泳结果,第三泳道为dshvabch1的电泳结果,结果与预期相符。分光光度计测定结果显示,其中dshvsrp54k浓度为5450ng/μl,dsgfp浓度为2803ng/μl。
[0056]
本例设计的靶向沉默基因hvsrp54k的dsrna为seq id no.2所示序列;但是,由于在特异性上下游引物的5’端各增加了一段t7启动子序列;因此,本例最终的dshvsrp54k是在seq id no.2所示序列的基础上,在5’端和3’端都具有一段t7启动子序列,即在5’端为seq id no.3所示序列,由上游引物添加,3’端为seq id no.3所示序列的反向互补序列,由下游引物添加。
[0057]
seq id no.2:
[0058]5’‑
cgggagagcacatagacgatttagaaccattcaaaactaaaccctttatcagtaaacttttgggtatgggagatattgaaggtctcattgataaagttaatgaattgaaattagaagataatgaagagttattagaaaaaattaaacacggacaatttacattgcgagacatgtacgagcagtttcagaacattatgaaaatgggaccattctcacaaattatgggtatgattccgggattcagtcaagacttcatgacaaaaggtagtgaacaagaatcaatggctagattaaaaaaactgatgacaatcatggacagtatgaatgatggcgaattggacaacagggatggtgccaagctcttctcaaaacaaccaggaaggacagtcagggtc-3’[0059]
1.3.2体外合成dsrna对实验室茄二十八星瓢虫种群的存活率的影响
[0060]
茄二十八星瓢虫1龄幼虫处理组(dshvsrp54k):在放有滤纸和加湿棉球的培养皿中放入10只茄二十八星瓢虫的1龄幼虫,10头为1个重复,设置3个重复,分别用浓度200ng/μl、100ng/μl、50ng/μl、25ng/μl、12.5ng/μl、6.25ng/μl的dshvsrp54k溶液浸泡直径为12mm的圆形茄子叶片1min,风干后饲喂幼虫,每隔24h更换一次叶片,饲喂用dshvsrp54k浸泡的叶片2d后,用未经处理的茄子叶片每天饲喂幼虫。以相同浓度和方法设置对照组,即喂食dsgfp溶液浸泡后的叶片。培养皿置于人工气候箱中,温度25
±
1℃,湿度70%-80%,光周期14l:10d。每隔24h统计每个培养皿中茄二十八星瓢虫的死亡数目,并计算存活率及lc
50
。
[0061]
1.3.3dshvsrp54k对茄二十八星瓢虫的沉默效率影响
[0062]
为了探究取食dshvsrp54k对茄二十八星瓢虫基因表达的影响,茄二十八星瓢虫1龄幼虫分别用lc
50
值(11.449ng/μl)的dshvsrp54k和dsgfp进行饲喂法rnai处理,即“1.3.2体外合成dsrna对实验室茄二十八星瓢虫种群的存活率的影响”的饲喂方法,24h和48h后收集样本,5头幼虫为1个生物学重复。所有样本均设置4个生物学重复。液氮速冻后,-80℃储存。提取所收集样品的总rna并反转录为cdna,方法与“1.2.总rna提取和cdna第一链的合成”相同。用rt-qpcr分析dshvsrp54k对茄二十八星瓢虫的沉默效率。并选取基因rps18作为内参基因。检测hvsrp54k基因的rt-qpcr引物标记为“rt-qpcr-hvsrp54k”,具体序列如表1所示。内参基因的引物标记为“rt-qpcr-hvrps18”,序列如表1所示。所有引物都由上海生工合成。
[0063]
rt-qpcr反应体系:cdna模板2.5μl、引物f和r(10μm)各2.5μl、tb green 25μl,ddh2o 17.5μl。
[0064]
qpcr反应程序为三个阶段,分别为变性阶段95℃30s;定量分析阶段为40个循环:95℃5s、60℃30s;熔解曲线95℃5s(4.4℃/s),60℃(2.2℃/s),95℃(0.11℃/s,每上升1℃拍照5次)。
[0065]
反应在96孔板microseal pcr plates(bio-rad inc.,usa)中进行,rt-qpcr的反应仪器为bio-rad c1000 real-time pcr system(bio-rad c1000 real-time pcr system,bio-rad,usa)。最终的结果计算采用2
‑△△
ct
法进行(livak and schmittgen,2001),其中c
t
表示循环数。
[0066]
1.3.4菌液表达dsrna的载体构建
[0067]
菌液表达dsrna的载体选择带有双t7启动子的l4440载体,用于构建表达载体的引物如表1所示,其中“l4440-dshvsrp54k”是构建靶向沉默基因hvsrp54k的dsrna的引物,即在特异性引物的5’端和3’端分别增加酶切位点;“l4440-dsgfp”是构建gfp的dsrna的引物,同样的,在特异性引物的5’端和3’端分别增加酶切位点。
[0068]
dshvsrp54k和dsgfp的pcr反应体系:ddh2o 35μl、2
×
pcr taq mastermix 50μl、cdna或gfp质粒5μl、上游引物(10μm)5μl、下游引物(10μm)5μl。
[0069]
pcr反应条件:94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸1min,35个循环;72℃延伸10min。
[0070]
在l4440载体上选择bamhi和saci作为酶切位点,用限制性内切酶quickcut saci和quickcut bamhi(takara)酶切l4440载体,同样的,回收产物也采用限制性内切酶quickcut saci和quickcut bamhi(takara)进行酶切。利用通用dna纯化试剂盒(北京天根)对酶切的pcr产物和线性化的l4440载体进行纯化。然后,用重组酶trelieftm sosoo cloning kit(擎科,广州),将纯化后的l4440载体与目的片段进行重组,将含有目的片段的重组载体转化到具有iptg诱导t7聚合酶活性的rnaseⅲ缺陷型大肠杆菌ht115(de3)细胞中。在lb琼脂平板上培养后,将含有目的片段的单菌落接种到含有tet(10μg/ml)和amp(100μg/ml)的4ml lb液体培养基中,以210rpm,37℃培养12-14h。将500μl菌液转移至50ml含有amp(100μg/ml)和tet(10μg/ml)的lb液体培养基中,将菌液稀释100倍扩大培养,培养至菌液的od值在0.5-0.8之间。然后,将iptg添加至菌液中使其终浓度为1mm,并在37℃,120rpm下振荡培养5h诱导dsrna。
[0071]
1.3.5菌液表达dsrna对茄二十八星瓢虫室内和田间种群存活率的影响
[0072]
使用菌液表达的dshvsrp54k和dsgfp对室内种群和田间种群的茄二十八星瓢虫1龄幼虫进行生物测定,所有生测的茄二十八星瓢虫包括3个重复:每个重复分别包括10头1龄幼虫,生测在培养皿中进行,开始生测前,供试昆虫饥饿处理3h。将大小相等的茄子叶片(直径12mm)浸泡在菌液表达的dsrna溶液中1min,放置在滤纸上,在室温下风干1h。风干后饲喂给1龄幼虫。每个重复连续饲喂dsrna处理过的叶片2d。从第3d开始,给测试昆虫饲喂等量的不含dsrna的叶片,每隔24h统计每个培养皿中茄二十八星瓢虫的死亡数目,并计算10d内存活率。
[0073]
1.4数据分析
[0074]
使用软件poloplus(leora software 2002,berkeley,ca)计算dshvsrp54k对茄二十八星瓢虫的致死中浓度lc
50
,死亡率数据的平等性和并行性的假设也通过poloplus进行了检验。单因素方差分析(breslow两两比较,p《0.05)用于检验饲喂dsrna后,对照和处理之间的沉默效率差异,并使用cox回归程序创建基于幼虫死亡率的生存曲线。
[0075]
二、结果与分析
[0076]
2.1体外合成的dsrna对实验室茄二十八星瓢虫种群存活率的影响
[0077]
dshvsrp54k对实验室种群茄二十八星瓢虫幼虫的不同浓度测定显示,开始死亡率统计的6d内,死亡率接近100%,因此选取第5d进行lc
50
值分析,如表2所示。结果显示,实验室种群茄二十八星瓢虫1龄幼虫对dshvsrp54k的lc
50
为11.449ng/μl。
[0078]
表2dshvsrp54k对茄二十八星瓢虫实验室种群的毒力测定
[0079]
龄期饲喂后测定时间(d)lc
50
(ng/μl)(95%cl)斜率
±
标准误χ2(df)1龄5d11.449(3.288-20.725)1.692
±
0.2835.8296(4)
[0080]
2.2dshvsrp54k对茄二十八星瓢虫的沉默效率的影响
[0081]
rt-qpcr分析结果表明,dshvsrp54k饲喂茄二十八星瓢虫1龄幼虫2d和4d后,与对照组相比,其hvsrp54k基因的表达水平被显著抑制,分别明显下降3.82倍(f
1,6
=80.453,p《0.001)和1.55倍(f
1,6
=27.427,p《0.05),结果如图1所示。图1中,数值为平均值
±
标准误,图中不同字母表示组间有显著性差异(tukey,p《0.05)。
[0082]
2.3菌液表达的dsrna对茄二十八星瓢虫室内和田间种群存活的影响
[0083]
茄二十八星瓢虫5个田间种群于2021年7月采集自广东省5个地区的龙葵上,具体分别采集自潮州(cz)、汕头(st)、江门(jm)、阳江(yj)和湛江(zj)五个地区;实验室种群于2018年4月采集自广州华南农业大学校园温室内的龙葵叶片,并进行继代培养;总计6个种群用于试验。
[0084]
结果显示,连续饲喂茄二十八星瓢虫1龄幼虫菌液表达的dshvsrp54k 2d后,不同地理种群茄二十八星瓢虫的处理组存活率与对照组相比均存在显著差异(p《0.001),并随着时间的增加处理组的存活率呈现急剧下降的趋势,不同地区种群的存活率差异呈现急剧下降的趋势,统计的10d内处理组的致死率均为100%,而对照组的存活率没有显著变化,如图2所示。图2中,分别利用不同地理种群幼虫的死亡率数据,使用cox回归程序建立存活曲线,图中不同字母表示组间有显著性差异(tukey,p《0.05);其中,a曲线为对照组曲线,b曲线组分别为6个种群的曲线。测试结果说明,取食菌液表达的dshvsrp54k能够在不同地理种群茄二十八星瓢虫的体内引发强烈的rnai效应,导致瓢虫死亡。
[0085]
根据以上试验可见,本例的seq id no.1所示序列的基因hvsrp54k能够影响茄二十八星瓢虫生长发育,通过沉默该基因hvsrp54k,能够高效致死茄二十八星瓢虫。
[0086]
以上内容是结合具体的实施方式对本技术所作的进一步详细说明,不能认定本技术的具体实施只局限于这些说明。对于本技术所属技术领域的普通技术人员来说,在不脱离本技术构思的前提下,还可以做出若干简单推演或替换。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1