重组人源岩藻糖基转移酶变异体及应用的制作方法
1.本发明涉及一种蛋白突变体,属于多肽技术领域。
背景技术:
2.糖基化是碳水化合物与目标分子(通常为蛋白质和脂质)共价连接的过程,蛋白质分子的糖基化是最丰富的翻译后修饰之一,这种修饰具有多种功能,例如,参与蛋白质分子的正确折叠,调节蛋白质的热力学和动力学稳定性,参与分子间相互作用和细胞间粘附,参与免疫识别或者免疫逃逸。与dna转录或蛋白质翻译不同,蛋白质的糖基化过程没有模板,是一种是酶促反应,供体分子通常是一种活化的核苷酸糖,在糖基转移酶的作用下,对受体位点(羟基或其它官能团)进行特异的糖缀合物的反应。岩藻糖作为糖蛋白中糖链的组成部分,广泛存在于各类细胞表面的质膜上。岩藻糖基转移酶是将l-岩藻糖从gdp-岩藻糖(鸟苷二磷酸岩藻糖)供体底物转移到受体底物的酶。据目前的各种文献报道,岩藻糖基转移酶的主要供体底物都是分子量比较小的gdp-岩藻糖。在岩藻糖基转移酶的作用下,将岩藻糖苷转移至哺乳细胞糖蛋白蛋白n-多糖上。人源的岩藻糖基转移酶一共有11种,分别为fut1; fut2; fut3; fut4; fut5; fut6; fut7; fut8; fut9; fut10; fut11。岩藻糖转移酶属于ii型一次跨膜蛋白,主要存在于高尔基体内。原核生物的岩藻糖基转移酶,目前经过验证的主要来自幽门螺杆菌(helicobacter pylori),包括6条序列(uniprot:http://www.cazy.org/gt10.html)。
3.细胞表面的分子决定了细胞如何与其它细胞以及周围环境相互作用。肿瘤的治疗性抗体例如抗-cd20, 抗-vegfr等通过结合t淋巴细胞和nk细胞表面的fcgr,同时结合肿瘤细胞表面的抗原,使得t和nk细胞发挥肿瘤杀伤作用(adcc)。受其启发,肿瘤免疫疗法近年来有了突变进展——嵌合抗原受体t细胞免疫疗法, chimeric antigen receptor t-cell immunotherapy (car-t),其中kymriah是第一款被美国批准用于治疗b细胞前体急性淋巴细胞白血病。这是一种治疗肿瘤的新型精准靶向疗法,其用生物技术把辨识癌细胞表面cd19抗原的car基因插到t细胞膜表面上,直接识别肿瘤细胞,激活t细胞进行肿瘤杀伤。但car-t的技术工艺复杂,价格昂贵。类似car-t这样的细胞工程的主要技术挑战是在不干扰细胞内源性功能的情况下赋予被操纵细胞新的特性。作为目前最常见和最稳健的细胞工程方法,首先受到技术复杂性和安全问题的限制,如原代细胞病毒转导效率的再现性不一致、car基因的异质表达水平,以及内源性基因被破坏的可能性。因此,使用化学生物学工具直接修饰细胞表面已成为细胞治疗的一种补充和普遍适用的方法。其中包括bertozzi等人开发的代谢寡糖修饰法(moe)和细菌转肽酶sortases催化的转肽反应。(stephan,等.nano today 2011, 6, 309
−
325.;griffin等. cell chem. biol. 2016, 23, 108
−
121. ;hudak等 chem. biol. 2014, 21, 16
−
37. ;bi, x等. engineering. chem.
ꢀ‑ꢀ
eur. j. 2018, 24, 8042
−
8050.))此外,wu等利用幽门螺杆菌的岩藻糖基转移酶成功地将抗体类大分子蛋白转移到细胞膜表面的多糖上,例如lacnac和α2,3 sialyl lacnac。利用这种技术,wu等构建了两种类型的工程细胞——使用自然杀伤细胞系(nk-92mi)和小鼠原代cd8
+
ot-1t细胞,
通过岩藻糖基转移酶将her2抗体和pd-l1的抗体分别转移至nk-92mi和cd8
+
ot-1t细胞,并在小鼠模型中展示了特异性肿瘤靶向性和对抗肿瘤细胞产生的抑制信号(参见li j,等. acs cent sci. 2018 dec 26;4(12):1633-1641. )。因此,利用岩藻糖基转移酶将与供体底物相结合的目的分子标记到携带有受体底物的目的细胞将使得诸如car-t这样的细胞治疗的效果得到大幅提升。
4.糖苷转移酶(glycotransferase)能够在中性条件下,尤其是哺乳细胞无损伤的反应条件下作用,对于细胞学工程是一个无以比拟的长处。但是无论是细菌来源的还是人源的岩藻糖基转移酶对于大分子的供体底物的酶活性并不好。本发明人在研究中发现,相比小分子gdp-fucose而言,岩藻糖基转移酶对于大分子的供体底物的酶活性降低近千倍,不能满足临床治疗的需求。因此,本发明的目的就是提供一种对于大分子的供体底物转移具有优异酶活性的岩藻糖基转移酶突变体。
技术实现要素:
5.基于上述目的,本发明首先提供了一种重组人源岩藻糖基转移酶变异体,所述重组人源岩藻糖基转移酶变异体在seq id no. 1所示的野生型氨基酸序列的第 109 氨基酸至第110氨基酸或者第 170 氨基酸至第171氨基酸的位置插入来源于幽门螺杆菌的alfa-1,3岩藻糖基转移酶序列中较为宽松的序列seq id no. 7或者seq id no. 8,此处所述较为宽松的序列是指没有固定的二级结构的非保守性序列。
6.在一个优选的实施方案中,所述重组人源岩藻糖基转移酶变异体的序列如seq id no. 3所示。
7.在另一个优选的实施方案中,所述重组人源岩藻糖基转移酶变异体的序列如seq id no. 5所示。
8.其次,本发明提供了一种上述重组人源岩藻糖基转移酶变异体的多核苷酸,所述多核苷酸的序列如seq id no. 4所示。
9.在另一个可选择的实施方案中,所述多核苷酸的序列如seq id no.6所示。
10.第三,本发明提供了一种含有上述多核苷酸的表达载体。
11.第四,本发明提供了一种含有上述表达载体的宿主细胞。
12.在一个优选的实施方案中,所述宿主细胞为hek293细胞或者cho细胞。
13.第五,本发明提供了一种应用上述的重组人源岩藻糖基转移酶变异体将靶分子标记于目的细胞或者目的蛋白质的方法,所述方法包括:(1)将供体底物与靶分子相缀合获得连接复合物;(2)在所述的重组人源岩藻糖基转移酶变异体存在的条件下,使步骤(1)获得的连接复合物与含有glcnac受体分子的目的细胞或者目的蛋白质一起孵育,获得被标记了靶分子的目的细胞。
14.在一个优选的实施方案中,所述供体底物的分子量为500d 至150kd的gdp-fucose-(peg4)n,所述n为0-10的整数。
15.在一个更为优选的实施方案中,所述靶分子为igg,所述n=2。
16.第六,本发明提供了一种根据上述方法标记的细胞或者蛋白质。
17.最后,本发明提供了上述的细胞或者蛋白质在制备疾病治疗药物中的应用。
tween 20 ph7.0的磷酸缓冲液中。图1为本发明实施例中纯化后的fut6,fut10和fut11重组蛋白的sds-page电泳, 上样缓冲液中加入还原剂β-巯基乙醇。
[0031] 实施例2. 重组岩藻糖基转移酶的活性检测纯化的fut6, fut10, fut11重组酶进行了酶活性的分析和测量,反应缓冲液中含有40ng重组酶 100
ꢀµ
m超纯gdp-岩藻糖(gdp-fucose)(promega cat.#va1097)作为供体底物,和40
µ
m胎球蛋白(promega cat#v4961)作为受体底物。所有酶反应均在25
µ
l体积的白色96孔板中进行。在室温下静置孵育60分钟。gdp糖基转移酶测定按手册(promega gdp-glo
™ꢀ
glycosyltransferase assay)所述进行。
[0032]
在pbs缓冲液25
µ
l反应体积中,含有40 ng的重组岩藻糖基转移酶和100
ꢀµ
m gdp-岩藻糖作为供体底物,以及对倍稀释(40
ꢀµ
m)的胎球蛋白作为受体底物,37度孵育30分钟。然后室温下加入 25
ꢀµ
l gdp detection reagent ,孵育60分钟,放入glomax
®ꢀ
96 微孔板发光检测仪 (cat# e6501),室温下读取,进行酶活性(km)的检测。在岩藻糖基转移酶的作用下,岩藻糖转移至胎球蛋白上,同时释放出游离的gdp。加入gdp检测试剂,将gdp转化为atp,并使用荧光素酶/荧光素反应测量新合成的atp。酶反应产生的荧光与gdp数量相关,从而反应出岩藻糖基转移酶的活性。具体操作如下文所述。
[0033]
2.1 gdp 生产率测定pbs缓冲液25
ꢀµ
l反应体积中含有40 ng 的fut6,fut10和fut11重组酶,胎球蛋白作为受体底物从0
ꢀ–ꢀ
40
ꢀµ
m对倍稀释,供体底物是100
ꢀµ
m gdp-岩藻糖。37度孵育30分钟。然后室温下加入 25
ꢀµ
l gdp 检测试剂 ,孵育60分钟,放入glomax
®ꢀ
96 微孔板发光检测仪 (cat# e6501),室温下读取。用公式y = 1491*x + 379.0(y是发光检测仪上读取的数据,x是gdp的浓度)计算出gdp的浓度μm,除以60(min)和 fut的质量 (ng), 得出gdp 生产率。即当供体底物、受体底物和酶的浓度一定的情况下,在以上所述的特定反应条件中,fucose-gdp上的fucose被转移到受体底物上,从而释放出gdp,因此检测反应体系中的gdp浓度即可反映出酶的活性。例如当受体底物为7.5 μm,供体底物为100 μm,酶的浓度是40 ng时,在37度孵育30分钟后检测,fut6, fut10和fut11的活性可以用gdp生产效率表示,分别为约140, 72,60 pmol/min/μg。1μg fut6在1分钟内可以催化140 pmol的底物转移,其催化能力大于fut10和fut11(参见图2)。
[0034]
2.2 岩藻糖基转移酶的活性测定以受体底物胎球蛋白为横坐标,gdp生产率为纵坐标,用非线性回归进行拟合获得km值。km又称米氏常数,km的含义是酶促反应达最大速度(vm)一半时的底物(s)的浓度,是酶的特征常数之一。不同的酶km值不同,同一种酶与不同底物反应km值也不同,km值可近似的反映酶与底物的亲和力大小:km值大,表明亲和力小;km值小,表明亲合力大。
[0035]
具体步骤为:pbs缓冲液25
ꢀµ
l反应体积中含有40 ng 的fut6,fut10和fut11重组酶,0-40
ꢀµ
m胎球蛋白作为受体底物,供体底物100
ꢀµ
m,分别是gdp-岩藻糖 (gdp-fucose),gdp-fucose-peg4-igg和gdp-fucose-(peg4)n-igg,其中,gdp-fucose-peg4-igg 为gdp-fucose 替换为用一个peg4分子作为接头偶联了igg的gdp-fucose,gdp-fucose-(peg4)n-igg为用n个peg4分子作为接头偶联了igg的gdp-fucose。在本发明的一个具体的实施方案中,n分别为1和2。其中,fucose-peg4
×
2-igg制备方法:tco-peg4-nhs(购自sigma)与抗体igg在室温下反应30分钟,获得tco-peg4-igg。gdp-azido-fucose(购自r&d system),与
methyltetrazine-peg4-azide或alkyne-peg4-nhs ester (购自click chemistry tools)在30
°
c反应6小时,获得gdp-fucose-peg4-methyltetrazine和gdp-fucose-peg4-nhs ester,分别与tco-peg4-igg和igg在室温下反应得到gdp-fucose-peg4
×
2-igg和gdp-fucose-peg4-igg。
[0036]
fut6,fut10和fut11重组酶,胎球蛋白作为受体底物,100
ꢀµ
m gdp-岩藻糖 (gdp-fucose),gdp-fucose-peg4-igg和gdp-fucose-(peg4)n-igg分别作为供体底物37度孵育30分钟,然后室温下加入 25
ꢀµ
l gdp 检测试剂 ,孵育60分钟,放入glomax
®ꢀ
96 微孔板发光检测仪 (cat# e6501),室温下读取。并用非线性回归拟合michaelis-menten方程后得到km值。当供体底物是gdp-fucose(分子量约为589.3)时,图3中显示fut6的酶活性高于fut10和fut11,用非线性回归拟合michaelis-menten方程后得到km值。fut6, fut10, fut11重组酶在以上的测试条件下的针对gdp-fucose的km值分别为 1.8 um, 2.3 um, 2.6 um(参见图3)。供体底物是gdp-fucose-peg4-igg时,fut6,fut10和fut11的km值约为1500~2500
µ
m,活力降低近1000倍;供体底物是gdp-fucose-(peg4)n-igg时,此时,gdp-fucose和igg之间的接头分子换成2个peg4,km值约为200~1000
µ
m,说明fut重组酶更容易识别小分子的gdp-fucose (分子量约为589.3)。相比一个peg4分子作为接头的gdp-fucose-igg, 2个peg4分子作为接头的gdp-fucose-(peg4)n-igg作为供体受体,更容易被fut重组酶识别。
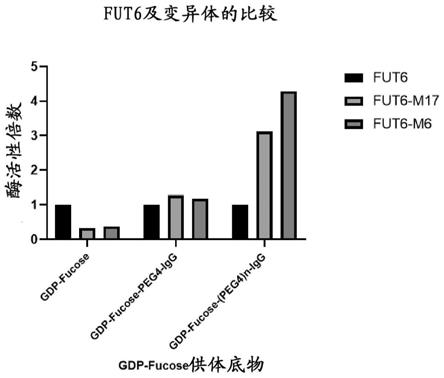
[0037] 实施例3. 突变fut6重组酶的制备和活性检测目前尚无研究显示岩藻糖基转移酶如何识别供体底物,也没有结构解析的数据。根据以上的试验,证实fut6不仅可以识别小分子的供体底物,也可以识别大分子供体底物。为了提高fut6识别大分子供体底物的能力,对fut6进行了氨基酸序列分析。人源的岩藻糖基转移酶一共有11种,与原核生物的岩藻糖基转移酶同属于糖基转移酶家族10 (glycosyltransferse family 10), 但是氨基酸一级序列无明显同源性。fut6与幽门螺杆菌的alfa-1,3岩藻糖基转移酶进行序列对比时发现,fut6有7处“缺口”(gap), 即,在seq id no. 1所示的野生型氨基酸序列的第 109 氨基酸至第110 氨基酸,第 126 氨基酸至第127 氨基酸,第 138氨基酸至第139 氨基酸,第 150 氨基酸至第151 氨基酸,第 170 氨基酸至第171 氨基酸,第 194 氨基酸至第195 氨基酸,第 299 氨基酸至第300 氨基酸的位置,推测这些缺口使得fut6在进化过程中结构更加稳定和紧凑,更容易识别小分子底物。因此如果用原核生物的相应序列,例如幽门螺杆菌的alfa-1,3岩藻糖基转移酶相对应的较为宽松的非保守性序列进行修补,可以使得fut6进行“退化”(devolution),从而识别底物更加宽容。根据这个设想,分别设计了18个突变体。突变的fut6重组酶分别进行表达和纯化,分别以gdp-fucose 和gdp-fucose-(peg4)n-igg作为岩藻糖供体,进行酶活力检测。结果显示,在seq id no. 1所示的野生型氨基酸序列的第 109 氨基酸至第110氨基酸或者第 170 氨基酸至第171氨基酸的位置插入宽松型序列,突变体的表达和纯化更容易获得理想的结果,继而带来对大分子供体底物的催化活性的提高。其中,fut6-m6(简称mut6,序列如seq id no. 3所示,核苷酸编码序列如seq id no. 4所示)为在seq id no. 1所示的野生型氨基酸序列的第 109 氨基酸至第110 氨基酸插入序列如seq id no. 7所示的宽松型序列, fut6-m17(简称mut17,序列如seq id no. 5所示,核苷酸编码序列如seq id no. 6所示)为在seq id no. 1所示的野生型氨基酸序列的第 170 氨基酸至第171氨基酸插入序列如seq id no. 8所示的宽松型序列。针对小分子的供体gdp-fucose,mut6 和 mut17与野生型的
fut6相比,酶活性下降3~4倍左右;而针对大分子的供体尤其是gdp-fucose-(peg4)n-igg,mut6 和 mut17与野生型的fut6相比,酶活性提高6倍。提高了对大分子供体底物的催化作用(参见图4和图5)。
[0038]
图4中, pbs缓冲液25
ꢀµ
l反应体积中含有40 ng 的fut6,fut6-m6和fut6-m17重组酶,0-40
ꢀµ
m胎球蛋白作为受体底物,供体底物100
ꢀµ
m,分别是gdp-岩藻糖 (gdp-fucose),gdp-fucose-peg4-igg和gdp-fucose-(peg4)n-igg。37度孵育30分钟,然后室温下加入 25
ꢀµ
l gdp 检测试剂 ,孵育60分钟,放入glomax
®ꢀ
96 微孔板发光检测仪 (cat# e6501),室温下读取。并用非线性回归拟合michaelis-menten方程后得到km值。当供体底物是gdp-fucose(分子量约为589.3d)时,fut6,fut6-m6和fut6-m17的km值分别为~1.7
µ
m, ~4.5
µ
m和5.9
µ
m;突变体的酶活性下降了3~4倍。当供体底物是gdp-fucose-peg4-igg(分子量约为150kd,比gdp-fucose大超过200倍)时,fut6,fut6-m6和fut6-m17的km值约为1300~1700
ꢀµ
m,活力降低近1000倍;供体底物是gdp-fucose-(peg4)n-igg时,此时,gdp-fucose和igg之间的接头分子换成2个peg4,fut6,fut6-m6和fut6-m17的km值分别为140
ꢀµ
m,34
µ
m 和 47
µ
m。
[0039]
图5中,fut6,fut6-m6和fut6-m17针对不同的供体底物gdp-fucose,gdp-fucose-peg4-igg和gdp-fucose-(peg4)n-igg的酶活性比较。突变体fut6-m6和fut6-m17识别小分子底物gdp-fucose的活性低于野生型fut,而识别大分子底物时,尤其是接头分子为2个peg4的gdp-fucose-(peg4)n-igg,突变体fut6-m6和fut6-m17显示出比野生型fut更高的活性。
[0040] 实施例4. 岩藻糖基转移酶的突变体催化的供体底物标记hek293活细胞fut6-m6(序列如seq id no. 5所示), fut6-m17(序列如seq id no. 6所示),分别在大肠杆菌和哺乳细胞中进行表达纯化,用于活细胞的标记。将hek293活细胞(~100万)悬浮在100μl含有 20 mm mgso4(例如cpda-1)和0.5%fbs的溶液中,ph值调节至5-6, 并依次加入0.1 mg/ml gdp-fucose-(peg4)n-igg和0.04 mg/ml fuctd-hisx6, fut6-mut6, fut6-mut17,在4度或者室温下,孵育20
ꢀ–ꢀ
30分钟后,用cpda-1(citrate phosphate dextrose adenine)清洗细胞两次。利用流式细胞仪和针对igg的荧光抗体分析细胞标记的效率,结果显示,在30分钟内,超过90%的细胞被有效地标记了igg。
[0041]
在100万hek293活细胞中加入供体底物gdp-fucose-(peg4)n-igg,并分别加入岩藻糖转移酶fuctd,fut-m6,fut-m17,在室温下孵育30分钟后对细胞进行检测。没有进行处理的hek293细胞(mock)作为阴性对照,同时转染了higg和migg的hek293细胞作为阳性对照(hek transfected w/ surface-higg and surface-migg)。用anti-human igg二抗检测higg在细胞表面的呈现,用anti-mouse igg二抗检测migg在细胞表面的呈现。 结果显示在岩藻糖转移酶fuctd,fut-m6,fut-m17的作用下,供体底物gdp-fucose-(peg4)n-igg转移至hek293细胞表面,并能够被anti-higg二抗识别(参见图6)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1