一种浅液层准静态的微藻培养系统及使用方法与流程
1.本技术涉及微藻生物技术领域,尤其涉及一种浅液层准静态的微藻培养系统及使用方法。
背景技术:
2.微藻是含有叶绿素a可进行光合作用的一类微生物的总称,胞内通常含有蛋白、油脂、多不饱和脂肪酸、多糖、天然色素、维生素等高附加值产物因此具有极高的价值,在食品、饲料、化妆品等行业已有广泛应用,同时在生物固碳、污水处理(减污降碳)、生物燃料、生物塑料及生物肥料生产等碳中和领域具有潜在的应用前景。
3.目前已知的微藻种类超过2万多种,但业已实现产业化的寥寥无几。制约微藻产业的瓶颈是光能利用率低、培养效率低导致的经济性差。而光生物反应器是微藻培养的重要基础,目前光生物反应器主要有开放式(跑道池、圆池等)和封闭式(列管式、水平管式、平板式、吊袋式等)两种。但都存在细胞密度低、产率低,耗水耗能的缺点。密度低势必造成所需生产水体体积大,推高采收能耗及成本。耗水尤其是大量的淡水,一方面造成培养基和水资源的浪费,另一方面污染周边受纳水体。封闭式反应器虽然可以提高细胞密度,但存在放大困难、成本高的问题,因此微藻光自养培养效率亟待提高以进一步降低生产成本。
技术实现要素:
4.本技术实施例的目的是提供一种浅液层准静态的微藻培养系统及使用方法,以解决相关技术中存在的单细胞受光不充分和藻细胞产率低、耗水耗能的技术问题。
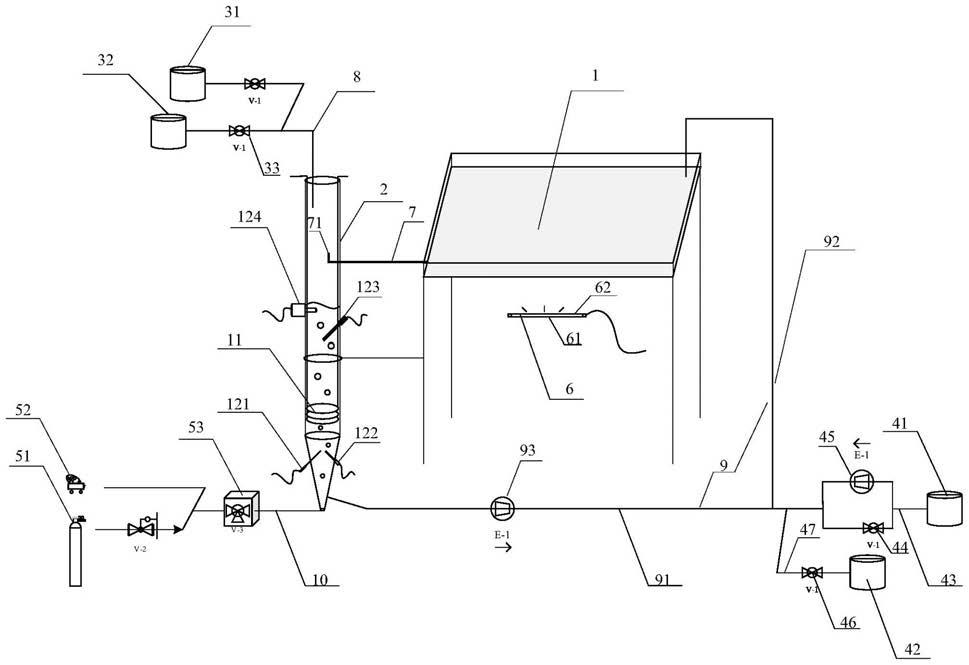
5.根据本技术实施例的第一方面,提供一种浅液层准静态的微藻培养系统,包括:
6.培养槽,用于容纳微藻及培养液;
7.交换柱,通过第一连接管与所述培养槽相连通,用于容纳培养液,所述第一连接管伸入所述交换柱的一端具有液位高度调节件;
8.管路循环驱动结构,包括第二连接管、第三连接管和第一泵,所述第二连接管的一端与所述交换柱相连通,另一端与所述第三连接管的一端相连通,所述第三连接管的另一端与所述培养槽相连通,所述第一泵设置在所述第二连接管上;
9.气体混合装置,通过第四连接管与所述交换柱的底部相连通;
10.温度调节装置,用于调节所述交换柱内部培养液的温度;及
11.补光装置,位于所述培养槽旁,用于给所述培养槽内的微藻进行补光。
12.进一步地,所述交换柱的上端为筒状,下端为锥状。
13.进一步地,还包括补液装置,所述补液装置通过第五连接管与所述交换柱相连通。
14.进一步地,所述补液装置包括:
15.用于补充无菌水的第一补液罐,及
16.用于补充培养基的第二补液罐,其中所述第五连接管的一端分别与所述第一补液罐和第二补液罐相连通,另一端通入所述交换柱。
17.进一步地,还包括集液装置,所述集液装置包括:
18.用于收集上清液的第一集液罐;
19.第六连接管,其一端与所述第一集液罐相连通,另一端连接在所述第二连接管和第三连接管的连接处;
20.第二泵和第一阀门,设置在所述第六连接管上,第二泵和第一阀门并联布置;
21.用于收集浓缩藻液的第二集液罐;
22.第七连接管,其一端与所述第二集液罐相连通,另一端连接在所述第二连接管和第三连接管的连接处;及
23.第二阀门,设置在所述第七连接管上。
24.进一步地,所述气体混合装置包括:
25.co2源和空气源,及
26.混合器,分别与所述co2源和空气源相连通,将两者混合后通过所述第四连接管与所述交换柱的底部相连通。
27.进一步地,所述补光装置包括:
28.灯架,及
29.安装在所述灯架上的光源。
30.进一步地,所述温度调节装置包括:
31.交换盘管,设置在所述交换柱内;及
32.热交换机,与所述交换盘管相连通。
33.进一步地,还包括:安装在所述交换柱上的传感器。
34.根据本技术实施例的第二方面,提供上述的一种浅液层准静态的微藻培养系统的使用方法,包括:
35.步骤s1.在补液装置中配置培养基,加入培养体系,形成浅液层;
36.步骤s2.接种藻细胞到培养体系的培养槽中;
37.步骤s3.先静置实现藻细胞沉降,让藻细胞附着在培养槽底面并静置培养;
38.步骤s4.启动第一泵,清液通过第二连接管和第三连接管流入培养槽实现准静态培养,通过气体混合装置向交换柱内通气实现补碳和氧气的解析,调节补光装置;
39.步骤s5.至培养结束,先收集上清液至第一集液罐,后收集培养槽中的浅层藻泥至第二集液罐,收集的上清液通过第二泵送至培养体系,其中含有的部分藻细胞作为接种量,启动第一泵,继续培养;
40.重复以上步骤s3~s5,按需利用补液装置中的培养基补足反应体系的体积。
41.本技术的实施例提供的技术方案可以包括以下有益效果:
42.与现有技术相比,本发明通过灵活调节液位高度,实现浅液层,又避免常规浅液层容易蒸发干涸的问题,实现自动化补液及维持液位深度,在培养槽中实现微藻的浅液层培养,节水和节省培养基,同时培养后可以实现初级浓缩,节省了采收成本,可以实现气液传质,溶解co2和解析氧气,实现热量交换,维持培养液的温度。无需搅拌装置,节省了能源,藻细胞准静态培养,通过清液的流动实现对藻细胞的营养供给和代谢物质的交换,并维持藻细胞的生长环境。通过ph与通气系统的偶联,在实现稳定ph的同时实现co2的补给。实现了稳定的自动化控制,并设有温度、ph及溶解氧的自动监测,随时监测培养环境并适当做出调
整,有利于实现工厂化和自动化培养。提高控制精准度。生产时间不受季节、天气和昼夜的影响、微藻曝光强度可控,微藻生长效率大幅度提高,在微藻固碳及微藻工业化生产等方面具有广阔前景。
43.综上所述,本技术的实施例提供的技术方案可以包括以下有益效果:(1)提高藻细胞的产率;(2)方便藻液浓缩和采收;(3)可进行连续工业化、自动化培养;(4)培养液可以回用,节水节能。
44.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本技术。
附图说明
45.此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本技术的实施例,并与说明书一起用于解释本技术的原理。
46.图1为本发明实施例提供的一种浅液层准静态微藻培养系统的结构示意图。
47.图2为本发明实施例提供的第一连接管及弯头装配示意图,其中(a)为主视图,(b)为左视图,(c)为俯视图。
48.图3为本发明实施例1~4浅液层深度对终细胞密度及单位面积产率的影响。
49.图中附图标记有:
50.1、培养槽;
51.2、交换柱;
52.3、补液装置;31、第一补液罐;32、第二补液罐;33、流量控制阀。
53.4、集液装置;41、第一集液罐;42、第二集液罐;43、第六连接管;44、第一阀门;45、第二泵;46、第二阀门;47、第七连接管;
54.5、气体混合装置;51、co2源;52、空气源;53、混合器;
55.6、补光装置;61、灯架;62、光源;
56.7、第一连接管;71、液位高度调节件;
57.8、第五连接管;
58.9、管路循环驱动结构;91、第二连接管;92、第三连接管;93、第一泵
59.10、第四连接管;
60.11、交换盘管;
61.12、传感器;121、温度探头;122、ph探头;123、溶解氧电极;124、液位电极。
具体实施方式
62.这里将详细地对示例性实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下示例性实施例中所描述的实施方式并不代表与本技术相一致的所有实施方式。相反,它们仅是与如所附权利要求书中所详述的、本技术的一些方面相一致的装置和方法的例子。
63.在本技术使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本技术。在本技术和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。还应当理解,本文中使用的术语“和/或”是指并包
含一个或多个相关联的列出项目的任何或所有可能组合。
64.应当理解,尽管在本技术可能采用术语第一、第二、第三等来描述各种信息,但这些信息不应限于这些术语。这些术语仅用来将同一类型的信息彼此区分开。例如,在不脱离本技术范围的情况下,第一信息也可以被称为第二信息,类似地,第二信息也可以被称为第一信息。取决于语境,如在此所使用的词语“如果”可以被解释成为“在
……
时”或“当
……
时”或“响应于确定”。
65.在光生物反应器内,可进行光合作用的微藻细胞的捕光特性及自遮挡效应导致藻液具有显著的光衰减特征,光线在其中的穿透性较差,而且随着细胞密度增加呈现指数型衰减趋势,特别是针对大容积的光生物反应器,其中大部分微藻通常处于光限制的状态,光能利用率低,生长受阻。常规的解决办法是加大混合,促进藻细胞在光暗区间的循环往复,实现均匀受光。但水体较大时为了维持均匀的混合,需要大量的动力消耗,而且通常藻细胞密度较低,因此极小比例的微藻的混合不得不经由大体积水体的混合来实现,所做的绝大部分是“无用功”,此外,相当多的微藻尤其是无细胞壁或有鞭毛微藻对剪切力敏感,加大混合反而会影响微藻活力。
66.另一方面,微藻生长依赖水环境,营养盐、co2需要借助水体的流动传质实现藻细胞与培养环境之间的物质交换,藻细胞也需要缓冲体系和渗透环境以保持自身形态并保障胞内生化反应的正常进行。基于以上特点,有研究提出新型培养方式如半干型贴附,但如果出现脱水等现象也会引起藻细胞的生长分裂停滞甚至死亡,此外表面水分极易因蒸发等因素造成营养组成波动,不利于藻细胞的稳态培养。
67.综上所述,发明人认为微藻培养的核心是增加受光面积,增强单个细胞对光能的可获得性,同时需加强传质,补充适量碳源,及时将光合作用产生的氧气排出,维持较低的溶解氧浓度,保证微藻培养的水环境以实现其他营养成分的充足供应。针对光生物反应器的优化,提高受光面积/体积比是关键。
68.实施例1:
69.参考图1,本发明实施例提供一种浅液层准静态的微藻培养系统,该系统可以包括:培养槽1、交换柱2、气体混合装置5、管路循环驱动结构9、温度调节装置和补光装置6。
70.所述培养槽1用于容纳微藻及培养液;具体地,所述培养槽1可以为水平放置的长方体容器(长宽高分别为100cm
×
100cm
×
10cm,可通过高度为100cm的支架进行固定。
71.所述交换柱2通过第一连接管7与所述培养槽1相连通,用于容纳培养液,通过鼓泡加速传热及传质,所述第一连接管7伸入所述交换柱2的一端具有液位高度调节件71;可以通过调节液位高度调节件71在所述第一连接管7端部的角度,以调节所述培养槽1内浅液层的深度,一般维持培养槽1中的浅液层深度在1cm及以下。具体地,所述液位高度调节件71可以为一弯头,也可以为多个管依次嵌套形成的伸缩组件,通过伸缩来调节高度;本实例以为例,参考图2,所述弯头旋接在所述第一连接管7的一端,通过调节旋转角度,即可调节培养槽1内浅液层的深度。
72.所述交换柱2的上端为筒状,下端为锥状。具体地,所述交换柱2为圆柱状,高度120cm,外径14cm,壁厚5mm,底部为锥形,锥高15cm,交换柱2通过支架固定。
73.管路循环驱动结构9,包括第二连接管91、第三连接管92和第一泵93,所述第二连接管91的一端与所述交换柱2相连通,另一端与所述第三连接管92的一端相连通,所述第三
连接管92的另一端与所述培养槽1相连通,所述第一泵93设置在所述第二连接管91上。通过启动第一泵93,实现培养液依次循环流经交换柱2、第二连接管91、第三连接管92、培养槽1、第一连接管7和交换柱2。
74.还包括补液装置3,所述补液装置3通过第五连接管8与所述交换柱2相连通,主要用于向所述交换柱2补给因蒸发而损失的水或者补充培养基,也还可用于更换后进行下一次补给培养。
75.具体地,所述补液装置3可包括:用于补充无菌水的第一补液罐31,及用于补充培养基的第二补液罐32,其中所述第五连接管8的一端分别与所述第一补液罐31和第二补液罐32相连通,另一端通入所述交换柱2。进一步地,为了可以更好的控制补给的量,可以在第一补液罐31和第二补液罐32安装流量控制阀。
76.还包括集液装置4,所述集液装置4是为了培养结束时采收及采收后清液回用,在正常培养运行过程中不启用。
77.具体地,所述集液装置4包括:第一集液罐41、第二集液罐42、第六连接管43、第一阀门44、第二泵45、第二阀门46、第七连接管47。第一集液罐41用于收集上清液;第六连接管43其一端与所述第一集液罐41相连通,另一端连接在所述第二连接管91和第三连接管92的连接处;第二泵45和第一阀门44设置在所述第六连接管43上,第二泵45和第一阀门44并联布置;第二集液罐42用于收集浓缩藻液;第七连接管47一端与所述第二集液罐42相连通,另一端连接在所述第二连接管91和第三连接管92的连接处;第二阀门46设置在所述第七连接管47上。
78.正常培养时,关闭第二泵45、第一阀门44及第二阀门46,打开第一泵93。收集清液至第一集液罐41时,关闭第二泵45、第二阀门46,打开第一阀门44、第一泵93。收集浓缩藻液至第二集液罐42时,将浓缩藻液经由第一连接管7转入交换柱2,关闭第一阀门44、第二泵45,打开第一泵93、第二阀门46。第一集液罐41中收集的清液因循环利用而需要返回培养系统时,关闭第一阀门44、第二阀门46和第一泵93,打开第二泵45直至输送完成后再关闭第二泵45。图中所示箭头方向为泵的输送方向。所述气体混合装置5通过第四连接管10与所述交换柱2的底部相连通,通过气体混合装置5,以实现碳源co2的稳定补给,将co2与空气混合达到设定的体积比后通入培养液,以提高co2的溶解率和利用率。
79.具体地,所述气体混合装置5包括:co2源51和空气源52及混合器53,所述混合器53分别与所述co2源51和空气源52相连通,将两者混合后通过所述第四连接管10与所述交换柱2的底部相连通。通过所述混合器53将co2源51和空气源52进行混合,以调节控制合理的co2浓度比例,该比例优选为2.5%。
80.所述补光装置6位于所述培养槽1旁,用于给所述培养槽1内的微藻进行补光。
81.具体地,所述补光装置6包括:灯架61,及安装在所述灯架61上的光源62。进一步地,所述光源62的光照强度为20~400μmol photons m-2
s-1
。
82.具体地,所述光源62可以采用led灯等,优选光照强度为50μmol photons m-2
s-1
。
83.所述温度调节装置用于调节所述交换柱内部培养液的温度,具体地所述温度调节装置可以包括:交换盘管11和热交换机。
84.所述交换盘管11设置在所述交换柱2内,所述热交换机与所述交换盘管相连通。进一步地,交换盘管11的直径1cm,螺旋直径为12cm,螺旋间距2mm,盘管高度为40cm。所述的交
换盘管11为铜管,其出入口与热交换器(未示出)相连接,通过传热介质水(热水或冰水)在管内的流动实现热量交换,使培养液温度恒定在25~28℃。
85.为了实时在线监控培养过程参数(温度、ph、溶解氧、液位等),该微藻培养系统还包括:安装在所述交换柱2上的传感器12。
86.本实例中,所述传感器12可以包括用于检测所述交换柱2内培养液温度的温度探头121、用于检测所述交换柱2内培养液ph值的ph探头122、用于检测所述交换柱2内培养液溶解氧的溶解氧电极123及用于检测所述交换柱2内培养液液位高度的液位电极124。
87.进一步地,所述温度探头121可以用于反馈控制所述交换盘管11;ph探头122和溶解氧电极123可以用于反馈控制所述气体混合装置5;所述液位电极124可以用于反馈控制所述补液装置3。
88.所述培养槽1及交换柱2的材质高透光有机玻璃材质,这样一方面方便观察,另一方面可以透光,以便进行光合作用。
89.本发明实施例还提供一种浅液层准静态的微藻培养系统的使用方法,该方法可以包括:
90.s1.在补液装置3中配置培养基,加入培养体系,形成浅液层;
91.s2.接种藻细胞到培养体系的培养槽1中;
92.s3.先静置实现藻细胞沉降,让藻细胞附着在培养槽1底面并静置培养;
93.s4.启动第一泵93,清液通过第二连接管91及第三连接管92流入培养槽1实现准静态培养,通过气体混合装置5向交换柱2内通气实现补碳和氧气的解析,调节补光装置6;
94.s5.至培养结束,先收集上清液至第一集液罐41,后收集培养槽1中的浅层藻泥至第二集液罐42。收集的上清液通过第二泵45送至培养体系,其中含有的部分藻细胞作为接种量,启动第一泵93,继续培养;
95.重复以上步骤s3~s5,按需利用补液装置3中的培养基补足反应体系的体积。
96.本发明实施例的工作原理是:利用藻细胞的沉降特性并结合其生长特性,先使得大部分藻细胞在培养槽1的底部停留,而含有培养基的培养清液在整个反应器内循环,形成藻细胞与培养液之间的相对运动,实现营养成分、代谢物的交换,并维持藻细胞生长的液体环境,同时藻细胞平铺在培养槽1中可以充分受光,提高藻细胞对光能的利用率。具体操作流程是:
97.通过在培养槽1中和交换柱2中加入过滤除菌的培养基,通过调节所述第一连接管7在所述交换柱2的竖直方向上的高度,维持培养槽1中的液位深度在10mm及以下,按照10%体积比接种藻细胞后静置12h,然后启动第一泵93(此时第二泵45停止、第一阀门44和第二阀门46关闭),使得上清液在培养槽1和交换柱2间循环,补液装置3与液位电极124监测相偶联,当液位低于设定值时,补充无菌水直至液位达到设定值,气体混合装置5与ph电极监测相偶联,当ph值高于设定值时,启动通气至ph降至设定值
±
0.5,自动化培养至藻细胞浓度增加缓慢时,调节弯头端口朝下,开启第一阀门44,通过第一集液罐41收集交换柱2及培养槽1中的清液,后关闭第一阀门44,启动第二阀门46,将培养槽1中附着的部分藻泥清扫并经由交换柱2和第二连接管91,收集于第二集液罐42,然后关闭第一泵93和第二阀门46,并将第一集液罐41中的清液通过第二泵45转移至培养槽1和交换柱2。而后关闭第二泵45,启动并经由第一泵93继续进行循环培养,液位电极124给出补液信号,打开流量控制阀,补充微
藻培养基至整个培养体系直至设定液位。启动第一泵93和补光装置6开启新一轮的培养。
98.热交换器及循环盘管内传热介质的流动与温度电极电信号相偶联,当温度高于设定值时,启动冷却液的循环,实现降温,一旦达到设定的温度值,即停止冷却液的循环。当微藻培养系统置于温度较低的环境下时,当温度低于设定值时,启动热流体的循环,实现升温,一旦达到设定的温度值,即停止热流体的循环。
99.本发明实施例所述的利用浅液层准静态微藻培养系统开展的微藻培养过程,主要包括培养前准备、培养及培养后处理三大步骤,其中培养前准备包括反应器(含管路、泵及阀门)的消毒、按照配方进行特定体积的培养基的配制、高压蒸汽灭菌或者过滤除菌,培养包括接种、过程自动控制和样品检测,培养后处理主要包括藻液(浆)采收、清液回用等步骤。
100.本说明书所述细胞干重、藻细胞数目的测定方法详见相关教科书及公开的文献材料。更具体地,细胞干重通过重量差法测定;细胞数目通过血球板计数方法获得。
101.对比例1
102.选取实施例1中的交换柱2(高透光有机玻璃材质的圆柱体,高度120cm,外径14cm,壁厚5mm,底部为锥形,锥高15cm,交换柱2通过支架固定,传感器12包括温度探头121、ph探头122、溶解氧电极123及液位电极124,交换柱2内设有交换盘管11,管直径1cm,螺旋直径为12cm,螺旋间距2mm,盘管高度为40cm)作为对照用柱式反应器,反应器装液体积为10l,反应器表面光强50μmol photons m-2
s-1
,在该反应器中培养淡水小球藻chlorella vulgaris,培养基及基本培养方法参见实施例1,所不同的是,接种后即开始鼓泡式培养。培养4天后,藻细胞密度1.25g l-1
,细胞产率0.24g l-1
d-1
。
103.对比例2
104.选取实施例1中的培养槽1(水平放置的长方体容器(长宽高分别为100cm
×
100cm
×
10cm))作为对照用反应器,封闭其与交换柱2的连接孔。保持培养液位10mm,反应器装液体积为10l,反应器表面光强50μmol photons m-2
s-1
,在该反应器中静置培养淡水小球藻chlorella vulgaris,培养基参见实施例1,接种后即开始静置培养。每日补充蒸发水量,通过鼓气使得培养液初始ph为7.5,培养过程中不调节ph,维持室温28
±
1℃,培养4天后,藻细胞密度0.55g l-1
,细胞产率0.06g l-1
d-1
,单位面积产率0.63g m-2
d-1
。
105.对比例3
106.选取常规实验型跑道池(尺寸:主体长宽高分别为140cm
×
50cm
×
40cm,沿长度方向中间设有隔板,隔板一侧安装蹼轮搅拌桨,跑道池两端半圆型;材质:pp)作为对比反应器,在该反应器中培养淡水小球藻chlorella vulgaris,培养液是以nano3为氮源的bg-11培养基。液位高度20cm,装液量为180l,搅拌转速15rpm,使得培养液平均整体流速约为0.05m s-1
,上部补光,使得液面处光强为50μmol photons m-2
s-1
,接种密度为0.3g l-1
。通入含co2体积分数为2%的空气二氧化碳混合气,通气量为18l min-1
,控制培养温度为28
±
1℃。培养7天后,藻细胞密度0.38g l-1
,细胞产率0.011g l-1
d-1
,单位面积产率2.94g m-2
d-1
。
107.实施例1
108.使用前先对培养槽1及交换柱2的内表面进行75%酒精喷洒(用量20~30ml m-2
)后晾干,而后用次氯酸钠水溶液对反应器及管路进行浸泡消毒,有效氯浓度100ppm,浸泡时间1~2h,而后在水体中加入10~25ppm硫代硫酸钠进行中和,直至碘试纸不变色,上述用水为
0.22μm膜过滤水。在该系统中培养淡水小球藻chlorella vulgaris,培养液是以nano3为氮源的bg-11培养基,培养基在补液罐32中进行配置。通过调节连接管道左侧弯头旋转角度,调节培养槽1中的液位深度为5mm,总装液体积为15l(培养槽1中5l及交换柱2中10l),接种密度为0.3g l-1
。接种后在培养槽1内静置培养12h,此过程不进行泵循环和调节ph,而后打开第一泵93,泵流速为400l h-1
,通入含co2体积分数为2.5%的空气二氧化碳混合气,其中空气由空气压缩机提供,而co2由液化钢瓶气提供,两者通过气体混合装置5按照比例混合后供气,通气量为2l min-1
,控制ph=7.5
±
0.5,控制培养温度为28
±
1℃。培养4天后,调节液位调节弯头朝下,先将清液回收(13l)至集液罐41,再收集附着的藻泥获得浓缩藻浆(2l)至集液罐42,藻浆中藻细胞终密度达到23.6g l-1
,清液中细胞密度0.7g l-1
,因此折合细胞体积密度为3.75g l-1
,面积产率为12.95g m-2
d-1
。实验期间,每日蒸发量约为1l,通过液位电极124及其反馈控制系统从补液罐31自动补加无菌水,由于室内温度恒定,本例中换热交换盘管11未使用。
109.实施例2
110.培养系统配置及培养方法同实施例1。其他保持不变,通过调节第一连接管7端部的弯头的旋转角度,调节培养槽1中的液位深度为10mm,装液体积为20l(培养槽1中10l及交换柱2中10l),观测培养结果,培养结束后收集清液(18l),再收集附着的藻泥获得浓缩藻浆(2l),藻浆中藻细胞终密度达到32.5g l-1
,清液中细胞密度0.1g l-1
,因此折合细胞体积密度为3.34g l1,面积产率为15.2g m-2
d-1
。
111.实施例3
112.培养系统配置及培养方法同实施例1。其他保持不变,通过调节第一连接管7端部的弯头的旋转角度,调节培养槽1中的液位深度为15mm,装液体积为25l(培养槽1中15l及交换柱2中10l),观测培养结果,培养结束后收集清液(23l),再收集附着的藻泥获得浓缩藻浆(2l),藻浆中藻细胞终密度达到30.7g l-1
,清液中细胞密度0.1g l-1
,因此折合细胞体积密度为2.55g l-1
,面积产率为14.05g m-2
d-1
。
113.实施例4
114.培养系统配置及培养方法同实施例1。其他保持不变,通过调节第一连接管7端部的弯头的旋转角度,调节培养槽1中的液位深度为30mm,装液体积为40l(培养槽1中30l及交换柱2中10l),观测培养结果,培养结束后收集清液(38l),再收集附着的藻泥获得浓缩藻浆(2l),藻浆中藻细胞终密度为20.8g l-1
,清液中细胞密度0.1g l-1
,因此折合细胞体积密度为1.14g l-1
,面积产率为8.35g m-2
d-1
。
115.实施例5
116.培养系统配置及培养方法同实施例1。其他保持不变,通过调节第一连接管7端部的弯头的旋转角度,调节培养槽1中的液位深度为60mm,装液体积为70l(培养槽1中60l及交换柱2中10l),观测培养结果,培养结束后收集清液(68l),再收集附着的藻泥获得浓缩藻浆(2l),藻浆中藻细胞终密度为13.2g l-1
,清液中细胞密度0.05g l-1
,因此折合细胞体积密度为0.43g l-1
,面积产率为2.20g m-2
d-1
。观察到藻液颜色显著不同于实施例1~4,呈现棕褐色。
117.实施例6
118.培养系统如图1所示,培养槽11为水平放置的长方体容器(长宽高分别为300cm
×
300cm
×
10cm),所用材质为10mm厚的高透光有机玻璃,通过高度为100cm的铝合金支架进行固定,交换柱2为高透光有机玻璃材质的圆柱体,高度120cm,外径40cm,壁厚5mm,底部为锥形,交换柱2通过支架固定,传感器12包括温度探头121、ph探头122、溶解氧电极123及液位电极124,交换柱2内设有交换盘管11,管直径1cm,螺旋直径为36cm,螺旋间距2mm,盘管高度为40cm,补液装置3包括第一补液罐31和第二补液罐32,其中第一补液罐31内装无菌水,第二补液罐32内装培养基;集液装置包括第一集液罐41及第二集液罐42,其中第一集液罐41主要用于收集上清液,第二集液罐42主要用于收集浓缩藻液。气体混合装置5通过调节co2和空气的混合比例,通过两者的流量调节,控制合理的co2浓度比例为2%,通气量为0.2vvm,补光装置6为在培养槽1的下侧面附近放置的9排led灯架61,光照强度可调,控制培养槽1表面光照强度为50μmol photons m-2
s-1
。
119.使用前先对培养槽1及交换柱2的内表面进行75%酒精喷洒(用量20~30ml m-2
)后晾干,而后用次氯酸钠水溶液对反应器及管路进行浸泡消毒,有效氯浓度100ppm,浸泡时间1~2h,而后在水体中加入10~25ppm硫代硫酸钠进行中和,直至碘试纸不变色,上述用水为0.22μm膜过滤水。在该系统中培养淡水小球藻chlorella vulgaris,培养液是以nano3为氮源的bg-11培养基,培养基在第二补液罐32中进行配置。总装液量为180l(培养槽1及交换柱2中各90l),接种密度为0.3g l-1
。接种后在培养槽1内静置培养12h,此过程不进行泵循环和调节ph,而后打开第一泵93,泵流速为4000l h-1
,通入含co2体积分数为2%的空气二氧化碳混合气,其中空气由空气压缩机提供,而co2由液化钢瓶气提供,两者通过气体混合装置5按照比例混合后供气,通气量为18l min-1
,控制ph=7.5
±
0.5,控制培养温度为28
±
1℃。培养4天后,打开第一阀门44,调节液位调节弯头朝下,先将清液回收(约160l)至第一集液罐41,再收集附着的藻泥获得浓缩藻浆(20l)至第二集液罐42,藻浆中藻细胞终密度达到30.2g l-1
,清液中细胞密度0.1g l-1
,因此折合细胞体积密度为3.44g l-1
,面积产率为15.7g m-2
d-1
。实验期间,每日蒸发量约为10l,通过液位电极124及其反馈控制系统从第一补液罐31自动补加无菌水,实验季节为秋季,为保持培养液温度恒定,本例中使用换热机连接交换盘管11用以保持培养温度。
120.实施例7
121.培养系统配置及培养方法同实施例2。其他保持不变,将泵更改为流速达4000l h-1
的循环泵,显著缩短培养清液的循环周期,观测培养结果。先将清液回收(约18l),再收集附着的藻泥获得浓缩藻浆(2l),藻浆中藻细胞终密度达到28.5g l-1
,清液中细胞密度0.25g l-1
,因此折合细胞体积密度为3.07g l-1
,面积产率为13.88g m-2
d-1
。
122.实施例8
123.培养系统配置同实施例2。培养方法参照实施例2,在该系统中培养海洋拟微球藻nannochloropsis sp.,培养液是以硝酸钠为氮源的改良asw培养基。初始接种密度0.3g l-1
,控制培养温度为25
±
1℃,培养光强调整为100μmol photons m-2
s-1
。培养4天后,打开第一阀门44,调节液位调节弯头朝下,先将清液回收(约18l),再收集附着的藻泥获得浓缩藻浆(2l),藻浆中藻细胞终密度达到25.8g l-1
,清液中细胞密度0.3g l-1
,因此折合细胞体积密度为2.85g l-1
,面积产率为12.75g m-2
d-1
。
124.实施例9
125.培养系统及方法同实施例7。将回收获得的18l清液通过泵循环回培养系统,另通
过第二补液罐32补加2l初始培养基,静置12h后,启动第一泵93,流量400l h-1
,继续进行培养,控制培养温度为25
±
1℃。培养4天后,打开第一阀门44,调节液位调节弯头朝下,先将清液回收(约18l),再收集附着的藻泥获得浓缩藻浆(2l),藻浆中藻细胞终密度达到20.8g l-1
,清液中细胞密度0.35g l-1
,因此折合细胞体积密度为2.40g l-1
,面积产率为10.48g m-2
d-1
。
126.实施例10
127.培养系统配置同实施例2,培养方法参照实施例2,在该系统中培养具有鞭毛的微藻,选取海洋微藻球等鞭金藻isochrysis galbana,培养液是以硝酸钠为氮源的f/2海水培养基,海水盐度36
‰
。控制光照强度为20μmol photons m-2
s-1
控制培养温度为25
±
1℃。培养初始细胞数目1.5
×
106cells ml-1
,培养7天后,打开第一阀门44,调节液位调节弯头朝下,先将清液回收(约18l),再收集附着的藻泥获得浓缩藻浆(2l),藻浆中藻细胞终密度达到90.5
×
106cells ml-1
,清液中细胞密度2.0
×
106cells ml-1
,因此折合体积细胞数为10.85
×
106cells ml-1
,生物量是初始接种量的7.23倍。显微观察表明细胞形态完好,大部分细胞仍具有鞭毛结构,少部分形成孢子态。
128.实施例11
129.培养系统配置同实施例2,培养方法参照实施例2,在该系统中培养较易附着的淡水硅藻舟形藻,培养液是以硝酸钙、硝酸钾为氮源并添加硅酸钠的csi培养基。控制光照强度为20μmol photons m-2
s-1
控制培养温度为25
±
1℃。培养初始细胞数目1.2
×
106cells ml-1
,培养7天后,打开第一阀门44,调节液位调节弯头朝下,先将清液回收(18.8l),再收集附着的藻泥获得浓缩藻浆(1.2l),藻浆中藻细胞终密度达到155
×
106cells ml-1
,清液中细胞密度0.2
×
106cells ml-1
,因此折合体积细胞数为9.5
×
106cells ml-1
,生物量是初始接种量的7.9倍。显微观察表明细胞形态完好。
130.以上为本发明公开的部分实施例,现结合具体实施方式分析讨论。实施例1~5的结果的比较分析(详见图3)表明,浅液层深度显著影响本发明公开的培养系统及方法的应用效果,优选的深度为5mm~60mm,更优选的为10mm~15mm,终细胞密度随着深度的增加而减少,具有显著的稀释效应,10mm组具有最高的单位面积产率。培养槽1中液位浅,浅液层中微藻光合作用产氧的解析更为方便快捷,然而其中水体流动性较差,不能形成整体流动,部分区域只能通过扩散,co2及营养元素的输送存在死区,因此生长部分受阻。相反,培养槽1中液位过深,则在相近的泵流量条件下,水槽水体的更新率较低,代谢废物的移除存在障碍,传热传质效率大为下降。因此需要控制浅液层的液位深度,以实现微藻培养环境的更新和传质。反观传统类型的跑道池(对比例3),液位深度通常在15~30cm,为促进传热及传质,需要搅拌桨推动水体整体流动,藻体与水体之间的相对运动仍然较差,仅依靠沉降及湍流来实现,但是由于水体较大,仅在搅拌桨附近存在明显的湍流,因此总体混合效果并不好。
131.实施例2和对比例1,2的结果表明:本发明的一个令人惊讶的结果在于,若单独实施交换柱式或者静态培养,藻细胞产率均较低,而将两者结合后能显著提高藻细胞产率。柱式反应器虽然有着均匀的混合,但是其随着直径的增加,光衰减极其严重,因此随着柱子直径的增加生产效率显著下降。但是将其作为交换柱,而不是作为光合作用的主要场所,就可以扬长避短发挥其传质传热效果佳的优势。培养槽1作为光合作用主场所,提高光照面积,减少藻体之间的相互遮挡,浅液层中藻体层也是毫米级,在光照穿透的范围之内,因此单细
胞的受光性显著提升。同时也可以看出,如果仅是静置(对比例2),由于传质及传热受限,细胞生长亦受限,而且细胞生长的环境尤其是co2及营养元素需要不断供给,而且培养的ph需要维持在合理的范围内,如果仅是静置培养,培养液的ph可以高达10.0及以上,显然不利于微藻的扩繁,因此需要不断维持良好的微藻培养的水体环境。
132.从实施例6与对比例3的结果的分析比较可以看出,虽然两者具有相同的装液体积,但本发明公开的系统及方法具有显著的优势,单位面积产率是前者的3.05倍。如前所述,跑道池提高液位深度主要目的是便于搅动形成混合,本发明公开的方法主旨是实现藻体和培养水体的相对运动,以达到充分交换的目的。相比之下,虽然同为敞开式反应器,本发明公开的系统及方法无需大功率的搅拌装置,而仅需小功率的输送泵(低扬程、小流量),因此节省了大量的能源消耗,同时更加安全。同时实施例6的结果表明本发明所述光生物反应器的体积放大是可行的,在受光面积增大9倍的情况下,单位面积产率15.7gm-2
d-1
甚至超过了实施例2中的小型反应系统。此外也表明,本发明的培养系统可以通过培养槽1和交换柱2之间的自由组合实现放大,组合方式包括培养槽1的串联或并联,以及交换柱2的串联或并联。
133.实施例7与实施例2的结果对比表明,提高泵流量未能显著增加细胞量和单位面积细胞产率,表明实施例2中的流量设置在合理的范围内,已经可以实现微藻正常生长所需的营养物质的供给和代谢废物的移除。同时也表明,为实现上述面积的光生物反应器系统的稳定运行,无需超大流量的清液置换和流动。表明流量与培养系统之间相匹配。
134.实施例8与9的结果表明:本发明的培养系统及方法的另一个显著优势是,采收后的清液可以重复利用进行二次培养,而且单位面积产率的下降幅度很小,表明虽然培养基的配比组成等与初始相比已经发生显著变化,本系统仍然可以促进微藻的生长和对营养元素的充分摄取。常规微藻培养需要对藻液进行采收后复用,如果采用絮凝等方法,清液中残留的絮凝剂等会抑制细胞生长从而限制了清液的循环利用,如果采用高速离心,强剪切往往造成部分细胞破碎导致清液组分发生较大变动,细胞碎片等也会影响下一批次的培养,而且胞内有机物外溶至清液容易滋生细菌、真菌等其他微生物,从而影响微藻生长和产物积累,因此本发明充分利用藻体的沉降特性,实现了藻体与清液的第一道分离,而且清液中的细胞通常是新分裂的小细胞,活力更强,因此更有利于后续的二次培养。
135.实施例8、10、11验证了本发明公开的浅液层准静态培养系统及方法在其他微藻(涵盖淡水及海水藻、有鞭毛和无鞭毛藻、底栖硅藻)培养中的运用,与已有的可公开获取的数据相比,本发明培养微藻的细胞产率较高,且可以用于饵料微藻的培养,经过培养,生物量可达初始接种量的7~8倍。说明了本发明具有极广泛的实用价值。
136.综上所述,通过系列的对比研究,并与已有的可公开获取的数据相比,本发明申请创新了微藻培养系统和方法,该系统及方法具有产率高、节水节能、连续化生产的特点。说明了本发明申请可以工业化实施,因此具有极广泛的实用价值。
137.以上实施例仅用以说明本发明的技术方案而非对其限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员依然可以对本发明的具体实施方式进行修改或者等同替换,这些未脱离本发明精神和范围的任何修改或者等同替换,均在申请待批的本发明的权利要求保护范围之内。
138.此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包
含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1