一种规模化生产套索肽21的方法与流程
1.本发明属于生物技术领域,尤其涉及一种规模化生产套索肽21的方法。
背景技术:
2.套索肽(lassopeptide)是一类具有生物活性的核糖体肽天然产物,因其独特的套索结构而得名,一般由15-26个氨基酸残基组成,分子量在1500-2500da之间。套索肽的n端一般为甘氨酸,其氨基可与第八或第九位的谷氨酸或者天冬氨酸的侧链羧基形成酰胺环,而其c末端尾部穿过环,从而形成稳定的拓扑结构,这一低熵的“套索”构型赋予了套索肽具有强的耐热性和抗蛋白酶水解活性。根据二硫键存在与否以及二硫键的数量将套索肽分为四大类,其中i类套索肽来源于链霉菌,ii类套索肽有源于革兰氏阴性菌,iii类来源于链霉菌,ⅳ类套索肽的二硫键连接c端尾上。根据基因组序列,绝大多数套索肽属于ii类。
3.ii类套索肽中,microcin j25(mcc j25)是套索肽的典型结构研究模型,不仅是最早发现的套索肽之一,且是最早鉴定出其生物合成基因簇的肽。mcc j25是由21残基质粒编码,具体由一个8残基循环和一13残基尾部组成,尾部循环返回并穿过循环。可抑制革兰氏阴性细菌rna聚合酶(rnap) 的活性,以及抑制革兰氏阴性细菌(主要或仅革兰氏阴性肠溶药物)的生长。
4.mcc j25可能是农业,动物生产和食品业消减和预防大肠杆菌和沙门氏菌的有效办法,文献报道:日粮添加mcc j25可提高断奶仔猪和肉鸡的生长性能,减缓腹泻和系统性炎症的发生,提高肠道屏障功能,改善粪便微生态组成。通过在小鼠模型中添加mcc j25的研究中,发现中剂量添加有正向的效果,高剂量添加有毒性风险。
5.套索肽主要通过基因工程和化学合成两种方法合成,其中基因工程合成主要通过异源表达套索肽,但是目前存在表达量低的技术问题。为了解决该问题,本技术人申请的公开号为cn113774006a 的中国发明专利申请,公开了一种高效表达mcc j25的工程菌株,构建时:分别对mcjabcd进行基因操作,成为一个方向,而且在大肠杆菌中共用一个启动子t7,克隆在载体pbr322,实现了在大肠杆菌的高效表达,表达量为2.4g/l。该专利构建了大肠杆菌表达载体和植物乳杆菌表达载体,实现了 mcc j25的高效表达。在大肠杆菌进行胞外表达和植物乳杆菌进行胞内表达,表达量分别达到为4.1g/l 和2.3g/l,为下一步生物兽药和饲料添加剂的应用奠定了基础。
6.上述专利提供的mcc j25的生产方法目前主要限于少量获得mcc j25,用于实验室研究,还无法进行在产业上规模化生产。
技术实现要素:
7.本发明的目的在于提供一种规模化生产套索肽21的方法,以至少解决上述技术问题之一。
8.本发明目的之一在于提供一种规模化生产套索肽21的方法,包括以下步骤:
9.s1、菌株活化:取重组大肠杆菌于培养基中活化,得到活化的重组大肠杆菌;
10.s2、采用摇瓶培养基培养活化的重组大肠杆菌制备摇瓶种子;
11.摇瓶培养基包括以下重量份原料:酵母提取物0.5-1.5份、酵母浸膏1-3份、甘油0.5-1.5份、蛋白胨0.5-1.5份、氯化钠0.3-0.6份、磷酸二氢钾0.3-0.6份、磷酸氢二钾0.2-0.5份、硫酸镁0.1-0.3份、硫酸铵4-6份;
12.s3、将s2得到的重组大肠杆菌接入种子罐培养基进行培养;种子罐培养基包括以下重量份原料:酵母提取物5-10份、玉米浆膏10-20份、蛋白胨5-10份、氯化钠3-8份、磷酸二氢钾3-8份、磷酸氢二钾3-8份、硫酸镁1-3份、硫酸铵5-20份、淀粉20-30份;
13.s4、将s3得到的重组大肠杆菌接入发酵培养基进行发酵,得到发酵液;发酵培养基包括以下重量份原料:酵母提取物20-40份、玉米浆膏10-15份、硫酸铵30-50份、玉米浆粉10-20份、氯化钠 10-20份、磷酸二氢钾10-30份、磷酸氢二钾10-30份、尿素20-30份、蔗糖40-60份;
14.s5-s8、将s4得到的发酵液过滤、浓缩和干燥后,得到套索肽。
15.优选地,s1的活化条件为32-36℃下活化12-16h。
16.优选地,s2的培养条件为:在32℃-36℃培养12-16h。
17.优选地,s3的培养条件为:32-36℃;0.01-0.1mpa;通气比0.5-1;4-8h后ph反弹至7.2-7.5。
18.优选地,s4的培养条件为:32-36℃;压力0.01-0.1mpa;通气比0.5-1;搅拌转速400-800r/min,溶氧维持在20-30%,流加质量百分比浓度为40-60%,葡萄糖溶液维持残糖在0.8-1.6%,流加氢氧化钠维持ph=6.8-7.4。
19.优选地,s5中,添加助滤剂、絮凝剂进行固液分离,收集板框滤液。
20.优选地,s5中,助滤剂为硅藻土10-50份;絮凝剂为聚合氯化铝0.1-0.5份和聚丙烯酰胺0.1-0.5 份。
21.优选地,将s5得到的板框滤液采用超滤膜截留3000da以下的截留液,再通过纳滤膜截留 1000-3000da的分子量,得到截留液。
22.优选地,s7中,将s6得到的截留液经三效浓缩,一效温度为70-80℃,二效温度为60-70℃,三效温度为50-60℃,压力为-0.2至-0.8mpa,得到三效浓缩液。
23.优选地,s8中,将s7得到的三效浓缩液进行喷雾干燥,得到套索肽。
24.本发明的原理和有益效果在于:
25.本发明所采用的重组大肠杆菌保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.24194。本发明是在公开号为cn113774006a的中国发明专利申请的基础上研发的规模化生产套索肽21的方法,实现了从实验室到工业规模化生产的成功转化。与实验室生产套索肽相比,本发明提供的方法规模化生产套索肽的产率在60-70%,为大规模生产套索肽提供了技术保障。
具体实施方式
26.下面通过具体实施方式进一步详细说明:
27.实施例1
28.一种规模化生产套索肽21的方法,具体包括以下步骤:
29.s1、菌株活化;
30.从-80℃的冰箱中取出保菌管,用挑菌环取重组大肠杆菌一环涂于固体培养基进行培养,在32℃活化12h,得到活化的重组大肠杆菌。
31.本实施例所采用的重组大肠杆菌是公开号为cn113774006a的中国发明专利申请中公开的高效表达mcc j25的工程菌株,本实施例不再赘述。
32.固体培养基为lb固体培养基,具体配制方法如下:称取胰化蛋白胨10kg、酵母粉5kg和氯化钠 10kg,加800l灭菌水溶解,并用玻璃棒搅拌均匀,用1mol/l的氢氧化钠调节ph=7.4左右,采用灭菌水定容至1000l,调至ph=7.4(若溶液至ph>7.4,采用1mol/l hcl回调)。将溶液分装入锥形瓶中,再加入2%的琼脂(例如150l的溶液中加入2.5kg琼脂)后在121℃下灭菌15min。
33.s2、制备摇瓶种子;
34.(1)配制摇瓶培养基,具体重量份如下:酵母提取物1份(1份为10kg)、酵母浸膏5份、甘油4份、蛋白胨4份、氯化钠0.5份、磷酸二氢钾0.5份、磷酸氢二钾0.3份、硫酸镁0.2份和硫酸铵 5份。
35.配制时,称取上述原料于锥形瓶中,加入灭菌水900ml,ph=7-8后再定容至1l。
36.(2)消毒:将锥形瓶于灭菌锅中,在121℃灭菌30min。
37.(3)控制:取s1得到的活化的重组大肠杆菌一株接种于摇瓶培养基中,在32℃培养12h,得到摇瓶种子。
38.s3、种子罐培养;
39.(1)种子罐培养基包括以下重量份原料:酵母提取物5份、玉米浆膏10份、蛋白胨5份、氯化钠3份、磷酸二氢钾3份、磷酸氢二钾3份、硫酸镁1份、硫酸铵5份、淀粉20份,体积500-1000l,初始ph=7-8。
40.称取上述原料于锥形瓶中,加入灭菌水900ml,ph=7-8后再定容至1l。
41.(2)消毒条件:将锥形瓶于灭菌锅中,在121℃灭菌30min。
42.(3)控制:将s2得到的重组大肠杆菌按接种量0.1%接入种子罐培养基进行培养;32℃;0.01mpa;通气比0.5;4h后ph反弹至7.2-7.5。
43.s4、发酵罐培养;
44.(1)发酵培养基包括以下重量份原料:酵母提取物20份、玉米浆膏10份、硫酸铵30份、玉米浆粉10份、氯化钠10份、磷酸二氢钾10份、磷酸氢二钾10份、尿素20份、蔗糖40份,体积 14000l-16000l,初始ph=7-8。称取上述原料于锥形瓶中,加入灭菌水900ml,ph=7-8后再定容至 1l。
45.(2)消毒:将锥形瓶于灭菌锅中,在121℃灭菌30min。
46.(3)控制:将s3得到的重组大肠杆菌按接种量1%接入发酵培养基进行发酵;32℃;压力0.01mpa;通气比0.5;搅拌转速400-800r/min,溶氧维持在20%,流加质量百分比浓度为40%,葡萄糖溶液维持残糖在0.8-%,流加氢氧化钠维持ph=6.8-7.4,流加消泡剂消泡。培养28h,收集发酵液。
47.s5、板框过滤;
48.助滤剂为硅藻土10份;絮凝剂为聚合氯化铝0.1份、聚丙烯酰胺0.1份、将发酵液ph调至3-5,用板框压滤机以压力0.4mpa来进行固液分离,收集板框滤液。
49.s6、超滤膜、纳滤膜截留;
50.板框滤液采用超滤膜截留3000da的分子量,再通过纳滤膜截留10000da的分子量,纳滤截留过程中控制ph在5-9,收集截留液。
51.s7、三效浓缩;
52.纳滤截留液经三效浓缩,一效温度为70℃,二效温度为60℃,三效温度为50℃,压力为-0.2mpa,得到三效浓缩液。
53.s8、喷雾干燥;
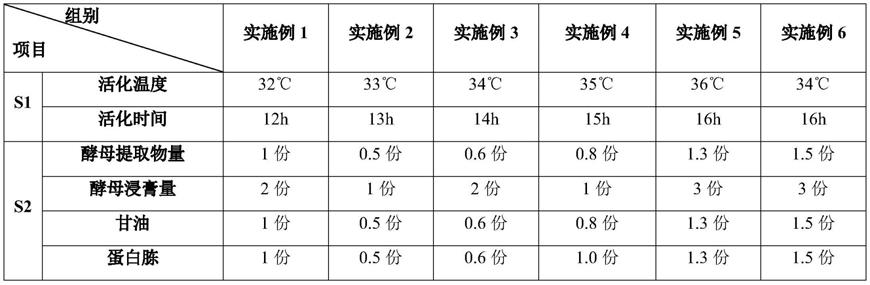
54.喷雾干燥将三效浓缩液ph调至8-13,添加载体为玉米淀粉10份、轻质碳酸钙5份、麦芽糊精5 份、喷干塔进风温度180℃,出风温度80℃,干粉水分5-10%,得到含量达0.06-0.1g/kg套索肽。
55.实施例2-6
56.实施例2-6与实施例1的主要区别如下表1所示:
57.表1:实施例1-6方法的主要区别
58.59.[0060][0061]
s1中:
[0062]
不同的菌群的活化温度不同,实施例1-6的重组大肠杆菌需要在32-36℃下活化12-16h,活化后的重组大肠杆菌刚刚进入指数生长期。
[0063]
s2中:
[0064]
实施例1-6的摇瓶培养基,具体重量份如下为:酵母提取物0.5-1.5份、酵母浸膏1-3份、甘油 0.5-1.5份、蛋白胨0.5-1.5份、氯化钠0.3-0.6份、磷酸二氢钾0.3-0.6份、磷酸氢二钾0.2-0.5份、硫酸镁0.1-0.3份、硫酸铵4-6份。将重组大肠杆菌接种到摇瓶培养基后在32℃-36℃培养12-16h。
[0065]
本实施例采用特定的摇瓶培养基,具体重量份如下、培养温度和培养时间,使得到的重组大肠杆菌处于对数生长的后期,具有较强的生长活力,可进行高密度生长。
[0066]
具体地,摇瓶培养基,具体重量份如下中同时添加了酵母提取物和酵母浸膏的原因在于:
①
酵母提取物和酵母浸膏为重组大肠杆菌的生长提供了有机氮源,硫酸铵为重组大肠杆菌的生长提供了无机氮源,三者搭配为重组大肠杆菌的生长提供了充足的氮源;
②
仅在酵母浸膏和酵母提取物的质量比= (3-5):1的情况下,得到的重组大肠杆菌的生长活性最高;
③
仅在同时添加酵母提取物和酵母浸膏的情况下可以大大提高重组大肠杆菌的生产速率及促进重组大肠杆菌中套索肽的形成。
[0067]
培养过程中,磷酸二氢钾、磷酸氢二钾的添加有助于保证摇瓶培养基ph的稳定。
[0068]
s3中:
[0069]
实施例1-6的种子罐培养基,具体重量份如下:酵母提取物5-10份、玉米浆膏10-20份、蛋白胨 5-10份、氯化钠3-8份、磷酸二氢钾3-8份、磷酸氢二钾3-8份、硫酸镁1-3份、硫酸铵5-20份、淀粉20-30份,体积500-1000l,初始ph=7-8。
[0070]
将摇瓶培养好的重组大肠杆菌按接种量0.1-0.5%接入种子罐培养基进行培养;32-36℃; 0.01-0.1mpa;通气比0.5-1;4-8h后ph反弹至7.2-7.5。
[0071]
s4中:
[0072]
实施例1-6的发酵培养基,具体重量份如下为:酵母提取物20-40份、玉米浆膏10-15份、硫酸铵30-50份、玉米浆粉10-20份、氯化钠10-20份、磷酸二氢钾10-30份、磷酸氢二钾10-30份、尿素20-30份、蔗糖40-60份。
[0073]
实施例1-6的发酵培养基能够促进重组大肠杆菌生长、酶促反应的进行与发酵产热的散发,也可以显著促进重组大肠杆菌菌群的生长繁殖,从而提高了发酵速度与套索肽产量。
[0074]
将种子罐培养好的重组大肠杆菌按接种量1-5%接入发酵培养基进行发酵;32-36℃;压力 0.01-0.1mpa;通气比0.5-1;搅拌转速400-800r/min,溶氧维持在20-30%,流加质量百分比浓度为 40-60%,葡萄糖溶液维持残糖在0.8-1.6%,流加氢氧化钠维持ph=6.8-7.4,流加消泡剂消泡。培养 28-38h,收集发酵液。
[0075]
实施例1-6将搅拌转速控制在400-800r/min,当仅改变搅拌转速时,在400-800r/min范围内,重组大肠杆菌的菌体密度增长较快且未产生大量泡沫,尤其是当转速控制在400r/min时,能够促进空气中氧溶解的同时,种子罐也未出现泡沫。
[0076]
当将压力控制在0.01-0.1mpa,通气比控制在0.5-1时,可以维持到67%的溶氧指数(溶氧指数是指测得水体的溶氧量与监测水体有相同水温和盐度时的饱和溶氧量之比)
[0077]
当仅改变溶氧量时,当溶氧量维持在20-30%时,重组大肠杆菌的菌体密度随着溶氧量的增加而增加,当溶氧量<20,或者溶氧量>30%时,重组大肠杆菌的菌体密度增长缓慢。
[0078]
当仅改变接种量时,当接种量维持在1-5%时,重组大肠杆菌的生长状态较佳,并且生长状态与发酵罐内的营养物质的消耗量匹配;当接种量<1%时,重组大肠杆菌的生长快,但是由于发酵罐内的营养物质相对较高,不能充分的吸收发酵罐内的营养物质而产生浪费;当接种量>5%时,重组大肠杆菌的生长慢,但是由于接种量过高而使发酵罐内的营养物质过早的大量消耗,不利于重组大肠杆菌后期生长,最后会浪费掉重组大肠杆菌。
[0079]
实施例1-6控制流加质量百分比浓度为40-60%,葡萄糖溶液维持残糖在0.8-1.6%,流加氢氧化钠维持ph=6.8-7.4,可以有效改变发酵培养基内液体流变学性质,增加氧的传递,提高重组大肠杆菌的摄氧率,从而有利于发酵进行。
[0080]
发酵罐培养后,实施例1-6产生的套索肽含量达到30-35g/l,其中实施例1的套索肽含量达到 35g/l。
[0081]
s5中:
[0082]
助滤剂为硅藻土10-50份;絮凝剂为聚合氯化铝0.1-0.5份和聚丙烯酰胺0.1-0.5份、将发酵液ph 调至3-5,用板框压滤机以压力0.4-0.8mpa来进行固液分离,收集板框滤液。板框压滤机的孔径为 4-7μm。
[0083]
s2和s3中的硫酸铵和硫酸镁,s4中添加的硫酸铵还有助于在s5中选择性沉淀重组大肠杆菌,并且有助于防止在s1-s4中代谢副产物乙酸积累,大肠杆菌高密度培养过程中,乙酸的积累容易出现抑制,甚至毒害重组大肠杆菌的问题。
[0084]
本步骤是规模化生产套索肽的主要瓶颈,s5中添加絮凝剂后,重组大肠杆菌、细胞
碎片和杂质等包裹在一起形成白色固体絮凝物,实验室中,采用简单的离心即可固液分离。工业生产采用离心,不仅获得大规模重组大肠杆菌的效率低,且高速离心产生的剪切力容易使重组大肠杆菌dna断裂,给后续纯化增加难度。
[0085]
本实施例采用过滤的方式固液分离,并添加助滤剂硅藻土能有效地提高过滤效率、降低过滤压力,避免宿主dna受到剪切力而断裂。添加的特定份数的絮凝剂聚合氯化铝和聚丙烯酰胺通过孔径为 4-7μm的板框压滤机有助于加速固液分离,选择性地获得大规模重组大肠杆菌。
[0086]
s6中:
[0087]
板框滤液采用超滤膜截留3000da以下的截留液,再通过纳滤膜截留1000-3000da的分子量,纳滤截留过程中控制ph在5-9,收集截留液。
[0088]
s5后,大量的宿主蛋白存在于板框滤液中,经过超滤膜和纳滤膜截留,可将各种微生物阻留在超滤膜和纳滤膜上,从而达到除菌的目的。
[0089]
s7中:
[0090]
截留液经三效浓缩,一效温度为70-80℃,二效温度为60-70℃,三效温度为50-60℃,压力为-0.2 至-0.8mpa,得到三效浓缩液。浓缩过程中,在不堵塞管道的同时,得到三效浓缩液。
[0091]
s8中:
[0092]
将三效浓缩液ph调至8-13,添加载体玉米淀粉10-50份、轻质碳酸钙5-30份、麦芽糊精10-30 份、喷干塔进风温度180-220℃,出风温度80-120℃,干粉水分5-10%,得到产率为60-70%的套索肽。
[0093]
对比例
[0094]
高效表达mccj25的工程菌株的发酵工艺,包括以下步骤:
[0095]
步骤一:准备lb罐,lb罐内培养基的组成为10g/l胰蛋白胨+5g/l酵母提取物+10g/l氯化钠,纯化水定容至1l,121℃高压灭菌后待用;
[0096]
步骤二:将菌种接种于lb罐内,进行扩大培养;
[0097]
步骤三:准备发酵罐,罐内培养基的组成为20g酵母粉+6g kh2po4,ph6.2,溶于1l去离子水中,高温高压灭菌;
[0098]
步骤四:将种液接种于发酵罐内,进行发酵培养,获得产率为51%的套索肽,对比实施例1-6和对比例得到的套索肽发现,扩大生产后,实施例1-6的方法规模化生产套索肽的产率不但没有降低,反而小试的对比例高,为大规模生产套索肽提供了技术保障。
[0099]
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术人员无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1