DCMU在提高微藻混养发酵时叶绿素产量或强光耐受性中的应用
dcmu在提高微藻混养发酵时叶绿素产量或强光耐受性中的应用
技术领域
1.本发明属于微藻生物技术领域,特别涉及dcmu在提高微藻混养发酵时叶绿素产量或强光耐受性中的应用。
背景技术:
2.微藻是一类单细胞光合微型生物的总称。微藻已经成为传统陆生植物的一个有吸引力的替代品,用于生产叶绿素、生物燃料和其他高价值产品,同时缓解耕地、二氧化碳排放和全球变暖的压力。然而,实现微藻产品的高生产率仍然是微藻商业应用的主要挑战。微藻的混养发酵是指微藻同时利用有机物和光照进行生长的一种培养模式,由于兼具光合自养生长与异养生长的优势,微藻的混养发酵可以成为一种提升微藻生长速度与产物产量的方法,如小球藻、衣藻、微拟球藻、斜生栅藻等微藻都被发现可以进行混养生长。混养发酵技术在微藻生成生物柴油、生物制品等方面的优势已经得到了广泛的研究。然而,微藻在利用自然光进行生长时,由于自然光的不可调节,当其光强过强时(如正午时)会对微藻产生光损伤,从而抑制微藻的生长速度。诸如人工光照控制系统、人工遮阳等光照控制方法虽然可以在一定程度上缓解过强光照对微藻的损伤,提高微藻的生长速度,但是面临成本太高、操作繁琐等问题,无法在工业水平上得到应用。因此,需要找到新的廉价且高效的提升微藻高光强耐受性的方法。
技术实现要素:
3.本发明的目的在于克服现有技术的缺点与不足,提供dcmu在提高微藻混养发酵时叶绿素产量或强光耐受性中的应用。
4.本发明的目的通过下述技术方案实现:dcmu(二氯苯基二甲脲)在提高微藻混养发酵时叶绿素产量或强光耐受性中的应用,是基于本发明发明人发现dcmu在微藻混养发酵中具有提高微藻叶绿素产量或强光耐受性的作用得到的研究成果。
5.所述的dcmu在提高微藻混养发酵时叶绿素产量或强光耐受性中的应用,具体包括如下步骤:将微藻接种于含有dcmu的混养培养基中进行光照培养。
6.所述的微藻为能进行混养生长的微藻,优选为小球藻、衣藻、微拟球藻或斜生栅藻。
7.所述的小球藻优选为凯氏拟小球藻。
8.所述的微藻优选为用自养培养基富集培养得到的微藻。
9.所述的自养培养基优选为bg11培养基。
10.所述的微藻的接种量优选按混养培养基体积百分比1~3%计算。
11.所述的微藻优选为细胞密度是1
×
108~1
×
109个/ml的微藻。
12.所述的dcmu在所述的混养培养基中的浓度为20~100 μg/l;优选为40~80 μg/l;更优选为60~80 μg/l。
tris 碱(tris-base),ph=7.00。
29.(3)将凯氏拟小球藻种子液按2%体积比接种至微藻葡萄糖混养培养基及自养bg11培养基中,添加不同终浓度的dcmu(0、5、10、20、40、80、120、160、200、300 μg/l),将凯氏拟小球藻培养物置于光照培养箱中培养,培养条件为:30℃、6000 lux光照,16/8小时光照周期培养3天,测量生物量(干重)变化。结果如图1所示:a、dcmu会抑制凯氏拟小球藻的自养生长,且抑制能力随着dcmu添加量的增加而增加,当dcmu添加量在160 μg/l以上时,对凯氏拟小球藻具有致死效果。
30.b、当凯氏拟小球藻混养生长时,随dcmu添加量的增加,凯氏拟小球藻生长速度呈现先上升后下降的趋势。dcmu添加量在20-80 μg/l时,显著促进凯氏拟小球藻的生长,dcmu添加量大于80 μg/l时会抑制凯氏拟小球藻的混养生长。
31.可见,dcmu对凯氏拟小球藻自养生长和混养生长具有不同的影响。
32.干重的测定方法:首先建立微藻od
680
与微藻干重之间的标曲,通过测量微藻培养液od
680
换算微藻干重。实施例中凯氏拟小球藻(parachlorella kessleri)fachb-4 干重标曲为:干重(g/l)=0.423
×
od
680-0.005。
33.实施例2:(1)以凯氏拟小球藻(parachlorella kessleri)fachb-4 (购自中国科学院淡水藻种库)为微藻藻种,首先用bg11培养液进行富集培养,当凯氏拟小球藻的细胞密度达到1
×
108~1
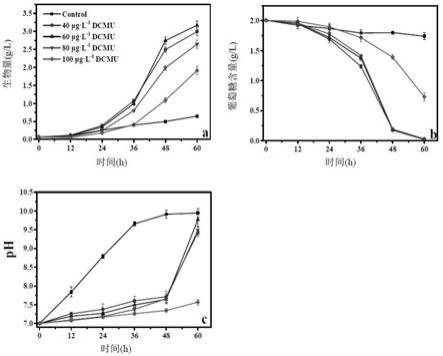
×
109个/ml时,获得凯氏拟小球藻种子液。bg11培养液的成分为:nano
3 1.5 g/l、k2hpo
4 40 mg/l、mgso4·
7h2o 70 mg/l,cacl2·
2h2o40 mg/l、柠檬酸 6 mg/l、柠檬酸铁铵 6 mg/l、edta-na
2 1 mg/l、na2co
3 20 mg/l、h3bo
3 2.86 mg/l、mncl2·
4h2o 1.86 mg/l、znso4·
7h2o 0.22 mg/l、na2moo4·
2h2o 0.39 mg/l、cuso4·
5h2o 0.08 mg/l、co(no3)2·
6h2o 0.05 mg/l,ph=7.00。
34.(2)配置微藻葡萄糖混养培养基,培养基为bg11培养基外加2 g/l葡萄糖,2 g/l tris 碱(tris-base),ph=7.00。
35.(3)将凯氏拟小球藻种子液按2%体积比接种至微藻葡萄糖混养培养基,添加不同终浓度的dcmu(0、40、60、80μg/l),将凯氏拟小球藻培养物置于光照培养箱中培养,培养条件为:30℃、6000 lux光照,16/8小时光照周期。
36.(4)每间隔12h取样,测量培养液的葡萄糖含量、凯氏拟小球藻的干重以及叶绿素含量,结果如图2所示:a、未添加dcmu的空白对照组,经过12小时的培养,凯氏拟小球藻叶绿素含量从最初的12.5 mg/g降低至4.97 mg/g,降低幅度超过50%,而添加dcmu后,叶绿素含量的降低得到明显的缓解,且dcmu添加量越大,叶绿素的含量降低的越少。添加80 μg/l dcmu时,经过12小时的培养,凯氏拟小球藻叶绿素含量为10.63 mg/g,为未添加dcmu时的2.14倍。经过72小时的培养,凯氏拟小球藻在含60 μg/l的dcmu培养基中混养生长的生物量为2.94 g/l,比空白对照提高18.55%。且凯氏拟小球藻在含60 μg/l的dcmu培养基中混养生长的叶绿素产量为49.19 mg/l,比空白对照提高81.36%。这一结果也说明dcmu的添加可以显著的提升凯氏拟小球藻的叶绿素产量以及生长速度。
37.b、随着培养基时间的推移,培养液内的葡萄糖含量降低,可见,凯氏拟小球藻利用了培养液内的葡萄糖,是以混养方式进行生长。
38.干重的测定方法同上。
39.叶绿素含量的测定:取2 ml微藻培养液,10000 rpm,离心2 min,去掉上清液;加入100
ꢀµ
l蒸馏水重悬微藻,加入1.9 ml 无水乙醇,75℃水浴5 min,10000 rpm离心2 min,收集上清液;记录下总上清液体积,以95%乙醇为空白,在波长665 nm、649 nm和750 nm下测定吸光度。根据公式进行叶绿素含量换算:总叶绿素(mg/l) chl=chla+chlb=6.10 od
665
+20.04 od
649
。
40.葡萄糖含量的测定使用3,5-二硝基水杨酸法:检测液成分(1 l):3,5二硝基水杨酸 6.3 g,naoh 21g,knac4h
12o10
·
4h2o 182g,苯酚 5g,na2so
3 5g。将发酵液稀释20倍与检测液按体积比1:3混合,100℃水浴5min,检测540 nm吸光度,对照标准曲线计算得到葡萄糖含量。
41.实施例3:(1)以凯氏拟小球藻(parachlorella kessleri)fachb-4为微藻藻种,首先用bg11培养液进行富集培养,当凯氏拟小球藻的细胞密度达到1
×
108~1
×
109个/ml时,获得凯氏拟小球藻种子液。bg11培养液的成分为:nano
3 (1.5 g/l),k2hpo
4 (40 mg/l),mgso4·
7h2o (70 mg/l),cacl2·
2h2o (40 mg/l),柠檬酸(6 mg/l),柠檬酸铁铵(6 mg/l),edta-na
2 (1 mg/l),na2co
3 (20 mg/l),h3bo
3 (2.86 mg/l),mncl2·
4h2o (1.86 mg/l),znso4·
7h2o (0.22 mg/l),na2moo4·
2h2o (0.39 mg/l),cuso4·
5h2o (0.08 mg/l),co(no3)2·
6h2o (0.05 mg/l),ph=7.00。
42.(2)配置微藻葡萄糖混养培养基(b+g培养基),培养基为bg11培养基外加2 g/l葡萄糖,2 g/l tris 碱(tris-base),ph=7.00。
43.(3)将凯氏拟小球藻种子液按5%(v/v)接种量分别接种至微藻葡萄糖混养培养基(b+g)及含有60 μg/l dcmu的微藻葡萄糖混养培养基(b+g+dcmu)中,6000 lux培养24小时后,得到低叶绿素含量微藻藻种(经微藻葡萄糖混养培养基培养后得到的微藻)及高叶绿素含量微藻藻种(经含有60 μg/l dcmu的微藻葡萄糖混养培养基培养后得到的微藻)。
44.(4)将低叶绿素含量微藻藻种按体积比1:1比例转接至新的bg11培养基,得到低叶绿素-自养实验组;将低叶绿素含量微藻藻种按体积比1:1比例转接至新的微藻葡萄糖混养培养基,得到低叶绿素-混养实验组;将高叶绿素含量微藻藻种按体积比1:1比例转接至新的bg11培养基,得到高叶绿素-自养实验组;将高叶绿素含量微藻藻种按体积比1:1比例转接至含有60 μg/l dcmu的bg11培养基,得到高叶绿素-自养-dcmu实验组;将高叶绿素含量微藻藻种按体积比1:1比例转接至微藻葡萄糖混养培养基,得到高叶绿素-混养实验组;将高叶绿素含量微藻藻种按体积比1:1比例转接至含有60 μg/l dcmu的微藻葡萄糖混养培养基,得到高叶绿素-混养-dcmu实验组。将前述实验组在6000 lux、30℃条件下培养12 h。
45.(5)测量接种1 h后培养体系内葡萄糖含量变化,测量培养前后凯氏拟小球藻的干重以及叶绿素含量变化,结果如图3所示:a、高叶绿素含量的凯氏拟小球藻相比于低叶绿素含量的凯氏拟小球藻,其自养生长速度及混养生长速度都得到显著的提高,说明叶绿素含量的增加可以提高微藻的生长速度。
46.b、高叶绿素含量的凯氏拟小球藻重新添加60 μg/ldcmu后,凯氏拟小球藻的自养及混养生长速度都会受到一定程度的抑制。dcmu是一种光合作用抑制剂,可以抑制微藻的
光合作用,从而抑制微藻的自养生长,而微藻混养生长时,其生长速度是自养生长和异养生长的叠加状态,所以dcmu也会在一定程度上影响微藻的混养生长速度。
47.c、高叶绿素含量的凯氏拟小球藻重新添加60 μg/ldcmu后,其自养生长速度与低叶绿素含量的凯氏拟小球藻的生长速度无显著性差异。这一结果说明叶绿素含量的提高对凯氏拟小球藻生长速度的提升效果与dcmu对凯氏拟小球藻自养生长的抑制效果相抵消,使得最终高叶绿素含量的凯氏拟小球藻在含60 μg/l dcmu的培养基中生长时,其自养生长速度与低叶绿素含量的凯氏拟小球藻的生长速度无显著性差异。
48.d、高叶绿素含量的凯氏拟小球藻重新添加60 μg/ldcmu后,其混养生长速度显著高于低叶绿素含量的凯氏拟小球藻的混养生长速度。由于前面已知高叶绿素含量的凯氏拟小球藻在含60 μg/ldcmu的培养基中生长时,其自养生长速度与低叶绿素含量的凯氏拟小球藻的生长速度无显著性差异,因此混养生长速度的提升肯定与凯氏拟小球藻的异养生长相关。
49.e、通过测量接种1 h后培养基葡萄糖含量变化可知,高叶绿素含量的凯氏拟小球藻对于葡萄糖的吸收速度要明显快于低叶绿素含量的凯氏拟小球藻,而60 μg/ldcmu的添加也并不会影响凯氏拟小球藻对葡萄糖的吸收速度。根据文献报道,微藻对于葡萄糖的吸收是通过同向质子通道,这一过程是需要消耗atp的,而atp的供给很大程度上由光合系统i主导的环式光合磷酸化途径提供。dcmu会通过抑制光合系统ii上的电子传递抑制光合作用及卡尔文循环,但是并不会对光合系统i主导的环式光合磷酸化途径产生影响。从而发明人认为,高叶绿素含量将提升环式光合磷酸化产atp途径,以提高微藻对葡萄糖的吸收,并最终提升微藻的混养生长速度。
50.总结以上实验结论,发明人推测dcmu提高微藻混养生长状态下的光耐受性机制为:1、dcmu通过抑制微藻的光合系统ii,降低微藻所受到的光损伤,降低叶绿素被光损伤的程度,使得微藻可以在高光强下保持更高的叶绿素含量;2、高叶绿素含量提升微藻光合系统i所主导的微藻环式光合磷酸化途径,提供更多的atp以提高微藻对于葡萄糖的吸收速度;3、高叶绿素含量所带来的光合作用的提升抵消了dcmu对于光合作用的抑制,使得微藻自养速度并不受dcmu的影响,而更快的葡萄糖吸收利用速度则提高了微藻的异养生长速度,使得最终微藻的混养生长速度得以提升。
51.实施例4:(1)以凯氏拟小球藻(parachlorella kessleri)fachb-4为微藻藻种,首先用bg11培养液进行富集培养,当凯氏拟小球藻的细胞密度达到1
×
108~1
×
109个/ml时,获得凯氏拟小球藻种子液。bg11培养液的成分为:nano
3 (1.5 g/l),k2hpo
4 (40 mg/l),mgso4·
7h2o (70 mg/l),cacl2·
2h2o (40 mg/l),柠檬酸(6 mg/l),柠檬酸铁铵(6 mg/l),edta-na
2 (1 mg/l),na2co
3 (20 mg/l),h3bo
3 (2.86 mg/l),mncl2·
4h2o (1.86 mg/l),znso4·
7h2o (0.22 mg/l),na2moo4·
2h2o (0.39 mg/l),cuso4·
5h2o (0.08 mg/l),co(no3)2·
6h2o (0.05 mg/l),ph=7.00。
52.(2)配置不同葡萄糖含量的微藻混养培养基,培养基为bg11培养基外加2 g/l葡萄糖,2 g/l tris碱,ph=7 .00。
53.(3)将凯氏拟小球藻种子液按2%体积比接种至不同葡萄糖含量的微藻混养培养基中,添加终浓度为60 μg/l的dcmu,将凯氏拟小球藻培养物置于光照培养箱中培养72 小时,
培养条件为:30℃,2000、4000、8000、12000 lux光照强度,16/8小时光照周期。同时设置对照组(ck),对照组为不添加dcmu。
54.(4)通过测量凯氏拟小球藻的干重及叶绿素含量衡量凯氏拟小球藻的光耐受性和叶绿素产量,结果如图4所示:经过24小时培养,凯氏拟小球藻叶绿素含量随光照强度的增大而降低;在2000、4000、8000、12000 lux光照强度下,添加dcmu实验组凯氏拟小球藻叶绿素含量是空白对照的1.35、2.02、2.3、2.6倍。经过72小时培养,空白对照在光照强度大于4000 lux后,生物产量出现下降,说明过强的光强抑制了凯氏拟小球藻的生长,而添加dcmu实验组生物量则呈现略微上升的趋势。在2000、4000、8000、12000 lux光照强度下,添加dcmu实验组凯氏拟小球藻生物量相比于空白对照提升6.03%、13.93%、22.64%、40.12%。这一结果说明dcmu的添加可以显著的提升凯氏拟小球藻对高光强的耐受性,且光照强度越大,dcmu对凯氏拟小球藻叶绿素的保护作用越明显,对凯氏拟小球藻混养生长的促进作用越明显。
55.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1