一种人脂肪间充质干细胞的分离培养方法及分化鉴定方法
1.本发明涉及细胞培养技术领域,尤其涉及一种人脂肪间充质干细胞的分离培养方法及分化鉴定方法。
背景技术:
2.间充质干细胞具有自我更新和多向分化的潜能,是组织工程的重要组成部分,最早于1974年在骨髓中被发现,主要包括骨髓间充质干细胞、胎盘间充质干细胞、脂肪间充质干细胞及脐带间充质干细胞等。其中,脂肪间充质干细胞是一种从脂肪组织中获取的间充质干细胞,主要来源于脂肪组织的基质血管部分。zuk等人在2001年首次利用吸脂术在脂肪中分离出了脂肪间充质干细胞,为干细胞的研究提供了新的方向。脂肪间充质干细胞可以通过分泌细胞因子、脂肪因子、生长因子、血管生成因子和神经营养因子来刺激正常组织功能的恢复或减少损伤,从而促进组织再生和修复。
3.与其它间充质干细胞相比,脂肪间充质干细胞具有以下优势:
①
脂肪间充质干细胞提取浓度明显高于骨髓、胚胎、脐带等其它来源的间充质干细胞;
②
脂肪间充质干细胞获得的途径多且方法较为简单;
③
脂肪间充质干细胞体外增殖能力强,更易培养;
④
脂肪间充质干细胞更适合同种异体移植;
⑤
脂肪间充质干细胞受到伦理学的限制较小。
4.目前,体外培养脂肪间充质干细胞尚无标准化的方法,大部分研究者采用胶原酶消化法、组织块法及双通脂肪乳糜器提取脂肪间充质干细胞,而基础培养基、胶原酶的种类与浓度、消化时间、离心的转速及时长等都存在差异。由于脂肪间充质干细胞属于脂肪组织中的基质血管成分,在提取的过程中如果消化不完全,就会极大降低提取的浓度,且供体的性别及脂肪组织的提取部位也会影响脂肪间充质干细胞的获取浓度,同时,高龄、肥胖、糖尿病和内分泌治疗等会降低脂肪间充质干细胞的增殖和分化潜能。
5.因此,一种能够培养出具有体外增殖能力强且可以多向分化的间充质干细胞的方法亟待研究。
技术实现要素:
6.针对上述现有技术存在的不足之处,本发明提供了一种人脂肪间充质干细胞的分离培养方法及分化鉴定方法。
7.本发明第一方面提供的一种人脂肪间充质干细胞的分离培养方法,包括:
8.获取脂肪组织冲洗至无血色,剪成1mm3大小的碎块;
9.通过i型胶原酶对所述脂肪组织碎块进行消化处理;待消化结束后,加入dmem培养基终止消化,获得消化液;
10.离心去除所述消化液的上清,将未消化完全的结构松散的组织块及下层的细胞团重悬,获得细胞重悬液;
11.将所述细胞重悬液置于培养皿中并放入培养箱中培养,获得人脂肪间充质干细胞。
12.进一步的,所述dmem培养基包括含体积比为10%的胎牛血清和体积比为1%的青链霉素的低糖dmem培养基,所述dmem培养基中还含有摩尔浓度为2mmol/l的谷氨酰胺。
13.进一步的,所述通过i型胶原酶对所述脂肪组织碎块进行消化处理,包括:
14.向所述脂肪组织碎块中加入与所述脂肪组织碎块体积相同的0.1%i型胶原酶,在37℃的温度下,以180~210rpm的震荡速度震荡消化25~35min,完成对所述脂肪组织碎块的消化处理。
15.进一步的,在获得消化液之后,将所述消化液以900~1100r
·
min-1
的速度离心15~20min,将所述消化液进行离心分离。
16.进一步的,在将未消化完全的结构松散的组织块及下层的细胞团重悬时,所用的重悬液与所述dmem培养基相同。
17.进一步的,将所述细胞重悬液置于培养皿中并放入培养箱中培养,包括:
18.所述细胞重悬液置于培养皿并放入恒温培养箱内,稳定培养;待细胞融合至80%-90%,按1:3的比例进行传代培养。
19.本发明第二方面提供的一种人脂肪间充质干细胞的分化鉴定方法,包括:
20.将通过上述所述的分离培养方法培养的人脂肪间充质干细胞用0.25%胰蛋白酶消化收集,并调整细胞浓度至1
×
105个
·
ml-1
;
21.将细胞均匀接种于24孔板上,并在24h后更换成骨诱导液或成脂诱导液,每3d换一次液;
22.在分化过程中通过倒置显微镜观察细胞形态学变化。
23.进一步的,还包括:
24.在所述人脂肪间充质干细胞成骨诱导2w后,细胞爬片;
25.用10%中性甲醛固定细胞0.4~0.6h后,加入碱性磷酸酶孵育液,并在37℃恒温箱内孵育至少3h;
26.对孵育后的细胞进行水洗、硝酸钴水溶液、以及硫化铵水溶液处理后,在对所述细胞进行脱水和透明处理;
27.对经所述脱水和透明处理后的细胞通过中性树胶进行封片处理。
28.进一步的,还包括:
29.在所述人脂肪间充质干细胞成脂诱导2w后,细胞爬片;
30.用10%中性甲醛固定细胞0.4~0.6h后,用60%异丙醇或75%酒精进行漂洗;
31.以3:2的体积比配置油红o储备液和蒸馏水的混合液,在室温下,将其混合后静置片刻,滤纸过滤,与固定后的细胞共孵育染色10min;
32.将经染色后的细胞爬片进行流水漂洗后,置于载玻片上,再通过甘油明胶对所述细胞进行封片。
33.进一步的,所述成骨诱导液含有维生素c 0.2mmol/l、β-甘油磷酸钠10mmol/l、地塞米松10-8
mol/l、以及体积比为10%fbs的l-dmem;所述成脂诱导液含有地塞米松0.25μmol/l、吲哚美辛50μmol/l、ibmx 0.5mmol/l、牛胰岛素10μg
·
ml-1
、l-谷氨酰胺4mmol/l、以及体积比为10%fbs的l-dmem。
34.本发明提供的一种人脂肪间充质干细胞的分离培养方法及分化鉴定方法,其中,分离培养方法能够通过i型胶原酶消化联合组织块培养法提取人脂肪间充质干细胞,将酶
消化时间缩短为30min,使组织块变得疏松,利于细胞从组织块中爬出,降低常规方法中的胶原酶i对于细胞活力的影响。同时,本发明能够分离出的人脂肪间充质干细胞产量极高,每1g脂肪大约能分离出4~5
×
106个原代细胞,且提取的细胞可以稳定传代,可满足组织工程对种子细胞数量的需求。
35.本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在所写的说明书、权利要求书、以及附图中所特别指出的结构来实现和获得。
36.下面通过附图和实施例,对本发明的技术方案做进一步的详细描述。
附图说明
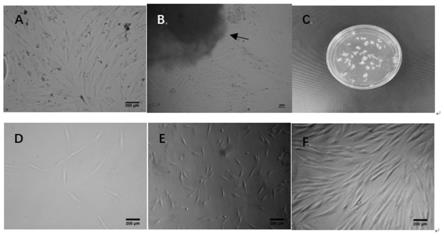
37.图1为对照例1和实施例1分别培养出的人脂肪间充质干细胞的形态学图像;(a:对照例1的p0代5d人脂肪间充质干细胞镜下形态(100
×
);b:实施例1的p0代5d人脂肪间充质干细胞镜下形态(
“→”
为组织块)(100
×
);c:实施例1p0代;d:实施例1的p1代人脂肪间充质干细胞镜下形态(100
×
);e:实施例1的p3代人脂肪间充质干细胞镜下形态(40
×
);f:实施例1的p6代人脂肪间充质干细胞镜下形态(100
×
))
38.图2为对照例1和实施例1分别培养出的人脂肪间充质干细胞产量的比较示意图(*p<0.05);
39.图3为对照例1和实施例1分别培养出的人脂肪间充质干细胞的生长曲线示意图;
40.图4为实施例1培养出的人脂肪间充质干细胞表面抗原cd105、cd73、cd44的表达示意图;
41.图5为实施例1培养出的人脂肪间充质干细胞成骨诱导碱性磷酸酶染色示意图;(a:未成骨诱导组人脂肪间充质干细胞(100
×
);b:成骨诱导组人脂肪间充质干细胞(100
×
)。)
42.图6为实施例1培养出的人脂肪间充质干细胞成脂诱导油红o染色示意图;(a:未成脂诱导组人脂肪间充质干细胞(100
×
);b:成脂诱导组人脂肪间充质干细胞(200
×
)c:成脂诱导组人脂肪间充质干细胞油红o染色(200
×
)。)
具体实施方式
43.为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
44.本发明提供的一种人脂肪间充质干细胞的分离培养方法,包括如下步骤:
45.步骤1、获取脂肪组织冲洗至无血色,剪成1mm3大小的碎块;
46.步骤2、通过i型胶原酶对脂肪组织碎块进行消化处理;待消化结束后,加入dmem培养基终止消化,获得消化液;
47.步骤3、离心去除消化液的上清,将未消化完全的结构松散的组织块及下层的细胞团重悬,获得细胞重悬液;
48.步骤4、将细胞重悬液置于培养皿中并放入培养箱中培养,获得人脂肪间充质干细
胞。
49.这里,在获取脂肪组织碎块时,用无菌的溶度为0.01mol/l的pbs反复冲洗脂肪组织,直至无血色;再用无菌眼科剪刀和镊子去除脂肪组织上的多余组织,并将其剪成约1mm3大小的脂肪组织碎块。
50.本发明通过i型胶原酶消化联合组织块培养法提取人脂肪间充质干细胞,将酶消化时间缩短为30min,使组织块变得疏松,利于细胞从组织块中爬出,降低常规方法中的胶原酶i对于细胞活力的影响。同时,本发明能够分离出的人脂肪间充质干细胞产量极高,每1g脂肪大约能分离出4~5
×
106个原代细胞,且提取的细胞可以稳定传代,可满足组织工程对种子细胞数量的需求。
51.在一些实施方式中,所述dmem培养基包括含体积比为10%的胎牛血清和体积比为1%的青链霉素的低糖dmem培养基,所述dmem培养基中还含有摩尔浓度为2mmol/l的谷氨酰胺。
52.在一些实施方式中,所述通过i型胶原酶对所述脂肪组织碎块进行消化处理,包括:向所述脂肪组织碎块中加入与所述脂肪组织碎块体积相同的0.1%i型胶原酶,在37℃的温度下,以180~210rpm的震荡速度震荡消化25~35min,完成对所述脂肪组织碎块的消化处理。
53.在一些实施方式中,在获得消化液之后,将所述消化液以900~1100r
·
min-1
的速度离心15~20min,将所述消化液进行离心分离。
54.在一些实施方式中,在将未消化完全的结构松散的组织块及下层的细胞团重悬时,所用的重悬液与所述dmem培养基相同。
55.在一些实施方式中,所述将所述细胞重悬液置于培养皿中并放入培养箱中培养,包括:所述细胞重悬液置于培养皿并放入恒温培养箱内,稳定培养;待细胞融合至80%~90%,按1:3的比例进行传代培养。
56.下面通过实施例对本发明提供的人脂肪间充质干细胞的分离培养方法做具体说明。
57.实施例1
58.一种人脂肪间充质干细胞的分离培养方法,包括如下步骤:
59.步骤1、获取脂肪组织冲洗至无血色,剪成1mm3大小的碎块;
60.步骤2、加入与脂肪组织碎块等体积的质量浓度为0.1%的i型胶原酶,在37℃的温度下,以180~210rpm的震荡速度震荡消化30min;待消化结束后,加入dmem培养基终止消化,获得消化液;其中,dmem培养基包括含体积比为10%的胎牛血清和体积比为1%的青链霉素、以及摩尔浓度为2mmol/l的谷氨酰胺的低糖dmem培养基;
61.步骤3、将消化液以900~1100r
·
min-1
的速度离心15~20min,将消化液进行离心分离,去除消化液的上清,将未消化完全的结构松散的组织块及下层的细胞团加入与dmem培养基成分相同的重悬液中进行重悬,获得细胞重悬液;
62.步骤4、将细胞重悬液置于培养皿中并放入培养箱中培养,待细胞融合至80%-90%,按1:3的比例进行传代培养,获得人脂肪间充质干细胞。
63.为了对实施例1培养出的人脂肪间充质干细胞进行对比分析,本技术还通过对照例1培养出常规方法培养出的人脂肪间充质干细胞。
64.对照例1
65.一种人脂肪间充质干细胞的常规分离培养方法,包括如下步骤:
66.步骤1、获取体积为1mm3的脂肪组织碎块;
67.步骤2、加入与脂肪组织碎块等体积的质量浓度为0.1%的胶原酶i,在37℃的温度下,以200rpm的震荡速度震荡消化60min,至糊状;待消化结束后,加入dmem培养基终止消化,获得消化液;
68.步骤3、对消化液通过200目筛网过滤后,将消化液以1000r
·
min-1
的速度离心15min,将消化液进行离心分离,去除消化液的上清,将未消化完全的结构松散的组织块及下层的细胞团加入与dmem培养基成分相同的重悬液中进行重悬,获得细胞重悬液;
69.步骤4、将细胞重悬液置于培养皿中并放入37℃、5%co2培养箱中培养,待细胞融合至80%~90%,按1:3的比例进行传代培养,获得人脂肪间充质干细胞。
70.为了对实施例1和对照例1分别获得的人脂肪间充质干细胞的形态学特征进行分析,这里,通过在倒置显微镜下可见不同方法,可观察到实施例1和对照例1分别对应的原代人脂肪间充质干细胞于接种后1d开始贴壁,形态呈卵圆形;2d后贴壁细胞数量逐渐增加,形态向长梭形过度;培养3d左右,贴壁细胞明显增多,且形态逐渐呈长梭形;在第7d左右,细胞融合至90%左右,生长呈一定的规律性,以组织块为中心,不断向周围生长,呈旋涡状(如图1)。在倒置显微镜观察发现,细胞在培养3d左右形态逐渐生长为长梭形,7d左右即可融合至80%~90%,且细胞呈鱼群样生长。人脂肪间充质干细胞在体外可传至第13代,镜下观察发现细胞形态始终呈纺锤形或长梭形,且均匀一致,无明显变化,这符合间充质干细胞的镜下形态学特征。
71.为了对实施例1和对照例1分别获得的人脂肪间充质干细胞的细胞产量进行分析,这里,通过细胞计数法比较实施例1和对照例1的细胞产量,具体为:分别对实施例1和对照例1这两种方法所用的1g脂肪组织中的人脂肪间充质干细胞,2d后首次换液,之后每3d更换培养基,分别用台盼蓝拒染法计数p0代第3d和第7d细胞。收集细胞制成单细胞悬液,将细胞悬液与台盼蓝溶液混合,使台盼蓝终浓度为0.04%;染色3min左右,将盖玻片盖在事先消毒好的计数板上,从盖玻片的一侧加入10μl细胞悬液,加样过程中混悬液不要溢出盖玻片,不要产生气泡。在倒置显微镜下,分别计数四大格中蓝染的细胞总数及未蓝染的细胞总数,对于压线的细胞,只计上侧和左侧,分别计数3次,取平均值,计算细胞总数。
72.这里,对实施例1和对照例1分别获得的人脂肪间充质干细胞的产量比较为:胶原酶i消化后细胞于24h大量贴壁,而在第3d,细胞不断从未消化完全的疏松组织块中爬出,原代细胞培养至3d和7d后,细胞计数比较发现,实施例1中的每g脂肪组织获取的细胞产量明显高于对照例1胶原酶i消化法,具有显著性差异(如图2)。通过比较两种不同方法从相同质量的脂肪组织中获取的原代人脂肪间充质干细胞分别在培养3、7d时的数量,我们发现在3d时,常规酶消化法由于消化时间充足,所获取的细胞较对照例1多,但随着贴壁细胞的不断增殖以及组织块中细胞的不断爬出,实施例1所获取的细胞数量远多于常规酶消化法。同时,从我们绘制的细胞生长曲线可以观察到,2种方法所获取的细胞在前48h均处于潜伏期,从第3d开始进入快速上升的对数生长期,实施例1细胞生长速度明显快于对照例1的细胞,对照例1在第7d达生长高峰,随后生长速度逐渐变缓,进入稳定的平台期,而实施例1到达平台期仅需6d左右,且两组细胞到达平台期后,实施例1的细胞数也远多于对照例1。
73.为了对实施例1和对照例1分别获得的人脂肪间充质干细胞的增殖能力进行分析,这里将实施例1和对照例1分别获取的p3代人脂肪间充质干细胞用0.25%胰蛋白酶消化,收集细胞,每孔5
×
103个接种于24孔板中;每日随机消化3孔,用台盼蓝拒染法计数,连续观察9天,以横坐标为细胞培养时间,纵坐标为单位细胞数,绘制人脂肪间充质干细胞的生长曲线图。采用patterson公式dt=δt
×
lg2/lg(nt/no)计算人脂肪间充质干细胞的细胞群体倍增时间(dt),δt为细胞培养时间,no为细胞对数生长期细胞的首次计数值,nt表示培养时间为t时的细胞数。一般情况下,no在细胞培养24h后计数,而nt常为对数生长期终点时的细胞数。
74.实施例1和对照例1分别获得的人脂肪间充质干细胞的增殖能力的比较方法为:用细胞计数法检测两组细胞生长增殖能力,观察发现实施例1和对照例1分别培养的人脂肪间充质干细胞生长曲线均呈“s”型。经计算,对照例1的细胞的群体倍增时间为49.51h,而实施例1的群体倍增时间为41.34h(如图3),这说明两组细胞均具有高效的增殖能力,但实施例1的增殖能力更强。
75.对实施例1和对照例1分别获得的人脂肪间充质干细胞的表面抗原鉴定,这里通过运用流式细胞术检测实施例1人脂肪间充质干细胞于p3代表面抗原的表达。结果表明,cd105、cd73与cd44均呈阳性,且纯度均达93%以上(如图4),这符合间充质干细胞表面标志的特性,表明通过实施例1可获得高纯度的人脂肪间充质干细胞。
76.综上所述,运用实施例1成功获取了人脂肪间充质干细胞,并通过比较两组细胞的产量及生长状况,同时鉴定其表面抗原与多向分化能力,发现实施例1获取的细胞活力更强,细胞产量多于相同条件下的对照例1,而分化能力无明显差异。这种改良方法的使用提高了脂肪组织的利用率,节约了研究者的时间和成本,这将为细胞移植治疗及组织工程学研究提供丰富的种子细胞。
77.本发明提供的一种人脂肪间充质干细胞的分化鉴定方法,包括如下步骤:
78.步骤1、将通过上述所述的分离培养方法培养的人脂肪间充质干细胞用0.25%胰蛋白酶消化收集,并调整细胞浓度至1
×
105个
·
ml-1
;
79.步骤2、将细胞均匀接种于24孔板上,并在24h后更换成骨诱导液或成脂诱导液,每3d换一次液;
80.步骤3、在分化过程中通过倒置显微镜观察细胞形态学变化。
81.在一些实施方式中,所述分化鉴定方法还包括:
82.在人脂肪间充质干细胞成骨诱导2w后,细胞爬片;用10%中性甲醛固定细胞0.4~0.6h后,加入碱性磷酸酶孵育液,并在37℃恒温箱内孵育至少3h;对孵育后的细胞进行水洗、硝酸钴水溶液、以及硫化铵水溶液处理后,在对细胞进行脱水和透明处理;对经脱水和透明处理后的细胞通过中性树胶进行封片处理。
83.这里,通过倒置显微镜的镜下观察见未诱导组人脂肪间充质干细胞镜下形态均一,呈长梭形,当细胞融合至80%~90%时,表现为鱼群样生长,碱性磷酸酶染色胞浆呈淡灰色,碱性磷酸酶活性为阴性(如图5a);诱导后的细胞形态由长梭形变为多角形,逐渐成复层生长,部分区域出现点状钙化斑,且钙化斑随着诱导的时间逐渐增大。诱导2w后行碱性磷酸酶染色,成骨诱导组细胞胞浆呈灰黑色,碱性磷酸酶活性为阳性(如图5b)。
84.因此,为了证实实施例1获取的细胞具有多向分化的能力,利用碱性磷酸酶染色评
估了人脂肪间充质干细胞成骨分化的能力。这里,未成骨诱导的细胞碱性磷酸酶染色后胞浆呈淡灰色,碱性磷酸酶活性为阴性,而成骨诱导2w的人脂肪间充质干细胞碱性磷酸酶染色后,细胞胞浆呈灰黑色,碱性磷酸酶活性为阳性。
85.在一些实施方式中,所述分化鉴定方法还包括:在人脂肪间充质干细胞成脂诱导2w后,细胞爬片;用10%中性甲醛固定细胞0.4~0.6h后,用60%异丙醇或75%酒精进行漂洗;以3:2的体积比配置油红o储备液和蒸馏水的混合液,在室温下,将其混合后静置片刻,滤纸过滤,与固定后的细胞共孵育染色10min;将经染色后的细胞爬片进行流水漂洗后,置于载玻片上,再通过甘油明胶对所述细胞进行封片。
86.这里,通过倒置显微镜的镜下观察发现,成脂诱导3d后细胞逐渐由长梭形变为卵圆形、多角形,部分细胞内可见多个小脂滴。2w后的油红o染色显示细胞内有大小不一的橘红色脂滴,部分融合成团,大部分细胞胞浆被染成橘红色(如图6)。
87.通过利用油红o染色评估了人脂肪间充质干细胞成脂分化的能力,p3代细胞成脂诱导3d后,细胞形态逐渐由典型的长梭形变为多边形或类圆形,7d左右可见部分细胞内出现小脂滴,14d后可见大小不一的橘红色脂滴部分融合成团,大部分细胞胞浆被染成橘红色。通过以上两种染色鉴定,发现实施例1碱性磷酸酶染色与油红o染色结果与常规酶消化法获取的细胞染色结果无明显差别,表明实施例1人脂肪间充质干细胞具有良好的成骨及成脂分化能力。
88.在一些实施方式中,所述成骨诱导液含有维生素c 0.2mmol/l、β-甘油磷酸钠10mmol/l、地塞米松10-8
mol/l、以及体积比为10%fbs的l-dmem;所述成脂诱导液含有地塞米松0.25μmol/l、吲哚美辛50μmol/l、ibmx0.5mmol/l、牛胰岛素10μg
·
ml-1
、l-谷氨酰胺4mmol/l、以及体积比为10%fbs的l-dmem。
89.最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1