新型氘取代的正电子发射断层扫描(PET)显像剂及其药理学应用的制作方法
新型氘取代的正电子发射断层扫描(pet)显像剂及其药理学应用
1.本技术是申请号为201880035650.6(pct/us2018/034691)、申请日为2018年5月25日、发明名称为“新型氘取代的正电子发射断层扫描(pet)显像剂及其药理学应用”的中国专利申请的分案申请。
技术领域
2.本技术涉及氘取代的正电子发射断层扫描(pet)显像剂及其药理学应用。
背景技术:
3.氘(d)是氢(h)的稳定同位素。虽然氢和氘之间在物理和化学性质上的差异相对较小(meanwell,j.med.chem.2011,54:2529-91),但氘代化合物可对氢最优开发的生物和化学过程产生重大影响。氘取代的亲脂性略低于氢,δlogp=-0.006,并且氘的摩尔体积比氢小0.140cm3/mol/每原子。碳-氘(c-d)键比碳氢(c-h)键短因此破坏c-d键相对于c-h键的活化能明显更高。从功能上讲,这将使c-d键的裂解速率比c-h键的裂解速率降低6.7倍(kuchar,molecules 2015,20:16186-220),从而可对药物药代动力学特性产生深远影响。
4.最近有关氘取代的活性药物的报道已经证明了氘对原料药的安全性和清除率的动力学同位素影响以及通过现有分子的氘代形式产生新药的益处(gant,j.med.chem.2014,57:3595-611)。下面显示了一些实例,诸如丁苯那嗪(nitoman或xenazine)、氘代丁苯那嗪(sd-809,austedo)、右美沙芬(dextromethorphan)和d6-右美沙芬(avp-786)。
[0005][0006]
氘代丁苯那嗪(sd-809)最近已获得fda批准用于治疗与亨廷顿氏病(huntington's disease)相关的舞蹈病。另一个实例是氘代右美沙芬avp-786,它被设计用于治疗阿尔茨海默氏病(alzheimer disease)患者的焦躁(garay,expert opin.investig.drugs 2017,26:121-32)。
[0007]
通过氢到氘的取代来调节药物代谢的能力为解决显像剂的常见困扰(缺乏合适的体内停留时间)提供了一种新型方法。在过去的几十年中,已有关于使用氢到氘的取代来改善体内pet显像剂的报道(kuchar,molecules 2015,20:16186-220;guengerich,j labelled comp radiopharm 2013,56:428-31)。用氘取代氢的目的是减缓体内代谢,以减少放射性示踪剂的损失,同时保持对特定酶或受体结合位点的结合能力。一个实例是使用
11
c-l-丙炔苯丙胺-d2(而不是
11
c-l-丙炔苯丙胺)对脑中的mao-b酶(单胺氧化酶-b;胺氧氧
化还原酶-b)活性进行作图(fowler,j.nucl.med.1995,36:1255-62;logan,nucl.med.biol.2000,27:43-9)。
[0008][0009]
氢到氘的取代用于开发pet示踪剂的另一个实例是四氘代
18
f-氟-瑞波西汀-d4,它通过延缓体内代谢而改善氘代pet示踪剂的体内稳定性(lin,nucl.med.biol.2005,2:415-22;ding,curr.pharm.des.2006,12:3831-45)。另外,已对患者中的
11
c-胆碱、
11
c-d4-胆碱、
18
f-氟乙基-胆碱和
18
f-氟乙基-d4-胆碱进行了比较,以研究肿瘤代谢活性(beauregard,cancer imaging 2016,16:41;nitsch,j.nucl.med.2016,57:38s-42s;smith,nucl.med.biol.2011,38:39-51;witney,clin.cancer res.2012,18:1063-72)。
[0010][0011]
需要例如使用氢到氘的取代开发改进的pet显像剂,以评价病状诸如帕金森氏病(parkinson's disease)、阿尔茨海默氏病,以及特定血管收缩素再摄取抑制剂(ssri)的血管收缩素转运蛋白结合以治疗抑郁症。
技术实现要素:
[0012]
本公开提供了用
18
f标记的氘取代的丁苯那嗪衍生物作为用于诊断帕金森氏病的pet显像剂。非放射性氘代衍生物提供了靶向囊泡单胺转运蛋白2以治疗运动障碍的药物。
[0013]
在一个实施方案中,本公开提供了具有式i-a的化合物:
[0014][0015]
或其药学上可接受的盐,其中:
[0016]
r1为c
1-4
烷基并且任选地被一个或多个氘原子取代;以及
[0017]
x为
18
f或
19
f;
[0018]
y为
–
(crarb)n–
,其中ra和rb各自独立地为氢或氘原子,n为1至6的整数;
[0019]
条件是r1或y处存在至少一个氘原子;以及
[0020]
条件是当n为2时,r1不为ch3。
[0021]
本公开还提供了氘取代的化合物,作为用于诊断阿尔茨海默氏病的pet显像剂。
[0022]
在一个实施方案中,本公开提供了具有式(ii-a)的化合物:
[0023][0024]
或其药学上可接受的盐,其中:
[0025]
r2为c
1-4
烷基并且任选地被一个或多个氘原子取代;
[0026]
x为
18
f或
19
f;
[0027]
y为
–
[o(crarb)2]m–
,其中ra和rb各自独立地为氢或氘原子,并且m为1至6的整数;以及
[0028]
a1、a2、a3、a4和a5各自独立地为n、ch或c,并且a1、a2、a3、a4和a5中的至多三个为n;
[0029]
条件是r2或y处存在至少一个氘原子。
[0030]
在另一个实施方案中,本公开提供了具有式(ii-d)的化合物:
[0031][0032]
或其药学上可接受的盐,其中:
[0033]
r3为c
1-4
烷基,其中r3被一个或多个氘原子取代,并且所述c
1-4
烷基的一个或多个碳原子任选地为
11
c;
[0034]
b1、b2、b3和b4各自独立地为c、n或ch,并且b1、b2、b3和b4中至多两个为n;
[0035]
x为氢、
18
f或
19
f;
[0036]
w为n或ch;以及
[0037]
z为o、s或nh;
[0038]
条件是所述化合物经
11
c或
18
f标记。
[0039]
本公开还提供了用于对脑部中的血管收缩素转运蛋白进行pet成像的氘取代的二芳基硫醚化合物。
[0040]
在一个实施方案中,本公开提供了具有式(iii-a)的化合物:
[0041][0042]
或其药学上可接受的盐,其中:
[0043]
r4和r5各自独立地为氢或c
1-4
烷基,其中所述c
1-4
烷基任选地被一个或多个氘原子取代;
[0044]
x为
18
f或
19
f;
[0045]
y为
–
(crarb)n–
,其中ra和rb各自独立地为氢或氘原子并且n为1至6的整数;以及
[0046]
r6为氢、卤素或cn;
[0047]
条件是r4、r5或y处存在至少一个氘原子。
[0048]
在一个实施方案中,本公开涉及一种药物组合物,其包含本文公开的氘取代的化合物和药学上可接受的载体。
[0049]
在一个实施方案中,本公开涉及一种用于在受试者中成像的方法,该方法包括向受试者施用本文公开的放射性标记化合物;并获得所述受试者或所述受试者的一部分的图像。
[0050]
在一个实施方案中,本公开涉及一种体内成像的方法,该方法包括向受试者施用有效量的本文公开的放射性标记化合物,并检测该化合物在受试者中的放射性模式。
具体实施方式
[0051]
本公开提供了氘取代的新型pet显像剂,用于评估帕金森氏病、阿尔茨海默氏病,以及用于测定特定血管收缩素再摄取抑制剂(ssri)活性以治疗抑郁症。
[0052]
如本文所用,除非另有说明,否则“一”、“一个(种)”或“所述(该)”意指一个或多个。
[0053]
术语“或”可以是连接的或转折的。
[0054]
诸如“包括”、“含有”之类的开放式术语意指“包含”。
[0055]
如本文所用,术语“约”旨在限定其修饰的数值,表示诸如在误差范围内的变量的值。术语“约”应理解为意指涵盖所列举的值的范围,以及通过考虑有效数字也四舍五入到该数字而包括在内的范围。如本文所用的术语“约”包括所列举的数字
±
10%。例如,“约10”表示9至11。
[0056]
当公开值的范围,并且使用“从n
1.
......至n
2”或“n
1-n
2”的表示法,其中n1和n2是数字时,则除非另有说明,否则该表示法旨在包括数字本身及其之间的范围。该范围可以是端值之间(包括端值)的整数或连续值。
[0057]
术语“氘富集度”是指在化合物中的给定位置并入氘取代氢的百分比。例如,给定位置1%的氘富集意指给定样品中1%的分子在指定位置含氘。因为天然存在的氘分布为约
0.0156%,所以使用非富集的原材料合成的化合物中任何位置的氘富集度均为约0.0156%。氘富集度可以使用本领域普通技术人员已知的常规分析方法来测定,包括质谱法和核磁共振波谱法。
[0058]
如本文所用,术语“氘富集因子”是指氘的同位素丰度与自然丰度之间的比率。例如,在本文公开的化合物中被指定为氘的每个原子处,被指定为具有氘的位置的最小同位素富集因子可为至少3340(氘并入率为50.1%)。
[0059]
在一些实施方案中,本发明的化合物对于每个指定氘原子的同位素富集因子为至少3500(每个指定氘原子处的氘并入率为54.6%),至少4000(氘并入率为62.4%),至少4500(氘并入率为70.2%),至少5000(氘并入率为78%),至少5500(氘并入率为85.8%),至少6000(氘并入率为93.6%),至少6090(氘并入率为95%),至少6218(氘并入率为97%),至少6346(氘并入率为99%)或至少6378(氘并入率为99.5%)。
[0060]
术语“是氘”在用于描述本文公开的化合物中的给定位置时,或符号“d”在化合物附图中用于表示给定位置时,意指该特定位置富含高于天然存在的氘分布的氘。在一些实施方案中,在指定位置处氘富集度为至少约1%,至少约5%,至少约10%,至少约20%,至少约50%,至少约70%,至少约80%,至少约90%,至少约95%,至少约97%,至少约98%或至少约99%的氘。
[0061]
本文公开的氘代化合物可以使用可商购的含氘的原材料制备。许多含氘的原材料在指定位置的氘富集度》99%。
[0062]
本文公开的一些化合物含一个或多个不对称中心,因此可以产生对映异构体、非对映异构体和其它立体异构形式。本发明意在涵盖所有此类可能形式的化合物,以及其外消旋和分解形式及其混合物。
[0063]
本文公开的某些化合物用放射性氟原子
18
f标记。本文公开的某些其它化合物含有氟的稳定同位素
19
f,可与本文的f互换使用。
[0064]
如本文所用,术语“药学上可接受的盐”是指在合理的医学判断范围内适合与人和低等动物的组织接触而没有过度毒性、刺激、过敏反应等,并且与合理的效益/风险比相称的那些盐。药学上可接受的盐是本领域熟知的。例如,s.m.berge等人在通过引用并入本文的j.pharmaceutical sciences,1977,66,1
–
19中详细描述了药学上可接受的盐。
[0065]
术语“药学上可接受的盐”包括与无机酸和有机酸以及无机碱和有机碱形成的盐。药学上可接受的盐包括但不限于金属盐,诸如钠盐、钾盐、铯盐等;碱土金属盐,诸如钙盐、镁盐等;有机胺盐,诸如三乙胺盐、吡啶盐、甲基吡啶盐、乙醇胺盐、三乙醇胺盐、二环己基胺盐、n,n'-二苄基乙二胺盐等;无机酸盐,诸如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;有机酸盐,诸如柠檬酸盐、乳酸盐、酒石酸盐、马来酸盐、富马酸盐、扁桃酸盐、乙酸盐、二氯乙酸盐、三氟乙酸盐、草酸盐、甲酸盐等;磺酸盐,诸如甲磺酸盐、苯磺酸盐、对甲苯磺酸盐等;和氨基酸盐,诸如精氨酸盐、天冬氨酸盐、谷氨酸盐等。
[0066]
术语“治疗”是指以有效改善与病症相关的病状、症状或参数或减缓或预防病症进展,达到统计学上显著的程度或达到本领域技术人员可检测的程度的量、方式或模式施用疗法。有效的量、方式或模式可以根据受试者而变化,并且可以针对受试者定制。受试者包括但不限于人或动物。
[0067]
作为囊泡单胺转运蛋白2(vmat2)显像剂的氘代
18
f-fp-dtbz(
18
f-av-133)
[0068]
已经制备了二羟基-丁苯那嗪的氟代烷基衍生物,并作为脑部中囊泡单胺转运蛋白2(vmat2)的显像剂进行了测试(goswami,nucl.med.biol.2006,33:685-94;kilbourn,nucl.med.biol.2007,34:233-7)。使用
11
c-二氢丁苯那嗪(
11
c-dtbz)进行的pet成像可用于对神经元中的vmat2分布作图。还开发了具有更长物理半衰期的
18
f标记的fp-dtbz(
18
f-fp-(+)-dtbz,
18
f-av-133)。在过去几年中,一些报告描述了
18
f-av-133作为vmat2显像剂的临床实用性。
18
f-av-133/pet的人体临床研究结果表明,它是有助于诊断和监测帕金森氏病的有用药剂。
[0069]
关于氘对代谢清除率的影响的发现,展示出这种影响的
18
f-av-133/pet的另一个应用领域是可视化胰腺内的β细胞。有人提出,胰腺中的vmat2结合可能是测量β细胞质量的有用指标,在糖尿病患者中β细胞质量显著降低(kung,j.nucl.med.2008,49:1171-6;raffo,j.endocrinol.2008,198:41-9;harris,j.mol.med.2008,86:5-16;harris,nucl.med.biol.2013,40:60-4;freeby,islets 2012,4:393-7)。
[0070][0071]
11
c-dtbz和
18
f-fp-dtbz均已在人体中作为用于诊断帕金森氏病的囊泡单胺转运蛋白2(vmat2)显像剂进行了测试。
18
f-fe-dtbz也已作为潜在的胰腺显像剂进行了研究。
[0072]
为了开发其它特异性靶向β细胞的vmat2显像剂,已经制备了类似的衍生物
18
f-氟乙基-dtbz(fe-dtbz)和相应的氘代
18
f-氟乙基-dtbz-d4(
18
f-fe-d4-dtbz-d4)用于对胰腺中的vmat2成像(eriksson,nucl.med.biol.2010,37:357-63;jahan,ejnmmi res 2011,1:33)。
[0073]
这些研究需要另外注意的是,在
18
f-fp-dtbz的制备期间可以产生副产物。很可能其中一种杂质源自氟离子的亲核取代,氟离子的亲核取代诱导消除反应。消除反应可能是通过首先破坏c-h键而发生的,从而导致了消除反应。不希望受理论束缚,据信用氘取代
18
f丙基上的氢原子可以减少消除反应,从而改善标记反应(方案1)。另外,氟丙基上的氘原子可以提供对帕金森氏病患者脑部中的vmat2结合位点成像具有更佳体内稳定性的化合物。
[0074]
方案1
[0075][0076]
本公开提供氘取代的丁苯那嗪衍生物作为pet显像剂,用于诊断和治疗帕金森氏病。
[0077]
在一个实施方案中,本公开提供了具有式i-a的化合物:
[0078][0079]
或其药学上可接受的盐,其中:
[0080]
r1为c
1-4
烷基并且任选地被一个或多个氘原子取代;以及
[0081]
x为
18
f或
19
f;
[0082]
y为
–
(crarb)n–
,其中ra和rb各自独立地为氢或氘原子,n为1至6的整数;
[0083]
条件是r1或y处存在至少一个氘原子;以及
[0084]
条件是当n为2时,r1不为ch3。
[0085]
本公开的一个实施方案提供了式i-a的化合物,其中n为3、4、5或6。在一些实施方案中,n为3。在一些实施方案中,y为-(ch2)2–
、
–
(cd2)2–
、
–
(ch2)3–
、
–
(cd2)3–
、
–
(ch2)4–
、
–
(cd2)4–
、
–
(ch2)5–
、
–
(cd2)5–
、-(ch2)6–
或
–
(cd2)6–
。在一些实施方案中,y为-(ch2)
3-或-(cd2)
3-。
[0086]
本公开的一个实施方案提供了式i-a的化合物,其中r1是可以氘代或非氘代的c
1-4
烷基。在一些实施方案中,r1为—ch3、—cd3、—ch2ch3、—cd2cd3、—cd2ch3、—ch2cd3、—ch(ch3)2、-cd(cd3)2、—ch(cd3)2、—cd(ch3)2、—ch2ch(ch3)2、—cd2ch(ch3)2、-ch2cd(ch3)2、—ch2ch(cd3)2、—cd2cd(ch3)2、—cd2ch(cd3)2、—ch2cd(cd3)2或—cd2cd(cd3)2。在这些实施方案的一些中,r1为—cd3、—cd2cd3、—cd2ch3、—ch2cd3、—cd(cd3)2、—ch(cd3)2、—cd(ch3)2、—cd2ch(ch3)2、-ch2cd(ch3)2、—ch2ch(cd3)2、—cd2cd(ch3)2、—cd2ch(cd3)2、—ch2cd(cd3)2或-cd2cd(cd3)2。在一些实施方案中,r1为-ch3或-cd3。在一些实施方案中,r1为-cd3。
[0087]
在一些实施方案中,式i-a的化合物具有下式:
[0088][0089]
或其药学上可接受的盐,其中x、y和r1如本文所定义。
[0090]
在一些实施方案中,式i-a的化合物具有下式:
[0091][0092]
或其药学上可接受的盐,其中x为
18
f或
19
f。
[0093]
在一些实施方案中,式i-a的化合物具有下式:
[0094][0095]
或其药学上可接受的盐,其中x为18f或19f。
[0096]
在一个实施方案中,式i-a的化合物为:
[0097][0098]
或其药学上可接受的盐。
[0099]
在一个实施方案中,式i-a的化合物为:
[0100][0101]
或其药学上可接受的盐。
[0102]
在一个实施方案中,式i-a的化合物为:
[0103][0104]
或其药学上可接受的盐。
[0105]
在一个实施方案中,式i-a的化合物为:
[0106][0107]
或其药学上可接受的盐。
[0108]
本公开提供了一种用于在有此需要的受试者中诊断帕金森氏病的方法,该方法包括向该受试者施用有效量的式i-a的化合物或其药学上可接受的盐并获得该受试者或该受试者的一部分的图像。在一些实施方案中,用于诊断帕金森氏病的方法包括施用有效量的本文公开的式i-a的化合物,其中x为
18
f。
[0109]
本公开提供了一种用于在有此需要的受试者中治疗帕金森氏病的方法,该方法包括向该受试者施用治疗有效量的式i-a的化合物或其药学上可接受的盐。在一些实施方案中,用于在有此需要的受试者中治疗帕金森氏病的方法包括施用治疗有效量的本文公开的式i-a的化合物,其中x为
19
f。
[0110]
本文公开的某些化合物可具有有用的vmat2抑制活性,并且可用于治疗或预防vmat2在其中发挥积极作用的病症。某些实施方案提供了用于抑制vmat2的方法。其它实施方案提供了用于在需要此类治疗的受试者中治疗vmat2介导的病症的方法,该方法包括向该受试者施用治疗有效量的式i-a的化合物。还提供了本文公开的某些化合物在生产用于治疗通过抑制vmat2得以改善的病症的药物中的用途。
[0111]
术语“vmat2介导的病症”是指以异常的vmat2活性为特征的病症。vmat2介导的病症可以通过调节vmat2完全或部分介导。具体而言,vmat2介导的病症是其中对vmat2的抑制导致对潜在疾病的一些影响的病症。
[0112]
vmat2介导的病症包括但不限于慢性运动机能亢进性运动障碍和/或通过施用vmat2抑制剂可减轻、缓解或预防的任何病症。术语“慢性运动机能亢进性运动障碍”是指以无目的、重复性、混乱的运动行为为特征的病症,被不同地称为“强迫性”、“有节奏的”或“刻
板型”运动障碍。在人类中,慢性运动机能亢进性运动障碍可以是心理性的(例如抽搐症)、特发性的(如同例如在图雷特综合征(tourette's syndrome)和帕金森氏病中)、遗传性的(如同例如在亨廷顿氏病的舞蹈病特征中)、传染性的(如同例如在西登哈姆氏舞蹈病(sydenham's chorea)中),或是药物诱发的(如同在迟发性运动障碍中)。除非另有说明,否则“慢性运动机能亢进性运动障碍”是指并且包括所有心理性、特发性、遗传性和药物诱发的运动障碍。
[0113]
在某些实施方案中,慢性运动机能亢进性运动障碍是亨廷顿氏病。在某些实施方案中,慢性运动机能亢进性运动障碍是帕金森氏病。
[0114]
用于阿尔茨海默氏病的氘代淀粉样蛋白显像剂
[0115]
在阿尔茨海默氏病(ad)中,β-淀粉样蛋白肽(aβ)聚集体沉积在通常由直纤丝组成的细胞外斑块中。这些结构也可以在正常老化时发现,有时也称为老年斑块。aβ斑块沉积(即淀粉样蛋白假说)被认为是导致ad的关键病理生理事件(gauthier,alzheimer dement 2016,12:60-4;harrison,br.j.psychiatry 2016,208:1-3)。在过去15年中,对aβ斑块特异性显像剂的研究是脑部成像领域中最令人着迷的发展之一,并且已得到广泛审查。对于脑部中的aβ斑块而言最具特征的pet显像剂是
11
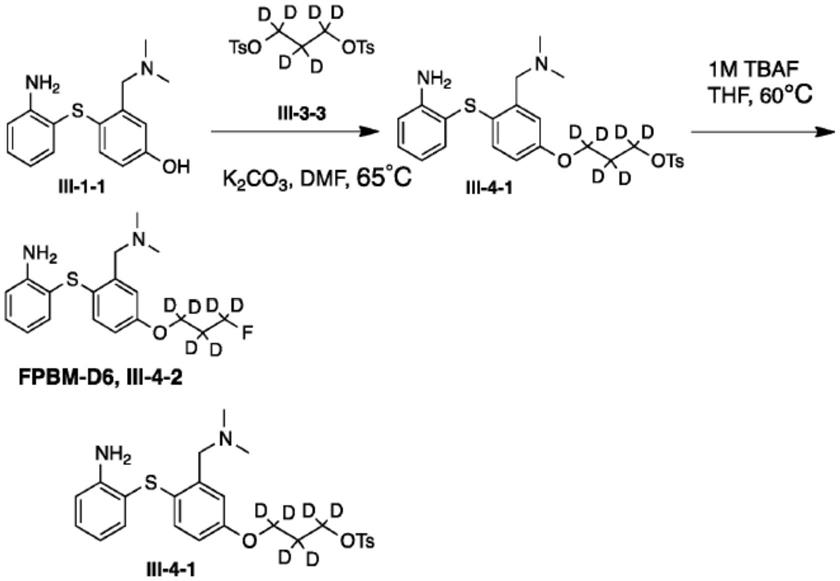
c-6-oh-bta-1,即(
11
c-pib)(mathis,semin.nucl.med.2012,42:423-32),并已用作对疑似ad患者脑部中的aβ斑块成像的示踪剂。已经制备和测试了许多不同的核心结构。在数百种显示出与aβ斑块良好结合的潜在配体中,已在人类中成功地测试了四种适于商业销售的
18
f标记的示踪剂(kung,acs med chem lett 2012,3:265
–
7;villemagne,semin.nucl.med.2017,47:75-88),并且fda已经批准了三种用于人类aβ成像(amyvid、neuraceq和vizamyl)(方案2)。结构上与氟美他莫(flutemetamol)(vizamyl)相似的另一种aβ斑块显像剂nav4694在人类研究中也显示出优良的体外结合和有前景的体内动力学(rowe,j.nucl.med.2013,54:880-6)。
[0116]
方案2
[0117][0118]
11
c-pib是在人类中测试的第一种药剂,从而导致开发了
18
f-vizamyl和nav4694。另外,修饰
11
c-sb-13导致发现了二苯乙烯和苯乙烯基吡啶系列的药剂。三个单元的聚乙二醇链附接至核。聚乙二醇链可用于调节亲脂性并提供用于氟取代的合适位置。所有这些pet显像剂均含有附接至苯环的n-甲基。给电子的n-甲基苯胺基在结合aβ斑块中的靶位点中起重要作用。不希望受理论束缚,据信用氘代n-甲基取代n-甲基可以减少体内的n-去甲基反应。
[0119]
先前有关
18
f-av-45(amyvid)体内代谢的报道显示,静脉(i.v.)注射后在血浆中快速变化。小鼠中
18
f-av-45的体内代谢表明,静脉内注射后30分钟,血浆中仅剩下30%的母体
18
f-av-45。估计小鼠血浆中
18
f-av-45的生物学t
1/2
少于30分钟。通过hplc与放射性检测和液相色谱/质谱分析进行代谢物分析和鉴定。血浆代谢物之一是n-去甲基化
18
f-av-160,在注射后30分钟时占代谢物的约48%(方案3)。注射后2分钟
18
f-av-160的脑部摄取量为4.5%id/g组织,在60分钟时降至1.8%id/g。母体
18
f-av-45的初始摄取量比该代谢物高1.5倍。使用ad脑部切片放射自显影术和体外ad脑匀浆结合测定法,用代谢物未观察到与aβ斑块的显著结合。av-160的抑制常数(ki=54
±
5nm)表明与ad脑组织匀浆中的aβ斑块的结合亲和力,与非放射性形式的
18
f-av-45(ki=2.87
±
0.17nm)相比,至少降低20倍(choi,j.nucl.med.2009,50:1887-94)。
[0120]
方案3
[0121][0122]
在人类中,发现体内代谢与小鼠的体内代谢相似(wong,j.nucl.med.2010,51:913-20)。注射
18
f-av-45后,血浆中的总放射性和由
18
f-av-45引起的血浆放射性分数迅速降低。血浆放射性在注射后10分钟内降低大约80%,在注射后20分钟内降低大约90%。除了母体化合物
18
f-av-45以外,在人血浆中还观察到三个代谢物峰。主峰之一与冷参考相匹配,为去甲基
18
f-av-45(n-去甲基
18
f-av-45,即
18
f-av-160)。相比之下,
18
f-av-1(nueraceq)也展示出快速的体内代谢;人血浆中的主要代谢物之一是n-去甲基
18
f-av-1(参见方案3)。据信,n-去甲基化导致针对脑部中aβ斑块的结合亲和力降低,并有助于增加非特异性结合。因此,通过取代av-45上的氘代n-甲基来减缓n-去甲基化过程而减少
18
f-av-160体内产生的新型策略,应通过增加
18
f-av-45向脑部中aβ斑块的摄取量和减少非特异性结合来改善成像(方案4)。
[0123]
方案4
[0124][0125]
发明人已经发现,对于av-45和av-1而言通过氘代甲基的取代增强了n-甲基苯胺基团的体内稳定性。氘代剂
18
f-av-45-d3显示出优良的脑部摄取量,与在小鼠中静脉内注射
后对
18
f-av-45所观察到的脑部摄取量相当。
[0126]
本公开提供了氘取代的化合物,作为用于诊断阿尔茨海默氏病的pet显像剂。
[0127]
在一个实施方案中,本公开提供了具有式ii-a的化合物:
[0128][0129]
或其药学上可接受的盐,其中:
[0130]
r2为c
1-4
烷基并且任选地被一个或多个氘原子取代;
[0131]
x为
18
f或f;
[0132]
y为
–
[o(crarb)2]m–
,其中ra和rb各自独立地为氢或氘原子,并且m为1至6的整数;以及
[0133]
a1、a2、a3、a4和a5各自独立地为n、ch或c,并且a1、a2、a3、a4和a5中的至多三个为n;
[0134]
条件是r2或y处存在至少一个氘原子。
[0135]
本公开的一个实施方案提供了式ii-a的化合物,其中r2是可以氘代或非氘代的c
1-4
烷基。在一些实施方案中,r2为-ch3、—cd3、—ch2ch3、—cd2cd3、—cd2ch3、—ch2cd3、—ch(ch3)2、-cd(cd3)2、—ch(cd3)2、—cd(ch3)2、—ch2ch(ch3)2、—cd2ch(ch3)2、—ch2cd(ch3)2、—ch2ch(cd3)2、—cd2cd(ch3)2、—cd2ch(cd3)2、—ch2cd(cd3)2或—cd2cd(cd3)2。在这些实施方案的一些中,r2为—cd3、—cd2cd3、—cd2ch3、—ch2cd3、—cd(cd3)2、—ch(cd3)2、—cd(ch3)2、—cd2ch(ch3)2、-ch2cd(ch3)2、—ch2ch(cd3)2、—cd2cd(ch3)2、—cd2ch(cd3)2、—ch2cd(cd3)2或—cd2cd(cd3)2。在一些实施方案中,r2为-ch3或-cd3。在一些实施方案中,r2为—cd3。
[0136]
本公开的一个实施方案提供了式ii-a的化合物,其中m为1、2、3或4。在一个实施方案中,m为3。在一些实施方案中,y为-[och2ch2]m–
或
–
[ocd2cd2]m–
。在一些实施方案中,y为
–
[och2ch2]3–
或-[ocd2cd2]3–
。在一些实施方案中,y为
–
[ocd2cd2]3–
。
[0137]
在一些实施方案中,本公开提供了式ii-a的化合物,其具有下式:
[0138][0139]
或其药学上可接受的盐,其中r2、x和y如本文所定义。
[0140]
在一些实施方案中,式ii-a的化合物具有下式:
[0141][0142]
或其药学上可接受的盐,其中:
[0143]
r2为c
1-2
烷基并且任选地被一个或多个氘原子取代;
[0144]
x为
18
f或
19
f;
[0145]
y为
–
[o(crarb)2]m–
,其中ra和rb各自独立地为氢或氘原子,并且m为1至4的整数;以及
[0146]
a1为n或ch;
[0147]
条件是r2或y处存在至少一个氘原子。
[0148]
在一些实施方案中,式ii-a的化合物具有下式:
[0149][0150]
或其药学上可接受的盐,其中:
[0151]
a1为n或ch;以及
[0152]
x为
18
f或
19
f。
[0153]
在一个实施方案中,式ii-a的化合物为:
[0154]
[0155]
或其药学上可接受的盐。
[0156]
在一个实施方案中,式ii-a的化合物为:
[0157][0158]
或其药学上可接受的盐。
[0159]
在另一个实施方案中,本公开提供了具有式ii-d的化合物:
[0160][0161]
或其药学上可接受的盐,其中:
[0162]
r3为c
1-4
烷基,其中r3被一个或多个氘原子取代,并且所述c
1-4
烷基的一个或多个碳原子任选地为
11
c;
[0163]
b1、b2、b3和b4各自独立地为c、n或ch,并且b1、b2、b3和b4中至多两个为n;
[0164]
x为氢、
18
f或
19
f;
[0165]
w为n或ch;以及
[0166]
z为o、s或nh;
[0167]
条件是所述化合物经
11
c或
18
f标记。
[0168]
本公开的一个实施方案提供了式ii-d的化合物,其中r3是可以氘代或非氘代的c
1-4
烷基。在一些实施方案中,r3为—ch3、—cd3、—ch2ch3、—cd2cd3、—cd2ch3、—ch2cd3、—ch(ch3)2、-cd(cd3)2、—ch(cd3)2、—cd(ch3)2、—ch2ch(ch3)2、—cd2ch(ch3)2、-ch2cd(ch3)2、—ch2ch(cd3)2、—cd2cd(ch3)2、—cd2ch(cd3)2、—ch2cd(cd3)2或—cd2cd(cd3)2。在这些实施方案的一些中,r3为—cd3、—cd2cd3、—cd2ch3、—ch2cd3、—cd(cd3)2、—ch(cd3)2、—cd(ch3)2、—cd2ch(ch3)2、-ch2cd(ch3)2、—ch2ch(cd3)2、—cd2cd(ch3)2、—cd2ch(cd3)2、—ch2cd(cd3)2或—cd2cd(cd3)2。在一些实施方案中,r3为—ch3或—cd3。在一些实施方案中,r3为—cd3。
[0169]
在一些实施方案中,本公开提供了式ii-d的化合物,其具有下式:
[0170][0171]
在一些其它实施方案中,本公开提供了式ii-d的化合物,其具有下式:
[0172][0173]
在一些实施方案中,式ii-d的化合物具有下式:
[0174]
[0175]
或其药学上可接受的盐,其中:
[0176]
r3为c
1-2
烷基;
[0177]
b1为c、n或ch;以及
[0178]
x、w和z如本文所定义。
[0179]
在一些实施方案中,本公开提供了具有式ii-d或ii-e的化合物,其中r3是被一个或多个氘原子取代的甲基。在一些实施方案中,r3为cd3且x为
18
f。
[0180]
在一些实施方案中,本公开提供了具有式ii-d或ii-e的化合物,其中r3为c
1-4
烷基,并且c
1-4
烷基的一个碳原子为
11
c。在一些实施方案中,r3为
11
cd3,并且x为氢。
[0181]
在一些实施方案中,式ii-d的化合物具有下式:
[0182][0183]
或其药学上可接受的盐,其中r3和x如本文所定义。在一些实施方案中,r3为-cd3,并且x为
18
f。在一些实施方案中,r3为-11
cd3,并且x为h。
[0184]
在一些实施方案中,式ii-d的化合物具有下式:
[0185][0186]
或其药学上可接受的盐,其中r3和x如本文所定义。在一些实施方案中,r3为-cd3,并且x为
18
f。在一些实施方案中,r3为-11
cd3,并且x为h。
[0187]
在一个实施方案中,式ii-d的化合物为:
[0188][0189]
或其药学上可接受的盐。
[0190]
在一个实施方案中,式ii-d的化合物为:
[0191][0192]
或其药学上可接受的盐。
[0193]
在一个实施方案中,式ii-d的化合物为:
[0194][0195]
或其药学上可接受的盐。
[0196]
在一个实施方案中,式ii-d的化合物为:
[0197][0198]
或其药学上可接受的盐。
[0199]
本公开提供了一种用于在有此需要的受试者中诊断阿尔茨海默氏病的方法,该方法包括向该受试者施用有效量的式ii-a的化合物或其药学上可接受的盐并获得该受试者或该受试者的一部分的图像。在一些实施方案中,用于诊断阿尔茨海默氏病的方法包括施用有效量的本文公开的式ii-a的化合物,其中x为
18
f。
[0200]
本公开提供了一种用于在有此需要的受试者中诊断阿尔茨海默氏病的方法,该方法包括向该受试者施用有效量的式ii-d的化合物或其药学上可接受的盐并获得该受试者或该受试者的一部分的图像。在一些实施方案中,用于诊断阿尔茨海默氏病的方法包括施用有效量的本文公开的式ii-d的化合物,其中x为
18
f。在一些实施方案中,用于诊断阿尔茨海默氏病的方法包括施用有效量的本文公开的式ii-d的化合物,其中r3为
11
cd3。
[0201]
作为血管收缩素转运蛋白(sert)显像剂的氘代fpbm
[0202]
中枢神经系统中的血管收缩素神经元在正常的脑部功能中起重要作用。定位于血管收缩素神经元上的血管收缩素转运蛋白(sert)通过将血管收缩素(神经递质)从突触转运回到突触前神经元中而充当用于终止血管收缩素作用的主要再摄取机制。这些转运蛋白对于控制突触中血管收缩素的浓度及其与突触后血管收缩素受体的结合非常重要。选择性血管收缩素再摄取抑制剂(ssri),诸如氟西汀(fluoxetine)、舍曲林(sertraline)、帕罗西汀(paroxetine)、依地普仑(escitalopram),特异性靶向sert并防止向神经元再摄取血管收缩素。因此,ssri通过控制突触中血管收缩素的浓度可用于治疗抑郁症以及许多其它精神病状(bousman,bmc psychiatry 2017,17:60)。通常将它们认为是抑郁症的一线疗法,并且它们是世界上最常用的处方药类别之一。用适当的
18
f标记的sert抑制剂进行正电子发射断层扫描(pet)成像可用作探测各种心理疾病的病理生理和治疗机制的方法(spies,lancet psychiatry 2015,2:743-55)。已经开发了许多用于体内成像的sert配体(参见下面的结构)。
11
c-mcn5652是人类中使用的第一种sert pet成像示踪剂。(+)-mcn5652的s-18
f-氟甲基类似物
18
f-fme-(+)-mcn5652的开发显示了在人类中用pet进行sert成像的有利特征(hesse,j.nucl.med.mol.imaging 2012,39:1001-11)。pet成像也适于sert的体内定量。
[0203][0204]
具有双苯基硫醇核心结构的配体作为体内sert显像剂也显示出有前景的结果。最常用的sert pet显像剂是
11
c-dasb(wilson,j.med.chem.2000,43:3103-10;wilson,nucl.med.biol.2002,29:509-15)。它显示出优良的选择性、高度重现性和简单的动力学建模以便进行定量(kupers,neuroimage 2011,54:1336-43;ginovart,synapse 2004,52:89-99)。然而,
11
c-dasb是
11
c标记的放射性示踪剂,其受到物理半衰期短(20分钟)的限制,因此不适合广泛的临床应用。
18
f具有较长的半衰期(110分钟),并且可以通过回旋加速器以几居里活性产生。这使得在放射性药厂进行放射性标记以及区域性分布配体成为可能。因此,
18
f标记的sert显像剂对于通过放射性药厂进行商业投放可能很有价值。为开发此类用于sert成像的
18
f标记的放射性示踪剂,已经做出了巨大的努力。一种有前景的
18
f标记的配体是
18
f-4-fadam(huang,eur.j.nucl.med.mol.imaging 2013,40:115-24;shiue,j.nucl.med.2003,44:1890-7)。
[0205]
18
f-4-fadam的首次人类研究结果表明,它用于对sert区域结合位点作图安全有效(huang,eur.j.nucl.med.mol.imaging 2013,40:115-24)。人脑部中特定区域的摄取量与已知的sert分布密切相关。最佳成像时间(约120分钟)略长,但对于常规临床使用是可接受的。已证实苯环上具有不同取代的替代性双苯基硫醇衍生物
18
f-fpbm具有高的选择性结合(ki=0.38nm)、高的脑部摄取量(静脉内注射后2分钟为0.99%剂量/g)和优良的体内靶标与非靶标比率(注射后120分钟时为7.7)(wang,nucl.med.biol.2008,35:447-58;wang,j.nucl.med.2009,50:1509-17;wang,nucl.med.biol.2010,37:479-86)。先前,对这种二芳基硫醚的标记是用k
18
f-f/k
2.2.2
,通过tso前体进行亲核氟化完成的(方案5)(qiao,nucl.med.biol.2016,43:470-7;zhu,nucl.med.biol.2013,40:974-9)。所需产物
18
f-fpbm通过高效液相色谱(hplc)或固相萃取(spe)进一步纯化。在标记过程中,观察到消除反应导致产生乙烯基副产物。
[0206]
与针对
18
f-fp-dtbz(
18
f-av-133)所观察到的相似,消除反应可能会通过首先破坏c-h键而发生。不希望受理论束缚,据信用氘取代丙基上的氢原子可以减少消除反应,从而改善标记反应。另外,n,n-二甲基可以被两个氘代甲基取代,这样将抵抗体内的去甲基反应。
[0207]
方案5
[0208][0209]
本公开提供了用于对脑部中的血管收缩素转运蛋白进行pet成像的氘取代的二芳基硫醚化合物。
[0210]
在一个实施方案中,本公开提供了具有式iii-a的化合物:
[0211][0212]
或其药学上可接受的盐,其中:
[0213]
r4和r5各自独立地为氢或c
1-4
烷基,其中所述c
1-4
烷基任选地被一个或多个氘原子取代;
[0214]
x为
18
f或
19
f;
[0215]
y为
–
(crarb)n–
,其中ra和rb各自独立地为氢或氘原子并且n为1至6的整数;以及
[0216]
r6为氢、卤素或cn;
[0217]
条件是r4、r5或y处存在至少一个氘原子。
[0218]
本公开的一个实施方案提供了式iii-a的化合物,其中r4和r5各自独立地为氢或可以氘代或非氘代的c
1-4
烷基。在一些实施方案中,r4和r5各自独立地为氢、—ch3、—cd3、—ch2ch3、—cd2cd3、—cd2ch3、—ch2cd3、—ch(ch3)2、-cd(cd3)2、—ch(cd3)2、—cd(ch3)2、—ch2ch(ch3)2、—cd2ch(ch3)2、-ch2cd(ch3)2、—ch2ch(cd3)2、—cd2cd(ch3)2、—cd2ch(cd3)2、—ch2cd(cd3)2或—cd2cd(cd3)2。在这些实施方案的一些中,r4和r5各自独立地为氢、—cd3、—cd2cd3、—cd2ch3、—ch2cd3、—cd(cd3)2、—ch(cd3)2、—cd(ch3)2、—cd2ch(ch3)2、—ch2cd(ch3)2、—ch2ch(cd3)2、—cd2cd(ch3)2、-cd2ch(cd3)2、—ch2cd(cd3)2或—cd2cd(cd3)2。在一些
实施方案中,r4和r5各自独立地为氢、-ch3或—cd3。在一些实施方案中,r4和r5均为—cd3。
[0219]
本公开的一个实施方案提供了式iii-a的化合物,其中n为3、4、5或6。在一些实施方案中,n为3。在一些实施方案中,y为-(ch2)2–
、
–
(cd2)2–
、
–
(ch2)3–
、
–
(cd2)3–
、
–
(ch2)4–
、
–
(cd2)4–
、
–
(ch2)5–
、
–
(cd2)5–
、-ch2)6–
或
–
(cd2)6–
。在一些实施方案中,y为
–
(ch2)3–
或
–
(cd2)3–
。
[0220]
本公开的一个实施方案提供了式iii-a的化合物,其中r6为氢、f、cl、br、i或cn。在一些实施方案中,r6为氢。在一些实施方案中,r6为f、cl、br或i。
[0221]
在一些实施方案中,式iii-a的化合物具有下式:
[0222][0223]
或其药学上可接受的盐,其中:
[0224]
x为
18
f或
19
f;以及
[0225]
r6为氢或卤素。
[0226]
在一些实施方案中,式iii-a的化合物具有下式:
[0227][0228][0229]
或其药学上可接受的盐,其中x和r6如本文所定义。
[0230]
在一个实施方案中,式iii-a的化合物为
[0231][0232]
或其药学上可接受的盐。
[0233]
本公开提供了一种用于在有此需要的受试者中对血管收缩素转运蛋白进行成像的方法,该方法包括向该受试者施用有效量的式iii-a的化合物或其药学上可接受的盐并获得该受试者或该受试者的一部分的图像。在一些实施方案中,对血管收缩素转运蛋白进行成像的方法包括施用有效量的本文公开的式iii-a的化合物,其中x为
18
f。
[0234]
在一些实施方案中,本公开提供了一种用于在有此需要的受试者中测定ssri活性以治疗抑郁症的方法,该方法包括向该受试者施用有效量的本文公开的式iii-a的化合物并获得该受试者或该受试者的一部分的图像。
[0235]
实施例
[0236]
实施例1
[0237]
化合物ia的合成
[0238]
方案6
[0239][0240]
合成化合物ia-2:(2r,3r,11r)-3-异丁基-10-甲氧基-2,3,4,6,7,11b-六氢-1h-吡啶并[2,1-a]异喹啉-2,9-二醇
[0241]
在室温下将9-苄基保护的dtbz(ia-1,380mg,0.96mmol)和10%干燥pd/c(15mg)的混合物在thf(10ml)和etoh(5ml)中于h2下搅拌6小时。将反应混合物过滤,并用etoh(10ml)和thf(10ml)洗涤。真空去除溶剂,得到呈黄色固体的ia-2(255mg,87%)。1hnmr(400mhz,cdcl3)δ6.68(s,1h),6.67(s,1h),3.87(s,3h),3.44-3.38(m,1h),3.16-2.97(m,4h),2.66-2.56(m,2h),2.49-2.42(m,1h),1.99(t,j=2.01hz,1h),1.79-1.68(m,2h),1.57-1.45(m,3h),1.12-1.05(m,1h),0.97-0.93(m,6h)。c
18h27
no3[m+h]
+
的hrms计算值为306.2069,实测值为306.2100。
[0242][0243]
合成化合物ia-4:[1,1,2,2,3,3-d6]-丙烷-1,3-二基双(4-甲基苯磺酸酯)
[0244]
在0℃下向化合物ia-3(270mg,3.29mmol)(99原子%d)在thf(10ml)中的溶液添加naoh(527mg,13.17mmol)在h2o(5ml)中的溶液。将反应混合物在室温下搅拌1小时。然后滴加在thf(10ml)中的tscl(1.88g,9.88mmol)。将反应物在室温下搅拌24小时。添加h2o(20ml)并用乙酸乙酯(3
×
30ml)萃取混合物。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(乙酸乙酯(ea)/己烷,0%至60%,体积/体积)纯化,得到呈白色固体的[1,1,2,2,3,3-d6]-丙烷-1,3-二基双(4-甲基苯磺酸酯),ia-4(970mg,76%)。1hnmr(400mhz,cdcl3)δ7.78-7.76(m,4h),7.38-7.36(m,4h),2.483(s,6h),c
17h14
d6o6s2[m+h]
+
的hrms计算值为391.1156,实测值为391.1140。
[0245][0246]
合成化合物ia-5:3-(((2r,3r,11r)-2-羟基-3-异丁基-10-甲氧基-2,3,4,6,7,11b-六氢-1h-吡啶并[2,1-a]异喹啉-9-基)氧基)丙基-[1,1,2,2,3,3-d6])-4-甲基苯磺酸酯。
[0247]
在室温下将ia-2(44mg,0.14mmol)和k2co3(119mg,0.86mmol)的混合物在dmf(4ml)中搅拌1小时。然后添加化合物ia-4(68mg,0.17mmol),并在室温下搅拌反应混合物24小时。加水(5ml),并用乙酸乙酯(5
×
15ml)萃取混合物。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(meoh/dcm,0%至10%,体积/体积)纯化,得到呈浅黄色固体的ia-5(33.7mg,45%)。1hnmr(400mhz,cdcl3)δ7.80-7.78(m,2h),7.30-7.29(m,2h),6.68(s,1h),6.54(s,1h),3.78(s,3h),3.43-3.39(m,1h),3.15-2.97(m,4h),2.65-2.57(m,2h),2.50-2.44(m,1h),2.43(s,3h),2.00(t,j=2.01hz,1h),1.78-1.68(m,2h),1.64-1.47(m,3h),1.12-1.05(m,1h),0.98-0.94(m,6h)。c
28h33
d6no6s[m+h]
+
的hrms计算值为524.2953,实测值为524.2963。
[0248][0249]
合成化合物ia:(2r,3r,11r)-9-(3-氟丙氧基-[1,1,2,2,3,3-d6])-3-异丁基-10-甲氧基-2,3,4,6,7,11b-六氢-1h-吡啶并[2,1-a]异喹啉-2-醇。
[0250]
将化合物ia-5(30mg,0.06mmol)和在thf(0.17ml,0.17mmol)中的1m tbaf的混合物在无水thf(5ml)中在60℃下搅拌5小时。添加h2o(5ml),并用乙酸乙酯(5
×
10ml)萃取混合物。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(meoh/dcm,0%至10%,体积/体积)纯化,得到呈浅黄色固体的ia(11.2mg,26%)。1hnmr(400mhz,cdcl3)δ6.71(s,1h),6.64(s,1h),3.84(s,3h),3.44-3.38(m,1h),3.16-2.98(m,4h),2.66-2.57(m,2h),2.51-2.44(m,1h),2.00(t,j=2.01hz,1h),1.79-1.68(m,2h),1.56-1.47(m,3h),1.12-1.05(m,1h),0.97-0.94(m,6h)。c
21h26
d6fno3[m+h]
+
的hrms计算值为372.2821,实测值为372.2824。
[0251][0252]
通过放射性标记制备
18
f-ia(
18
f-av-133-d6)通过以下步骤实现。将
18
f氟化物上样到活化的qma轻质柱(light cartridge)上,并用0.7ml k
222
/k2co3溶液(40mg k2co3、220mg k
222
、3.6ml水、18.4ml acn)洗脱到锥形小瓶中。在80℃下将溶液在氩气流下干燥,并用1ml乙腈共沸干燥两次。将1mg ia-5溶于0.5ml dmso(无水)中并添加到干燥的[
18
f]f-/k
222
/k2co3复合物。将反应混合物在115℃下加热15分钟。将所得反应混合物冷却至室温,并添加到8ml水。将混合物上样到oasis hlb(3cc)柱上。洗脱并用3ml水洗涤两次。用1ml乙腈洗脱所需
18
f-ia(收率:62%,rcp~98%hplc(supelco ascentis 150
×
4.6mm,acn/10mm甲酸铵缓冲液(afb)45/55,1ml/分钟)。向该溶液中添加约1ml的10mm afb,并注入制备型hplc(phenomenex gemini 250
×
10mm,acn/10mm afb 45/55,3ml/分钟)。收集所需
18
f-ia的洗脱液(660μci mci,滞留时间14
–
15分钟)。将该溶液与18ml水混合,并添加到oasis hlb 3cc上。用1ml 100%乙醇(590μci)洗脱活性。将溶液浓缩至约200μl体积,用1.8ml缓冲液稀释。hplc(hplc:supelco ascentis 150
×
4.6mm,acn/10mm afb 45/55,1ml/分钟)上的hplc图谱显示
18
f-ia(
18
f-av-133-d6)在6分钟时有单峰,rcy 48%(dc):rcp:99%。sa~182ci/mmol(在280nm下测量的)。滞留时间与冷ia相对应。
[0253]
实施例2
[0254]
用于av-133相对于av-133-d6(ia)的ki测定的体外结合测定
[0255]
在50mm hepes(ph 7.5)和0.3m蔗糖中制备纹状体(从大鼠脑部中切下)的组织匀浆。检查化合物在10-7
至10-12
m浓度范围内竞争结合
18
f-av-133或
18
f-av-133-d6(
18
f-ia)(0.15-0.2nm)的能力。结合测定在玻璃管(12x 75mm)中以0.25ml的最终体积进行。用10μm
(
±
)-丁苯那嗪(tbz)定义非特异性结合。在室温下温育90分钟后,通过玻璃纤维过滤器过滤将结合配体与游离配体分离。用4ml冰冷pbs缓冲液(ph 7.4)洗涤过滤器三次,并用γ计数器(wizard2,perkin-elmer)对过滤器上的放射性进行计数。使用非线性最小二乘曲线拟合程序ligand对数据进行分析以确定ic
50
,并通过cheng-prusoff方程使用0.11nm作为av-133和av-133-d6(ia)的kd来计算ki。
[0256]
表1a.
[0257]
针对(
±
)tbz、av-133和av-133-d6(ia)与囊泡单胺转运蛋白2(vmat2)的体外结合亲和力(ki,nm)的比较
[0258][0259][0260]
(
±
)tbz显示出较低的结合亲和力,与文献中报道的等同。对av-133和av-133-d6(ia)的结合研究结果表明,氢到氘的取代对vmat2结合位点提供了相同的结合亲和力。结果表明,
18
f-av-133-d6(ia)是对于vmat2结合位点的优良pet显像剂。与最近批准的氘代丁苯那嗪sd-809相似,对靶位点(vmat2)显示出更高结合亲和力的“冷”av-133-d6(ia)可能是运动障碍的有用治疗剂。
[0261]
实施例3
[0262]
大鼠中fp-dtbz生物分布数据的比较:
18
f-fp-(+)dtbz相对于
18
f-fp-dtbz-d6(
18
f-ia)
[0263][0264]
每项生物分布研究使用每组的三只大鼠。在异氟烷麻醉下,将0.2ml含20μci放射性示踪剂的盐水溶液注入股静脉。在异氟烷麻醉下,在指定时间通过心脏切除将大鼠处死。取出目标器官并称重,并对放射性进行计数。通过将组织计数与同时测量的1%初始剂量(注射材料的100倍稀释等分试样)的计数进行比较,计算出每个器官的剂量百分比。静脉内注射放射性示踪剂后,测量大鼠中的脑部区域性分布。将来自不同脑部区域(皮质、纹状体、海马、小脑和下丘脑)的样品进行解剖、称重并计数。通过将样品计数与上述稀释的初始剂量的计数进行比较,计算出每个样品的百分比剂量/g。通过将每个区域的百分比剂量/g除
以小脑的百分比剂量/g来计算比率。将小脑用作计算靶标与非靶标结合比率的参考区域,因为小脑部中仅存在微量的vmat2结合位点。
[0265]
表1b.静脉内注射
18
f-fp-(+)dtbz后正常雄性cd大鼠中的生物分布(3只大鼠的平均值
±
sd)
[0266][0267][0268]
18
f-fp-(+)dtbz的脑部区域性分布(%剂量/克
±
sd)
[0269] 2分钟60分钟120分钟小脑0.68
±
0.060.19
±
0.020.13
±
0.01纹状体1.12
±
0.041.04
±
0.050.87
±
0.12海马0.80
±
0.070.30
±
0.010.24
±
0.03皮质0.82
±
0.070.21
±
0.010.15
±
0.02其余部分0.83
±
0.060.31
±
0.020.21
±
0.02下丘脑1.06
±
0.100.73
±
0.110.54
±
0.11
[0270]
18
f-fp-(+)dtbz的相对于小脑的比率
[0271] 2分钟60分钟120分钟小脑1.00
±
0.001.00
±
0.001.00
±
0.00纹状体1.66
±
0.155.66
±
0.726.54
±
0.59海马1.19
±
0.031.64
±
0.191.79
±
0.12皮质1.21
±
0.041.13
±
0.091.11
±
0.09其余部分1.23
±
0.031.68
±
0.071.59
±
0.09下丘脑1.57
±
0.043.91
±
0.374.04
±
0.66
[0272]
表1c.静脉内注射
18
f-fp-(+)dtbz-d6(
18
f-ia)后正常雄性cd igs大鼠中的生物分布(3只大鼠的平均值
±
sd)
[0273][0274][0275]
18
f-fp-(+)dtbz-d6(
18
f-ia)的脑部区域性分布(%剂量/克
±
sd)
[0276] 2分钟60分钟120分钟小脑0.48
±
0.040.23
±
0.010.18
±
0.01纹状体1.00
±
0.221.40
±
0.061.00
±
0.08海马0.60
±
0.070.39
±
0.010.31
±
0.04皮质0.65
±
0.070.26
±
0.010.20
±
0.00其余部分0.64
±
0.070.37
±
0.020.28
±
0.02下丘脑0.82
±
0.100.91
±
0.030.65
±
0.11
[0277]
18
f-fp-(+)dtbz-d6(
18
f-ia)的相对于小脑的比率
[0278] 2分钟60分钟120分钟小脑1.00
±
0.001.00
±
0.001.00
±
0.00纹状体2.08
±
0.306.05
±
0.435.49
±
0.43海马1.26
±
0.041.68
±
0.121.74
±
0.32皮质1.36
±
0.051.13
±
0.021.10
±
0.09其余部分1.33
±
0.031.59
±
0.041.52
±
0.03下丘脑1.71
±
0.103.93
±
0.153.56
±
0.49
[0279]
在大鼠中
18
f-fp-(+)dtbz与
18
f-fp-dtbz-d6(
18
f-ia)之间的这项比较生物分布研究表明,存在良好的相似性。然而,最明显的差异是骨摄取量。氘代
18
f-fp-dtbz-d6(
18
f-ia)表现出明显独特的骨摄取量降低,对于
18
f-fp-(+)dtbz,在60和120分钟时的骨摄取量分别为1.33和1.86%剂量/g,而氘代
18
f-fp-dtbz-d6(
18
f-ia)分别显示出0.47和0.65%剂量/g的骨摄取量。降低骨摄取量中所显示的改善可能与c-d相比于c-h的键能更高相关;因此它降低了血液循环中游离
18
f氟化物的水平。
[0280]
另一个主要观察结果是静脉内注射后120分钟时脑部摄取量改善。
18
f-fp-(+)dtbz和
18
f-fp-dtbz-d6(
18
f-ia)的脑部总摄取量分别为0.26和0.34%剂量/g。这相当于脑部总摄取量增加40%。这两种药剂显示出等同的脑部区域性摄取比率;静脉内注射后60分钟时
5.16(m,1h),1.44(s,9h)。
13
cnmr(100mhz,cdcl3)δ:154.49,143.28,136.14,129.11,126.28,125.55,112.13,28.27。c
14h16
d3no2的hrms计算值为236.1604,实测值为237.2107[m+h]
+
。
[0290][0291]
将iia-12(1g,4.1mmol)、2-[2-[2-[(5-碘-2-吡啶基)氧基]乙氧基]乙氧基]乙醇(1.47g,4.1mmol)、碳酸钾(0.69g,5.0mmol)、四丁基溴化铵(1.29g,4.0mmol)和乙酸钯(22mg,0.10mmol)在15ml dmf中的溶液通过用氮气吹扫15分钟进行脱氧,然后将在65℃下加热2小时。将溶液冷却至室温(rt),用80ml乙酸乙酯稀释,并用盐水(20ml)洗涤。将有机层经na2so4干燥并过滤。浓缩滤液,并将残留物通过fc(etoac/己烷=8/2)纯化,得到白色固体iia-13(1.27g,65.2%)。1hnmr(400mhz,cdcl3)δ:168.04(d,j=2.0hz,1h),7.85(s,1h),7.65-7.62(m,1h),7.31-7.29(m,2h),7.10-7.08(m,2h),6.82(s,2h),6.67-6.64(m,1h),4.37-4.36(m,2h),3.73(t,j=2.0hz,2h),3.59-3.55(m,6h),3.49-3.47(m,2h),1.34(s,9h)。
13
cnmr(100mhz,cdcl3)δ:162.90,162.43,154.46,145.50,142.97,135.78,133.96,127.16,126.13,126.33,125.77,124.30,111.26,80.23,72.53,70.53,70.24,69.54,65.11,61.45,28.23。c
25h31
d3n2o6的hrms计算值为461.2605。实测值为462.2801[m+h]
+
。
[0292][0293]
依次添加iia-13(1g,2.1mmol)在20ml dcm中的溶液(0℃)、2ml et3n、tscl(1.64g,8.7mmol)和10mg dmap,在0℃下搅拌反应物0.5小时,然后在室温下过夜。用盐水(20ml)洗涤该溶液。将有机层经na2so4干燥并过滤。浓缩滤液,并将残留物通过fc纯化,得到浅黄色油状物iia-14(1.24g,93.2%)。1hnmr(400mhz,cdcl3)δ:8.04(d,j=2.4hz,1h),7.81-7.77(m,3h),7.44(dd,j=1.6,1.6hz,2h),7.11(dd,j=1.6,1.6hz 2h),7.23(d,j=8.8hz,2h),6.96(d,j=2.4hz,2h),6.79(d,j=8.8hz,1h),4.48-4.46(m,2h),4.17-4.15(m,2h),3.83-3.81(m,2h),3.70-3.60(m,6h),2.43(s,3h),1.47(s,9h)。
13
cnmr(100mhz,cdcl3)δ:163.05,154.63,145.62,144.76,143.14,135.37,134.07,133.04,1333.04,129.80,127.96,127.32,126.75,126.43,125.42,124.44,111.41,80.40,77.40,77.08,76.77,70.76,70.62,69.75,69.25,68.71,65.22,28.34,21.61。c
32h37
d3n2o8s的hrms计算值为615.2694。实测值为616.3120[m+h]
+
。
[0294][0295]
在70℃下搅拌iia-14(0.1g,0.16mmol)和四丁基氟化铵(0.25ml,1.0m在thf中)在1.5ml thf中的溶液4小时。真空蒸发反应物,并将残留物通过fc纯化,得到白色固体iia-15(64mg,85.4%)。1hnmr(400mhz,cdcl3)δ:8.19(d,j=2.0hz,1h),7.81-7.79(m,1h),7.46-7.44(m,2h),7.28-7.23(m,2h),6.98(d,j=2.0hz,2h),6.79(d,j=8.4hz,1h),4.63(d,j=
4.0hz,1h),4.53-4.50(m,3h),3.90-3.87(m,2h),3.83-3.72(m,6h),1.48(s,9h)。
13
cnmr(100mhz,cdcl3)δ:163.10,154.65,145.64,143.15,135.33,134.10,127.30,126.73,126.42,125.44,124.49,111.42,83.99,82.31,80.42,77.33,77.01,76.10,70.85,70.73,70.55,70.35,69.79,65.27,28.47。c
25h30
d3fn2o5的hrms计算值为463.2562,实测值为464.2408[m+h]
+
。
[0296][0297]
将iia-15(30mg,0.06mmol)和1ml tfa的溶液在室温下搅拌10分钟。真空蒸发反应物,并将残留物通过fc纯化,得到白色固体iia-1(19mg,81.5%)。1hnmr(400mhz,cdcl3)δ:8.51(s,1h),8.23(d,j=2.0hz,1h),8.01(dd,j=2.4,2.4hz,1h),7.65(dd,j=1.6,1.6hz,2h),7.31(dd,j=1.6,1.6hz,2h),7.15(d,j=3.2hz,2h),6.85(d,j=8.4hz,1h),4.59(t,j=4.0hz,1h),4.47-4.45(m,3h),3.88-3.86(m,2h),3.78-3.86(m,2h),3.78-3.09(m,6h)。
13
cnmr(100mhz,cdcl3)δ:162.87,145.37,141.13,135.78,135.72,127.21,127.04,126.78,124.74,122.18,110.84,83.94,81.83,70.28,69.79,65.22。c
20h22
d3fn2o3的hrms计算值为363.2038;实测值为364.2176[m+h]
+
。
[0298]
放射性标记av-45-d3(
18
f-iia-1)
[0299][0300]
通过放射性标记制备
18
f-iia1通过以下步骤完成,这与先前报道的非常相似(choi,j.nucl.med.2009;50:1887-94)。将
18
f氟化物上样到活化的qma轻质柱上,并用0.7ml k
222
/k2co3溶液(40mg k2co3、220mg k
222
、3.6ml水、18.4ml acn)洗脱到锥形小瓶中。在90℃下将溶液在氩气流下干燥,并用1ml乙腈共沸干燥两次。将1mg iia-14溶于0.5ml dmso(无水)中并添加到干燥的f-/k
222
/k2co3复合物中。将反应混合物在110℃下加热15分钟。使所得反应混合物冷却,并添加250μl 10%hcl。将该混合物在100℃下加热10分钟,然后在冰浴中冷却。将该混合物用8ml水稀释,用850μl 1n naoh中和,然后上样到oasis hlb(3cc)柱上。洗脱混合物,并用3ml水洗涤两次。用1ml乙腈洗脱所需
18
f-iia1(收率:80%,rcp~98%hplc(supelco ascentis 150
×
4.6mm,acn/10mm甲酸铵缓冲液(afb)60/40,1ml/分钟)。向该溶液中添加约1ml的10mm afb,并注入制备型hplc(phenomenex gemini 250
×
10mm,acn/10mm afb 60/40,4ml/分钟)。收集所需
18
f-iia1的洗脱液(3.37mci,滞留时间9
–
10分钟)。将该溶液与18ml水混合,并添加到oasis hlb 3cc上。用1ml乙醇/5μl 10%hcl(3.03mci)洗脱活性。将溶液浓缩至约200μl体积,用1.8ml缓冲液稀释。hplc(hplc:supelco ascentis150
×
4.6mm,acn/10mm afb 6/4,1ml/分钟)上的hplc图谱显示在6分钟时有单峰。剂量:3.03mci;rcy 71%(dc):rcp:99%;sa~830ci/mmol(在350nm下测量的)。滞留时间与“冷”iia1相对应。
[0301]
实施例5
[0302]
化合物iia2的合成
[0303]
方案8
[0304][0305]
添加4-二苯乙烯醇(1g,4.7mmol)在40ml thf中的溶液,然后添加二碳酸二叔丁酯(4.13g,18.9mmol)和et3n(1.91g,18.9mmol)。将溶液在40℃下搅拌过夜。真空蒸发反应物,并将残留物通过fc纯化,得到白色固体iia-21(1.69g,86.8%)。1hnmr(400mhz,cdcl3)δ:7.49-7.46(m,2h),7.43-7.41(m,2h),7.37(d,j=8.8hz,2h),7.17(dd,j=1.6,1.6hz,1h),6.99(s,1h),6.69(s,1h),1.59(s,9h),1.55(s,9h)。
13
cnmr(100mhz,cdcl3)δ:152.67,151.85,150.25,137.99,135.25,132.01,128.39,127.17,127.15,126.21,121.45,118.61,83.54,80.57,28.37,27.72。c
24h29
no5的hrms计算值为411.2046。实测值为412.3102[m+h]
+
。
[0306][0307]
向iia-21(1g,2.4mmol)在15ml dmf中的悬浮液中,缓慢添加60%nah在矿物油中的分散物(60%,240mg,6mmol),在室温下搅拌0.5小时后,添加氘代碘甲烷(0.73g,5mmol)(≥99.5原子%d)。将反应物在室温下搅拌1小时,在0℃下将反应混合物用40ml饱和氯化铵(nh4cl)猝灭。然后用60ml的etoac萃取该混合物。将有机层用水以及盐水(40ml)洗涤,通过na2so4干燥,并过滤。浓缩滤液,并将残留物通过fc(etoac/己烷=3/7)纯化,得到无色油状物iia-22(1g,96.8%)。1hnmr(400mhz,cdcl3)δ:7.51(d,j=8.8hz,2h),7.47(d,j=8.8hz,2h),7.24(d,j=8.4hz,2h),7.18(d,j=8.4hz,2h),7.08(d,j=0.8hz,1h),1.59(s,9h),1.48(s,9h)。
13
cnmr(100mhz,cdcl3)δ:151.79,150.43,143.20,135.03,134.15,128.19,127.40,127.29,126.58,125.43,121.47,83.59,80.41,28.35,27.21。c
25h28
d3no5的hrms计算值为428.2391。实测值为429.3102[m+h]
+
。
[0308][0309]
向iia-22(1g,2.3mmol)在15ml水和20ml甲醇中的悬浮液中,添加naoh(0.46g,
11.6mmol)。在室温下搅拌反应物2小时,将反应物用1n hcl中和,用乙酸乙酯萃取,通过na2so4干燥,并过滤。浓缩滤液,并将残留物通过fc(etoac/己烷=3/7)纯化,得到无色油状物iia-23(0.71g,92.5%)。1hnmr(400mhz,cdcl3)δ:7.36(d,j=8.4hz,2h),7.30(d,j=8.4hz,2h),7.21(d,j=8.4hz,2h),6.93(dd,j=1.6,1.6hz,2h),6.66(d,j=7.6hz,2h),6.39(s,1h),1.52(s,9h)。
13
cnmr(100mhz,cdcl3)δ:155.95,155.35,142.28,135.46,126.51,128.59,127.74,126.54,125.87,125.37,115.72,80.86,28.42。c
20h20
d3no3的hrms计算值为328.1866。实测值为329.1902[m+h]
+
。
[0310][0311]
向iia-23(0.7g,2.1mmol)在15ml dmf中的悬浮液中,添加二-对甲苯磺酸三乙二醇酯(1.95g,4.2mmol),在室温下搅拌反应物过夜。将反应物用盐水洗涤,用乙酸乙酯萃取,然后通过na2so4干燥并过滤。浓缩滤液,并将残留物通过fc(etoac/己烷=3/7)纯化,得到无色油状物iia-24(1.18g,90.2%)。1hnmr(400mhz,cdcl3)δ:7.76-7.73(m,2h),7.41-7.37(m,4h),7.27(dd,j=6.8,6.8hz,2h),7.18(d,j=8.4hz,2h),6.95-6.92(m,2h),6.88-6.84(m,2h),4.12(t,j=4.8hz,2h),4.06(t,j=4.8hz,2h),3.76(t,j=4.8hz,2h),3.64-3.59(m,4h),3.56-3.52(m,2h),2.35(s,3h),1.44(s,9h)。
13
cnmr(100mhz,cdcl3)δ:158.40,154.60,144.79,144.72,134.57,133.00,130.21,129.85,127.92,127.88,127.65,126.30,125.89,125.35,114.84,80.24,70.68,70.55,69.69,69.34,69.30,68.64,67.44,28.33,21.55。c
33h38
d3no8s的hrms计算值为614.2741。实测值为615.2736[m+h]
+
。
[0312][0313]
在70℃下搅拌iia-24(0.1g,0.16mmol)和四丁基氟化铵(0.25ml,1.0m在thf中)在1.5ml thf中的溶液4小时。真空蒸发反应物,并将残留物通过fc纯化,得到白色固体iia-25(63mg,84.4%)。1hnmr(400mhz,cdcl3)δ:7.45(dd,j=1.2,1.2hz,4h),7.23(d,j=8.4hz,2h),7.01-6.91(m,4h),4.65-4.63(m,1h),4.53-4.51(m,1h),4.17(t,j=4.4hz,2h),3.89(t,j=4.4hz,2h),3.81-3.73(m,4h),1.48(s,9h)。
13
cnmr(100mhz,cdcl3)δ:158.51,142.78,134.68,130.33,127.98,126.32,126.00,125.44,114.87,83.98,82.30,80.34,70.90,70.85,70.56,70.37,69.82,67.52。c
26h31
d3fno5的hrms计算值为462.2609。实测值为407.2122[m+h-tbu]
+
。
[0314][0315]
将iia-25(40mg,0.08mmol)和1ml tfa的溶液在室温下搅拌10分钟。真空蒸发反应物,并将残留物通过fc纯化,得到白色固体iia-2(29mg,92.3%)。1hnmr(400mhz,cdcl3)δ:7.41(d,j=8.4hz,2h),7.36(d,j=8.4hz,2h),6.90(dd,j=5.6,4.8hz,4h),6.61(d,j=
8.4hz,2h),4.65-4.63(m,1h),4.53-4.51(m,1h),4.17(t,j=4.8hz,2h),3.90-3.88(m hz,2h),3.82-3.73(m,6h)。
13
cnmr(100mhz,cdcl3)δ:157.86,148.77,131.20,127.43,127.10,127.05,126.99,124.00,114.82,124.00,114.82,112.47,83.99,82.31,70.98,70.56,70.30,69.85,67.51。c
21h23
d3fno3的hrms计算值为362.2085。实测值为363.2402[m+h]
+
。
[0316]
实施例6
[0317]
化合物iib的合成
[0318]
化合物iib可以通过方案9中描绘的合成方法制备。
[0319]
方案9
[0320][0321]
实施例7
[0322]
化合物
11
c-pib-d3的合成
[0323]
化合物
11
c-pib-d3可以通过方案10中描绘的合成方法制备。
[0324]
方案10
[0325][0326]
实施例8
[0327]
化合物iic
[0328]
化合物iic可以通过方案11中描绘的合成方法制备。
[0329]
方案11
[0330][0331]
实施例9
[0332]
化合物
18
f-iic的合成
[0333]
化合物
18
f-iic可以通过方案12中描绘的合成方法制备。
[0334]
方案12
[0335][0336]
实施例10
[0337]
人ad脑匀浆的aβ聚集体的体外结合测定
[0338]
竞争性结合测定是在12
×
75mm硼硅酸盐玻璃管中进行的。反应混合物含100μl ad脑匀浆(20
–
25ug)、100μl[
18
f]av-45或[
18
f]av-45-d3(~150,000cpm)和100μl竞争性化合物(10-5
至10-10
m连续稀释在含0.1%牛血清白蛋白的pbs中),最终体积为0.25ml。在同一测定管中,在1μm impy(6-碘-2-(4'-二甲基氨基-)苯基-咪唑并[1,2-a]吡啶)的存在下定义非特异性结合。将该混合物在室温下温育60分钟,并通过whatman gf/b过滤器使用brandel m-24r细胞收集器进行真空过滤,然后用pbs缓冲液洗涤三次来分离结合的和游离的放射性。用γ计数器(wizard2,perkin-elmer)对过滤器上的放射性进行计数。使用非线性最小二乘曲线拟合程序ligand对数据进行分析,以确定ic
50
。通过cheng-prusoff方程使用3.51nm作为av-45和av-45-d3的kd来计算ki。
[0339]
表2a.
[0340]
使用先前描述的方法(choi,2009)进行的人ad脑匀浆的aβ聚集体的体外结合亲和力(ki,nm)。
[0341][0342][0343]
使用
18
f-av-45-d3或
18
f-av-45作为“热配体”的结合研究结果表明,氢到氘的取代(av-45相对于av-45-d3、av-1-d3)表现出对aβ聚集体结合位点的相同的优良结合亲和力。
所有氘代剂av-45-d3(iia1),av-1-d3(iia2)都显示出相同的结合亲和力。
[0344]
实施例11
[0345]
小鼠中的生物分布研究
[0346]
每组三只小鼠用于生物分布研究。在异氟烷麻醉下,将0.1ml含放射性示踪剂的盐水溶液注入尾静脉。在异氟烷麻醉下,在指定时间通过心脏切除将小鼠处死。取出目标器官并称重,并对放射性进行计数。通过将组织计数与同时测量的1%初始剂量(注射材料的100倍稀释等分试样)的计数进行比较,计算出每个器官的剂量百分比。
[0347]
表2b
[0348]
18
f-av-45-d3(iia1)在正常雄性小鼠中的生物分布。%剂量/g(n=3的平均值
±
sd)
[0349] 2分钟30分钟60分钟120分钟血液2.16
±
0.052.93
±
0.272.08
±
0.071.36
±
0.12心脏5.08
±
0.392.40
±
0.391.72
±
0.191.18
±
0.03肌肉3.21
±
0.141.79
±
0.061.20
±
0.040.75
±
0.07肺部4.88
±
0.162.90
±
0.471.97
±
0.251.31
±
0.03肾脏9.51
±
0.806.41
±
1.863.74
±
0.472.09
±
0.02脾脏2.50
±
0.121.52
±
0.211.22
±
0.120.83
±
0.07胰腺4.94
±
0.772.05
±
0.291.43
±
0.200.87
±
0.15肝脏12.0
±
0.7012.0
±
0.718.15
±
0.755.47
±
0.29皮肤1.24
±
0.272.07
±
0.141.34
±
0.070.91
±
0.13骨1.74
±
0.182.24
±
0.442.76
±
0.374.41
±
0.77脑6.26
±
0.231.71
±
0.371.53
±
0.201.26
±
0.04
[0350]
表2c
[0351]
先前报道(choi,2009)的
18
f-av-45在正常雄性小鼠中的生物分布%剂量/g(n=3的平均值
±
sd)。
[0352] 2分钟60分钟120分钟180分钟血液2.51
±
0.312.37
±
0.271.96
±
0.231.39
±
0.13肌肉3.49
±
0.331.33
±
0.081.02
±
0.070.78
±
0.09肝脏16.3
±
5.3811.1
±
1.838.96
±
0.285.39
±
0.31骨1.33
±
0.243.66
±
0.306.48
±
0.347.83
±
1.08脑7.33
±
1.541.88
±
0.141.80
±
0.201.48
±
0.15
[0353]
在统计误差范围内,
18
f-av-45和
18
f-av-45-d3(
18
f-iia1)在小鼠中的生物分布显示出非常相似的结果。氘代和非氘代av-45都在静脉内注射后2分钟显示出等同的脑部初始穿透,但在稍后的时间点60分钟和120分钟时脑部滞留较低。
[0354]
实施例12
[0355]
化合物fpbm(iii-1)的合成
[0356][0357]
在65℃下将化合物iii-1-1(50mg,0.18mmol)和k2co3(76mg,0.55mmol)的混合物在无水dmf(3ml)中搅拌1.5小时。然后添加3-氟丙基-4-甲基苯磺酸酯(64mg,0.27mmol)。将混合物再搅拌2小时,冷却至室温,并添加nacl饱和溶液(12ml)。用ea(15ml x 3)萃取混合物。将有机层合并,并且用mgso4干燥并过滤。真空干燥滤液,通过快速色谱法(硅胶)(meoh/dcm,0%至10%,体积/体积)纯化,得到呈无色蜡状物质的产物fpbm,iii-1(38mg,收率62%)。1h nmr(400mhz,丙酮)δ7.33(dd,j=7.7,1.5hz,1h),7.15
–
7.09(m,1h),6.98(t,j=5.1hz,2h),6.79
–
6.74(m,2h),6.63-6.59(m,2h),5.26(s,2h),4.69(t,j=5.9hz,1h),4.57(t,j=5.9hz,1h),4.09(t,j=6.2hz,2h),3.55(s,2h),2.26(s,6h),2.21
–
2.06(m,2h)。
13
c nmr(100mhz,丙酮)δ157.53,149.70,139.69,136.17,131.11,130.00,127.37,116.71,116.25,116.04,114.80,113.90,81.36,79.75,63.63,63.57,61.88,44.53。c
18h23
fn2os[m+h]
+
的hrms计算值为335.1593。实测值为335.1603。
[0358]
实施例13
[0359]
化合物fpbm-d6(iii-2)的合成
[0360]
方案13
[0361][0362]
在0℃下将二甲基-d6-胺盐酸盐(0.53g,6.50mmol)(99原子%d)和et3n(1.32g,12.99mmol)的混合物在无水dcm(20ml)中搅拌。然后滴加在无水dcm(15ml)中的化合物iii-2-1(1.08g,4.33mmol)。添加后,将反应物在室温下搅拌5小时。然后添加水(30ml),并用dcm(20ml x 2)萃取。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至60%,体积/体积)纯化,得到呈无色蜡状物质的产物iii-2-2(0.95g,收率83%)。1h nmr(400mhz,cdcl3)δ7.45(d,j=8.3hz,1h),6.83
–
6.79(m,2h),3.81(s,3h)。
13
c nmr(100mhz,cdcl3)δ159.16,139.29,133.52,116.55,112.87,109.38,55.59。c
10
h6d6brno2[m+h]
+
的hrms计算值为264.0506。实测值为264.0529。
[0363][0364]
在125℃下将化合物iii-2-2(510mg,1.94mmol)、cu(25mg,0.39mmol)、cu2o(27mg,0.19mmol)、2-氨基硫酚(364mg,2.91mmol)和et3n(1.96g,19.40mmol)的混合物在2-乙氧基乙醇(8ml)中搅拌40小时。然后将混合物过滤并用甲醇(20ml)和dcm(20ml)洗涤。将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至60%,体积/体积)纯化,得到呈无色粘性油
状物的产物iii-2-3(370mg,收率62%)。1h nmr(400mhz,cdcl3)δ7.46(d,j=7.6hz,1h),7.21
–
7.09(m,2h),6.84
–
6.66(m,4h),3.78(s,3h).
13
c nmr(100mhz,cdcl3)δ158.71,148.65,138.91,136.72,132.33,130.62,123.43,118.02,115.94,115.80,115.37,111.54,55.47。c
16h12
d6n2o2s[m+h]
+
的hrms计算值为309.1544。实测值为309.1640。
[0365][0366]
在0℃下将化合物iii-2-3(300mg,0.97mmol)的溶液搅拌在无水dcm(15ml)中,然后在n2下滴加在dcm中的1m bbr3(2.92ml,2.92mmol)。完全添加后,在室温下搅拌反应混合物。添加nahco3饱和溶液,并用dcm(20ml x 2)萃取。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,并通过快速色谱法(硅胶)(ea/己烷,0%至80%,体积/体积)纯化,得到呈无色粘性油状物的产物iii-2-4(200mg,收率70%)。1h nmr(400mhz,cdcl3)δ7.40(dd,j=7.6,1.5hz,1h),7.18
–
7.14(m,1h),6.89(d,j=8.6hz,1h),6.73
–
6.54(m,4h),4.44(brs,2h)。c
15h10
d6n2o2s[m+h]
+
的hrms计算值为295.1387。实测值为295.1304。
[0367][0368]
在室温下,将化合物iii-2-4(200mg,0.68mmol)的溶液在无水thf(4ml)中搅拌。然后添加在thf(3.4ml,3.40mmol)中的1m bh3。使反应混合物回流8小时。完成时,冷却混合物,并小心地添加0.5ml浓hcl(0.5ml),并真空去除溶剂。添加10ml的1m hcl溶液,然后使其回流1小时,冷却至室温,并用na2co3饱和溶液将ph调至8。用ea(20ml x 3)萃取溶液,将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发。将其通过快速色谱法(硅胶)(甲醇/ea,0%至10%,体积/体积)纯化,得到呈无色蜡状物质的产物iii-2-5(135mg,收率71%)。1h nmr(400mhz,meod)δ7.16(dd,j=7.7,1.5hz,1h),7.12-7.08(m,1h),6.93(d,j=8.5hz,1h),6.83(d,j=2.7hz,1h),6.78(dd,j=8.1,1.3hz,1h),6.66
–
6.61(m,2h),3.60(s,2h).
13
c nmr(100mhz,meod)δ156.32,148.33,138.51,134.51,131.68,129.18,124.90,117.71,117.41,117.33,115.20,115.15,60.85。c
15h12
d6n2os[m+h]
+
的hrms计算值为281.1595。实测值为281.1210。
[0369][0370]
在65℃下将化合物iii-2-5(15mg,0.05mmol)和k2co3(22mg,0.16mmol)的混合物在无水dmf(3ml)中搅拌1.5小时。然后添加3-氟丙基-4-甲基苯磺酸酯(25mg,0.10mmol),并且再搅拌混合物2小时,冷却至室温并添加nacl饱和溶液(12ml)。用ea(15ml x 3)萃取混合物,将有机层合并并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(thf/己烷,0%至60%,体积/体积)纯化,得到呈无色蜡状物质的产物fpbm-d6,iii-2(6mg,收率35%)。1h nmr(400mhz,丙酮)δ7.33(dd,j=7.7,1.5hz,1h),7.15
–
7.10(m,1h),6.98(t,j=5.1hz,2h),6.79
–
6.73(m,2h),6.61(d,j=1.1hz,1h),5.24(d,j=13.6hz,2h),4.69(t,j=5.9hz,1h),4.57(t,j=5.9hz,1h),4.09(t,j=6.2hz,2h),3.55(s,2h),2.26(s,6h),2.21
–
2.08(m,2h)。
13
c nmr(100mhz,丙酮)δ157.53,149.70,139.69,136.17,131.11,130.00,127.37,116.71,116.25,116.04,114.80,113.90,81.36,79.75,63.63,63.57,61.88,44.53。c
18h17
d6fn2os[m+h]
+
的hrms计算值为341.1970。实测值为341.1912。
[0371]
实施例14
[0372]
化合物fpbm-d12(iii-3)的合成
[0373]
方案14
[0374][0375]
在0℃下,向化合物iii-3-2(270mg,3.29mmol)(99原子%d)在thf(10ml)中的溶液添加在水(5ml)中的naoh(527mg,13.17mmol)。在室温下搅拌反应混合物1小时。然后滴加在thf(10ml)中的tscl(1.88g,9.88mmol)。在室温下搅拌反应物24小时。添加h2o(20ml),并用乙酸乙酯(3
×
30ml)萃取混合物。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至60%,体积/体积)纯化,得到呈白色固体的[1,1,2,2,3,3-d6]-丙烷-1,3-二基双(4-甲基苯磺酸酯),iii-3-3(970mg,76%)。1hnmr(400mhz,cdcl3)δ7.78
–
7.76(m,4h),7.38
–
7.36(m,4h),2.483(s,6h),c
17h14
d6o6s2[m+h]
+
的hrms计算值为391.1156。实测值为391.1140。
[0376][0377]
在65℃下将化合物iii-2-6(40mg,0.14mmol)和k2co3(59mg,0.43mmol)的混合物在无水dmf(3ml)中搅拌1.5小时。然后添加化合物iii-3-3(67mg,0.17mmol),并且再搅拌混合物2小时,冷却至室温并添加nacl饱和溶液(12ml)。用ea(15ml x 3)萃取混合物,将有机层合并并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(meoh/dcm,0%至10%,体积/体积)纯化,得到呈无色蜡状物质的产物iii-3-1(38mg,收率54%)。1h nmr
(400mhz,丙酮)δ7.76(d,j=8.2hz,2h),7.39
–
7.33(m,3h),7.12(t,j=7.6hz,1h),6.95(d,j=8.6hz,1h),6.87(d,j=2.6hz,1h),6.77(d,j=8.0hz,1h),6.63
–
6.59(m,2h),5.31(s,1h),3.55(s,2h),2.37(s,3h)。
13
cnmr(100mhz,丙酮)δ157.30,149.78,144.89,139.61,136.24,133.20,131.03,130.03,129.94,127.69,127.34,116.66,116.03,114.80,113.94,61.74,20.62。c
25h18d12
n2o4s2[m+h]
+
的hrms计算值为499.2478。实测值为499.2432。
[0378][0379]
在65℃下将化合物iii-3-1(20mg,0.04mmol)的混合物在无水thf(3ml)中搅拌。然后添加在thf(0.2ml,0.20mmol)中的1mtbaf,在65℃下搅拌反应混合物3小时,然后真空蒸发溶剂。添加水(8ml),并用ea(15ml x 3)萃取混合物。将有机层合并,并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(thf/己烷,0%至60%,体积/体积)纯化,得到呈无色蜡状物质的产物fpbm-d12,iii-3(7mg,收率50%)。1h nmr(400mhz,cdcl3)δ7.41(dd,j=8.0,1.6hz,1h),7.20
–
7.14(m,1h),6.96(d,j=8.6hz,1h),6.90(d,j=2.8hz,1h),6.76
–
6.66(m,3h),4.55(brs,1h),3.56(s,2h).
13
c nmr(100mhz,cdcl3)δ157.34,148.29,139.31,136.33,130.76,130.08,127.22,118.21,117.09,116.39,115.23,114.08,62.22。c
18h11d12
fn2os[m+h]
+
的hrms计算值为347.2347。实测值为347.24。
[0380]
实施例15
[0381]
化合物fpbm-d6(iii-4-2)的合成
[0382]
方案15
[0383][0384]
将化合物iii-1-1(40mg,0.15mmol)和k2co3(61mg,0.44mmol)的混合物在无水dmf(3ml)中在65℃下搅拌1.5小时。然后添加化合物iii-3-3(68mg,0.18mmol),并且再搅拌混合物2小时,冷却至室温,并添加nacl饱和溶液(10ml)。用ea(15ml x 3)萃取混合物,将有机层合并并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(meoh/dcm,0%至10%,体积/体积)纯化,得到呈无色蜡状物质的产物iii-4-1(45mg,63%)。1h nmr(400mhz,cdcl3)δ7.76(d,j=8.3hz,2h),7.41(dd,j=8.0,1.5hz,1h),7.28
–
7.26(m,2h),7.20
–
7.16(m,1h),6.92(d,j=8.6hz,1h),6.79(d,j=2.8hz1h),6.74
–
6.70(m,2h),6.53(dd,j=8.6,2.8hz,1h),4.56(brs,2h),3.55(s,2h),2.39(s,3h),2.32(s,6h).
13
c nmr(100mhz,cdcl3)δ157.02,148.36,144.76,139.21,136.40,132.86,130.65,130.16,129.83,127.84,127.39,118.20,116.97,116.18,115.24,114.10,62.31,45.33,21.59。c
25h24
d6n2o4s2[m+h]
+
的hrms计算值为493.2102。实测值为493.2013。
[0385][0386]
在65℃下将化合物iii-4-1(20mg,0.04mmol)的混合物在无水thf(5ml)中搅拌,然后添加1m tbaf在thf(0.12ml,0.12mmol)中的溶液,在65℃下搅拌反应混合物3小时,然后真空蒸发溶剂。添加水(8ml),并用ea(10ml x 3)萃取混合物。将有机层合并,并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(meoh/dcm,0%至10%,体积/体积)纯化,得到呈无色蜡状物质的产物fpbm-d6,iii-4-2(7mg,51%)。1h nmr(400mhz,cdcl3)δ7.39(dd,j=8.1,1.5hz,1h),7.19
–
7.14(m,1h),6.97(d,j=8.6hz,1h),6.93(d,j=2.3hz,1h),
6.75
–
6.66(m,3h),3.59(s,2h),2.33(s,6h)。c
18h17
d6fn2os[m+h]
+
的hrms计算值为341.1970。实测值为341.2005。
[0387]
实施例16
[0388]
化合物iii-4-25至iii-4-28的合成方案16
[0389][0390]
方案17
[0391][0392]
在0℃下将1-溴-2-硝基苯(1g,4.95mmol)的混合物搅拌在浓h2so4(10ml)中,缓慢添加nis(1.23g,5.45mmol)。完全添加后,在室温下搅拌反应混合物5小时,然后添加冰水(30ml),并用ea(30ml x 3)萃取。将有机层合并,并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至15%,体积/体积)纯化,得到呈白色固体的产物iii-4-3(1.35g,收率84%)。1h nmr(400mhz,cdcl3)δ8.15(d,j=2.0hz,1h),7.75(dd,j=8.4,2.0hz,1h),7.47(d,j=8.4hz,1h)。
[0393][0394]
在0℃下搅拌乙醇(20ml),然后缓慢添加钠(356mg,15.48mmol)。在所有钠被消耗
完并且变成乙醇钠后,将溶剂温热至80℃,并添加在乙醇(10ml)中的化合物iii-4-4(1.31g,6.19mmol),并在80℃下于n2下搅拌反应混合物1小时。然后添加化合物iii-4-3(2.63g,8.05mmol)并使其回流2小时。蒸发溶剂并添加h2o(30ml),用浓hcl中和ph=5,并用ea(30ml x 3)萃取。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,并通过快速色谱法(硅胶)(ea/己烷,0%至60%,体积/体积)纯化,得到呈黄色固体的产物iii-4-8(1.6g,57%)。1h nmr(400mhz,cdcl3)δ8.49(d,j=1.8hz,1h),7.62(dd,j=8.7,1.8hz,1h),7.50(d,j=8.6hz,1h),7.01(dd,j=8.6,2.6hz,1h),6.95(d,j=2.7hz,1h),6.67(d,j=8.7hz,1h),3.89(s,3h),3.04(s,3h),2.87(s,3h)。
13
c nmr(100mhz,cdcl3)δ168.81,161.87,145.30,145.07,142.07,139.17,139.03,133.87,130.68,116.97,116.55,112.72,87.77,55.68,38.53,34.60。c
16h15
in2o4s[m+h]
+
的hrms计算值为458.9875。实测值为458.9828。
[0395][0396]
制备化合物iii-4-9至iii-4-12的通用程序a
[0397]
在0℃下将化合物iii-4-5至iii-4-8(2mmol)在甲醇(10ml)中搅拌,并添加浓hcl(5ml)。然后添加sncl2(1.52g,8mmol),并在室温下搅拌反应混合物过夜。完成后,将混合物用水(30ml)稀释,并用2m naoh水溶液碱化至ph=10,并用ea(30ml x 3)萃取。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发并通过快速色谱法(硅胶)(ea/己烷,0%至80%,体积/体积)纯化,得到呈无色蜡状油状物的产物iii-4-9至iii-4-12。
[0398][0399]
根据程序a,由化合物iii-4-5制备化合物iii-4-9,得到呈无色蜡状物质的iii-4-9,收率为68%。1h nmr(400mhz,cdcl3)δ7.38(d,j=8.1hz,1h),7.13(d,j=8.7hz,1h),6.81(dd,j=8.7,2.6hz,1h),6.74(d,j=2.6hz,1h),6.69
–
6.61(m,2h),4.67(s,2h),3.79(s,3h),3.16(s,3h),2.87(s,3h)。
13
c nmr(100mhz,cdcl3)δ170.01,158.97,149.65,139.19,137.61,136.33,132.75,122.73,117.72,115.92,114.74,114.42,111.45,55.49,38.53,34.64。c
16h17
cln2o2s[m+h]
+
的hrms计算值为337.0778。实测值为337.0855。
[0400][0401]
根据程序a,由化合物iii-4-6制备化合物iii-4-10,得到呈无色蜡状物质的iii-4-10,收率为69%。1h nmr(400mhz,cdcl3)δ7.30(d,j=8.3hz,1h),7.11(d,j=8.7hz,1h),6.87
–
6.74(m,4h),4.76(s,2h),3.79(s,3h),3.17(s,3h),2.88(s,3h)。
13
c nmr(100mhz,cdcl3)δ170.42,158.94,149.66,138.29,137.76,132.46,124.61,122.65,120.82,117.78,116.17,114.72,111.61,55.51,38.63,34.86。c
16h17
brn2o2s[m+h]
+
的hrms计算值为381.0272、383.0252。实测值为381.0183、383.0162。
[0402][0403]
根据程序a,由化合物iii-4-7制备化合物iii-4-11,得到呈无色蜡状物质的iii-4-11,收率为71%。1h nmr(400mhz,cdcl3)δ7.48
–
7.40(m,1h),7.10(d,j=8.7hz,1h),6.80(dd,j=8.7,2.8hz,1h),6.74(d,j=2.8hz,1h),6.43
–
6.35(m,2h),4.71(s,2h),3.78(s,3h),3.17(s,3h),2.88(s,3h)。c
16h17
fn2o2s[m+h]
+
的hrms计算值为321.1073。实测值为321.1117。
[0404][0405]
根据程序a,由化合物iii-4-8制备化合物iii-4-12,得到呈无色蜡状物质的iii-4-12,收率为68%。1h nmr(400mhz,cdcl3)δ7.13(dd,j=8.3,6.5hz,2h),7.03(d,j=1.5hz,1h),6.98(dd,j=8.1,1.6hz,1h),6.80(dd,j=8.7,2.6hz,1h),6.74(d,j=2.6hz,1h),3.78(s,3h),3.15(s,3h),2.85(s,3h)。
13
c nmr(100mhz,cdcl3)δ169.98,159.00,149.74,139.27,137.74,132.91,126.63,123.65,122.46,115.93,111.48,96.47,55.50,38.54,34.65。c
16h17
in2o2s[m+h]
+
的hrms计算值为429.0134。实测值为429.0038。
[0406]
制备化合物iii-4-13至iii-4-16的通用程序b
[0407][0408]
在0℃下将化合物iii-4-9至iii-4-12的混合物(2mmol)在无水dcm(15ml)中搅拌。然后在n2下滴加在dcm中(6ml,6mmol)的1m bbr3。完全添加后,在室温下搅拌反应混合物过夜。反应后,添加nahco3饱和溶液,并用dcm(20ml x 2)萃取混合物。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,并通过快速色谱法(硅胶)(ea/己烷,0%至80%,体积/体积)纯化,得到呈无色蜡状物质的产物iii-4-13至iii-4-16。
[0409][0410]
根据程序b,由化合物iii-4-9制备化合物iii-4-13,得到呈无色蜡状物质的iii-4-13,收率为68%。1h nmr(400mhz,meod)δ7.27(d,j=8.3hz,1h),7.12(d,j=8.6hz,1h),6.78-6.76(m,2h),6.65(d,j=2.7hz,1h),6.58(dd,j=8.3,2.3hz,1h),3.08(s,3h),2.78(s,3h)。
13
c nmr(100mhz,meod)δ170.69,157.12,150.35,138.98,136.85,135.62,132.88,120.85,116.81,116.68,114.20,114.05,113.12,37.56,33.50。c
15h15
cln2o2s[m+h]
+
的hrms计算值为323.0621。实测值为323.0658。
[0411][0412]
根据程序b,由化合物iii-4-10制备化合物iii-4-14,得到呈无色蜡状物质的iii-4-14,收率为71%。1h nmr(400mhz,cdcl3)δ7.26(d,j=8.2hz,1h),6.87(dd,j=7.9,5.3hz,2h),6.80(dd,j=8.2,2.0hz,1h),6.64(d,j=2.6hz,1h),6.60(dd,j=8.6,2.6hz,1h),3.14(s,3h),2.85(s,3h)。c
15h15
brn2o2s[m+h]
+
的hrms计算值为367.0116、369.0095。实测值为367.0147、369.0127。
[0413][0414]
根据程序b,由化合物iii-4-11制备化合物iii-4-15,得到呈无色蜡状物质的iii-4-15,收率为69%。1h nmr(400mhz,cdcl3)δ7.40(dd,j=9.2,6.4hz,1h),6.87(d,j=8.6hz,1h),6.66(d,j=2.6hz,1h),6.60(dd,j=8.5,2.4hz,1h),6.44
–
6.35(m,2h),3.17(s,3h),2.89(s,3h)。c
15h15
fn2o2s[m+h]
+
的hrms计算值为307.0917。实测值为307.0947。
[0415][0416]
根据程序b,由化合物iii-4-12制备化合物iii-4-16,得到呈无色蜡状物质的iii-4-16,收率为68%。1h nmr(400mhz,cdcl3)δ7.08(dd,j=16.6,4.8hz,2h),7.02
–
6.99(m,1h),6.87(d,j=8.6hz,1h),6.64(d,j=2.5hz,1h),6.58(dd,j=8.6,2.6hz,1h),4.48(s,2h),3.16(s,3h),2.86(s,3h)。c
15h15
in2o2s[m+h]
+
的hrms计算值为414.9977。实测值为414.9912。
[0417][0418]
用于制备化合物iii-4-17至iii-4-20的通用程序c
[0419]
在室温下,将化合物iii-4-13至iii-4-16(1mmol)在无水thf(5ml)中搅拌。然后添加在thf(3ml,3mmol)中的1m bh3,使反应混合物回流8小时。冷却混合物,并小心地添加0.5ml浓hcl。真空去除溶剂,并添加1m hcl溶液(10ml)并使其回流1小时,冷却至室温并用na2co3饱和溶液将ph调至8。用ea(20ml x 3)萃取混合物,将有机层合并并经无水mgso4干燥,过滤并将滤液真空蒸发并通过快速色谱法(硅胶)(ea/甲醇,0%至10%,体积/体积)纯化,得到呈无色蜡状油状物的产物iii-4-17至iii-4-20。
[0420][0421]
根据程序c,由化合物iii-4-13制备化合物iii-4-17,得到呈无色蜡状油状物的iii-4-17,收率为66%。1h nmr(400mhz,cdcl3)δ7.24(d,j=8.2hz,1h),6.87(d,j=8.5hz,1h),6.73(d,j=2.7hz,1h),6.70(d,j=2.1hz,1h),6.66(dd,j=8.2,2.2hz,1h),6.59(dd,j=8.5,2.8hz,1h),3.56(s,2h),2.32(s,6h).
13
c nmr(100mhz,cdcl3)δ155.25,149.02,138.47,136.94,135.69,131.32,125.79,118.30,118.04,116.18,115.61,114.81,61.60,45.08。c
15h17
cln2os[m+h]
+
的hrms计算值为309.0828。实测值为309.0780。
[0422][0423]
根据程序c,由化合物iii-4-14制备化合物iii-4-18,得到呈无色蜡状油状物的iii-4-18,收率为69%。1h nmr(400mhz,cdcl3)δ7.17(d,j=8.2hz,1h),6.91(d,j=8.6hz,1h),6.85(d,j=2.0hz,1h),6.83
–
6.77(m,2h),6.62(dd,j=8.6,2.8hz,1h),4.79(brs,2h),3.58(s,2h),2.33(s,6h)。
13
c nmr(100mhz,cdcl3)δ155.32,149.13,138.47,136.98,131.66,125.56,123.77,121.13,117.94,117.70,116.32,116.16,61.61,45.02。c
15h17
brn2os[m+h]
+
的hrms计算值为353.0323、355.0303。实测值为353.0284、355.0277。
[0424][0425]
根据程序c,由化合物iii-4-15制备化合物iii-4-19,得到呈无色蜡状油状物的iii-4-19,收率为63%。1h nmr(400mhz,meod)δ7.26(dd,j=8.5,6.5hz,1h),6.85(d,j=8.5hz,1h),6.78(d,j=2.7hz,1h),6.61(dd,j=8.5,2.8hz,1h),6.48(dd,j=11.2,2.7hz,1h),6.37-6.32(m,1h),3.57(s,2h),2.31(s,6h).13c nmr(100mhz,meod)δ165.75,163.33,155.92,151.27,151.14,138.01,137.47,137.37,130.55,125.54,117.35,115.08,111.68,103.76,103.54,100.88,100.63,61.20,44.02。c
15h17
fn2os[m+h]
+
的hrms计算值为293.1124。实测值为293.0578。
[0426][0427]
根据程序c,由化合物iii-4-16制备化合物iii-4-20,得到呈无色蜡状物质的iii-4-20,收率为67%。1h nmr(400mhz,meod)δ7.13(d,j=1.8hz,1h),7.00(d,j=8.5hz,1h),6.91(dd,j=8.1,1.8hz,1h),6.84(dd,j=5.4,2.7hz,2h),6.68(dd,j=8.5,2.7hz,1h),3.67(s,2h),2.37(s,6h)。c
15h17
in2os[m+h]
+
的hrms计算值为401.0185。实测值为401.0158。
[0428][0429]
制备化合物iii-4-21至iii-4-24的通用程序d
[0430]
将化合物iii-4-17至iii-4-20(0.1mmol)和k2co3(41mg,0.3mmol)在无水dmf(3ml)中在65℃下搅拌1.5小时,然后添加化合物ii-3-3(39mg,0.1mmol),并且再搅拌混合物2小时,冷却至室温并添加饱和nacl溶液(10ml)。用ea(15ml x 3)萃取混合物,将有机层合并并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(meoh/dcm,0%至10%,体积/体积)纯化,得到呈无色油状物的化合物iii-4-21至iii-4-24。
[0431][0432]
根据程序d,由化合物iii-4-17制备化合物iii-4-21,得到呈无色油状物的iii-4-21,收率为50%。c
25h23
d6cln2o4s2[m+h]
+
的hrms计算值为527.1712。实测值为527.1637。
[0433][0434]
根据程序d,由化合物iii-4-18制备化合物iii-4-22,得到呈无色油状物的iii-4-22,收率为51%。c
25h23
d6brn2o4s2[m+h]
+
的hrms计算值为571.1207、573.1187。实测值为
571.1311、573.1288。
[0435][0436]
根据程序d,由化合物iii-4-19制备化合物iii-4-23,得到呈无色油状物的iii-4-23,收率为58%。c
25h23
d6fn2o4s2[m+h]
+
的hrms计算值为511.2008。实测值为511.1965。
[0437][0438]
根据程序d,由化合物iii-4-20制备化合物iii-4-24,得到呈无色油状物的iii-4-24,收率为53%。c
25h23
d6in2o4s2[m+h]
+
的hrms计算值为619.1068。实测值为619.1003。
[0439]
制备化合物ii-4-25至ii-4-28的通用程序e
[0440][0441]
在65℃下将化合物iii-4-21至iii-4-24(0.2mmol)在无水thf(5ml)中搅拌。然后添加在thf(0.6ml,0.6mmol)中的1m tbaf。在65℃下搅拌反应混合物3小时,然后真空蒸发溶剂,添加水(8ml)。用ea(15ml x 3)萃取混合物,将有机层合并并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(meoh/dcm,0%至10%,体积/体积)纯化,得到呈无色油状物的产物iii-4-25至iii-4-28。
[0442][0443]
根据程序e,由化合物iii-4-21制备化合物iii-4-25,得到呈无色油状物的iii-4-25,收率为60%。1h nmr(400mhz,cdcl3)δ7.35(dd,j=7.8,0.6hz,1h),6.97(d,j=8.6hz,
1h),6.86(d,j=2.8hz,1h),6.74
–
6.65(m,3h),4.79(s,2h),3.54(s,2h),2.31(s,6h)。
13
c nmr(100mhz,cdcl3)δ157.47 149.38,139.36,137.43,135.80,131.13,126.85,117.91 116.65 115.56,114.66,114.17,62.51,45.25。c
18h16
d6clfn2os[m+h]
+
的hrms计算值为375.1580。实测值为375.1649。
[0444][0445]
根据方法e,使用化合物iii-4-22制备化合物iii-4-26,得到呈无色油状物的iii-4-26,收率为57%。1h nmr(400mhz,cdcl3)δ7.26(s,1h),6.98(d,j=8.6hz,1h),6.85(dd,j=5.3,2.4hz,2h),6.81(dd,j=8.1,2.1hz,1h),6.70(dd,j=8.6,2.9hz,1h),4.78(s,2h),3.54(s,2h),2.31(s,6h).
13
c nmr(100mhz,cdcl3)δ157.51,149.52,139.45,137.53,131.26,126.66,123.93,120.79,117.56,116.66,116.21,114.17,62.52,45.25。c
18h16
d6brfn2os[m+h]
+
的hrms计算值为419.1075、421.1055。实测值为419.1050、421.1030。
[0446][0447]
根据步骤e,由化合物iii-4-23制备化合物iii-4-27,得到呈无色油状物的iii-4-27,收率为52%。1h nmr(400mhz,cdcl3)δ7.43(dd,j=8.2,6.6hz,1h),6.93(d,j=8.6hz,1h),6.85(d,j=2.8hz,1h),6.70(dd,j=8.6,2.8hz,1h),6.45
–
6.38(m,2h),4.86(s,2h),3.55(s,2h),2.32(s,6h)。
13
c nmr(100mhz,cdcl3)δ165.84,163.40,157.25,150.43,150.31,138.90,138.54,138.44,130.48,127.56,116.63,114.13,112.03,105.06,104.84,101.70,101.45,62.49,45.25。c
18h16
d6f2n2os[m+h]
+
的hrms计算值为359.1876。实测值为359.1793。
[0448][0449]
根据程序f,由化合物iii-4-24制备化合物iii-4-28,得到呈无色油状物的iii-4-28,收率为55%。1h nmr(400mhz,meod)δ7.14(d,j=0.9hz,1h),6.99(d,j=8.7hz,1h),6.95(d,j=2.8hz,1h),6.92(d,j=0.9hz,2h),6.79(dd,j=8.7,2.8hz,1h),3.60(s,2h),2.31(s,6h).
13
c nmr(100mhz,meod)δ157.92,150.20,138.69,136.34,131.21,126.28,125.91,123.25,116.58,116.37,114.19,94.78,61.17,44.03。c
18h16
d6fin2os[m+h]
+
的hrms
计算值为467.0936。实测值为467.0887。
[0450]
实施例17
[0451]
化合物iii-5-5的合成
[0452]
方案18
[0453][0454]
在125℃下将化合物iii-5-1(500mg,2.17mmol)、cu(28mg,0.43mmol)、cu2o(31mg,0.22mmol)、2-氨基硫酚(408mg,3.26mmol)和et3n(2.20g,21.74mmol)的混合物在2-乙氧基乙醇(8ml)中搅拌40小时。将混合物过滤并用甲醇(20ml)和dcm(20ml)洗涤。真空蒸发滤液,通过快速色谱法(硅胶)(ea/己烷,0%至60%,体积/体积)纯化,得到呈白色固体的产物iii-5-2(350mg,收率59%)。1h nmr(400mhz,meod)δ7.36(d,j=7.7hz,1h),7.18(t,j=7.7hz,1h),7.07(d,j=2.2hz,1h),6.90
–
6.79(m,3h),6.67(t,j=7.5hz,1h),3.79(s,3h)。
13
c nmr(100mhz,meod)δ172.24,157.78,149.77,136.67,136.00,130.47,129.60,126.16,117.51,116.24,115.11,115.03,112.96,54.58。c
14h14
n2o2s[m+h]
+
的hrms计算值为275.0854。实测值为275.0821。
[0455][0456]
在0℃下将化合物iii-5-2(350mg,1.28mmol)在无水dcm(15ml)中搅拌,然后在氮气下滴加在dcm(3.83ml,3.83mmol)中的1m bbr3。添加后,使反应混合物回流5小时,冷却并添加nahco3饱和溶液。用dcm/meoh(10/1)溶液(20ml x 3)萃取混合物。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,并通过快速色谱法(硅胶)(ea/己烷,0%至80%,体积/体积)纯化,得到呈白色固体的产物iii-5-3(230mg,收率69%)。1h nmr(400mhz,meod)δ7.35(d,j=7.7hz,1h),7.16(t,j=7.7hz,1h),6.93(d,j=2.6hz,1h),6.81(dd,j=10.4,8.4hz,2h),6.73
–
6.63(m,2h)。
13
c nmr(100mhz,meod)δ172.54,155.62,149.51,
136.76,136.38,130.30,130.21,123.93,117.52,117.48,115.70,115.11,114.30。c
13h12
n2o2s[m+h]
+
的hrms计算值为261.0698。实测值为261.0687。
[0457][0458]
将化合物iii-5-3(40mg,0.15mmol)和k2co3(64mg,0.46mmol)的混合物在无水dmf(4ml)中在65℃下搅拌1.5小时,然后添加化合物3-氟丙基-4-甲基苯磺酸酯(71mg,0.30mmol),并且再搅拌混合物2小时,冷却至室温,并添加nacl饱和溶液(12ml)。用ea(15ml x 3)萃取混合物,将有机层合并并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至70%,体积/体积)纯化,得到呈白色固体的产物iii-5-4(30mg,收率61%)。1h nmr(400mhz,cdcl3)δ7.41(dd,j=7.6,1.4hz,1h),7.25
–
7.18(m,2h),6.96(d,j=8.8hz,1h),6.87
–
6.84(m,1h),6.78
–
6.73(m,2h),4.69(t,j=5.7hz,1h),4.57(t,j=5.7hz,1h),4.38(brs,2h),4.09(t,j=6.1hz,2h),2.22
–
2.10(m,2h)。
13
c nmr(100mhz,cdcl3)δ169.62,157.17,148.61,136.65,135.07,130.88,126.27,118.74,117.89,115.61,115.46,114.61,81.28,79.64,63.94,63.88,30.39,30.19。c
16h17
fn2o2s[m+h]
+
的hrms计算值为321.1073。实测值为321.1120。
[0459][0460]
在室温下,将化合物iii-5-4(25mg,0.68mmol)在无水thf(4ml)中搅拌。添加在thf(3.4ml,3.40mmol)中的1m bh3,并使反应混合物回流8小时。冷却混合物,并小心地添加0.5ml浓hcl(0.2ml),并真空去除溶剂。添加1m hcl溶液(5ml),然后回流1小时,冷却至室温,并用na2co3饱和溶液将ph调至8。用ea(20ml x 3)萃取混合物,将有机层合并并经无水mgso4干燥,过滤并将滤液真空蒸发,并通过快速色谱法(硅胶)(甲醇/dcm,0%至13%,体积/体积)纯化,得到呈白色固体的产物iii-5-5(12.5mg,收率52%)。1h nmr(400mhz,cdcl3)δ7.29
–
7.25(m,1h),7.19
–
7.15(m,1h),7.02
–
6.97(m,2h),6.78
–
6.68(m,3h),4.70(t,j=5.8hz,1h),4.59(t,j=5.8hz,1h),4.09(t,j=6.1hz,2h),3.99(s,2h),2.26
–
2.07(m,2h).
13
c nmr(100mhz,cdcl3)δ158.18,147.53,143.82,135.10,131.30,129.85,124.73,118.86,116.79,115.41,114.89,113.64,81.46,79.82,63.64,63.59,62.74,44.90。c
16h19
fn2os[m+h]
+
的hrms计算值为307.1280。实测值为307.1291。
[0461]
实施例18
[0462]
化合物iii-5-8的合成
[0463]
方案19
[0464][0465]
在65℃下将化合物iii-5-3(40mg,0.15mmol)和k2co3(64mg,0.46mmol)的混合物在无水dmf(4ml)中搅拌1.5小时。然后添加化合物iii-8(72mg,0.18mmol),并且再搅拌混合物2小时,冷却至室温并添加nacl饱和溶液(12ml)。用ea(15ml x 3)萃取混合物,将有机层合并并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至70%,体积/体积)纯化,得到呈白色固体的产物iii-5-6(37mg,收率50%)。c
23h18
d6n2o5s2[m+h]
+
的hrms计算值为479.1581。实测值为479.1566。
[0466][0467]
在65℃下将化合物iii-5-6(37mg,0.08mmol)在无水thf(5ml)中搅拌,然后添加在thf(0.23ml,0.23mmol)中的1m tbaf。在65℃下搅拌反应混合物3小时,然后真空蒸发溶剂,添加h2o(8ml),并用ea(15ml x 3)萃取混合物。将有机层合并,并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至70%,体积/体积)纯化,得到呈白色固体的产物iii-5-7(14mg,收率56%)。1h nmr(400mhz,meod)δ7.36(dd,j=7.7,1.4hz,1h),7.20
–
7.16(m,1h),7.10
–
7.09(m,1h),6.86-6.80(m,3h),6.89
–
6.65(m,1h)。
[0468][0469]
在室温下将化合物iii-5-7(14mg,0.04mmol)在无水thf(2ml)中搅拌,然后添加在thf(0.43ml,0.43mmol)中的1m bh3。使反应混合物回流8小时。冷却混合物,并小心地添加0.5ml浓hcl(0.2ml),并真空去除溶剂。添加1m hcl溶液(5ml)并使其回流1小时,冷却至室
温,并用na2co3饱和溶液将ph调至8。用ea(20ml x 3)萃取混合物。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(甲醇/dcm,0%至13%,体积/体积)纯化,得到呈白色固体的产物iii-5-8(7mg,收率52%)。1h nmr(400mhz,cdcl3)δ7.26(dd,j=7.7,1.4hz,1h),7.19
–
7.15(m,1h),7.04
–
6.97(m,2h),6.79
–
6.70(m,3h),4.02(s,2h),3.52(brs,4h)。
13
c nmr(100mhz,cdcl3)δ158.25,147.50,143.18,135.05,131.51,129.89,124.81,118.93,116.75,115.49,115.13,113.96,44.40。c
16h13
d6fn2os[m+h]
+
的hrms计算值为313.1657。实测值为313.1716。
[0470]
实施例19
[0471]
化合物iii-6-5的合成
[0472]
方案20
[0473][0474]
在125℃下将化合物iii-6-1(500mg,2.05mmol)、cu(26mg,0.41mmol)、cu2o(29mg,0.21mmol)、2-氨基硫酚(384mg,3.07mmol)和et3n(2.07g,20.49mmol)的混合物在2-乙氧基乙醇(8ml)中搅拌40小时。将混合物过滤并用甲醇(20ml)和dcm(20ml)洗涤。真空蒸发滤液,通过快速色谱法(硅胶)(ea/己烷,0%至60%,体积/体积)纯化,得到呈淡黄色固体的产物iii-6-2(350mg,收率59%)。iii-6-21h nmr(400mhz,meod)δ7.34(d,j=7.7hz,1h),7.17(dd,j=10.7,4.7hz,1h),6.98(d,j=2.6hz,1h),6.94
–
6.78(m,3h),6.66(t,j=7.5hz,1h),3.78(s,3h),2.92(s,3h)。
13
c nmr(100mhz,meod)δ170.43,157.99,149.64,136.92,136.47,130.38,129.99,125.74,117.50,115.99,115.11,112.92,54.59,25.32。c
15h16
n2o2s[m+h]
+
的hrms计算值为289.1011。实测值为289.1088。
[0475]
[0476]
在0℃下将化合物iii-6-2(300mg,1.04mmol)在无水dcm(15ml)中搅拌。然后在氮气下滴加在dcm(3.13ml,3.13mmol)中的1m bbr3。添加后,在室温下搅拌反应混合物;然后添加nahco3饱和溶液,并用dcm(20ml x 2)萃取。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,并通过快速色谱法(硅胶)(ea/己烷,0%至70%,体积/体积)纯化,得到呈无色粘性油状物的产物iii-6-3(190mg,收率67%)。1h nmr(400mhz,cdcl3)δ7.36(dd,j=8.0,1.5hz,1h),7.19
–
7.15(m,1h),6.86(dd,j=16.0,5.7hz,2h),6.76
–
6.70(m,2h),6.66(dd,j=8.6,2.7hz,1h),6.60(d,j=4.8hz,1h),4.41(brs,2h)。c
14h14
n2o2s[m+h]
+
的hrms计算值275.0854。实测值为275.0867。
[0477][0478]
在65℃下将化合物iii-6-3(40mg,0.15mmol)和k2co3(61mg,0.44mmol)的混合物在无水dmf(3ml)中搅拌1.5小时。添加化合物3-氟丙基-4-甲基苯磺酸酯(68mg,0.30mmol),并且再搅拌混合物2小时,冷却至室温并添加nacl饱和溶液(12ml)。用ea(15ml x 3)萃取混合物。将有机层合并,并用mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至80%,体积/体积)纯化,得到呈无色粘性油状物的产物iii-6-4(30mg,收率61%)。c
17h19
fn2o2s[m+h]
+
的hrms计算值为335.1230。实测值为335.1185。
[0479][0480]
在室温下将化合物iii-6-4的混合物(30mg,0.09mmol)在无水thf(4ml)中搅拌。然后添加在thf(0.9ml,0.90mmol)中的1m bh3。使反应混合物回流8小时。冷却混合物,并小心地添加0.5ml浓hcl(0.5ml),并真空去除溶剂。添加1m hcl溶液(10ml),然后回流1小时,冷却至室温,并用na2co3饱和溶液将ph调至8。用ea(20ml x 3)萃取混合物。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(甲醇/dcm,0%至13%,体积/体积)纯化,得到呈无色粘性油状物的产物iii-6-5(15mg,收率52%)。1h nmr(400mhz,cdcl3)δ7.31(dd,j=7.7,1.4hz,1h),7.19
–
7.15(m,1h),6.97(dd,j=11.8,5.7hz,2h),6.78
–
6.69(m,3h),4.70(t,j=5.8hz,1h),4.57(d,j=5.8hz,1h),4.08(t,j=6.1hz,2h),3.90(s,2h),2.50(s,3h),2.21-2.11(m,2h)。
13
c nmr(100mhz,cdcl3)δ157.80,147.73,140.44,135.43,131.05,129.93,125.66,118.69,116.84,115.87,115.37,114.08,81.48,79.84,63.63,63.58,54.07,36.02,30.50,30.30。c
17h21
fn2os[m+h]
+
的hrms计算值为321.1437。实测值为321.1451。
[0481]
实施例20
[0482]
化合物iii-6-8的合成
[0483]
方案20
[0484][0485]
在0℃下将化合物iii-5-5(20mg,0.07mmol)和et3n(33mg,0.33mmol)的混合物在无水dcm(7ml)中搅拌。滴加(boc)2o(30mg,0.14mmol)。添加后,在室温下搅拌反应物3小时。然后添加h2o(30ml)。用dcm(10ml x 2)萃取混合物,将有机层合并并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至70%,体积/体积)纯化,得到呈无色油状物的产物iii-6-6(17mg,64%)。1h nmr(400mhz,cdcl3)δ7.24(d,j=7.7hz,1h),7.19
–
7.13(m,1h),7.03(d,j=8.6hz,1h),6.96(d,j=2.4hz,1h),6.77-6.70(m,3h),4.96(s,1h),4.70(t,j=5.8hz,1h),4.58(t,j=5.8hz,1h),4.44(d,j=5.6hz,2h),4.22(s,2h),4.08(t,j=6.1hz,2h),2.24
–
2.04(m,2h),1.47(s,9h)。
13
c nmr(100mhz,cdcl3)δ158.16,155.79,147.36,139.82,134.90,131.60,129.84,118.96,115.48,115.36,114.30,81.43,79.79,77.32,63.66,63.60,42.97,30.45,30.25,28.41。c
21h27
fn2o3s[m+h]
+
的hrms计算值为407.1805。实测值为407.1763。
[0486][0487]
在0℃下将化合物iii-6-6(17mg,0.04mmol)在无水dmf(2ml)中搅拌,然后缓慢添加60%nah(3.3mg,0.08mmol)。添加后,在0℃下搅拌反应物30分钟。添加氘代碘甲烷(9mg,0.06mmol),并在0℃下再搅拌1小时。添加nacl饱和溶液(15ml),并用ea(20ml x 2)萃取混合物。将有机层合并,并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/己烷,0%至50%,体积/体积)纯化,得到呈白色固体的产物iii-6-7(13mg,73%)。1h nmr(400mhz,cdcl3)δ7.18
–
7.14(m,2h),7.04
–
6.94(m,1h),6.77
–
6.70(m,4h),4.70(t,j=
5.8hz,1h),4.58(t,j=5.8hz,1h),4.19(brs,2h),4.07(t,j=6.1hz,2h),2.22-2.10(m,2h),1.52
–
1.46(m,9h)。c
22h26
d3fn2o3s[m+h]
+
的hrms计算值为424.2149。实测值为424.2158。
[0488][0489]
在室温下将化合物iii-6-7(13mg,0.03mmol)在cf3cooh(3ml)中搅拌过夜,然后真空蒸发溶剂。用na2co3饱和溶液将ph调至8。用ea(10ml x 3)萃取混合物,将有机层合并并经无水mgso4干燥,过滤并将滤液真空蒸发,通过快速色谱法(硅胶)(ea/甲醇,0%至10%,体积/体积)纯化,得到呈无色油状物的产物iii-6-8(5mg,50%)。1h nmr(400mhz,cdcl3)δ7.29
–
7.27(m,1h),7.20
–
7.15(m,1h),7.04
–
7.01(m,2h),6.77
–
6.71(m,3h),4.69(t,j=5.8hz,1h),4.57(t,j=5.8hz,1h),4.08(t,j=6.1hz,2h),3.99(s,2h),2.23
–
2.04(m,2h).
13
c nmr(100mhz,cdcl3)δ157.99,147.71,137.89,135.36,131.44,130.08,126.01,118.86,116.50,116.27,115.55,114.97,81.43,79.79,63.70,63.65,52.86,30.44,30.24。c
17h18
d3fn2os[m+h]
+
的hrms计算值为324.1625。实测值为324.1628。
[0490]
实施例21
[0491]
18
f-iii-3(
18
f-fpbm-d12)的放射性标记
[0492][0493]
通过放射性标记制备
18
f-iii-3(
18
f-fpbm-d12)通过以下步骤实现。将
18
f氟化物上样到活化的qma轻质柱上,并用0.7ml k
222
/k2co3溶液(40mg k2co3、220mg k
222
、3.6ml水、18.4ml acn)洗脱到锥形小瓶中。在80℃下将溶液在氩气流下干燥,并用1ml乙腈共沸干燥两次。将2mg前体溶于0.5ml乙腈(无水)中并添加到干燥的
18
f f-/k
222
/k2co3复合物中。将含有iii-3-1的反应混合物在80℃下加热15分钟。将所得反应混合物冷却至室温,并添加到8ml水。将混合物上样到oasis hlb(3cc)柱上。对柱进行洗脱,并用3ml水洗涤两次。用1ml乙腈洗脱所需
18
f-iii-3(收率:53%,rcp~99%hplc(supelco ascentis 150
×
4.6mm,acn/10mm甲酸铵缓冲液(afb)50/50,1ml/分钟)。向该溶液中添加1ml水,并注入制备型hplc(phenomenx gemini 250
×
10mm,acn/水60/40,4ml/分钟)中。收集所需
18
f-iii-3的洗脱液(14.5mci,滞留时间21
–
22分钟)。将该溶液与30ml水混合,并添加到oasis hlb 3cc上。用1ml 100%乙醇(12.2mci)洗脱活性。将溶液浓缩至约200μl体积,并用1.8ml缓冲液稀释。hplc(hplc:supelco ascentis 150
×
4.6mm,acn/10mm afb 50/50,1ml/分钟)上的放射性图谱显示
18
f-iii-3(
18
f-fpbm-d12)在4分钟时有单峰,rcy 32%(dc):rcp:99%。sa~
1700ci/mmol(在280nm下测定的)。滞留时间与冷iii-3相对应,从而确认了化学特性。
[0494]
实施例22
[0495]
体外结合测定
[0496]
制备血管收缩素转运蛋白(llc-sert,在共同的亲本细胞系llc-pk1中表达)的膜匀浆,并将其用于结合测定。竞争性结合测定以0.25ml的最终体积进行。将膜悬浮液的等分试样与50mm tris-hcl(ph 7.4)、120mm nacl和0.1%牛血清白蛋白、0.2nm[
125
i]idam和8-10个浓度(10-13
至10-7
m)的竞争性药物混合。用10μm西酞普兰(citalopram)定义非特异性结合。在室温下进行温育60分钟,并将结合的配体收集在用1%聚乙烯亚胺(sigma,st.louis,mo)预先浸泡的玻璃纤维过滤器上,并在γ计数器(wizard2,perkin elmer)中计数。使用非线性最小二乘曲线拟合程序ligand对数据进行分析以确定ic
50
,并通过cheng-prusoff方程使用0.2nm作为[
125
i]idam的kd来计算ki。
[0497]
表3a.
[0498]
环卤素(x)取代对sert结合亲和力。
[0499][0500][0501]
该系列中氘代剂的结合亲和力显示出极高的结合亲和力。添加氟丙基-d6基团显示出等同结合亲和力。
[0502]
表3b.
[0503]
n-甲基取代基对sert结合亲和力的影响。
[0504][0505]
在这一系列药剂中,结合亲和力取决于n,n-二甲基取代,其中有或无氘的二取代化合物显示出最高的结合亲和力。
[0506]
表3c.
[0507]
氢相对于氘取代对sert结合亲和力。
[0508][0509][0510]
结合亲和力研究表明,与相应的非氘代剂相比,氘代剂全部对sert结合位点展示出等同结合亲和力。新型氘代剂可用于与sert结合位点结合。
[0511]
实施例23
[0512]
大鼠中的生物分布
[0513]
每项生物分布研究使用每组的三只大鼠。在异氟烷麻醉下,将0.2ml含20μci放射性示踪剂的盐水溶液注入股静脉。在异氟烷麻醉下,在指定时间通过心脏切除将大鼠处死。取出目标器官并称重,并对放射性进行计数。通过将组织计数与同时测量的1%初始剂量(注射材料的100倍稀释等分试样)的计数进行比较,计算出每个器官的剂量百分比。静脉内注射放射性示踪剂后,测量大鼠的脑部区域性分布。将来自不同脑部区域[皮质、纹状体、海马、小脑和下丘脑]的样品进行解剖、称重并计数。通过将样品计数与上述稀释的初始剂量的计数进行比较,计算出每个样品的百分比剂量/g。通过将每个区域的百分比剂量/g除以小脑的百分比剂量/g来计算比率。将小脑用作计算靶标与非靶标结合比率的参考区域,因为小脑部中仅存在微量的sert。
[0514]
表3d.
[0515]
在静脉内注射后的不同时间点正常大鼠中
18
f-iii-3(
18
f-fpbm-d12)的生物分布,%剂量/g(n=3的平均值
±
sd)。
[0516]
[0517][0518]
区域与小脑的比率
18
f-iii-3(
18
f-fpbm-d12)
[0519] 2分钟30分钟60分钟120分钟下丘脑1.17
±
0.212.99
±
0.465.32
±
0.457.55
±
0.82小脑1.00
±
0.001.00
±
0.001.00
±
0.001.00
±
0.00海马0.97
±
0.132.04
±
0.273.45
±
0.423.85
±
0.28皮质1.44
±
0.271.81
±
0.302.68
±
0.352.67
±
0.50纹状体1.15
±
0.182.43
±
0.383.96
±
0.624.69
±
1.26其余部分1.21
±
0.132.42
±
0.133.77
±
0.434.74
±
0.71
[0520]
区域与小脑的比率
18
f-iii-1(
18
f-fpbm)
[0521]
(先前报道,wang,j.nucl.med.2009,50:1509-17)
[0522]
器官2分钟30分钟60分钟120分钟下丘脑1.14
±
0.163.50
±
0.674.69
±
1.767.67
±
2.60小脑1.00
±
0.151.00
±
0.191.00
±
0.461.00
±
0.33海马0.88
±
0.112.26
±
0.442.82
±
1.063.87
±
1.00皮质1.03
±
0.132.87
±
0.644.26
±
1.584.53
±
1.33纹状体0.90
±
0.102.58
±
0.593.19
±
1.234.67
±
1.51其余部分0.98
±
0.142.54
±
0.403.11
±
1.224.49
±
1.29
[0523]
静脉内注射
18
f-iii-3(
18
f-fpbm-d12)后大鼠体内的生物分布研究表明,新的氘代剂穿透血脑屏障,并定位于血管收缩素转运蛋白结合位点浓度高的区域,即下丘脑和纹状体区域(表3d)。先前报道,氘代
18
f-iii-3(
18
f-fpbm-d12)在脑部中的区域性分布与非氘代
18
f-iii-1(
18
f-fpbm)等同。
[0524]
新的新型氘代化合物
18
f-iii-3(
18
f-fpbm-d12)可用于在服用血管收缩素再摄取抑制剂(ssri)之前和之后对患者进行成像,以监测药物作用。如上所述的“冷”剂也可用于
parki n son
′
s disease patients.nucl.med.biol.2014;41:322-9.
[0551]
[23]hsiao it,weng yh,hsieh c j,lin wy,wey sp,kung mp,et al.correlation of parkinson disease severity and 18f-dtbz positron emission tomography.jama neurol 2014;71:758-66.
[0552]
[24]okamura n,villemagne v,drago j,pejoska s,dhamija r,mulligan r,et al.in vivo measurement of vesicular monoamine transporter type 2 densityy in parkinson disease with 18f-av-133.j.nucl.med.2010;51:223-8.
[0553]
[25]villemagne vl,okamura n,pejoska s,drago j,mulligan rs,chetelat g,et al.in vivo assessment of vesicular monoamine transporter type 2 in dementia with lewy bodies and alzheimer disease.arch.neurol.2011;68:905-12.
[0554]
[26]kung m,hou c,lieberman b,oya s,ponde d,blankemeyer e,et al.in vivo imaging of{beta}-cell mass in rats using 18f-fp-(+)-dtbz:a potential pet ligand for studying diabetes mellitus.j.nucl.med.2008;49:1171-6.
[0555]
[27]raffo a,hancock k,polito t,xie y,andan g,witkowski p,et al.role of vesicular monoamine transporter type2in rodent insulin secretion and glucose metabolism revealed by its specific antagonist tetrabenazine.j.endocrinol.2008;198:41-9.
[0556]
[28]harris pe,ferrara c,barba p,polito t,freeby m,and maffei a.vmat2 gene expression and function as it applies to imaging beta-cell mass.j.mol.med.2008;86:5-16.
[0557]
[29]harris pe,farwell md,and ichise m.pet quantification of pancreatic vmat 2binding using(+)and(-)enantiomers of[(1)(8)f]fp-dtbz in baboons.nucl.med.biol.2013;40:60-4.
[0558]
[30]freeby m,ichise m,and harris pe.vesicular monoamine transporter,type 2(vmat2)expression as it compares to insulin and pancreatic polypeptide in the head,body and tail of the human pancreas.islets 2012;4:393-7.
[0559]
[31]normandin md,petersen kf,ding ys,lin sf,naik s,fowles k,et al.in vivo imaging of endogenous pancreatic beta-cell mass in healthy and type 1 diabetic subjects using 18f-fluoropropyl-dihydrotetrabenazine and pet.j.nucl.med.2012;53:908-16.
[0560]
[32]eriksson o,jahan m,johnstrom p,korsgren o,sundin a,halldin c,et al.in vivo and in vitro characterization of[18f]-fe-(+)-dtbz as a tracer for beta-cell mass.nucl.med.biol.2010;37:357-63.
[0561]
[33]jahan m,eriksson o,johnstrom p,korsgren o,sundin a,johansson l,et al.decreased defluorination using the novel beta-cell imaging agent[18f]fe-dtbz-d4 in pigs examined by pet.ejnmmi res 2011;1:33.
[0562]
[34]gauthier s,albert m,fox n,goedert m,kivipelto m,mestre-ferrandiz j,et al.why has therapy development for dementia failed in the last two decades?alzheimers dement 2016;12:60-4.
[0563]
[35]harrison jr and owen mj.alzheimer disease:the amyloid hypothesis on trial.br.j.psychiatry 2016;208:1-3.
[0564]
[36]mathis ca,mason ns,lopresti bj,and klunk we.development of positron emission tomography beta-amyloid plaque imaging agents.semin.nucl.med.2012;42423-32.
[0565]
[37]zeng f and goodman mm.fluorine-18 radiolabeled heterocycles as pet tracers for imaging beta-amyloid plaques in alzheimer disease.curr.top.med.chem.2013;13:909-19.
[0566]
[38]kung h.the β-amyloid hypothesis in alzheimer disease:seeing is believing..acs med chem lett 2012;3:265-7.
[0567]
[39]villemagne vl,dore v,bourgeat p,burnham sc,laws s,salvado o,et al.abeta-amyloid and tau imaging in dementia.semin.nucl.med.2017;47:75-88.
[0568]
[40]rowe cc,pejoska s,mulligan rs,jones g,chan jg,svensson s,et al.head-to-head comparison of 11c-pib and 18f-azd4694(nav4694)for beta-amyloid imaging in aging and dementia.j.nucl.med.2013;54:880-6.
[0569]
[41]nelissen n,van laere k,thurfjell l,owenius r,vandenbulcke m,koole m,et al.phase 1 study of the pittsburgh compound b derivative 18f-flutemetamol in healthy volunteers and patients with probable alzheimer disease.j.nucl.med.2009;50:1251-9.
[0570]
[42]rowe cc,jones g,dore v,pejoska s,margison l,mulligan rs,et al.standardized expression of 18f-nav4694 and 11c-pib beta-amyloid pet results with the centiloid scale.j.nucl.med.2016;57:1233-7.
[0571]
[43]rowe cc,pejoska s,mulligan rs,jones g,chan jg,svensson s,et al.head-to-head comparison of 11c-pib and 18f-azd4694(nav4694)for beta-amyloid imaging in aging and dementia.j.nucl.med.d2013;54:880-6.
[0572]
[44]kung h,choi s,qu w,zhang w,and skovronsky d.(18)f stilbenes and styrylpyridines for pet imaging of abeta plaques in alzheimer disease:a miniperspective.j.med.chem.2009;53:933-41.
[0573]
[45]zhu l,ploessl k,and kung hf.pet/spect imaging agents for neurodegenerative diseases.chem.soc.rev.2014.
[0574]
[46]choi s,golding g,zhuang z,zhang w,lim n,hefti f,et al.preclinical properties of 18f-av-45:a pet agent for aβplaques in the brain.j.nucl.med.2009;50:1887-94.
[0575]
[47]wong d,rosenberg p,zhou y,kumar a,raymont v,ravert h,et al.in vivo imaging of amyloid deposition in alzheimer disease using the radioligand 18f-av-45(flobetapir f 18).j.nucl.med.2010;51:913-20.
[0576]
[48]patt m,schildan a,barthel h,becker g,schultze-mosgau mh,rohde b,et al.metabolite analysis of[18f]florbetaben(bay 94-9172)in human subjects:a substudy within a proof of mechanism clinical trial.j.radioanal.nucl.chem.20
10;284:557-62.
[0577]
[49]rowe c,ackerman u,browne w,mulligan r,pike k,o
′
keefe g,et al.imaging of amyloid beta in alzheimer disease with(18)f-bay94-9172,a novel pet tracer:proof of mechanism.lancet neurol.2008;7:129-35.
[0578]
[50]bousman ca,forbes m,jayaram m,eyre h,reynolds cf,berk m,et al.antidepressant prescribing in the precision medicine era:a prescriber
′
s primer on pharmacogenetic tools.bmc psychiatry 2017;17:60.
[0579]
[51]kambeitz jp and howes od.the serotonin transporter in depression:meta-analysis of in vivo and post mortem findings and implications for understanding and treating depression.j.affect.disord.2015;186:358-66.
[0580]
[52]spies m,knudsen gm,lanzenberger r,and kasper s.the serotonin transporter in psychiatric disorders:insights from pet imaging.lancet psychiatry 2015;2:743-55.
[0581]
[53]oya s,choi s,kung m,and kung h.5-chloro-2-(2
′‑
((dimethylamino)methyl)-4
′‑
iodophenylthio)benzenamine:a new serotonin transporter ligand.nucl.med.biol.2007;34:129-39.
[0582]
[54]kung h,newman s,choi s,oya s,hou c,zhuang z,et al.2-(2-(dimethylaminomethyl)phenoxy)-5-iodophenylamine:an improved serotonin transporter imaging agent.j.med.chem.2004;47:5258-64.
[0583]
[55]wang jl,parhi ak,oya s,lieberman b,kung mp,and kung hf.2-(2
′‑
((dimethylamino)methyl)-4
′‑
(3-[(18)f]fluoropropoxy)-phenylthio)benzenamine for positron emission tomography imaging of serotonin transporters.nucl.med.biol.2008;35:447-58.
[0584]
[56]wang jl,deutsch ec,oya s,and kung hf.flipadam:a potential new spect imaging agent for the serotonin transporter.nucl.med.biol.2010;37:577-86.
[0585]
[57]huang y,zheng mq,and gerdes jm.development of effective pet and spect imaging agents for the serotonin transporter:has a twenty-year journey reached its destination?curr.top.med.chem.2010;10:1499-526.
[0586]
[58]mavel s,meheux n,guilloteau d,and emond p.synthesis and in vitro evaluation of fluorinated diphenyloxide derivatives and sulfur analogs as serotonin transporter ligands.bioorg.med.chem.2010;18:236-41.
[0587]
[59]jarkas n,voll rj,williams l,and goodman mm.validation of two fluoro-analogues of n,n-dimethyl-2-(2
′‑
amino-4
′‑
hydroxymethyl-phenylthio)benzylamine as serotonin transporter imaging agents using micropet.nucl.med.biol.2010;37:593-603.
[0588]
[60]kang hh,wang ch,chen hc,li ih,cheng cy,liu rs,et al.investigating the effects of noise-induced hearing loss on serotonin transporters in rat brain using 4-[(18)f]-adam/small animal pet.neuroimage 2012.
validation of an intracerebral beta-sensitive microprobe system to determine in vivo drug-induced receptor occupancy using [11c]raclopride in rats.synapse 2004;52:89-99.
[0602]
[73]kim e,howes od,park jw,kim sn,shin sa,kim bh,et al.altered serotonin transporter binding potential in patients with obsessive-compulsive disorder under escitalopram treatment:[11c]dasb pet study.psychol.med.2015:1-1 0.
[0603]
[74]oya s,choi sr,coenen h,and kung hf.new pet imaging agent for the serotonin transporter:[(18)f]acf(2-[(2-amino-4-chloro-5-fluorophenyl)thio]-n,n-dimethyl-benzenmethanamine).j.med.chem.2002;45:4716-23.
[0604]
[75]huang y,bae sa,zhu z,guo n,roth bl,and laruelle m.fluorinated diaryl sulfides as serotonin transporter ligands:synthesis,structure-activity relationship study,and in vivo evaluation of fluorine-18-labeled compounds as pet imaging agents.j.med.chem.2005;48:2559-70.
[0605]
[76]shiue g,choi s,fang p,hou c,acton p,cardi c,et al.n,n-dimethyl-2-(2-amino-4-(18)f-fluorophenylthio)-benzylamine(4-(18)f-adam):an improved pet radioligand for serotonin transporters.j.nucl.med.2003;44:1890-7.
[0606]
[77]wang j,parhi a,oya s,lieberman b,and kung h.in vivo characterization of a series of 18f-diaryl sulfides(18f-2-(2
′‑
((dimethylami no)methyl)-4
′‑
(fluoroalkoxy)phenylthio)benzenamine)for pet imaging of the serotonin transporter.j.nucl.med.2009;50:1509-17.
[0607]
[78]wang j,oya s,parhi a,lieberman b,ploessl k,hou c,et al.in vivo studies of the sert-selective[18f]fpbm and vmat2-selective[18f]av-133 radiotracers in a rat model of parkinson
′
s disease.nucl.med.biol.2010;37:479-86.
[0608]
[79]qiao h,zhang y,wu z,zhu l,choi sr,ploessl k,et al.one-step preparation of[(18)f]fpbm for pet imaging of serotonin transporter(sert)in the brain.nucl.med.biol.2016;43:470-7.
[0609]
[80]zhu l,li g,choi sr,plossl k,chan p,qiao h,et al.an improved preparation of [18f]fpbm:a potential serotonin transporter(sert)imaging agent.nucl.med.biol.2013;40:974-9.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1