家蚕Period基因或蛋白在家蚕育种和家蚕茧生产中的应用
家蚕period基因或蛋白在家蚕育种和家蚕茧生产中的应用
技术领域
1.本发明涉及养蚕学技术领域,尤其涉及一种家蚕period基因或蛋白在家蚕育种和家蚕茧生产中的应用。
背景技术:
2.饲养家蚕(bombyx mori)生产蚕茧的养蚕生产和加工家蚕茧丝的丝织生产是中国的传统和优势产业。家蚕的茧丝98%以上是蛋白质,包括纤维蛋白质丝素和非纤维蛋白质丝胶。茧丝蛋白质由幼虫期特别发达的丝腺组织合成并分泌和储存在丝腺的腺腔中,其中丝胶蛋白质完全由中部丝腺细胞合成,而丝素蛋白质绝大部分由后部丝腺细胞合成,少量由中部丝腺后区合成。家蚕成熟幼虫的后部丝腺的腺腔中的丝素蛋白,以蛋白质多聚体亚稳态的高浓度水溶液胶体缓慢向中部丝腺移动,进入中部丝腺后,表面逐渐被丝胶蛋白质水溶液包围。在中部丝腺腔内移动中的丝素蛋白,发生失水和金属离子含量的变化,出现分子聚合度和水溶液胶体的比粘度增加等丝素成熟变化;进一步在幼虫成熟吐丝结茧时,受腺腔内压力的作用,丝素被推送到管径急剧减小的前部丝腺,发生分子纤维化等丝素成纤维变化,最后通过榨丝区和吐丝孔吐出体外,成为纤维化的丝素蛋白质,即茧丝的丝芯,其纤维外层包裹了水溶性的丝胶蛋白质(冯丽春等,2015.)。家蚕茧由于丝纤维的表面的水溶性丝胶蛋白质在脱水干燥过程中发生相互粘连,形成紧密的茧壳层。
3.家蚕茧的主要加工方式有两类,一类是通过缫丝加工成织绸等用途的超长纤维生丝,另一类是制成被用或无纺布材料等用途的絮状丝绵,两类产品加工的工艺和技术都是利用部分溶解茧丝纤维的丝胶蛋白质来解离蚕茧的紧密粘连的茧壳层,所不同的是生丝生产要求蚕茧符合机器或手工缫丝所需的规则的茧形,还要求茧丝纤维表面有较高的稳定的丝胶含量,以保证很高的茧丝纤维的解舒率,而丝绵加工过程中对茧型和茧丝的解舒率没有要求,茧丝纤维表面的丝胶含量可以有更大的变化范围。
4.无论是生丝生产还是丝绵生产,最终产品真正需要的只是丝素,丝胶则需要被除去。丝绵的主要用途是生产丝绵被,以蓬松度为标志的通透性和保暖性是丝绵的主要性能要求。纺织工程的生产技术是通过高温碱水精练脱胶,充分去除茧丝纤维表面的丝胶蛋白质层,保证丝绵的纤维蓬松度和舒适性。因此,家蚕品种培育过程中,大幅度降低茧丝中丝胶蛋白质的含量、提高丝素蛋白质的含量,是提高丝绵的品质和生产效率的有效途径。
5.近年来,丝绵生产和使用量快速增加,已经超过家蚕丝生产量的35%,并且还在不断增加,培育丝绵生产专用蚕品种需求十分迫切。现有的遗传突变体绵茧家蚕遗传资源,生产的蚕茧的丝纤维中丝胶蛋白质含量比常规蚕品种降低30%-50%,但由于中部丝腺严重退化或畸形,突出的问题是丝腺整体功能退化,茧丝产量很低,因此养蚕生产还没有实用性家蚕品种选育成功的报道。通过遗传工程手段敲除或敲降中部丝腺细胞中的丝胶蛋白质基因表达,则普遍出现丝腺发育畸形和茧丝产量显著降低、家蚕个体生命力显著下降等问题。因此,研究发现丝腺发育或丝腺细胞丝蛋白质合成调控的新机制,是开发提高家蚕茧丝纤维的丝素和丝胶蛋白质相对含量的控制技术,提高丝绵的品质和生产效率的有效途径。
no.2所示蛋白的表达。
20.进一步地,抑制bmperiod基因或蛋白的物质在家蚕茧生产中的应用。
21.进一步地,蚕茧的蚕茧层厚度和/或全茧量增加。
22.进一步地,蚕茧的出丝率提高。
23.进一步地,蚕茧的茧丝纤维中丝素蛋白质的含量提高。
24.本发明首次发现,通过抑制bmperiod基因表达可使成熟幼虫的丝腺占身体的重量系数升高,进一步地成熟幼虫的后部丝腺与中部丝腺的重量相对比值或长度相对比值升高,在提高蚕茧产量的同时,后部丝腺生产的丝素蛋白质含量增加,同时中部丝腺生产的丝素蛋白质含量降低,从而调节蚕茧丝纤维的丝蛋白质成分比例,提高出丝率。
25.借由上述方案,本发明至少具有以下优点:
26.本发明通过bmperiod基因敲除突变体家蚕生产的蚕茧,与野生型品种生产的蚕茧相比,全茧量提高20%,茧层率提高25%,茧层厚度增加1倍以上,茧丝纤维中丝素蛋白质的相对含量提高5.8%,干茧出丝率提高19.0%。
27.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
28.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
29.图1为家蚕bmperiod基因的结构示意图及其sgrna靶点(ts)序列;
30.图2为本发明采用crispr/cas9诱导的基因突变结果;
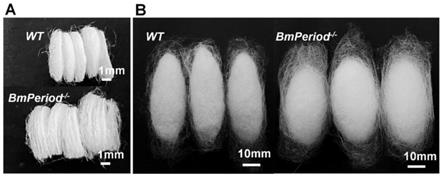
31.图3为bmperiod基因敲除的家蚕大造纯合品系bmperiod-/-与野生型大造品系wt的蚕茧差异;其中,a为wt和bmperiod-/-的茧层厚度对比,b为wt和bmperiod-/-的蚕茧大小对比;
32.图4为bmperiod基因敲除的家蚕大造纯合品系bmperiod-/-与野生型大造品系wt的发育状况比较;其中,a为wt和bmperiod-/-5龄后期幼虫的形态发育情况,b为wt和bmperiod-/-蛹的形态发育情况,c为wt和bmperiod-/-丝腺发育情况。
具体实施方式
33.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
34.实施例1家蚕bmperiod基因的crispr/cas9敲除载体构建
35.(1)首先,本发明针对bmperiod基因的序列、经过大量的选择及试验,利用crisprdirect网站(http://crispr.dbcls.jp/),在bmperiod基因的第6外显子选取了2个家蚕bmperiod基因特异的sgrna识别靶点(seq id no.3和seq id no.4)及其全长序列(seq id no.5和seq id no.6)。bmperiod基因的核苷酸序列如seq id no.1所示,氨基酸序列如seq id no.2所示。家蚕bmperiod基因结构示意图及sgrna靶点序列如图1所示。
36.sgrna识别靶点序列如下:
37.sgrna1:5
’‑
tctccagcgcatgtacaggt-3’(seq id no.3)
38.sgrna2:5
’‑
cactgaaggcgacaaggtag-3’(seq id no.4)
39.sgrna全长序列如下:
40.sgrna1:
[0041]5’‑
gacctgtacatgcgctggagagttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttt-3’(seq id no.5)
[0042]
sgrna2:
[0043]5’‑
gcactgaaggcgacaaggtaggttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttt-3’(seq id no.6)
[0044]
(2)根据pbac-pxlu6载体质粒中两个u6后的酶切位点:nhelⅰ和salⅰ,设计sgrna同源重组引物,引物序列如seq id no.7—seq id no.10所示。
[0045]
sgrna靶点序列引物如下:
[0046]
sgrna-f1-nhelⅰ:
[0047]5’‑
tatcgtgctctacaagtggacctgtacatgcgctggagagttttagagctagaaatagcaagttaaaataa-3’(seq id no.7)
[0048]
sgrna-f2-salⅰ:
[0049]5’‑
tatcgtgctctacaagtggcactgaaggcgacaaggtaggttttagagctagaaatagcaagttaaaataa-3’(seq id no.8)
[0050]
sgrna-r-nhelⅰ:
[0051]5’‑
tagatatcaagctgctagaaaaaaaagcaccgactcggtgccactttttcaagttgataacggactagccttattttaacttgctatttct-3’(seq id no.9)
[0052]
sgrna-r-salⅰ:
[0053]5’‑
cttatcgataccgtcgaaaaaaaaagcaccgactcggtgccactttttcaagttgataacggactagccttattttaacttgctatttct-3’(seq id no.10)
[0054]
(3)使用sgrna同源重组引物进行pcr反应,从pcr反应产物的分离电泳胶中进行胶回收,获得的pcr产物序列如seq id no.11和seq id no.12所示。
[0055]
pcr同源重组产物序列如下:
[0056]
ce-sgrna-nhelⅰ:
[0057]5’‑
tatcgtgctctacaagtggacctgtacatgcgctggagagttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttttttcgacggtatcgataag-3’(seq id no.11)
[0058]
ce-sgrna-salⅰ:
[0059]5’‑
tatcgtgctctacaagtggcactgaaggcgacaaggtaggttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttttttcgacggtatcgataag-3’(seq id no.12)
[0060]
(4)组装靶点序列sgrna表达盒到pbac-pxlu6载体质粒,以南京诺唯赞生物科技有限公司的clonexpress快速克隆重组试剂盒为例,利用同源重组的原理将pcr产物与酶切后的pbac-pxlu6载体质粒进行同源重组,获得重组载体质粒测序验证后用于显微注射。
[0061]
实施例2建立家蚕bmperiod基因敲除纯合系
[0062]
(1)家蚕卵准备:以常规的低温黑暗催青非滞育卵生产方法获得家蚕大造品种非
滞育性卵。以保鲜膜作为卵附着材料,收集30min内母蛾所产卵,清洁水浸泡20min后轻轻地洗落蚕卵。迅速收集蚕卵,将饱满的湿润状态蚕卵整齐排列在灭菌处理过的载玻片上,滤纸吸去水渍后再晾干20min,然后放入3%甲醛水乳液中消毒2min,灭菌水清洗后晾干20min以上供显微注射使用。
[0063]
(2)重组载体质粒导入家蚕卵:将实施例1构建的重组载体质粒导入卵裂期的非滞育性蚕卵内。以卵显微注射导入重组载体质粒方法为例,在卵龄3h-6h,每卵注射重组载体质粒注5-10ng,注射后蚕卵用中性胶水封堵注射口,放置于无菌人工气候箱保护至孵化。蚕卵保护环境为高湿的相对湿度80-90%,同时蚕卵周围放置4%的甲醛水溶液,依靠甲醛自然蒸发的空气防止蚕卵防霉,每12h换气5min。
[0064]
(3)bmperiod基因敲除突变体筛选:从显微注射后的蚕卵中孵化的g0代幼虫,用新鲜桑叶或人工饲料饲养,获得结茧后的蚕蛹,进一步获得羽化后成虫。g0代成虫逐蛾与野生型异性成虫交配,待母蛾产卵后,取所有g0代蚕蛾头部提取基因组dna,针对bmperiod基因的sgrna序列,设计了特异性的检测引物对编辑位置bmperiod基因组序列进行扩增并测序检测,筛选出被编辑后bmperiod基因功能丧失的成虫,检测引物为:
[0065]
bmperiod-ts-r:5
’‑
acgattggcgatagggaaa-3’(seq id no.13)
[0066]
bmperiod-ts-f:5
’‑
ttggaaaagtttgtggctaata-3’(seq id no.14)
[0067]
筛选出的g0代bmperiod基因敲除突变体成虫与野生型成虫所产的g1代杂合体卵,继代饲养并蛾区内个体自交留种,持续检测配对成虫的bmperiod基因突变与基因转录和翻译,直至获得bmperiod基因敲除纯合系家蚕,突变类型如图2所示。
[0068]
(4)bmperiod基因敲除纯合系家蚕的蚕茧观察:
[0069]
将筛选获得的bmperiod基因敲除的纯合品系家蚕与野生型家蚕在相同条件饲养,成熟幼虫所结蚕茧的形态出现显著差异,结果如图3所示,bmperiod基因敲除纯合系家蚕所结蚕茧的茧层厚度显著增加(图3a),蚕茧显著变大(图3b)。
[0070]
观察幼虫期丝腺发育和幼虫与蛹的形态发育,结果如图4所示,bmperiod基因敲除纯合系家蚕成熟幼虫的丝腺、5龄后期幼虫、以及蚕蛹的形态发育都正常,与野生型之间没有明显的差异。
[0071]
下表1调查数据系统展示了实施例2的bmperiod基因敲除突变体生产丝绵用蚕茧的优势和机制。熟蚕丝腺系数表明,由于突变体后部丝腺重量显著增加,其完整丝腺重量占体重的百分比较野生型显著增大,进一步导致突变体生产的茧重和茧层率(茧丝重量占体重的百分比)比野生型分别提高了20%和25%,更好发育的后部丝腺增强了丝素蛋白质的合成能力,导致茧丝的丝素对丝胶的相对含量显著提高,丝胶的比例降低导致蚕茧的茧丝粘连减弱,进一步导致茧层厚度增加1倍以上,茧层率和丝素比例升高导致了蚕茧生产丝绵的出丝率提高19%以上。
[0072]
表1
[0073][0074]
注:表中茧丝调查样本雌性与雄性各30颗茧。
[0075]
实施例3选育丝绵生产使用的家蚕bmperiod基因突变体杂交品种
[0076]
(1)按照实施例1和实施例2的方法,制备家蚕bmperiod基因敲除突变体,以bmperiod基因敲除突变纯合体的雌蛾为母本,与结黄色茧的二化性实用杂交组合苏玉
×
春橙的春橙雄蛾交配,获得h1代蚕卵,以单蛾育方法饲养h1代蚕卵孵化的幼虫,以茧层紧密度低和厚茧层为指标,优选10%的蛾区和所选蛾区内10%的高茧丝量的个体进行蛾区内交配,获得h2代蚕卵;
[0077]
(2)以单蛾育方法饲养h2代幼虫,在胚胎发育至点青期抽样蚕卵,以实施例2中的bmperiod基因敲除突变体筛选步骤检测单粒卵dna,估算蛾区内蚕卵的bmperiod基因突变率,饲养突变率90%以上的蛾区蚕卵孵化的幼虫,以茧层紧密度低和厚茧层为指标,优选10%的蛾区和所选蛾区内10%的高茧丝量的个体进行蛾区内交配,获得h3代蚕卵;
[0078]
(3)蛾区蚁量育饲养h3代蚕卵孵化的幼虫,以茧层紧密度低和厚茧层为指标,优选10%的蛾区和所选蛾区内10%的高茧丝量的雌性个体,与步骤(1)所用的春橙雄蛾回交,单蛾产卵,获得h4代蚕卵;
[0079]
(4)以单蛾育方法饲养h4代蚕卵孵化的幼虫,重复2次步骤(1)至步骤(3)蛾区和个体选留、交配组合方法,获得h10代蚕卵,即获得丝绵生产使用的bmperiod基因的突变纯合型的结黄色茧的实用性日本系统专用原种春橙p;
[0080]
(5)按照步骤(1)至步骤(4)方法,获得丝绵生产使用的bmperiod基因的突变纯合型的结黄色茧的实用性中国系统专用原种苏玉p;
[0081]
(6)将苏玉p与春橙p杂交生产苏玉p
×
春橙p一代杂交种,一代杂交种的主要性状见表1。
[0082]
使用本发明实施例3的方法,能够利用养蚕业黄色茧生产实用品种的苏玉
×
春橙杂交组合的高配合力和优秀的茧丝生产性能,将大造突变体的bmperiod突变基因导入中国系统苏玉和日本系统春橙,育成丝胶含量低、丝素含量高的供养蚕生产使用的一代杂交种。
[0083]
使用本发明实施例3方法,能够快速定向改造大造突变体的茧丝纤度、净度和强度
等茧丝质,提高茧丝产量、达到实用品种的要求。
[0084]
下表2中展示了实施例3选育的苏玉p
×
春橙p一代杂交种作为丝绵生产的优势。
[0085]
表2
[0086][0087]
注:表中茧丝调查样本雌性与雄性各30颗茧。
[0088]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1