一种用于槭叶铁线莲遗传多样性分析的SSR分子标记及其应用的制作方法
一种用于槭叶铁线莲遗传多样性分析的ssr分子标记及其应用
技术领域
1.本发明属于生物技术领域,具体涉及一种用于槭叶铁线莲遗传多样性分析的ssr分子标记及其应用。
背景技术:
2.槭叶铁线莲(clematis acerifolia maxim.)是毛茛科,铁线莲属植物。花期四月,花姿优雅,主要分布在北京地区的房山、门头沟等地,在河北、河南偶有分布。由于气候变化、经济开发及其自身遗传特性的变化,槭叶铁线莲种群呈现出植物数量较少、分布狭窄、种群自我更新和繁殖较慢的问题,属于北京市一级保护植物。
3.遗传多样性是指种群内部及种群间遗传变异的总和。遗传多样性反映了植物对不良环境的抵抗能力。通过遗传多样性评价,可以了解植物的现状,预测植物发展的未来,对保护珍稀植物具有重要作用。进行植物遗传多样性评价可以使用表型标记、生化标记和分子标记。ssr(simple sequence repeats)标记数量丰富、覆盖整个基因组,具有极其丰富的多态性和共显性特点,在遗传多样性研究中应用广泛。
4.为保护槭叶铁线莲,评估其种群状态,判断其种群发展趋势,对槭叶铁线莲保护提出切实可行的策略,研究其遗传多样性有重要意义。由于槭叶铁线莲尚无基因组测序相关信息,因此开发其相关的ssr分子标记具有一定难度。
技术实现要素:
5.本发明的目的是提供用于槭叶铁线莲遗传多样性分析的ssr分子标记及其应用。
6.为了实现上述目的,本发明首先提供了可用于槭叶铁线莲遗传多样性分析的ssr引物组。
7.本发明提供的可用于槭叶铁线莲遗传多样性分析的ssr引物组包括引物对1、引物对2、引物对3、引物对4、引物对5、引物对6、引物对7、引物对8、引物对9、引物对10、引物对11、引物对12、引物对13、引物对14、引物对15、引物对16、引物对17、引物对18、引物对19、引物对20、引物对21、引物对22、引物对23、引物对24、引物对25、引物对26、引物对27、引物对28和引物对29;
8.所述引物对1由引物1-f和引物1-r组成;所述引物对2由引物2-f和引物2-r组成;所述引物对3由引物3-f和引物3-r组成;所述引物对4由引物4-f和引物4-r组成;所述引物对5由引物5-f和引物5-r组成;所述引物对6由引物6-f和引物6-r组成;所述引物对7由引物7-f和引物7-r组成;所述引物对8由引物8-f和引物8-r组成;所述引物对9由引物9-f和引物9-r组成;所述引物对10由引物10-f和引物10-r组成;所述引物对11由引物11-f和引物11-r组成;所述引物对12由引物12-f和引物12-r组成;所述引物对13由引物13-f和引物13-r组成;所述引物对14由引物14-f和引物14-r组成;所述引物对15由引物15-f和引物15-r组成;所述引物对16由引物16-f和引物16-r组成;所述引物对17由引物17-f和引物17-r组成;所
述引物对18由引物18-f和引物18-r组成;所述引物对19由引物19-f和引物19-r组成;所述引物对20由引物20-f和引物20-r组成;所述引物对21由引物21-f和引物21-r组成;所述引物对22由引物22-f和引物22-r组成;所述引物对23由引物23-f和引物23-r组成;所述引物对24由引物24-f和引物24-r组成;所述引物对25由引物25-f和引物25-r组成;所述引物对26由引物26-f和引物26-r组成;所述引物对27由引物27-f和引物27-r组成;所述引物对28由引物28-f和引物28-r组成;所述引物对29由引物29-f和引物29-r组成;
9.所述引物1-f为序列表的序列1所示的单链dna分子;
10.所述引物1-r为序列表的序列2所示的单链dna分子;
11.所述引物2-f为序列表的序列3所示的单链dna分子;
12.所述引物2-r为序列表的序列4所示的单链dna分子;
13.所述引物3-f为序列表的序列5所示的单链dna分子;
14.所述引物3-r为序列表的序列6所示的单链dna分子;
15.所述引物4-f为序列表的序列7所示的单链dna分子;
16.所述引物4-r为序列表的序列8所示的单链dna分子;
17.所述引物5-f为序列表的序列9所示的单链dna分子;
18.所述引物5-r为序列表的序列10所示的单链dna分子;
19.所述引物6-f为序列表的序列11所示的单链dna分子;
20.所述引物6-r为序列表的序列12所示的单链dna分子;
21.所述引物7-f为序列表的序列13所示的单链dna分子;
22.所述引物7-r为序列表的序列14所示的单链dna分子;
23.所述引物8-f为序列表的序列15所示的单链dna分子;
24.所述引物8-r为序列表的序列16所示的单链dna分子;
25.所述引物9-f为序列表的序列17所示的单链dna分子;
26.所述引物9-r为序列表的序列18所示的单链dna分子;
27.所述引物10-f为序列表的序列19所示的单链dna分子;
28.所述引物10-r为序列表的序列20所示的单链dna分子;
29.所述引物11-f为序列表的序列21所示的单链dna分子;
30.所述引物11-r为序列表的序列22所示的单链dna分子;
31.所述引物12-f为序列表的序列23所示的单链dna分子;
32.所述引物12-r为序列表的序列24所示的单链dna分子;
33.所述引物13-f为序列表的序列25所示的单链dna分子;
34.所述引物13-r为序列表的序列26所示的单链dna分子;
35.所述引物14-f为序列表的序列27所示的单链dna分子;
36.所述引物14-r为序列表的序列28所示的单链dna分子;
37.所述引物15-f为序列表的序列29所示的单链dna分子;
38.所述引物15-r为序列表的序列30所示的单链dna分子;
39.所述引物16-f为序列表的序列31所示的单链dna分子;
40.所述引物16-r为序列表的序列32所示的单链dna分子;
41.所述引物17-f为序列表的序列33所示的单链dna分子;
42.所述引物17-r为序列表的序列34所示的单链dna分子;
43.所述引物18-f为序列表的序列35所示的单链dna分子;
44.所述引物18-r为序列表的序列36所示的单链dna分子;
45.所述引物19-f为序列表的序列37所示的单链dna分子;
46.所述引物19-r为序列表的序列38所示的单链dna分子;
47.所述引物20-f为序列表的序列39所示的单链dna分子;
48.所述引物20-r为序列表的序列40所示的单链dna分子;
49.所述引物21-f为序列表的序列41所示的单链dna分子;
50.所述引物21-r为序列表的序列42所示的单链dna分子;
51.所述引物22-f为序列表的序列43所示的单链dna分子;
52.所述引物22-r为序列表的序列44所示的单链dna分子;
53.所述引物23-f为序列表的序列45所示的单链dna分子;
54.所述引物23-r为序列表的序列46所示的单链dna分子;
55.所述引物24-f为序列表的序列47所示的单链dna分子;
56.所述引物24-r为序列表的序列48所示的单链dna分子;
57.所述引物25-f为序列表的序列49所示的单链dna分子;
58.所述引物25-r为序列表的序列50所示的单链dna分子;
59.所述引物26-f为序列表的序列51所示的单链dna分子;
60.所述引物26-r为序列表的序列52所示的单链dna分子;
61.所述引物27-f为序列表的序列53所示的单链dna分子;
62.所述引物27-r为序列表的序列54所示的单链dna分子;
63.所述引物28-f为序列表的序列55所示的单链dna分子;
64.所述引物28-r为序列表的序列56所示的单链dna分子;
65.所述引物29-f为序列表的序列57所示的单链dna分子;
66.所述引物29-r为序列表的序列58所示的单链dna分子。
67.进一步的,所述ssr引物组由所述引物对1、所述引物对2、所述引物对3、所述引物对4、所述引物对5、所述引物对6、所述引物对7、所述引物对8、所述引物对9、所述引物对10、所述引物对11、所述引物对12、所述引物对13、所述引物对14、所述引物对15、所述引物对16、所述引物对17、所述引物对18、所述引物对19、所述引物对20、所述引物对21、所述引物对22、所述引物对23、所述引物对24、所述引物对25、所述引物对26、所述引物对27、所述引物对28和所述引物对29组成。
68.更进一步的,上述ssr引物组的每个引物对中的各条引物的摩尔比均为1:1。
69.为了实现上述目的,本发明又提供了上述ssr引物组的新用途。
70.本发明提供了上述ssr引物组在如下m1)-m10)中任一种中的应用:
71.m1)制备分析或评价槭叶铁线莲遗传多样性的产品;
72.m2)制备分析或评价槭叶铁线莲遗传分化程度的产品;
73.m3)制备分析或评价槭叶铁线莲遗传亲缘关系的产品;
74.m4)制备构建或制备槭叶铁线莲遗传图谱或指纹图谱的产品;
75.m5)制备鉴定不同地理种群槭叶铁线莲的产品;
76.m6)分析或评价槭叶铁线莲遗传多样性;
77.m7)分析或评价槭叶铁线莲遗传分化程度;
78.m8)分析或评价槭叶铁线莲遗传亲缘关系;
79.m9)构建或制备槭叶铁线莲遗传图谱或指纹图谱;
80.m10)鉴定或区分不同地理种群槭叶铁线莲。
81.为了实现上述目的,本发明还提供了含有上述ssr引物组的试剂盒;
82.所述试剂盒具有如下n1)-n5)任一种功能:
83.n1)分析或评价槭叶铁线莲遗传多样性;
84.n2)分析或评价槭叶铁线莲遗传分化程度;
85.n3)分析或评价槭叶铁线莲遗传亲缘关系;
86.n4)构建或制备槭叶铁线莲遗传图谱或指纹图谱;
87.n5)鉴定或区分不同地理种群槭叶铁线莲。
88.进一步的,所述试剂盒还包括用于pcr扩增的其它试剂,如dntp、dna聚合酶、缓冲液和h2o等。
89.更进一步的,所述用于pcr扩增的其它试剂为mix(南京维诺赞生物科技有限公司,货号为p115-02)和h2o。
90.上述试剂盒的制备方法也属于本发明的保护范围。所述试剂盒的制备方法包括将上述ssr引物组中的各条引物分别单独包装的步骤。
91.为了实现上述目的,本发明还提供了上述试剂盒的新用途。
92.本发明提供了上述试剂盒在如下m1)-m10)中任一种中的应用:
93.m1)制备分析或评价槭叶铁线莲遗传多样性的产品;
94.m2)制备分析或评价槭叶铁线莲遗传分化程度的产品;
95.m3)制备分析或评价槭叶铁线莲遗传亲缘关系的产品;
96.m4)制备构建或制备槭叶铁线莲遗传图谱或指纹图谱的产品;
97.m5)制备鉴定不同地理种群槭叶铁线莲的产品;
98.m6)分析或评价槭叶铁线莲遗传多样性;
99.m7)分析或评价槭叶铁线莲遗传分化程度;
100.m8)分析或评价槭叶铁线莲遗传亲缘关系;
101.m9)构建或制备槭叶铁线莲遗传图谱或指纹图谱;
102.m10)鉴定或区分不同地理种群槭叶铁线莲。
103.为了实现上述目的,本发明还提供了一种分析或评价槭叶铁线莲遗传多样性的方法或一种分析或评价槭叶铁线莲遗传分化程度的方法或一种分析或评价槭叶铁线莲遗传亲缘关系的方法或一种构建或制备槭叶铁线莲遗传图谱或指纹图谱的方法或一种鉴定或区分不同地理种群槭叶铁线莲的方法。
104.本发明提供的一种分析或评价槭叶铁线莲遗传多样性的方法或一种分析或评价槭叶铁线莲遗传分化程度的方法或一种分析或评价槭叶铁线莲遗传亲缘关系的方法或一种构建或制备槭叶铁线莲遗传图谱或指纹图谱的方法或一种鉴定或区分不同地理种群槭叶铁线莲的方法包括采用上述ssr引物组对槭叶铁线莲叶片基因组dna进行pcr扩增的步骤。
105.上述任一方法中,
106.采用引物对1进行pcr扩增时的引物退火温度为62℃,循环数为30;
107.采用引物对2进行pcr扩增时的引物退火温度为58℃,循环数为32;
108.采用引物对3进行pcr扩增时的引物退火温度为60℃,循环数为30;
109.采用引物对4进行pcr扩增时的引物退火温度为60℃,循环数为30;
110.采用引物对5进行pcr扩增时的引物退火温度为58℃,循环数为32;
111.采用引物对6进行pcr扩增时的引物退火温度为58℃,循环数为32;
112.采用引物对7进行pcr扩增时的引物退火温度为58℃,循环数为32;
113.采用引物对8进行pcr扩增时的引物退火温度为60℃,循环数为30;
114.采用引物对9进行pcr扩增时的引物退火温度为58℃,循环数为32;
115.采用引物对10进行pcr扩增时的引物退火温度为58℃,循环数为32;
116.采用引物对11进行pcr扩增时的引物退火温度为62℃,循环数为30;
117.采用引物对12进行pcr扩增时的引物退火温度为58℃,循环数为32;
118.采用引物对13进行pcr扩增时的引物退火温度为58℃,循环数为32;
119.采用引物对14进行pcr扩增时的引物退火温度为60℃,循环数为30;
120.采用引物对15进行pcr扩增时的引物退火温度为58℃,循环数为32。
121.采用引物对16进行pcr扩增时的引物退火温度为58℃,循环数为32;
122.采用引物对17进行pcr扩增时的引物退火温度为58℃,循环数为32;
123.采用引物对18进行pcr扩增时的引物退火温度为58℃,循环数为32;
124.采用引物对19进行pcr扩增时的引物退火温度为58℃,循环数为32;
125.采用引物对20进行pcr扩增时的引物退火温度为58℃,循环数为32;
126.采用引物对21进行pcr扩增时的引物退火温度为60℃,循环数为30;
127.采用引物对22进行pcr扩增时的引物退火温度为58℃,循环数为32;
128.采用引物对23进行pcr扩增时的引物退火温度为58℃,循环数为32;
129.采用引物对24进行pcr扩增时的引物退火温度为58℃,循环数为32;
130.采用引物对25进行pcr扩增时的引物退火温度为58℃,循环数为32;
131.采用引物对26进行pcr扩增时的引物退火温度为58℃,循环数为32;
132.采用引物对27进行pcr扩增时的引物退火温度为58℃,循环数为32;
133.采用引物对28进行pcr扩增时的引物退火温度为58℃,循环数为32;
134.采用引物对29进行pcr扩增时的引物退火温度为58℃,循环数为32。
135.所述pcr扩增的反应程序具体如下:pcr程序:先94℃预变性处理5min;然后94℃变性30s,58-62℃退火30s,72℃延伸30s,如此进行30-32个循环;再72℃延伸7min,最后25℃保存。
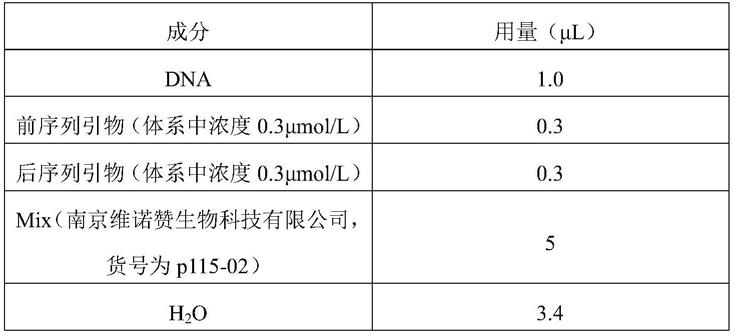
136.所述pcr扩增的反应体系(总体积10μl)具体如下:dna 1μl、前序列引物(体系中浓度0.3μmol/l)0.3μl、后序列引物(体系中浓度0.3μmol/l)0.3μl、mix 5μl、h2o 3.4μl。
137.每个pcr扩增反应体系对应一对ssr引物和一种样品。
138.所述pcr扩增完成后还包括跑胶和染胶的步骤。
139.为了实现上述目的,本发明最后提供了上述ssr引物组的开发方法。
140.本发明提供的上述ssr引物组的开发方法包括如下步骤:
141.1)对不同地理种群槭叶铁线莲样品进行简化基因组测序,所有样品测序结果在一起拼接,运行拼接程序,把拼接最长的20%的序列保存为fasta文本格式,每一个fasta文件包含一个完整的拼接序列;
142.2)使用ssrhunter1.3软件对每一条拼接序列进行检验,检验条件如下:构成重复元件的核苷酸数最多为6、重复次数最少为4,得到候选ssr分子标记;
143.3)使用primer3(v.0.4.0)(https://bioinfo.ut.ee/primer3-0.4.0/)对所述候选ssr分子标记进行引物设计,引物设计条件如下:扩增产物总长度≤200bp、前序列引物起始位置≤125bp、后序列引物起始位置≥175bp,得到候选ssr引物;
144.4)分别在不同地理种群槭叶铁线莲样品中选择代表样品对所述候选ssr引物跑胶,进行筛选,筛选标准如下:所选ssr引物在每个代表样品中均能扩增出清晰稳定的条带且该ssr引物在不同代表样品中扩增出的条带至少有1处存在差异,最终得到上述ssr引物组。
145.所述1)中,所述不同地理种群槭叶铁线莲样品的个数为90个,分别为60个来源于北京的槭叶铁线莲、20个来源于河北的槭叶铁线莲和10个来源于河南的槭叶铁线莲。
146.所述4)中,所述代表样品的个数为6个,分别为2个来源于北京的槭叶铁线莲、2个来源于河北的槭叶铁线莲和2个来源于河南的槭叶铁线莲。
147.上述任一所述应用或方法中,所述槭叶铁线莲或所述不同地理种群槭叶铁线莲为来源于北京的槭叶铁线莲、来源于河北的槭叶铁线莲和来源于河南的槭叶铁线莲。进一步的,所述来源于北京的槭叶铁线莲具体可为来源于房山三渡、五合二隧道、南石洋大峡谷、京西古道、霞云岭、杏黄的槭叶铁线莲。所述来源于河北的槭叶铁线莲具体可为来源于四背峪、苟各庄的槭叶铁线莲。所述来源于河南的槭叶铁线莲具体可为来源于云台山的槭叶铁线莲。
148.本发明利用简化基因组的测序结果进行拼接,筛选出适宜槭叶铁线莲遗传多样性研究的ssr分子标记,对开展槭叶铁线莲遗传多样性研究和保育工作具有重要意义。
附图说明
149.图1为90个槭叶铁线莲个体聚类分析。图中1-90分别对应表1中编号为1-90的试验材料。
具体实施方式
150.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
151.下述实施例中所用的实验仪器如下:pcr仪、凝胶电泳仪、水浴锅、烘箱。
152.实施例1、槭叶铁线莲ssr分子标记的筛选
153.一、试验材料与方法
154.1、试验材料
155.槭叶铁线莲主要分布在北京地区,在河北、河南偶有分布。根据实地探查结果,选
择如下9个地点进行取样:四背峪(河北)、苟各庄(河北)、房山三渡(北京)、五合二隧道(北京)、云台山(河南)、南石洋大峡谷(北京)、京西古道(北京)、霞云岭(北京)、杏黄(北京),取样标准为每个种群取样10株,单株之间距离至少2m,避免取同一悬崖缝隙中的材料。全部试验材料的相关信息及编号如表1所示。
156.表1、群体取样基本信息
157.群体编号地点样品数目样品编号p1四背峪(河北)101-10p2苟各庄(河北)1011-20p3房山三渡(北京)1021-30p4五合二隧道(北京)1031-40p5云台山(河南)1041-50p6南石洋大峡谷(北京)1051-60p7京西古道(北京)1061-70p8霞云岭(北京)1071-80p9杏黄(北京)1081-90
158.2、试验方法
159.采用ctab法分别提取步骤1中试验材料的基因组dna,然后以提取的基因组dna为模板进行pcr扩增。
160.pcr扩增的反应体系(总体积为10μl)如表2所示。
161.pcr扩增的反应条件如表3所示。不同引物对的退火温度x和循环数y有所不同。
162.表2、pcr反应体系
[0163][0164]
表3、pcr反应条件
[0165][0166]
pcr扩增完成后进行跑胶和染胶。
[0167]
二、槭叶铁线莲ssr分子标记的设计与筛选
[0168]
1、由于目前尚无关于槭叶铁线莲基因组测序相关信息,本发明使用简化基因组测序的方法获得基因组基本信息。具体方法如下:对步骤一中的编号为1-90的样品进行简化基因组测序,所有样品测序结果在一起拼接,运行拼接程序,把拼接最长的20%的序列保存为fasta文本格式,每一个fasta文件包含一个完整的拼接序列。
[0169]
2、使用ssrhunter 1.3软件对每一条拼接序列进行检验,检验条件如下:构成重复元件的核苷酸数最多为6,重复次数最少为4,得到候选ssr分子标记,并保存为word文档。
[0170]
3、使用primer3(v.0.4.0)(https://bioinfo.ut.ee/primer3-0.4.0/)对候选ssr分子标记进行引物设计,引物设计条件如下:扩增产物总长度≤200bp,前序列引物起始位置≤125bp,后序列引物起始位置≥175bp。从20000条序列中选出1600对候选ssr引物。
[0171]
4、在编号为1-20的样品中选择6号、7号样品作为河北分布的槭叶铁线莲代表,在编号为41-50的样品中选择41号、48号样品作为河南分布的槭叶铁线莲代表,在编号为51-90的样品中选择63号、67号样品作为北京分布的槭叶铁线莲代表,基于6个代表样品对候选ssr引物跑胶,进行筛选,筛选具体标准如下:所选ssr引物在每个代表样品中均能扩增出清晰稳定的条带且该ssr引物在6个代表样品中扩增出的条带至少有1处存在差异。
[0172]
最终从1600对ssr引物中筛选得到29对ssr引物用于进行后续遗传多样性的分析,29对ssr引物的序列信息具体如表4所示。
[0173]
表4、29对ssr引物的序列信息
[0174]
[0175][0176]
三、ssr引物pcr扩增的退火温度和循环数优化
[0177]
以6号、7号、41号、48号、63号、67号为样品,分别采用步骤二筛选得到的29对ssr引物在不同退火温度(58℃、60℃、62℃)和不同循环数(30个、32个)条件下进行pcr扩增,跑胶和染胶,并根据如下标准确定每对ssr引物适合的pcr扩增的退火温度和循环数:扩增条带清晰稳定且同一个引物在6个样品中扩增出的条带至少有1处存在差异。29对ssr引物pcr扩增的退火温度和循环数优化结果如表4所示。
[0178]
四、槭叶铁线莲ssr分子标记的验证
[0179]
分别采用步骤二筛选得到的29对ssr引物对步骤一中的编号为1-90的样品进行pcr扩增,pcr扩增反应体系如表2所示,pcr扩增反应条件如表3所示。每个pcr扩增反应体系对应一对ssr引物和一种样品。每对ssr引物进行pcr扩增所使用的退火温度和循环数具体如表4所示。
[0180]
结果表明:每个引物对在全部槭叶铁线莲样品中均能扩增得到多态性条带。其中,引物对ca63在90个槭叶铁线莲样品中共扩增得到3种带型、引物对ca64在90个槭叶铁线莲样品中共扩增得到3种带型、引物对ca75在90个槭叶铁线莲样品中共扩增得到4种带型、引物对ca85在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca122在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca142在90个槭叶铁线莲样品中共扩增得到4种带型、引物对ca143在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca213在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca255在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca305在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca315在90个槭叶铁线莲样品中共扩增得到6种带型、引物对ca356在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca425在90个槭叶铁线莲样品中共扩增得到3种带型、引物对ca454在90个槭叶铁线莲样品中共扩增得到4种带型、引物对ca487在90个槭叶铁线莲样品中共扩增得到3种带型、引物对ca506在90个槭叶铁线莲样品中共扩增得到3种带型、引物对ca551在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca554在90个槭叶铁线莲样品中共扩增得到3种带型、引物对ca620在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca635在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca720在90个槭叶铁线莲样品中共扩增得到6种带型、引物对ca782在90个槭叶铁线莲样品中共扩增得到6种带型、引物对ca830在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca997在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca1091在90个槭叶铁线莲样品中共扩增得到4种带型、引物对ca1152在90个槭叶铁线莲样品中共扩增得到3种带型、引物对ca1324在90个槭叶铁线莲样品中共扩增得到6种带型、引物对ca1544在90个槭叶铁线莲样品中共扩增得到2种带型、引物对ca1547在90个槭叶铁线莲样品中共扩增得到5种带型。
[0181]
实施例2、使用ssr分子标记分析槭叶铁线莲遗传多样性
[0182]
一、29个ssr位点遗传多样性参数
[0183]
使用群体遗传学软件popgene version1.32对29个ssr位点的观测等位基因数(na)、有效等位基因数(ne)、shannon's多样性指数(i)、观测杂合度(ho)、期望杂合度(he)和f统计量(fit,fis,fst)进行计算。使用powermarker v3.25软件对多态性信息含量(pic)进行计算。基因流(num)=(1-fst)/4fst进行计算。
[0184]
结果如表5所示,由表5可知,在9个群体中,29个ssr位点的观测等位基因数(na)变化范围为2到4,平均值为2.4483。有效等位基因数(ne)变化范围为1.1172到2.2839,平均值为1.6310。shannon's多样性指数(i)变化范围为0.2146到1.0092,平均值为0.5682;shannon's多样性指数(i)出现最高值的引物为ca315,最低值的引物为ca255、ca356、ca620和ca635。观测杂合度(ho)变化范围为0至0.8889,平均值为0.3169,观测杂合度(ho)出现最高值的引物为ca305,在ca143、ca830、ca1544和ca551中,观测杂合度(ho)为0,说明在这4个位点是纯合的。期望杂合度(he)变化范围为0.1055到0.5653,平均值为0.3483。多态性信息含量(pic)变化范围为0.0994到0.4888,多态性信息含量(pic)出现最高值的引物为ca315,出现最低值的引物为ca255、ca356、ca620和ca635,平均值为0.2910;多态性信息含量(pic)在0到0.25范围之内的引物有12个,占41.4%;多态性信息含量(pic)在0.25到0.5范围之内的引物有17个,占58.6%。对29对标记进行f统计量分析可知,亚群内的近交系数fis的平均值为-0.3442,群体内的近交系数fit的平均值为0.0851,表明这些位点在亚群内多为杂合
子,在群体内纯合子较多。在9个群体中,多态性位点间的fst变化范围为0.064到1,平均值为0.3194,说明31.94%的等位基因频率变化是由于群体间遗传变异引起的,表明9个群体间存在较大程度的遗传分化。多态性位点的基因流(num)变化范围为0到3.6573,平均值为0.5328。
[0185]
表5、29对标记遗传多样性参数
[0186][0187][0188]
二、槭叶铁线莲群体遗传多样性参数
[0189]
使用群体遗传学软件popgene version1.32对9个槭叶铁线莲群体进行观测等位基因数(na)、有效等位基因数(ne)、shannon's多样性指数(i)、观测杂合度(ho)和期望杂合度(he)进行计算。
[0190]
结果如表6所示,由表6可知,9个群体的观测等位基因数(na)变化范围为1.5517到1.7586,平均值为1.6207,最高值出现在群体p5,最低值出现在群体p7。有效等位基因数(ne)变化范围为1.3485到1.5176,平均值为1.4299,最高值出现在群体p5,最低值出现在群体p8。shannon's多样性指数(i)变化范围为0.2972到0.4011。观测杂合度(ho)最大值为
0.3862,最小值为0.2621。期望杂合度(he)变化范围为0.2087到0.2800。上述shannon's多样性指数(i)、观测杂合度(ho)和期望杂合度(he)最高值均出现在群体p5,最低值均出现在群体p6。
[0191]
表6、槭叶铁线莲群体遗传多样性参数
[0192]
群体naneihohe11.62071.46750.36120.32070.262421.62071.42750.35010.31030.250531.58621.44050.35300.34480.256641.62071.45820.36610.31380.265551.75861.51760.40110.38620.280061.58621.35290.29720.26210.208771.55171.42800.33400.30340.244181.58621.34850.30990.30.217291.65521.42860.34920.31030.2481mean1.62071.42990.34690.31680.2481
[0193]
实施例3、使用ssr分子标记计算9个槭叶铁线莲群体间的遗传分化系数fst
[0194]
遗传分化系数(fst)是群体间分化程度的标志,在0到1之间变化。fst小于0.05,表示两个群体之间基本没有遗传分化趋势,fst在0.05至0.15之间表示中等程度分化,fst在0.15至0.25之间表示有较大程度的遗传分化,fst大于0.25表示分化程度很大。使用genalex 6.5对9个槭叶铁线莲群体的遗传分化系数进行计算。
[0195]
结果如表7所示,由表7可知,9个槭叶铁线莲群体间的遗传分化系数(fst)变化范围为0.023到0.469。河南分布的槭叶铁线莲与河北、北京分布的槭叶铁线莲遗传分化系数(fst)大于0.25,说明存在较大程度的遗传分化,遗传分化系数(fst)最大的是群体p8和群体p5之间(fst=0.469)。河北分布的两个群体间fst=0.044,说明两个群体间基本没有遗传分化;河北分布的槭叶铁线莲群体p1与房山三渡群体p3、五合二隧道群体p4分布的槭叶铁线莲fst值小于0.05,说明群体之间基本没有分化;河北分布的群体p2与群体p3存在中等程度遗传分化(fst=0.054),与群体p4基本不存在遗传分化;河北分布群体与北京分布的南石洋群体p6、京西古道群体p7、霞云岭群体p8、杏黄群体p9存在中等程度遗传分化。
[0196]
对分布在北京的6个群体进行分析。分布于北京的槭叶铁线莲群体p3和p4、p3和p8之间基本不存在遗传分化,其余分布在北京的槭叶铁线莲群体两两之间存在中等程度遗传分化。群体p3和p4之间的遗传分化系数最小,群体p3和p6之间的遗传分化系数最大。
[0197]
表7、9个群体遗传分化系数fst
[0198]
群体12345678910.000
ꢀꢀꢀꢀꢀꢀꢀꢀ
20.0440.000
ꢀꢀꢀꢀꢀꢀꢀ
30.0360.0540.000
ꢀꢀꢀꢀꢀꢀ
40.0230.0320.0390.000
ꢀꢀꢀꢀꢀ
50.4580.4510.4650.4590.000
ꢀꢀꢀꢀ
60.1080.0670.1040.0800.4480.000
ꢀꢀꢀ
70.0850.0730.0780.0730.4460.0760.000
ꢀꢀ
80.0690.0650.0400.0510.4690.0600.0700.000 90.0730.0900.0780.0590.4620.0870.0840.0840
[0199]
实施例4、聚类分析
[0200]
使用ntsyspc 2.11a软件对90个样品材料进行聚类分析。
[0201]
结果如图1所示,由图1可知,分布在河南的槭叶铁线莲群体p5的10个材料在遗传一致性0.38处与其它材料成两类,分布在北京和河北的材料类间有交叉,说明河南的材料与北京、河北材料之间差异较大,北京与河北材料之间的差异较小。这与前面分析的趋势一致。
[0202]
实施例5、利用ssr分子标记进行槭叶铁线莲群体遗传距离和遗传一致性分析使用popgene version1.32对群体遗传距离和遗传一致性进行计算。
[0203]
结果如表8所示,由表8可知,9个群体间遗传距离变化范围为0.0148到0.9603,遗传距离最近的群体是p1和p4,最远的是群体p3和p5。分布在北京的6个群体遗传距离变化范围为0.0207到0.0699;群体3和群体4之间的遗传距离最近,群体3和群体6之间的遗传距离最远。分布在河南的槭叶铁线莲与分布在北京和河北的群体之间的遗传距离大于0.8,北京和河北群体之间的遗传距离小于0.1,说明河南分布群体与河北、北京群体之间遗传差异较大。
[0204]
表8、群体间遗传一致性(上)和遗传距离(下)
[0205]
群体1234567891 0.96900.98120.98530.39590.92920.94550.95440.953320.0315 0.96240.97960.41280.96290.95640.95810.940830.01890.0383 0.97950.38280.93240.95080.97810.950140.01480.02060.0207 0.39750.95770.95980.97340.959550.92660.88490.96030.9226 0.41550.43840.39160.388760.07340.03780.06990.04320.8783 0.96040.96180.945370.05610.04460.05040.04100.82470.0405 0.95780.954780.04670.04280.02210.02700.93750.03900.0431 0.945890.04790.06100.05120.04140.94500.05620.04640.0557 [0206]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1