一种波形蛋白的提纯方法
1.本发明涉及蛋白提取技术领域,尤其涉及一种波形蛋白的提纯方法。
背景技术:
2.波形蛋白为极度保守的细胞骨架iii型中间丝蛋白,分子量为53~57kda,等电点5.05,在ph值7.2~7.4最稳定。波形蛋白可在细胞外表达,主要以细胞分泌、细胞破裂后释放的形式存在,具有固有免疫调节功能,参与淋巴细胞增殖过程,具有生物药品开发的前景。
3.目前,研究人员开发了多种波形蛋白的分离纯化工艺,比如nelson等(nelson w j,traub p.purification ofthe intermediate filament protein vimentinfrom ehrlich ascites tumor cells.[j].journal of biological chemistry,1982,257(10):5536.)在体外培养艾氏腹水瘤细胞,通过deae-纤维素层析以6m尿素溶液纯化得到波形蛋白。有学者(hans,bloemendal m,willemsen g,etal.isolation of the intermediate filament protein vimentin bychromatofocusing.[j].febs letters,1985,180(2):181-184.)以牛晶状体原料,分别用sephadexg25柱和pbe94聚焦层析法、sephadexg-25柱和羟基磷灰石柱分离纯化得到波形蛋白。hartzer等(hartzer,michael kenneth,purification and properties of porcine cardiac desmin and vascular smoothmuscle vimentin[d].retrospective theses and dissertations.1984,8171.)依次用deae纤维素柱、羟基磷灰石柱和deae-sepharose cl-6b柱从猪主动脉平滑肌纯化得到波形蛋白。后来有学者开始采用猪眼晶状体,geisler等(geisler n,weber k.isolation of polymerization-competent vimentin fromporcine eye lens tissue[j].febs letters,1981,125(2).)用sephadexg-25、cm-32及de52三次过柱纯化得到波形蛋白,苏永新等(苏永新,郭寿延,王宝美.中间丝波形蛋白抗原提纯、抗体制备和初步应用[j].中华病理学杂志,1989,18(01):30-33.)用de52及cm-32两次过柱纯化得到波形蛋白。
[0004]
然而,上述波形蛋白纯化方法主要以猪或牛眼晶状体为原材料,采用多种层析柱分离提取,原材料不易获得,且提取时间较长,纯化过程复杂。
技术实现要素:
[0005]
本发明的目的在于提供一种波形蛋白的提纯方法,所述提纯方法无需过柱,方法简单,时间短。
[0006]
为了实现上述发明目的,本发明提供以下技术方案:
[0007]
本发明提供了一种波形蛋白的提纯方法,包括以下步骤:
[0008]
将猪脑、第一盐溶液和聚乙二醇单辛基苯基醚混合,进行第一洗涤,得到第一沉淀;
[0009]
将所述第一沉淀重悬于第二盐溶液,进行第二洗涤,得到第二沉淀;
[0010]
将所述第二沉淀与pbs缓冲液混合后,调节所得混合物的ph值为5.1~5.4,加入十
二烷基硫酸钠直至十二烷基硫酸钠在所得混合物中的浓度为50mmol/l,进行第一纯化,得到纯化产物;
[0011]
将所述纯化产物第一分离后,调节所得上清液的ph值为4.7~4.9,加入十二烷基硫酸钠直至十二烷基硫酸钠在所得混合物中的浓度为100mmol/l,进行第二纯化,将所得产物第二分离后,得到波形蛋白。
[0012]
优选的,所述第一盐溶液的组成包括:100mmol/l kcl、2mmol/lmgcl2、2mmol/l edta、20mmol/l磷酸钾和0.5mmol/l苯甲基磺酰氟,所述第一盐溶液的ph值为6.8。
[0013]
优选的,所述猪脑的湿重与所述第一盐溶液的体积之比为(1.8~2)g:(10~20)ml。
[0014]
优选的,所述聚乙二醇单辛基苯基醚的质量为所述猪脑湿重的1%。
[0015]
优选的,所述第二盐溶液的组成包括:500mol/l nacl、5mmol/ledta、0.5mmol/l pmsf和50mmol/l tris-hcl;所述tris-hcl的ph值为7.0。
[0016]
优选的,所述第一洗涤的次数为3次,每次洗涤的时间为30min;所述第二洗涤的时间为30min。
[0017]
优选的,完成所述第一洗涤和第二洗涤后,还独立包括:将所得洗涤物进行离心分离;所述离心分离的温度为4℃,离心力为10000g,时间为20min。
[0018]
优选的,所述pbs缓冲液的浓度为0.01mol/l。
[0019]
优选的,所述第一纯化和第二纯化的时间为60min。
[0020]
优选的,所述第一分离和第二分离的温度为4℃,时间为10min,离心力为10000g。
[0021]
本发明提供了一种波形蛋白的提纯方法,包括以下步骤:将猪脑、第一盐溶液和聚乙二醇单辛基苯基醚混合,进行第一洗涤,得到第一沉淀;将所述第一沉淀重悬于第二盐溶液,进行第二洗涤,得到第二沉淀;将所述第二沉淀与pbs缓冲液混合后,调节所得混合物的ph值为5.1~5.4,加入十二烷基硫酸钠直至十二烷基硫酸钠在所得混合物中的浓度为50mmol/l,进行第一纯化,得到纯化产物;将所述纯化产物第一分离后,调节所得上清液的ph值为4.7~4.9,加入十二烷基硫酸钠直至十二烷基硫酸钠在所得混合物中的浓度为100mmol/l,进行第二纯化,将所得产物第二分离后,得到波形蛋白。
[0022]
本发明以猪脑为原材料,通过两次盐溶液洗涤去除猪脑中盐溶性蛋白和肌球蛋白(杂蛋白,等电点接近5,通过盐溶液萃取去除),然后利用ph值小于蛋白质等电点时,阴离子表面活性剂能引起蛋白质沉淀;ph值大于蛋白质等电点时,阳离子表面活性剂才能沉淀蛋白质的原理(波形蛋白等电点为5.05),调节混合物ph值为5.1~5.4且十二烷基硫酸钠(sds)浓度为50mmol/l,然后调节所得上清液ph值为4.7~4.9且sds浓度100mmol/l,得到波形蛋白。本发明利用等电点和十二烷基硫酸钠(sds)法实现了波形蛋白的分离纯化。
[0023]
本发明的方法无需过柱,分离程序简便,提纯时间短,原材料易得且量足,解决了市场上波形蛋白稀缺的问题,且相比以往波形蛋白提取纯化方法既经济又省力。
附图说明
[0024]
图1为实施例1所得沉淀的10%sds-page电泳分析图;
[0025]
图2为实施例1所得沉淀的western blot验证结果图;
[0026]
图3为实施例2所得不同产物的10%sds-page电泳分析图;
[0027]
图4为实施例2所得沉淀的western blot验证结果图;
[0028]
图5为实施例3所得不同产物的10%sds-page电泳分析图;
[0029]
图6为实施例3所得沉淀的western blot验证结果图。
具体实施方式
[0030]
本发明提供了一种波形蛋白的提纯方法,包括以下步骤:
[0031]
将猪脑、第一盐溶液和聚乙二醇单辛基苯基醚混合,进行第一洗涤,得到第一沉淀;
[0032]
将所述第一沉淀重悬于第二盐溶液,进行第二洗涤,得到第二沉淀;
[0033]
将所述第二沉淀与pbs缓冲液混合后,调节所得混合物的ph值为5.1~5.4,加入十二烷基硫酸钠直至十二烷基硫酸钠在所得混合物中的浓度为50mmol/l,进行第一纯化,得到纯化产物;
[0034]
将所述纯化产物第一分离后,调节所得上清液的ph值为4.7~4.9,加入十二烷基硫酸钠直至十二烷基硫酸钠在所得混合物中的浓度为100mmol/l,进行第二纯化,将所得产物第二分离后,得到波形蛋白。
[0035]
在本发明中,若无特殊说明,所需制备原料均为本领域技术人员熟知的市售商品。
[0036]
本发明将猪脑、第一盐溶液和聚乙二醇单辛基苯基醚混合,进行第一洗涤,得到第一沉淀。本发明对所述猪脑的获取方式没有特殊的限定,按照本领域熟知的方式获取即可。本发明优选将所述猪脑剪碎,再进行所述混合;本发明对所述剪碎后的物料尺寸没有特殊的限定,根据实际需求调整即可。
[0037]
在本发明中,所述第一盐溶液的组成优选包括:100mmol/l kcl、2mmol/lmgcl2、2mmol/l edta、20mmol/l磷酸钾和0.5mmol/l苯甲基磺酰氟(pmsf),所述第一盐溶液的ph值为6.8;所述第一盐溶液所用溶剂优选为水;本发明对所述第一盐溶液的配制过程没有特殊的限定,按照本领域熟知的方式配制得到上述浓度要求的盐溶液即可。
[0038]
在本发明中,所述猪脑的湿重与所述第一盐溶液的体积之比优选为(1.8~2)g:(10~20)ml。
[0039]
在本发明中,所述聚乙二醇单辛基苯基醚(tritonx-100)的质量优选为所述猪脑湿重的1%。
[0040]
本发明对所述猪脑、第一盐溶液和聚乙二醇单辛基苯基醚混合的过程没有特殊的限定,按照本领域熟知的过程将物料混合均匀即可。
[0041]
在本发明中,所述第一洗涤的次数优选为3次,每次洗涤的时间优选为30min;所述第一洗涤优选在搅拌条件下进行;本发明对所述搅拌的过程没有特殊的限定,按照本领域熟知的过程进行即可。
[0042]
完成所述第一洗涤后,本发明优选还包括将所得物料使用第一盐溶液进行洗涤,将所得洗涤物进行离心分离,得到第一沉淀;所述离心分离的温度优选为4℃,离心力优选为10000g,时间优选为20min。
[0043]
本发明通过第一洗涤过程,利用第一盐溶液和聚乙二醇单辛基苯基醚去除猪脑中的盐溶性蛋白,目标波形蛋白存在于第一沉淀中。
[0044]
得到第一沉淀后,本发明将所述第一沉淀重悬于第二盐溶液,进行第二洗涤,得到
第二沉淀。在本发明中,所述第二盐溶液的组成优选包括:500mol/l nacl、5mmol/l edta、0.5mmol/l pmsf和50mmol/l tris-hcl;所述第二盐溶液的ph值优选为7.0;所述第二盐溶液所用溶剂优选为水;本发明对所述第二盐溶液的配制过程没有特殊的限定,按照本领域熟知的过程配制得到上述浓度要求的盐溶液即可。本发明对所述tris-hcl没有特殊的限定,本领域熟知的市售商品即可。
[0045]
在本发明中,所述第一沉淀的质量与第二盐溶液的体积之比优选为1g:10ml。
[0046]
本发明对所述重悬的过程没有特殊的限定,按照本领域熟知的过程进行即可。
[0047]
在本发明中,第二洗涤的时间优选为30min;所述第二洗涤优选在搅拌条件下进行;本发明对所述搅拌的过程没有特殊的限定,按照本领域熟知的过程进行即可。
[0048]
完成所述第二洗涤后,本发明优选还包括:将所得洗涤物进行离心分离,得到第二沉淀;所述离心分离的温度优选为4℃,离心力优选为10000g,时间优选为20min。本发明通过第二洗涤去除猪脑中的肌球蛋白,目标波形蛋白存在于第二沉淀中。
[0049]
得到第二沉淀后,本发明将所述第二沉淀与pbs缓冲液混合后,调节所得混合物的ph值为5.1~5.4,加入十二烷基硫酸钠直至十二烷基硫酸钠在所得混合物中的浓度为50mmol/l,进行第一纯化,得到纯化产物。在本发明中,所述pbs缓冲液的浓度优选为0.01mol/l;本发明对所述pbs缓冲液的具体组成没有特殊的限定,本领域熟知的市售商品均可;所述第二沉淀的质量与pbs缓冲液的体积之比优选为1g:5ml。
[0050]
在本发明中,所述第二沉淀与pbs缓冲液混合的过程优选为将第二沉淀重悬于pbs缓冲液中,搅拌30min;本发明对所述搅拌的速率没有特殊的限定,按照本领域熟知的过程将物料混合均匀即可。
[0051]
本发明优选采用稀盐酸调节所得混合物的ph值为5.1~5.4,更优选为5.16~5.27;本发明对所述稀盐酸的浓度没有特殊的限定,本领域熟知浓度的稀盐酸调整到所需ph即可。
[0052]
在本发明中,所述第一纯化的时间优选为60min;所述第一纯化优选在搅拌条件下进行;本发明对所述搅拌的过程没有特殊的限定,按照本领域熟知的过程进行即可。
[0053]
得到纯化产物后,本发明将所述纯化产物第一分离后,调节所得上清液的ph值为4.7~4.9,加入十二烷基硫酸钠直至十二烷基硫酸钠在所得混合物中的浓度为100mmol/l,进行第二纯化,将所得产物第二分离后,得到波形蛋白。
[0054]
本发明优选采用稀盐酸调节所得上清液的ph值为4.7~4.9;本发明对所述稀盐酸的浓度没有特殊的限定,本领域熟知浓度的稀盐酸调整到所需ph即可。
[0055]
在本发明中,所述第二纯化的时间优选为60min;所述第二纯化优选在搅拌条件下进行;本发明对所述搅拌的过程没有特殊的限定,按照本领域熟知的过程进行即可。
[0056]
在本发明中,所述第一分离和第二分离的温度优选为4℃,时间优选为10min,所述第一分离和第二分离的方式优选为离心分离,所述离心分离的离心力优选为10000g。
[0057]
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0058]
实施例1
nacl、5mmol/l edta、0.5mmol/l pmsf、50mmol/l tris-hcl(ph 7.0),溶剂为水),搅拌30min,将所得洗涤物在4℃离心20min,离心力为10000g,得到第二沉淀;
[0071]
3)将所述第二沉淀在5倍体积(按照1g:10ml计算)0.01m pbs缓冲液中搅拌30min,调节所得溶液ph值为5.16,加入sds使其在混合液中浓度为50mm,搅拌60min,将所得产物在4℃离心10min,离心力为10000g;取上清液调节ph为4.7,加入sds使其在混合物料中浓度为100mm,搅拌60min,将所得产物在4℃离心10min,离心力为10000g,所得沉淀即为波形蛋白。
[0072]
验证
[0073]
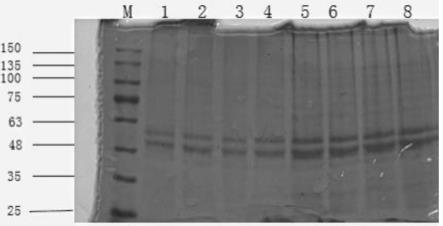
1)采用实施例1的方法对实施例2所得不同产物进行10%sds-page分析,结果见图3;图3中,m:marker,泳道1:粗提液沉淀(步骤1)中第一次洗涤后所得沉淀);泳道2:ph 5.16上清液(步骤3)中第二沉淀加入sds,离心后所得上清液);泳道3:调节ph为4.7的上清液;泳道4:ph4.7时最终的波形蛋白沉淀;泳道5:粗提液上清(步骤1)中第一次洗涤后所得上清液);
[0074]
由图3可知,粗提液上清液和沉淀、ph5.16和ph4.7上清液均含有波形蛋白,但是杂蛋白较多,而ph4.7沉淀中仅剩53kd和57kd分子量的条带。
[0075]
2)按照实施例1的方法将实施例2所得ph4.7沉淀进行wb验证,所得结果见图4,图4中泳道均为ph 4.7沉淀,图4结果显示:53kd和57kd分子量均显色,表明两个分子量蛋白均为波形蛋白。
[0076]
实施例3
[0077]
1)取猪脑,剪碎,称湿重180g,用1.8l盐溶液(100mmol/l kcl,2mmol/lmgcl2,2mmol/l edta,20mmol/l磷酸钾,0.5mmol/lpmsf,溶剂为水,ph 6.8)分别洗涤4次,前三次每次洗涤均加入相对于猪脑湿重1%的tritonx-100,每次搅拌洗涤30分钟,将四次洗涤后所得洗涤物在4℃离心20min,离心力为10000g,得到第一沉淀;
[0078]
2)将所述第一沉淀重悬于10倍体积(按照1g:10ml计算)第二盐溶液(500mol/l nacl、5mmol/l edta、0.5mmol/l pmsf、50mmol/l tris-hcl(ph 7.0),溶剂为水),搅拌30min,将所得洗涤物在4℃离心20min,离心力为10000g,得到第二沉淀;
[0079]
3)将所述第二沉淀在5倍体积(按照1g:10ml计算)0.01m pbs缓冲液中搅拌30min,调节所得溶液ph值为5.4,加入sds使其在混合液中浓度为50mm,搅拌60min,将所得产物在4℃离心10min,离心力为10000g;取上清液调节ph为4.7,加入sds使其在混合物料中浓度为100mm,搅拌60min,将所得产物在4℃离心10min,离心力为10000g,所得沉淀即为波形蛋白。
[0080]
验证
[0081]
1)采用实施例1的方法对实施例3所得不同产物进行10%sds-page分析,结果见图5;图5中,m:marker,泳道1:粗提液上清(步骤1)中第一次洗涤后所得上清液);泳道2:ph 5.4上清液(第二沉淀中加入sds,离心所得上清液);泳道3:粗提液上清(同泳道1);泳道4:ph5.4沉淀(第二沉淀加入sds,离心所得沉淀);泳道5:粗提液上清(同泳道1);泳道6:ph4.7上清液;泳道7:粗提液上清(同泳道1);泳道8:500mmnacl处理后上清;泳道9:ph4.7最终波形蛋白沉淀;
[0082]
由图5可知,粗提液、ph5.4上清液和沉淀、ph4.7上清液均含有波形蛋白,但是杂蛋白较多,而ph4.7沉淀中仅剩53kd和57kd分子量的条带。
[0083]
2)按照实施例1的方法将实施例3所得ph4.7沉淀进行wb验证,所得结果见图6,图6
中泳道均为ph 4.7沉淀,图6结果显示:53kd和57kd分子量均显色,表明两个分子量蛋白均为波形蛋白。
[0084]
方法学验证
[0085]
将实施例1~3所得沉淀和第一次洗涤过程所得粗提溶液以10%sds-page电泳,考马斯亮蓝染色。凝胶成像后用image lab 4.0软件作灰度值分析波形蛋白的纯度。
[0086]
相对回收率=(纯化蛋白质量
×
纯化蛋白质纯度)/(精提蛋白质量
×
精提蛋白质纯度);其中,纯化蛋白质为最终波形蛋白,精提蛋白质为第二沉淀结束所得蛋白质产物;
[0087]
结果表明,实施例1~3中第一次洗涤过程所得粗提液中波形蛋白纯度依次为12.40%、12.42%和12.43%,实施例1~3中所得波形蛋白纯度依次为86.6%、86.8%和87.3%;精提蛋白质量依次为34.98g、34.91g和34.96g,纯化蛋白质量分别为1.044g、1.116g和1.112g;相对回收率依次为20.84%、22.32%和22.36%。
[0088]
综上,实施例1~3的结果表明,调节ph值为5.1~5.4,能有效去除等电点5.1以上的杂蛋白;再次调节ph值4.7~4.9,能获得仅含有目的蛋白沉淀-波形蛋白,且所得波形蛋白的纯度为(平均值86.91
±
标准差0.36)%,相对回收率为(平均值21.84
±
标准差0.87)%。
[0089]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1