肠癌类器官培养液、培养试剂组合及培养方法与流程
1.本技术涉及生物组织工程技术领域,例如涉及一种肠癌类器官培养液、培养试剂组合及培养方法。
背景技术:
2.肠癌,包括结肠癌和直肠癌,是我国的十大恶性肿瘤之一。目前,肠癌的病因尚未完全清楚,目前认为主要是环境因素与遗传因素综合作用的结果。肠癌类器官,例如,结直肠癌类器官,是研究肠癌的优势模型。目前虽有一些肠癌类器官培养基的研究报道,但是其培养过程生长慢,增加时间投入成本。
3.在研发过程中,发现相关技术中至少存在如下问题:现有肠癌类器官的培养过程中,每次传代至少需要培养7天,甚至更多天,才达到传代要求。而且,获得的细胞量也非常少,为了收获更多的细胞,进行下游试验,需要时间更长,使得整个器官的构建过程缓慢,导致肠癌类器官研究的时间成本高。
技术实现要素:
4.为了对披露的实施例的一些方面有基本的理解,下面给出了简单的概括。所述概括不是泛泛评述,也不是要确定关键/重要组成元素或描绘这些实施例的保护范围,而是作为后面的详细说明的序言。
5.本技术实施例提供一种肠癌类器官培养液、培养试剂组合及培养方法,以加快肠癌类器官细胞的生长,提高培养速度。
6.在一些实施例中,所述肠癌类器官培养液,包括,条件培养基、基础培养基、复合抗生素和生长因子;所述条件培养基与所述基础培养基的体积比为1~4﹕1;所述基础培养基包括advanced dmem/f12(优化后的杜氏改良eagle培养基/营养混合物f-12),hepes(4-(2-羟乙基)-1-哌嗪乙磺酸) 5~15 mm和glutamax 0.5x~1.5x;所述复合抗生素包括primocin 50~500 μg/ml,青霉素-链霉素0.5x~1.5x和甲硝唑2~10 μg/ml;所述生长因子包括:egf(表皮细胞生长因子) 10~100 ng/ml,fgf-10(成纤维细胞生长因子10) 10~100 ng/ml,n2 0.25x~1.5x,b27 0.25x~1.5x,n-acetylcysteine(乙酰半胱氨酸) 1~2 mm,nicotinamide (烟酰胺)5~20 mm,gastrin 5~20 nm,prostaglandin e2 0.2~2 μm,y-27632 5~15 μm,hgf 10~50 ng/μl,il-6 5~40 ng/μl,sdf1 3~30 ng/μl;所述条件培养基包括两种或三种蛋白条件培养基,其中所述蛋白条件培养基选自wnt-3a(wnt蛋白家族3a型蛋白)条件培养基,r-spondin1(r-spondin蛋白家族1型蛋白)、r-spondin3条件培养基和头蛋白条件培养基。
7.在一些实施例中,所述肠癌类器官培养试剂组合,包括:酶解液和前述的肠癌类器官培养液;所述酶解液包括基础培养基、ⅰ型胶原酶、ⅲ型胶原酶和primocin;其中,所述ⅰ型胶原酶的浓度为0.1~2 mg/ml,所述ⅲ型胶原酶的浓度为0.1~1 mg/ml,所述primocin的浓度为0.2~2 mg/ml;所述肠癌类器官培养液与所述酶解液独立包装。
8.在一些实施例中,所述肠癌类器官的培养方法,包括:将肠样本进行物理预处理,得到样本组织碎块;将所述样本组织碎块进行酶解预处理,过滤获得滤过液,将所述滤过液离心处理,获得细胞沉淀;采用基质胶重悬所述细胞沉淀,获得混有细胞的凝胶;然后将所述凝胶接种于培养孔,于37℃细胞培养箱静置培养,使得所述凝胶凝固;向培养孔内加入前述的肠癌类器官培养液进行培养,获得原代肠癌类器官;将原代肠癌类器官进行传代培养,传代培养过程中采用前述的肠癌类器官培养液进行培养,每次传代培养的培养周期为3~5天,获得相应代肠癌类器官。
9.本技术实施例提供的一种肠癌类器官培养液、培养试剂组合及培养方法,可以实现以下技术效果:本技术实施例提供的肠癌类器官培养液各物质之间相互协同作用,其中,基质衍生因子-1(stromal derived factor-1,sdf-1)刺激癌细胞增殖,并可通过招募内皮前体细胞增加肿瘤血管生成;hgf 可通过hgf/c-met/stat3/twist1通路促进肿瘤细胞的增殖、迁移和侵袭;il-6可通过il-6/il-6r/jak2/stat3/twist1通路发生相同促进肿瘤细胞的增殖、迁移和侵袭的作用,il-6还可以上调c-met的表达,进而与hgf在增强caf(肿瘤相关成纤维细胞)的特性方面存在协同作用;以及复合抗生素的种类和浓度的控制,在防止污染的同时还能够保持细胞活性;综上,通过在培养基中增加以上细胞因子而产生的相互协同作用,配合复合抗生素,加快了肠癌类器官细胞的形成和生长,提高培养速度,在传代培养过程中,培养3-4天即可达到传代要求。本技术实施例的培养液能够适用于人源肠癌类器官的培养,例如,小肠癌、直肠癌、结肠癌等,在培养过程中,能够维持原发组织的形体结构与病理特征。而且,进行多次传代获得的肠癌类器官与肿瘤组织的特征性蛋白marker表达具有一致性。
10.本技术实施例提供的肠癌类器官培养试剂中,酶解液利用ⅰ型胶原酶和ⅲ型胶原酶进行酶解,能够缩短酶解时间,获得的细胞活性高,还可有效降低样本污染;然后利用本技术实施例的肠癌类器官培养液对肠癌肿瘤样本进行培养,能够加快肠癌类器官细胞的生长,提高培养速度。
11.本技术实施例提供的肠癌类器官的培养方法,操作简单,采用本技术实施例的肠癌类器官培养液能够有效缩减了原代类器官形成与生长时间,在传代培养时,每代培养时间能够缩短至3天。在传代培养过程中,培养3天类器官直径可达80~110 μm,5天可达200μm,传代周期稳定缩短。而且,在采用肠癌类器官培养试剂进行原代提取培养过程中,培养24 h后即可见大量结直肠癌类器官形成,最大直径达200 μm以上。
12.以上的总体描述和下文中的描述仅是示例性和解释性的,不用于限制本技术。
附图说明
13.一个或多个实施例通过与之对应的附图进行示例性说明,这些示例性说明和附图并不构成对实施例的限定,附图中具有相同参考数字标号的元件示为类似的元件,附图不构成比例限制,并且其中:图1是本技术实施例的一种肠癌类器官培养方法的原代培养24 h后的肠癌类器官的光镜图;图2是本技术实施例的另一种肠癌类器官培养方法的原代培养24 h后的肠癌类器
官的光镜图;图3是本技术实施例的另一种肠癌类器官培养方法的传代培养3天时的肠癌类器官的图片;图4是本技术实施例的另一种肠癌类器官培养方法中经酶解预处理的细胞的台盼蓝染色图;图5是本技术实施例的另一种肠癌类器官培养方法的传代培养5天时的肠癌类器官的atp检测发光强度柱状图;图6是本技术实施例的另一种肠癌类器官培养方法的传代培养5天时的肠癌类器官的图片;图7是经本技术实施例的冻存方法冻存后复苏并常规培养24 h后的肠癌类器官的光镜图;图8是对比例1的肠癌类器官培养方法的传代培养7天时的肠癌类器官的图片;图9是对比例2的肠癌类器官培养方法的传代培养7天时的肠癌类器官的图片;图10是对比例3的肠癌类器官培养方法的传代培养7天时的肠癌类器官的图片;图11是对比例4的肠癌类器官培养方法的传代培养7天时的肠癌类器官的图片;图12是本技术实施例的肠癌类器官培养方法获得的肠癌类器官的免疫组化结果图;图13是本技术实施例的肠癌类器官培养方法获得的肠癌类器官同源组织的免疫组化结果图。
具体实施方式
14.为了能够更加详尽地了解本技术实施例的特点与技术内容,下面结合附图对本技术实施例的实现进行详细阐述,所附附图仅供参考说明之用,并非用来限定本技术实施例。在以下的技术描述中,为方便解释起见,通过多个细节以提供对所披露实施例的充分理解。然而,在没有这些细节的情况下,一个或多个实施例仍然可以实施。在其它情况下,为简化附图,熟知的结构和装置可以简化展示。
15.本技术实施例的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本技术实施例的实施例。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含。
16.在本技术实施例中,术语“上”、“下”、“内”、“中”、“外”、“前”、“后”等指示的方位或位置关系为基于附图所示的方位或位置关系。这些术语主要是为了更好地描述本技术实施例及其实施例,并非用于限定所指示的装置、元件或组成部分必须具有特定方位,或以特定方位进行构造和操作。并且,上述部分术语除了可以用于表示方位或位置关系以外,还可能用于表示其他含义,例如术语“上”在某些情况下也可能用于表示某种依附关系或连接关系。对于本领域普通技术人员而言,可以根据具体情况理解这些术语在本技术实施例中的具体含义。
17.另外,术语“设置”、“连接”、“固定”应做广义理解。例如,“连接”可以是固定连接,可拆卸连接,或整体式构造;可以是机械连接,或电连接;可以是直接相连,或者是通过中间
媒介间接相连,又或者是两个装置、元件或组成部分之间内部的连通。对于本领域普通技术人员而言,可以根据具体情况理解上述术语在本技术实施例中的具体含义。
18.除非另有说明,术语“多个”表示两个或两个以上。
19.需要说明的是,在不冲突的情况下,本技术实施例中的实施例及实施例中的特征可以相互组合。
20.本技术实施例中,涉及的各物质的名称均为本领域常规采用的简写、英文名称或商品名称,具体如下:hepes为4-(2-羟乙基)-1-哌嗪乙磺酸,primocin为primocin
tm
抗生素,egf为表皮生长因子,fgf-10为大鼠成纤维细胞生长因子,n-acetylcysteine为n-乙酰半胱氨酸,nicotinamide为烟酰胺,gastrin为胃泌素,prostaglandin e2为前列腺素 e2,hgf为肝细胞生长因子,il-6为白介素6,sdf1为基质细胞衍生因子,advanced dmem/f12为在dulbecco's modified eagle medium/ham's f-12(dmem/f12)基础上改良的培养基。
21.本技术实施例提供的一种肠癌类器官培养液,包括条件培养基、基础培养基、复合抗生素和生长因子;其中,条件培养基与基础培养基的体积比为1~4﹕1,基础培养基包括advanced dmem/f12,hepes 5~15 mm和glutamax 0.5x~1.5x;复合抗生素包括primocin 50~500 μg/ml,青霉素-链霉素 0.5x~1.5x和甲硝唑2~10 μg/ml;生长因子包括:egf 10~100 ng/ml,fgf-10 10~100 ng/ml,n2 0.25x~1.5x,b27 0.25x~1.5x,n-acetylcysteine 1~2 mm,nicotinamide 5~20 mm,gastrin 5~20 nm,prostaglandin e2 0.2~2 μm,y-27632 5~15 μm,hgf 10~50 ng/μl,il-6 5~40 ng/μl,sdf1 3~30 ng/μl;所述条件培养基包括两种或三种蛋白条件培养基,其中所述蛋白条件培养基选自wnt-3a条件培养基,r-spondin1、r-spondin3条件培养基和noggin条件培养基。
22.本技术实施例的肠癌类器官培养液中,各物质之间相互协同作用,其中,基质衍生因子-1(stromal derived factor-1,sdf-1)刺激癌细胞增殖,并可通过招募内皮前体细胞增加肿瘤血管生成;hgf 可通过hgf/c-met/stat3/twist1通路促进肿瘤细胞的增殖、迁移和侵袭;il-6可通过il-6/il-6r/jak2/stat3/twist1通路发生相同促进肿瘤细胞的增殖、迁移和侵袭的作用,il-6还可以上调c-met的表达,进而与hgf在增强caf的特性方面存在协同作用;以及复合抗生素的种类和浓度的控制,在防止污染的同时还能够保持细胞活性;综上,通过在培养基中增加以上细胞因子而产生的相互协同作用,配合复合抗生素,加快了肠癌类器官细胞的形成和生长,增加细胞收获数量的同时还提高培养速度,在传代培养过程中,培养3-4天即可达到传代要求。本技术实施例的培养液能够适用于人源肠癌类器官的培养,例如,小肠癌、直肠癌、结肠癌等,而且在培养过程中,能够维持原发组织的形体结构与病理特征。
23.本技术实施例的肠癌类器官培养液中,条件培养基中的各蛋白条件培养基采用自制获得,大大降低了成本。其余组份均采用市售产品。
24.本技术实施例中,将条件培养基和基础培养基按体积比例混合后,获得混合培养基,再向该混合培养基中加入复合抗生素和生长因子,混匀,即得肠癌类器官培养液。
25.基础培养基中,hepes和glutamax的浓度是在基础培养基内的浓度。可选地,基础培养基包括advanced dmem/f12,hepes 8~12 mm和glutamax 0.75x~1.25x。可选地,基础培养基包括advanced dmem/f12,hepes 10 mm和glutamax 1x。
26.可选地,条件培养基与基础培养基的体积比为2~3﹕1。可选地,条件培养基与基础
培养基的体积比为1﹕1或者7﹕3(2.3﹕1)。
27.可选地,生长因子包括:egf40~80ng/ml,fgf-1040~80ng/ml,n20.75x~1.25x,b270.75x~1.25x,n-acetylcysteine1.25~1.8mm,nicotinamide8~15mm,gastrin8~15nm,prostaglandine20.5~1.5μm,y-276328~12μm,hgf20~40ng/μl,il-610~30ng/μl,sdf15~20ng/μl。
28.可选地,生长因子包括:egf50ng/ml,fgf-1050ng/ml,n20.75x~1x,b270.75x~1x,n-acetylcysteine1.25~1.5mm,nicotinamide8~10mm,gastrin8~10nm,prostaglandine20.5~1μm,y-276328~10μm,hgf20~30ng/μl,il-610~20ng/μl,sdf15~10ng/μl。
29.可选地,复合抗生素包括primocin50~150μg/ml,青霉素-链霉素0.6x~1.4x和甲硝唑2~6μg/ml。
30.可选地,复合抗生素包括primocin75~125μg/ml,青霉素-链霉素0.75x~1.25x和甲硝唑3~5μg/ml。
31.可选地,复合抗生素包括primocin100μg/ml,青霉素-链霉素1x和甲硝唑4μg/ml。
32.在一些实施例中,条件培养基包括wnt-3a条件培养基,r-spondin1、r-spondin3条件培养基和noggin条件培养基。三种蛋白条件培养基可以任意比例混合。
33.可选地,wnt-3a条件培养基,r-spondin1、r-spondin3条件培养基和noggin条件培养基的体积比依次为0.1~0.8﹕1~2﹕1。
34.可选地,wnt-3a条件培养基,r-spondin1、r-spondin3条件培养基和noggin条件培养基的体积比依次为0.3~0.6﹕1.2~1.8﹕1。
35.可选地,wnt-3a条件培养基,r-spondin1、r-spondin3条件培养基和noggin条件培养基的体积比依次为0.5﹕1.5﹕1。
36.可选地,在肠癌类器官培养液中,按体积百分比,条件培养基为70%,基础培养基为30%;其中,条件培养基中,按体积百分比,包括wnt-3a条件培养基为20%,r-spondin1、r-spondin3条件培养基为50%,noggin条件培养基为30%。
37.在一些实施例中,条件培养基包括r-spondin1、r-spondin3条件培养基和noggin条件培养基。该两种蛋白条件培养可以任意比例混合。
38.可选地,r-spondin1、r-spondin3条件培养基和noggin条件培养基的体积比为1~2﹕1。
39.可选地,r-spondin1、r-spondin3条件培养基和noggin条件培养基的体积比为1.2~1.8﹕1。
40.可选地,r-spondin1、r-spondin3条件培养基和noggin条件培养基的体积比为1.5﹕1。
41.可选地,在肠癌类器官培养液中,按体积百分比,条件培养基为50%,基础培养基为50%;其中,条件培养基中,按体积百分比,包括r-spondin1、r-spondin3条件培养基为60%,noggin条件培养基为40%。
42.本技术实施例中,蛋白条件培养基通过以下方法获得:s110、将产目的蛋白的细胞系依次进行初次培养、抗生素筛选培养和二次培养后,
进入孵育培养阶段。
43.步骤s110中,依据目的蛋白的种类确定采用的细胞系,本实施例中将该细胞系定义为目的细胞系,便于后续引用。目的细胞系为目的蛋白过表达细胞株,可以通过慢病毒转染方式,向cho细胞系中转入目的基因,实现特定蛋白的过表达。例如,目的蛋白为wnt-3a,采用的wnt-3a过表达细胞株通过慢病毒转染方式,向cho细胞系中转入wnt-3a目的基因,实现特定蛋白的过表达。
44.可选地,初次培养包括:复苏目的细胞系,并使用第一完全培养基进行培养。第一完全培养基采用advanced dmem/f12+10%fbs(胎牛血清)+1% p/s(双抗(青霉素加链霉素))。
45.可选地,抗生素筛选培养包括:在初次培养至细胞汇合度达90%后,传代至培养皿,然后使用第二完全培养进行一次筛选培养2~3天;在细胞汇合度达90%后,传代至新培养皿,然后使用第二完全培养进行二次筛选培养2~3天。其中,第二完全培养基是在第一完全培养基的基础上,加入puromycin(嘌呤霉素),且控制其浓度为5 μg/ml。
46.可选地,二次培养包括:在二次筛选培养至细胞汇合度达90%后,用胰酶消化传代至透气培养瓶,采用第一完全培养基(同初次培养)继续培养,期间2天或者3天换液一次。这里,透气培养瓶采用t175透气培养瓶,且每瓶透气培养瓶中控制总培养基30 ml,当然也可以是其他体积量,不限定。
47.可选地,孵育培养包括:在二次培养至细胞汇合度达95%~100%后,去除培养基,用pbs清洗后,每瓶加入新配制的第一完全培养基,孵育培养。在pbs清洗过程中,视情况确定pbs的体积,例如,10ml。
48.s120、在孵育培养阶段中,每孵育24小时收取一次培养基,并将培养基在4℃下离心处理,将上清液转移至无菌瓶,并置于4℃下存储,依据收取时间顺序对应获得第一次条件培养基至第十二次条件培养基;其中,将第一次条件培养基至第四次条件培养基混合作为第一批次条件培养基;将第五次条件培养基至第八次条件培养基混合作为第二批次条件培养基;将第九次条件培养基至第十二次条件培养基混合作为第三批次条件培养基;将第一批次条件培养基、第二批次条件培养基和第三批次条件培养基混合,获得蛋白条件培养基。
49.这里,还会对各批次条件培养基中的蛋白含量进行检测,检测合格后,再混合使用。同时,还可以将每个批次条件培养基过滤后分别冻存,在使用时,再解冻后混合。
50.本步骤s120中,可选地,将培养基在4℃下离心处理条件包括:离心力为2000 g,离心时间为5 min。
51.可选地,每批次条件培养基采用0.22μm真空过滤器。
52.可选地,冻存条件为零下80℃(-80℃)。
53.可选地,第一批次条件培养基、第二批次条件培养基和第三批次条件培养基等体积比例混合。
54.本技术实施例还提供一种肠癌类器官培养试剂组合,包括酶解液和前述任一实施例的肠癌类器官培养液。其中,酶解液,包括基础培养基、ⅰ型胶原酶、ⅲ型胶原酶和primocin;其中,ⅰ型胶原酶的浓度为0.1~2 mg/ml,ⅲ型胶原酶的浓度为0.1~1 mg/ml,primocin的浓度为0.2~2 mg/ml;肠癌类器官培养液与酶解液独立包装。
55.采用本技术实施例的肠癌类器官培养试剂组合是套装试剂,利用酶解液进行酶解,能够缩短酶解时间,获得的细胞活性高,还可有效降低样本污染;然后利用本技术实施例的肠癌类器官培养液对肠癌肿瘤样本进行培养,能够加快肠癌类器官细胞的生长,提高培养速度。
56.在一些实施例中,酶解液中,基础培养基采用与肠癌类器官培养液一致的基础培养基,advanced dmem/f12。
57.在一些实施例中,酶解液,包括基础培养基、ⅰ型胶原酶、ⅲ型胶原酶和primocin;其中,ⅰ型胶原酶的浓度为1~1.5 mg/ml,ⅲ型胶原酶的浓度为0.3~0.7 mg/ml,primocin的浓度为1~2 mg/ml。
58.可选地,酶解液,包括基础培养基、ⅰ型胶原酶、ⅲ型胶原酶和primocin;其中,ⅰ型胶原酶的浓度为1.2 mg/ml,ⅲ型胶原酶的浓度为0.5 mg/ml,primocin的浓度为1.5 mg/ml。
59.本技术实施例的培养试剂组合中,酶解液与肠癌类器官培养液的比例不限定,依据培养过程的实际需求确定。
60.本技术实施例还提供一种肠癌类器官的培养方法,包括以下步骤:s210、将肠样本进行物理预处理,得到样本组织碎块。
61.本步骤s210中,物理预处理包括清洗和破碎等物理处理方式。可选地,物理预处理,包括步骤s211、将肠癌肿瘤样本采用含5%双抗(青霉素-链霉素)和50 ng/ml庆大霉素的pbs缓冲液清洗后,将样本组织转移至培养皿中,然后剪碎,获得样本组织碎块。清洗次数不限定,达到充分清洗目的即可。
62.s220、将步骤s210获得的样本组织碎块进行酶解预处理获得滤过液;将滤过液离心处理,获得细胞沉淀。
63.本步骤s220中,酶解预处理可以采用常规酶解液和酶解操作。具体地,酶解预处理,包括以下步骤:向样本组织碎块加入酶解液,在37℃摇床上孵育预设孵育时间后,加入酶解中止剂,中止酶解后,过滤,获取滤过液。完成酶解预处理。其中,酶解中止剂可以采用4℃的advanced dmem/f12,加入量依据酶解液的加入量确定。
64.可选地,滤过液离心处理条件包括:离心力为300 g,离心时间为5 min。
65.s230、采用基质胶重悬步骤s220获得的细胞沉淀,获得混有细胞的凝胶;然后将该凝胶接种于培养孔,于37℃细胞培养箱静置培养,使得该凝胶凝固。
66.可选地,以每孔50μl的接种量将该凝胶接种于孔板中。孔板的孔数不限,例如,24孔板。
67.可选地,静置培养时间为15~40min。可选地,静置培养时间为15min~30min。可选地,静置培养时间为30min。
68.本步骤s230中,凝胶凝固的标准为竖直放置培养板凝胶不可自由流动即可。
69.s240、向培养孔内加入前述任一实施例的肠癌类器官培养液进行培养,获得原代肠癌类器官。
70.s250、将步骤s240获得的原代肠癌类器官进行传代培养,在代培培养过程中采用前述任一实施例的肠癌类器官培养液进行培养,每次传代培养的培养周期为3~4天,获得相应代肠癌类器官。
71.本技术实施例的培养方法中,操作简单,采用本技术实施例的肠癌类器官培养液,能够有效缩减了原代类器官形成与生长时间,在传代培养时,每代培养时间能够缩短至3天。在传代培养过程中,培养3~4天类器官直径可达80~110μm,传代周期稳定缩短。
72.在一些实施例中,步骤s220中,酶解预处理,包括以下步骤:s221、向步骤s210获得的样本组织碎块加入前述的肠癌类器官培养试剂组合中的酶解液,在37℃摇床、200r/min的条件下,孵育15~25min。
73.本步骤s221中,酶解液的加入量与样本大小相关,可选地,每1g样本加入5~15ml酶解液。
74.可选地,样本组织碎块的重量为0.5g时,酶解液的加入量为5ml。通过控制酶解液的加入量,进而可以控制酶解孵育时间。
75.s222、加入酶解中止剂,中止酶解后,过滤,获取滤过液。其中,酶解中止剂可以采用4℃的advanceddmem/f12,加入量依据酶解液的加入量确定。
76.可选地,酶解中止剂的加入体积与酶解液的加入体积的比例为1.5~3﹕1。可选地,比例为2﹕1。
77.可选地,步骤s221中,酶解液的加入量为5ml,步骤s222中,酶解中止剂的加入量为10ml。
78.可选地,在加入酶解中止剂后,用移液枪进行充分吹打,中止酶解。
79.可选地,过滤采用100μm细胞筛进行过滤。
80.本实施例中,采用前述肠癌类器官培养试剂组合中的酶解液进行酶解处理后,能够缩短酶解时间,获得的细胞活性高,还可有效降低样本污染;然后利用本技术实施例的肠癌类器官培养液对肠癌肿瘤样本进行培养,能够加快肠癌类器官细胞的生长,提高培养速度。在进行原代提取培养过程中,培养24h后即可见大量结直肠癌类器官形成,最大直径达200μm以上;培养3~4天类器官直径即可达80~110μm,可进行传代。
81.在一些实施例中,一种肠癌类器官的培养方法,还包括:s250、用基质胶包埋步骤s240获得的肠癌类器官,采用advanceddmem/f12培养基吹散后,离心处理,获得基质胶与细胞混合沉淀。
82.本步骤s250中,离心处理的条件包括:离心力为300g,离心时间为5min。
83.s260、将步骤s250获得的混合沉淀重悬获得重悬液;将重悬液置于37℃水浴8~10min;然后向重悬液中加入两倍体积的4℃的advanceddmem/f12培养基中止消化,离心处理,获得二次细胞沉淀。
84.本步骤s260中,重悬采用tryple重悬。离心处理的条件包括:离心力为300g,离心时间为5min。
85.s270、将二次细胞沉淀采用冻存液重悬,然后使用程序性梯度降温盒进行冻存;一天后转移至液氮中进行长期保存。二次细胞沉淀与冻存液的重悬比例为每1
×
105~5
×
106个细胞团用1ml冻存液重悬。冻存液采用市售产品。
86.经过步骤s250至步骤s270处理进行液氮冻存的类器官12个月后复苏仍然可以稳定生长,且保持了类器官活性与干性,复苏后类器官生长状态良好。
87.下面给出本技术实施例的具体实施例,以说明本技术实施例的效果。
88.实施例1肠癌类器官培养液
一种肠癌类器官培养液,包括,条件培养基、基础培养基、复合抗生素和生长因子。其中,条件培养基和基础培养基的体积比为7﹕3;条件培养基中,按体积百分比,包括wnt-3a条件培养基 20%,r-spondin1、r-spondin3条件培养基 50%和noggin条件培养基 30%,且三者的体积比依次为0.5﹕1.5﹕1。基础培养基包括advanced dmem/f12,hepes 10 mm和glutamax 1x。复合抗生素包括primocin 100 μg/ml,青霉素-链霉素 1x和甲硝唑4 μg/ml。
89.本实施例1中,生长因子的种类及含量见下表1所示,从而对应获得不同的肠癌类器官培养液。
90.表1本实施例1的肠癌类器官培养液,将各成分按比例用量混合即可。除了条件培养基自行制备获取外,其余成分均可采用市售产品。
91.本实施例1的肠癌类器官培养液适用于人源肠癌类器官培养液。
92.本实施例1中,条件培养基中包括的三种蛋白条件培养基,均可通过以下方法制备获得:s101、复苏目的细胞系,并使用第一完全培养基进行培养。第一完全培养基采用advanced dmem/f12+10%fbs(胎牛血清)+1% p/s(双抗(青霉素加链霉素))。目的细胞系为目的蛋白过表达细胞株,通过慢病毒转染方式,向cho细胞系中转入目的基因,实现特定蛋白的过表达。
93.目的蛋白包括wnt-3a、r-spondin1、r-spondin3和noggin。
94.s102、在初次培养至细胞汇合度达90%后,传代到10cm培养皿,然后使用第二完全培养基进行一次筛选培养2-3天;在细胞汇合度达90%后,传代至新10cm培养皿,然后使用第二完全培养进行二次筛选培养2~3天。其中,第二完全培养基是在第一完全培养基的基础上,加入puromycin,且控制其浓度为5 μg/ml。
95.s103、在二次筛选培养至细胞汇合度达90%后,用胰酶消化传代至t175透气培养瓶,每瓶透气培养瓶中控制总培养基30ml;采用第一完全培养基(同步骤s101)继续培养至细胞汇合度达95%~100%,期间2天或者3天换液一次;然后去除培养基,用10mlpbs震荡清洗一遍,每瓶加入新配制的第一完全培养基,孵育培养。
96.s104、在孵育培养阶段中,每孵育24小时收取一次培养基,并将培养基在4℃下离心处理(离心力为2000g,离心时间为5min),将上清液转移至500ml无菌瓶,并置于4℃下存储,依据收取时间顺序对应获得第一次条件培养基至第十二次条件培养基;其中,将第一次条件培养基至第四次条件培养基混合作为第一批次条件培养基;将第五次条件培养基至第八次条件培养基混合作为第二批次条件培养基;将第九次条件培养基至第十二次条件培养基混合作为第三批次条件培养基。且每批次条件培养基采用0.22μm真空过滤器。冻存条件为零下80℃。
97.s105、使用时,将冻存的第一批次条件培养基、第二批次条件培养基和第三批次条件培养基解冻后等体积比例混合,作为目的蛋白条件培养基。
98.本实施例1中采用上述蛋白条件培养基的制备方法,成本低。
99.本实施例1中,以培养液1
‑ⅱ
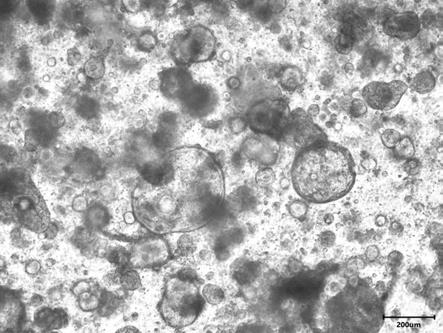
为基础,改变复合抗生素中各组分的浓度,从而获得具有不同抗生素浓度的培养液,如下表2所示。其余组分和各组分含量均与培养液1
‑ⅱ
相同。
100.表2实施例2本实施例2的肠癌类器官培养液,与实施例1不同的是,条件培养基包括r-spondin1、r-spondin3条件培养基和noggin条件培养基;且所述r-spondin1、r-spondin3条件培养基和所述noggin条件培养基的体积比为1.5﹕1。即,按体积比,r-spondin1、r-spondin3条件培养基30%和noggin条件培养基20%,advanceddmem/f1250%。其余的advanceddmem/f12和生长因子均相同。
101.同样,依据实施例1中的生长因子相同的种类和含量,同样提供了5种肠癌类器官培养液,记为培养液2
‑ⅰ
、培养液2
‑ⅱ
、培养液2
‑ⅲ
、培养液2
‑ⅳ
和培养液2
‑ⅴ
。
102.本实施例2中,r-spondin1、r-spondin3条件培养基和noggin条件培养基采用实施例1中步骤s101至步骤s105的制备方法获得。
103.实施例3肠癌类器官培养试剂组合一种肠癌类器官培养试剂组合,包括酶解液和实施例1或实施例2的肠癌类器官培养液。其中,酶解液,包括基础培养基、ⅰ型胶原酶、ⅲ型胶原酶和primocin;其中,ⅰ型胶原酶的浓度为0.1~2mg/ml,ⅲ型胶原酶的浓度为0.1~1mg/ml和primocin的浓度为0.2~2mg/ml。肠癌类器官培养液与酶解液独立包装。
104.本实施例3中,酶解液中的基础培养基为advanced dmem/f12。
105.根据ⅰ型胶原酶、ⅲ型胶原酶和primocin的浓度不同,分别获得如下表3所示的五种酶解液。
106.表3 本实施例3中,酶解液按各组分的用量混合即可。
107.实施例4一种肠癌类器官的培养方法,包括以下步骤:s201、将肠癌肿瘤样本(重量为0.5g)采用含5%双抗(青霉素-链霉素)的pbs缓冲液震荡清洗5次后,将样本组织转移至培养皿(例如,60ml培养皿)中,然后用眼科剪剪碎至2~4 mm组织碎块,获得样本组织碎块。并将组织碎块转移至离心管中。其中,肠癌肿瘤样品可以为结肠癌样本,也可以为直肠癌样本。
108.s202、将步骤s201获得的样本组织碎块进行酶解预处理获得滤过液;将滤过液离心处理(离心力为300 g,离心时间为5 min),获得细胞沉淀。其中,酶解预处理,包括以下步骤:向样本组织碎块加入5ml常规酶解液,在37℃摇床(200 r/min)上孵育50 min后,加入10ml酶解中止剂(4℃的advanced dmem/f12),用移液枪进行充分吹打,中止酶解,采用100 μm细胞筛进行过滤,获取滤过液。
109.其中,常规酶解液为含有1.5 mg/ml
ꢀⅳ
型胶原酶,20 μg/ml透明质酸酶和1%双抗(青霉素-链霉素)的advanced dmem/f12。
110.s203、采用基质胶重悬步骤s202获得的细胞沉淀,获得混有细胞的凝胶;然后以每孔50μl的接种量将该凝胶接种24孔板的培养孔中,再静置培养30min,使得该凝胶凝固。
111.s204、向培养孔内加入实施例1的肠癌类器官培养液进行培养,获得原代肠癌类器官。本步骤s204中,培养24h后可见肠癌类器官形成。如图1所示,图1为采用常规酶解液进行酶解处理后,进行原代培养24h后的肠癌类器官的光镜图,可见,肠癌类器官直径小于100μm,则,原代培养至少7天后才可以进行传代。
112.s205、将步骤s204获得的原代肠癌类器官进行传代培养,在传代培养过程中采用实施例1的肠癌类器官培养液进行培养,每次传代培养的培养周期为3~5天,获得相应代肠癌类器官。
113.实施例5本实施例5的一种肠癌类器官的培养方法,包括:
s301、将肠癌肿瘤样本(重量为0.5g)采用含5%双抗(青霉素-链霉素)的pbs缓冲液震荡清洗5次后,将样本组织转移至培养皿(例如,60ml培养皿)中,然后用眼科剪剪碎至2~4 mm组织碎块,获得样本组织碎块。并将组织碎块转移至离心管中。其中,肠癌肿瘤样品可以为结肠癌样本,也可以为直肠癌样本。
114.s302、将步骤s301获得的样本组织碎块进行酶解预处理获得滤过液;将滤过液离心处理(离心力为300 g,离心时间为5 min),获得细胞沉淀。其中,酶解预处理,包括以下步骤:向样本组织碎块加入5ml酶解液,在37℃摇床(200 r/min)上孵育15~25min后,加入10ml酶解中止剂(4℃的advanced dmem/f12),用移液枪进行充分吹打,中止酶解,采用100 μm细胞筛进行过滤,获取滤过液。
115.s303、采用基质胶重悬步骤s302获得的细胞沉淀,获得混有细胞的凝胶;然后以每孔50μl的接种量将该凝胶接种24孔板的培养孔中,再静置培养30min,使得该凝胶凝固。
116.s304、向培养孔内加入实施例1的肠癌类器官培养液进行培养,获得原代肠癌类器官;且培养3天后,即可进行传代。本步骤s304中,培养24h后可见肠癌类器官形成,且肠癌类器官的最大直径达200μm以上,且原代培养3天即可以进行传代。本实施例中,对步骤s302中采用实施例3中的酶解液ⅲ进行酶解处理,并在步骤s304中具体采用实施例1的培养液1
‑ⅱ
进行原代培养24h后的肠癌类器官进行检测,获得如图2所示的光镜图。可见,培养24h的肠癌类器官的最大直径达200μm以上,则原代培养3天即可以进行传代。
117.s305、将步骤s304中培养3天获得的原代肠癌类器官进行传代培养,在传代培养过程中采用实施例1的肠癌类器官培养液进行培养,每次传代培养的培养周期为3~5天,获得相应代肠癌类器官。
118.本实施例5的步骤s304中,培养3天后的肠癌类器官即可进行传代,传代比例可为1:1.5至1:3。可以稳定长期进行结直肠癌类器官的传代培养,传代周期3~4天。如图3所示,即为采用经实施例3的酶解液ⅲ酶解预处理后并采用实施例1的培养液1
‑ⅱ
进行培养(原代培养)3天的肠癌类器官的图片,可见,200 μm直径以上的类器官数量增多,且类器官最小直径达80 μm以上,可以进行传代。
119.本实施例5中,在步骤s304中,对分别采用培养液1
‑ⅱ
、培养液1
‑ⅲ
和培养液1
‑ⅳ
进行原代培养3天时,各自获得的肠癌类器官1
‑ⅱ
、肠癌类器官1
‑ⅲ
和肠癌类器官1
‑ⅳ
进行了细胞量和细胞活率的检测,检测方法为将类器官酶解为单细胞,使用台盼蓝染色,对细胞总量和活细胞数进行统计。检测结果如下表4所示。
120.表4由表4可知,采用培养液1
‑ⅱ
进行培养时获得的肠癌类器官的活性最好,收获的细胞量最多。
121.本实施例5中,步骤s302中,分别采用实施例3中的酶解液ⅰ至酶解液
ⅴ
进行酶解预处理,各酶解液所对应的孵育时间如下表5所示。
122.表5
可见,采用实施例3的酶解液进行酶解能够明显缩短降解孵育时间,相比实施例4中采用常规酶解液的孵育时间缩短了一半以上。
123.同时,对酶解后的肠癌样本的细胞进行了台盼蓝染色,如图4所示的采用实施例3的酶解液ⅲ酶解预处理的细胞的台盼蓝染色图,可见,酶解效果好,且细胞具有很好的活性。
124.本实施例中,在步骤s304中,分别采用实施例1中的具有不同复合抗生素比例的培养液1
‑ⅱ‑
1、培养液1
‑ⅱ‑
2、培养液1
‑ⅱ‑
3(即实施例1的培养液1
‑ⅱ
)、培养液1
‑ⅱ‑
4和培养液1
‑ⅱ‑
5,进行培养5天时,各自获得的肠癌类器官1
‑ⅱ‑
1至肠癌类器官1
‑ⅱ‑
5,并对5个肠癌类器官进行了atp发光强度测试,测试结果的柱状图如图5所示。由图5可知,采用培养液1
‑ⅱ‑
3培养获得的肠癌类器官1
‑ⅱ‑
3的细胞活性高,同时结合前述表4的细胞量和细胞活率的检测结果,结合整体提取成功率发现,既可以防止污染,又可以保持活性。
125.实施例6本实施例6是在实施例4或5的基础上,对获得的原代肠癌类器官(肠癌类器官)进行传代处理。具体地,肠癌类器官传代处理包括以下步骤:s401、对实施例4或实施例5中基质胶包埋的原代肠癌类器官,每孔使用1 ml 4℃ advanced dmem/f12培养基吹散,回收于离心管中,离心处理(离心力为300 g,离心时间为5 min),获得基质胶与细胞混合沉淀。
126.s402、将获得的沉淀采用tryple(gibco)重悬获得重悬液;将该重悬液置于37℃水浴8~10 min;然后向重悬液中加入两倍体积的4℃的advanced dmem/f12培养基中止消化,用移液枪反复吹打数次。离心处理(离心力为300 g,离心时间为5 min),获得二次细胞沉淀。
127.其中,tryple的使用量以包埋类器官的基质胶量为准,理论上每100 μl基质胶包埋的类器官使用1 ml tryple进行重悬。
128.其中,中止消化后使用移液枪反复吹打情况与类器官的消化程度直接相关。使用1 ml移液枪吹打10-20次,然后用1 ml移液枪头套200 μl移液枪头再次吹打10-20次,可以将所有类器官消化为均一大小的细胞团,一般的,细胞团中含2-10个细胞。
129.s403、用advanced dmem/f12重悬二次细胞沉淀,吹打均匀,离心处理(离心力为300 g,离心时间为5 min),获得三次细胞沉淀。若杂质较多,可重复此步骤。
130.s404、采用基质胶重悬三次细胞沉淀,获得混有细胞的凝胶;然后以每孔50 μl的接种量将该凝胶接种24孔板中,37℃培养箱孵育30 min,使得该凝胶凝固。
131.s405、向凝固后的类器官培养孔中加入实施例1的肠癌类器官培养液进行培养。如图6所示,培养5天后类器的光镜照片,可见,类器官大小均一,长势良好。生长直径近200 μm,且视野内大直径类器官比例高,比对比例1至对比例4中培养7天后的肠癌类器官还要大。
132.实施例7本实施例7是在实施例4或5的基础上,对获得的肠癌类器官进行冻存处理。具体
地,冻存处理包括以下步骤:s501、对实施例4或5中基质胶包埋的肠癌类器官,每孔使用1 ml 4℃ advanced dmem/f12培养基吹散,回收于离心管中,离心处理(离心力为300 g,离心时间为5 min),获得基质胶与细胞混合沉淀。
133.s502、将步骤s501获得的器官细胞沉淀采用tryple(市售产品gibco)重悬获得重悬液;将该重悬液置于37℃水浴8~10min;然后向重悬液中加入两倍体积的4℃的advanced dmem/f12培养基中止消化,离心处理(离心力为300 g,离心时间为5 min),获得二次细胞沉淀。
134.s503、对于二次细胞沉淀,每1
×
105~5
×
106个细胞团用1 ml含有0.1%~0.5% y27632的冻存液重悬,使用程序性梯度降温盒进行冻存。一天后转移至液氮中进行长期保存。此处,一天一般指过夜。
135.经本实施例8液氮冻存处理后的肠癌类器官12个月后复苏仍然可以稳定生长,且保持了类器官活性与干性,如图7所示的复苏后的肠癌类器官经常规培养24h后的光镜图,可见,类器官活性较高,生长状态良好。
136.对比例1本对比例1的对比培养液ⅰ是在实施例1的培养液1
‑ⅱ
的基础上,不添加hgf、il-6和基质衍生因子-1。其他同培养液1
‑ⅱ
相同。
137.对比例1中,采用该对比培养液ⅰ,对肠癌样本进行培养,培养方法同实施例5,其中,步骤s302中的酶解液采用实施例3中的酶解液ⅲ。
138.如图8所示的采用对比培养液ⅰ进行原代培养(即步骤s304)7天的肠癌类器官的图片,可见,肠癌类器官的大小仍然达不到实施例5中图3和实施例6中的图6中的肠癌类器官,且小类器官比例高。
139.对比例2本对比例2的对比培养液ⅱ是在实施例1的培养液1
‑ⅱ
的基础上,不添加hgf和il-6。其他同培养液1
‑ⅱ
相同。
140.对比例2中,采用该对比培养液ⅱ,对肠癌样本进行培养,培养方法同实施例5,其中,步骤s302中的酶解液采用实施例3中的酶解液ⅲ。
141.如图9所示的采用对比培养液ⅱ进行原代培养(即步骤s304)7天的肠癌类器官的图片,可见,肠癌类器官的大小仍然达不到实施例5中图3和实施例6中的图6中的肠癌类器官。
142.对比例3本对比例3的对比培养液ⅲ是在实施例1的培养液1
‑ⅱ
的基础上,不添加hgf和基质衍生因子-1。其他同培养液1
‑ⅱ
相同。
143.使用该对比培养液ⅰ采用实施例5的培养方法进行培养,其中,步骤s202中的酶解液采用实施例3中的酶解液ⅲ。
144.对比例3中,采用该对比培养液ⅲ,对肠癌样本进行培养,培养方法同实施例5,其中,步骤s302中的酶解液采用实施例3中的酶解液ⅲ。
145.如图10所示的采用对比培养液ⅲ进行原代培养(即步骤s304)7天的肠癌类器官的图片,可见,肠癌类器官的大小仍然达不到实施例5中图3和实施例6中的图6中的肠癌类器
官。
146.对比例4本对比例4的对比培养液ⅳ是在实施例1的培养液1
‑ⅱ
的基础上,不添加il-6和基质衍生因子-1。其他同培养液1
‑ⅱ
相同。
147.对比例4中,采用该对比培养液ⅳ,对肠癌样本进行培养,培养方法同实施例5,其中,步骤s302中的酶解液采用实施例3中的酶解液ⅲ。
148.如图11所示的采用对比培养液ⅳ进行原代培养(即步骤s304)7天的肠癌类器官的图片,可见,肠癌类器官的大小仍然达不到实施例5中图3和实施例6中的图6中的肠癌类器官。
149.本技术实施例中,对实施例5中获得的原代肠癌类器官,采用实施例7中的传代方法,进行传代培养,并进行至9次传代,获得第10代肠癌类器官。其中,实施例5中采用实施例3的酶解液ⅲ酶解预处理后,实施例5中的原代培养以及实施例7中的传代培养中均采用实施例1的培养液1
‑ⅱ
。对每次传代培养5天后获得的肠癌类器官进行了鉴定。鉴定方法为:将肠癌肿瘤组织样本和该样本形成的类器官进行多聚甲醛固定和石蜡包埋,对石蜡包埋切片进行免疫组化染色,共表征了he、cdx2、ck20和ki67四项指标。
150.如图12所示的由肠癌肿瘤组织样本培养获得的第10代肠癌类器官免疫组化结果,如图13所示的实施例5中进行原代肠癌类器官培养用的肠癌肿瘤组织样本(即同源肠癌组织)的免疫组化结果图。可见,第10代肠癌类器官与同源肿瘤组织的特征性蛋白marker表达的一致性。
151.本技术实施例中,在不做特殊说明时,涉及百分比浓度时均为体积百分比浓度。
152.本技术实施例的实施例4至实施例8,以及对比例1至对比例4中,涉及的肠癌组织为结肠癌组织。当然,将各实施例中的肠癌组织采用直肠癌时,可获得同结肠癌一致的结果。
153.而且,本技术实施例还采用实施例2的培养液2
‑ⅱ
对肠癌组织进行培养,培养获得的肠癌类器官的检测分析结果与采用培养液1
‑ⅱ
培养获得的肠癌类器官的检测分析结果一致,在此不再赘述。
154.以上描述和附图充分地示出了本技术的实施例,以使本领域的技术人员能够实践它们。其他实施例可以包括结构的以及其他的改变。实施例仅代表可能的变化。除非明确要求,否则单独的部件和功能是可选的,并且操作的顺序可以变化。一些实施例的部分和特征可以被包括在或替换其他实施例的部分和特征。本技术的实施例并不局限于上面已经描述并在附图中示出的结构,并且可以在不脱离其范围进行各种修改和改变。本技术的范围仅由所附的权利要求来限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1