亚隔孢壳属内生真菌及其次生代谢产物的提取方法和应用
1.本发明涉及微生物领域,特别是涉及一种亚隔孢壳属内生真菌及其次生代谢产物的提取方法和应用,该菌株的次生代谢产物中含有白花前胡甲素,白花前胡乙素与白花前胡e素,能够抑制前胡抽薹。
背景技术:
2.植物内生菌是指能够在某一阶段存在于健康植物组织中生存而不引起寄主植物明显病变的一类微生物,主要包括细菌和真菌。内生菌在植物的生长发育过程中扮演着不可或缺的角色,越来越多的学者聚焦于植物相关微生物的研究。
3.前胡,伞形科植物白花前胡的干燥根,始载于《名医别录》,具有解热化痰的功效,一般用于治疗某些呼吸系统疾病,比如风热感冒,痰多咳嗽,哮喘等。香豆素类为前胡的主要化学成分,主要包括角型吡喃香豆素和呋喃香豆素等,其中白花前胡甲素,白花前胡乙素,白花前胡e素是主要的角型吡喃香豆素,它们具有很多重要的生物活性,如抗炎,抗癌,抗氧化等。前胡是多年生一次开花植物,抽薹后根部逐渐木质化,在野外可生长三年至五年才开始抽薹,由于市场需求量逐渐增加,前胡种植规模越来越大,据药农反映,人工种植的前胡抽薹时间逐渐提前,一般1~2年即抽薹,其有效成分积累不足,药用价值极低。
4.随着人们对于化学肥料越来越依赖,导致某些农药滥用的情况,虽然短期内提高作物产量,但更多的是带来某些严重的环境污染,比如:土壤酸化、板结,营养物质低下,水体富营养化等,还有昆虫抗性以及对非目标生物(包括天敌和人类)的危害。而使用生物菌肥,在提高作物产量与质量的同时,还能够有效避免此类问题的发生,所以生物防治是近些年进行土壤结构改善或者促进植物对土壤中营养物质的吸收利用的重要途径。前胡微生物资源极其丰富,已有人从中分离出新微生物,但是暂未有报道从前胡中分离出产香豆素的内生菌,更没有研究显示内生真菌可以抑制前胡抽薹。
技术实现要素:
5.本发明的目的是针对前胡早薹问题,提供一种从白花前胡根中分离的产香豆素类物质、且能抑制前胡抽薹的亚隔孢壳属内生真菌。
6.本发明的另一目的是提取上述菌株次生代谢产物的方法,其次生代谢产物中含有白花前胡甲素,白花前胡乙素与白花前胡e素。
7.本发明还有一个目的是提供上述菌株次生代谢产物抑制前胡抽薹的应用。施加适宜浓度的菌悬液于前胡根部周围,能够显著降低前胡抽薹率,同时对其白花前胡甲素含量略有提高,这不仅能够改善前胡早薹问题,同时也提高前胡药材质量,对于目前过度依赖化学肥料而造成的环境问题的解决具有重要意义。
8.为实现上述目的,本发明提供了如下方案:
9.一种亚隔孢壳属内生真菌(didymellasegeticola)q1-5,是从白花前胡新鲜健康的根组织中分离得到,于2022年1月7日保藏于中国典型培养物保藏中心,菌种保藏编号为
cctcc no.m2022032,保藏地址为:中国湖北省武汉市武昌区武汉大学校内。
10.上述亚隔孢壳属内生真菌提取次菌株生代谢产物的方法,包括以下步骤:
11.(1)取亚隔孢壳属内生真菌菌种,接种于pda培养基上活化,取活化后的菌种接种于pdb培养基中,140~200rpm,25~40℃条件下摇床培养5~10天,得菌株发酵产物;
12.(2)将步骤(1)所得的菌株发酵产物真空抽滤,分离得菌丝体和发酵液,用蒸馏水冲洗菌丝体,将菌丝体置于50
±
2℃条件下烘干,研磨,得菌丝体粉;将菌丝体粉按重量体积比1:20加入二氯甲烷,超声提取10min,过滤,50℃水浴蒸干,残渣用甲醇冲洗,0.22μm滤膜过滤,即得菌株次生代谢产物提取物(即菌丝提取物)。
13.优选步骤(1)中140rpm,28℃条件下摇床培养5~7天,得菌株发酵产物。
14.所述的菌种次生代谢产物含有白花前胡甲素,白花前胡乙素和白花前胡e素。
15.本发明亚隔孢壳属内生真菌能够抑制前胡抽薹、开花。优选使用菌体含量为0.01%~2.00%范围。白花前胡didymellasegeticola菌在施用的时候与无菌水配制成菌悬液,施用量优选为10ml/次/10d,持续四个月。
16.上述亚隔孢壳属内生真菌菌株可以提高前胡香豆素含量。
17.上述亚隔孢壳属内生真菌菌株可以抑制前胡抽薹。
18.与现有技术比较本发明的有益效果:本发明菌株是从白花前胡根中分离得到的内生真菌,该菌株能够产生白花前胡甲素,白花前胡乙素及白花前胡e素,施加至白花前胡根中能够显著降低抽薹率,特别是在第一年生长期中,抽薹率可降低7.22%。且施加菌悬液后的白花前胡甲素含量略有提高,这不仅有效改善前胡早薹问题,还能够提高前胡药材质量。
附图说明
19.图1为前胡5种香豆素成分标准品的高效液相色谱图(图中,1:香豆精i,2:白花前胡甲素,3:香豆精ii,4:白花前胡乙素,5:白花前胡e素);
20.图2为didymellasegeticola q1-5菌的菌丝提取物的高效液相色谱图;
21.图3为didymellasegeticola q1-5菌的菌丝提取物的白花前胡甲素离子质谱图;
22.图4为didymellasegeticola q1-5菌的菌丝提取物的白花前胡乙素离子质谱图;
23.图5为didymellasegeticola q1-5菌的菌丝提取物的白花前胡e素离子质谱图;
24.图6为didymellasegeticola q1-5菌株的培养特征,其中左为平板正面,右为平板反面照片。图7为didymellasegeticola q1-5菌株的系统进化树。
具体实施方式
25.以下通过具体实施例对本发明进行进一步解释说明。
26.实施例1白花前胡内生真菌的分离鉴定
27.1、实验材料
28.安徽省六安市东河口前胡栽培基地白花前胡的根。
29.2、分离纯化
30.将采集的健康无病害前胡植株用剪刀剪取根部,自来水冲洗,去除表面附着的泥沙,放置超净工作台内晾干,进行表面消毒处理:置于0.1%升汞中2-3min,无菌水漂洗4~5次,无菌纱布擦干,再置于75%乙醇中浸泡2~3min,无菌水漂洗6~7次,最后用无菌纱布擦
去表面附着的水分。取最后一次冲洗的无菌水涂于pda培养基检验样品表面消毒效果。
31.组织切片法:用无菌剪刀将表面消毒过的前胡根纵向切开,剪取2~3mm,切面向下接入pda培养基,每个培养皿接入3~5个组织。28
±
1℃暗培养,培养2~3d左右,可见根部边缘逐渐开始生成菌丝,用无菌竹签挑取边缘生长良好的菌丝,分别接种在新的pda固体培养基上,待新接种的菌丝长成菌落后,再挑取其边缘的菌丝培养,如此反复纯化,直到培养皿上得到单一无污染菌落。共分离纯化出49株内生真菌。
32.实施例2亚隔孢壳属内生真菌提取次菌株生代谢产物
33.1、供试品制备
34.将实施例1获得的49株菌接种于pda培养基上活化,取活化后的菌种接种于pdb培养基中,28℃,140r/min摇床培养5-7d,得菌株发酵产物,布氏漏斗真空抽滤分离得菌丝体和发酵液,用蒸馏水冲洗菌丝体,将菌丝体在50
±
2℃条件下烘干,研磨,得菌丝体粉。按重量(g)体积比(ml)1:20精密加入二氯甲烷,密塞,超声处理10分钟,滤过,50℃水浴蒸干,残渣用甲醇冲洗,0.22μm滤膜过滤即为菌丝提取物。
35.2、色谱条件
36.zorbax eclipse plus c18(150mm
×
4.6mm,5μm)色谱柱;以甲醇-水(75:25)为流动相;流速:1.0ml/min-1;柱温:30℃;检测波长:235nm;进样量:l0μl。5种香豆素类成分对照品,见图1(1:香豆精i,2:白花前胡甲素,3:香豆精ii,4:白花前胡乙素,5:白花前胡e素)。测得前胡香豆精i保留时间为2min左右,前胡甲素保留时间为5~6min,前胡香豆精ii保留时间为6~7min,前胡乙素保留时间为10~11min,前胡e素保留时间为14~15min。
37.3、高效液相色谱(hplc)检测菌丝提取物中含有与前胡甲素,乙素,e素标准品保留时间比较接近的成分,其保留时间分别为5.682,11.766,15.439,见图2,与标准品保留时间相近,表明其可能含有香豆素或其类似物。
38.实施例3lc-ms确定菌株次生代谢产物。
39.1、色谱条件
40.c18色谱柱:zorbax eclipse plus c18柱(2.1
×
100mm,1.8μm,安捷伦,美国);流动相:洗脱液a为水,洗脱液b为甲醇。流速为0.25ml/min,进样量为2μl。柱温:30℃。梯度程序为:0~3.00min,30
→
75%b;3.00~15.00min,75%b;15.00~16.00min,75
→
100%b;16.00~20.00min,100%b;20.00~21.00min,100
→
30%;21.00~22.00min,30%b。
41.2、质谱条件
42.电喷雾离子源(esi),正离子扫描;离子源温度325℃;毛细管电压3500v,碰撞能30v,裂解电压175v,标准溶液的参考离子位于m/z[m+na]
+
:白花前胡甲素:409.1263,香豆精i:411.142,白花前胡乙素:449.1577和白花前胡e素:451.1733处。
[0043]
3、将实施例2的菌株次生代谢产物注入lc-ms仪器中,测得菌株次生代谢产物的离子质谱图见图3,4,5,表明该菌株次生代谢产物中确有白花前胡甲素,白花前胡乙素,白花前胡e素。
[0044]
4、使用hplc测得菌丝提取物中白花前胡甲素含量为9.95
×
10-7
,白花前胡乙素百分含量为9.29
×
10-7
,白花前胡e素百分含量为1.72
×
10-6
。
[0045]
实施例4菌株q1-5的鉴定
[0046]
1、形态鉴定
[0047]
菌株在pda培养基上生长良好,菌落边缘整齐,生长初期中央隆起为白色,羊毛状气生菌丝,后期逐渐变为灰褐色至黑褐色,边缘白色,菌落背面黑褐色。见图6。
[0048]
3、分子鉴定
[0049]
对分离出的内生真菌进行its,18s,28s基因位点测序,并将测序结果于ncbi数据库比对,选择同源性最高的菌株序列使用mega6软件构建发育树,见图7,确定菌株的分类地位,最终确定菌株为亚隔孢壳属didymellasegeticola。
[0050]
实施例5didymellasegeticola q1-5菌对前胡早薹的影响
[0051]
1、实验材料
[0052]
前胡种子,购于安徽省宣城市宁国。
[0053]
2、菌液制备
[0054]
didymellasegeticola q1-5菌株接种于pdb培养基,经28℃,140rpm恒温摇床培养5~7天,按照实施例2的方法制备得到亚隔孢壳属内生真菌的菌丝提取物,破碎后,无菌水重悬制得原液,将原液稀释为菌体含量为0.01%的菌悬液。
[0055]
3、对前胡早薹的作用
[0056]
前胡种子采取温水消毒法进行消毒:将种子置于25℃温水中浸泡15min,随后升温至50℃浸泡30min,并不断搅拌使种子受热均匀。
[0057]
于2021年3月10日皖西学院植物园中准备好试验区,即2
×
3m的土壤6块,消毒后的种子按照点播的方式播种,行距30cm、窝距20cm、窝深5cm。一共6个小区,每个小区100株前胡。田间小区正常管理。播种后一个月,前胡开始陆续发芽,待其发芽长至5cm高时开始根据需要补齐田间缺失的植株。
[0058]
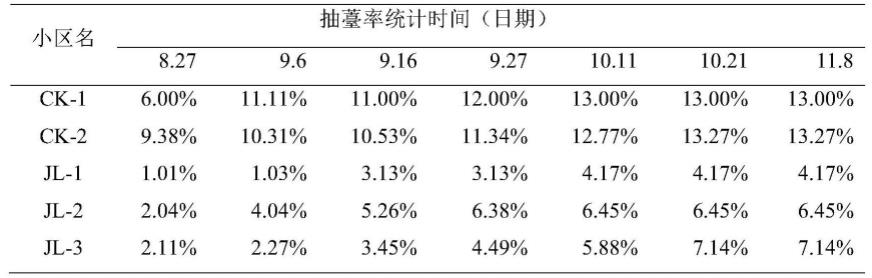
采用灌根接种法:将活化的didymellasegeticola q1-5菌株转移到300ml的pdb培养基中,置于28℃,140rpm的摇床上培养5~7天,通过抽滤收集菌丝体,菌丝破碎后无菌水重悬制得原液,将原液稀释为菌体含量为0.01%左右的菌悬液。前胡植株发芽15天后,在每株根部附近浇灌10ml稀释后的菌悬液(jl-1,jl-2,jl-3三组平行样品),对照(ck-1,ck-2两组平行样品)用等量无菌水,每隔10天浇灌一次。当前胡开始抽薹之后每隔10天统计抽薹率,直至不再新增抽薹前胡为止。
[0059]
前胡抽薹率统计结果如表1所示。
[0060]
表1前胡抽薹率统计表
[0061][0062]
从表1中可以看出,无论是何时统计,施加菌悬液的前胡抽薹率均显著低于对照组,可见该菌悬液可以有效延缓前胡抽薹,改善前胡早薹问题。
[0063]
实验例5不同浓度菌悬液对前胡含量的影响
[0064]
1、实验仪器
[0065]
lc-2030c 3d plus cn高效液相色谱仪,zorbax eclipse plus c18色谱柱,电子分析天平,粉碎机,超声波清洗器。
[0066]
2、试剂
[0067]
白花前胡甲素(中国食品药品检定研究院,质量分数以99.4%计)、白花前胡乙素(中国食品药品检定研究院,质量分数以98.9%计)和白花前胡e素(上海源叶生物科技有限公司,生产批号:b20036,质量分数以99.9%计)。甲醇(色谱纯,上海麦克林生化科技公司);水为纯净水,其它试剂均为分析纯。
[0068]
3、高效液相色谱条件
[0069]
zorbax eclipse plus c18色谱柱(150mm
×
4.6mm,5μm),进样量10μl,流动相a为水,b为甲醇,0~40min为50%~100%b,流速:1ml/min,柱温:30℃,检测波长:321nm。
[0070]
4、对照品溶液的制备
[0071]
取白花前胡甲素、白花前胡乙素和白花前胡e素对照品适量,加甲醇配制成白花前胡甲素为79.94μg/ml、白花前胡乙素为86.88μg/ml和白花前胡e素为58.688μg/ml。将对照品溶液储存于4℃下备用。
[0072]
5、供试品溶液的制备
[0073]
采集试验小区的前胡抽薹前,抽薹后各3棵,前胡根阴干,粉碎过80目筛,每一棵做3个重复。称取0.2g于具塞锥形瓶中,精密加入25ml甲醇,称定重量,超声(功率250w,频率33khz)提取30min,放冷,加甲醇补足失重,摇匀滤过,取续滤液为供试品。滤液过0.22μm有机滤膜,随后进行hplc检测。
[0074]
6、线性关系的确定:
[0075]
精密吸取上述的对照品溶液,用甲醇连续稀释,混匀,分别进样10ul,以进样浓度(μg/ml)为横坐标,峰面积为纵坐标绘制标准曲线,得到回归方程如表2所示。
[0076]
表2线性关系考察结果
[0077][0078]
测得前胡含量见下表:
[0079]
表3前胡抽薹前含量测定结果
[0080][0081]
表4前胡抽薹后含量测定结果
[0082][0083]
注:同一列中不同小写字母表示差异显著(p《0.05)
[0084]
从表中可知,前胡抽薹后香豆素含量显著降低,而菌悬液处理后的前胡(jl)在抽薹前白花前胡甲素含量略高于无菌水浇灌的前胡(ck),抽薹后的白花前胡甲素、白花前胡e素含量偏高,缓解了抽薹后香豆素骤然下降的趋势。
[0085]
综上所述,菌悬液处理后,不仅降低了前胡的抽薹率,且对前胡的香豆素含量略有提高,同时缓解前胡抽薹后香豆素含量突然下降的趋势。
[0086]
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制。凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效变化,均仍属于本发明技术方案的保护范围以内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1