一种高通量器官芯片及其应用
1.本技术涉及微流控器官芯片技术领域,特别涉及一种高通量器官芯片及其应用。
背景技术:
2.器官芯片为微流控器官芯片的简称,是一种三维细胞培养装置,包括相应器官周边的细胞,分泌物和物理力组成的微环境。与传统的药物筛选模型相比,器官芯片更能模拟真实器官的功能,而且避免了动物模型存在的种属差异问题。
3.目前,尽管很多器官芯片能实现具有多个培养单元的高通量结构,但实验时还是依靠手工进样和采样,因为封闭的芯片结构只有出入口和外界相通,难以与现有的自动化装置兼容。此外,对于上皮或内皮屏障功能的研究,跨膜电阻是一个重要功能指标,但是现在的测量方法都存在一定的问题。对于没有集成电极结构的芯片,测量电极在芯片出入口施加,远离上皮或内皮屏障所在的位置,造成测量精确度不高。而集成电极结构的芯片,芯片结构是封闭的,无法进行自动化加样和采样。因此,需要提供一种新型的器官芯片,以解决现有技术中存在的技术问题。
技术实现要素:
4.为了解决现有技术的问题,本技术提供了一种高通量器官芯片及其应用。技术方案如下:
5.一方面,提供了一种高通量器官芯片,所述芯片包括:多个培养模块;
6.单个培养模块包括:第一培养层、第二培养层、多孔隔膜层和电极层;
7.所述第一培养层为开放式培养层;
8.所述第二培养层为封闭式培养层;
9.所述第一培养层设置有细胞培养孔和至少两个流体孔;所述细胞培养孔和所述流体孔相邻设置;
10.所述第二培养层设置有细胞培养流道;
11.所述细胞培养流道与所述流体孔相连通;
12.所述多孔隔膜层设置于所述细胞培养流道和所述细胞培养孔之间;
13.所述电极层设置于所述第二培养层远离所述第一培养层的一侧。
14.进一步地,所述多孔隔膜层的材料包括聚对苯二甲酸乙二醇酯、聚二甲基硅氧烷、聚碳酸酯和玻璃中的至少一种;
15.所述多孔隔膜层的孔径为0.4um~3um。
16.进一步地,所述电极层上设置有电极结构;所述电极结构为两圈环形结构;所述电极结构的一端设置于所述细胞培养流道处;所述电极结构与所述细胞培养流道内的液体相接触;在进行跨膜电阻的测量的情况下,所述电极结构与所述细胞培养孔内插入的电极配合。
17.进一步地,所述细胞培养孔用于培养类器官、细胞球状体或单层贴壁细胞中的至
少一种,以及储存细胞培养基或药物稀释液。
18.进一步地,所述细胞培养流道用于静态培养或动态培养上皮或内皮屏障细胞构成的生物屏障细胞层;
19.所述动态培养为基于目标对象的血液流动的参数设置所述细胞培养流道内流体的参数;在动态培养时,所述流体孔与蠕动泵或注射泵连接,所述蠕动泵或所述注射泵控制细胞培养流道中溶液的流速。
20.进一步地,所述器官芯片中包括多个阵列排布的培养模块。
21.进一步地,所述细胞培养孔的孔径为5~20mm;
22.所述流体孔的孔径为0.8~3mm。
23.进一步地,所述器官芯片的加工方式为一体成型和分层加工中的至少一种;所述器官芯片的微加工方法包括玻璃内雕法、数控铣刻方法、激光刻蚀方法、化学腐蚀方法、软刻蚀方法、注塑成型、热压法、金属溅射和金属电镀中的至少一种。
24.进一步地,所述第一培养层和所述第二培养层的材料包括聚甲基丙烯酸甲酯、聚苯乙烯、聚二甲基硅氧烷和玻璃中的至少一种;
25.进一步地,所述高通量器官芯片还包括移液工作站;
26.移液工作站用于对所述第一培养层进行加液、换液和采样处理;
27.所述移液工作站的xyz三轴位移臂将可插入式电极棒浸入所述细胞培养孔与所述电极结构配合进行跨膜电阻的测量。
28.另一方面,本技术还提供了一种高通量器官芯片的检测平台,请参考图5,图5是本技术实施例提供的一种高通量器官芯片与检测平台的结构示意图;一种高通量器官芯片的检测平台包括用于进行屏障结构跨膜电阻测量的机械臂,机械臂上设置有第一电极;还包括与上述高通量器官芯片的电极结构相匹配的第二电极,通过第一电极和第二电极能够实现电化学阻抗谱测试和屏障结构跨膜阻抗测量。
29.另一方面,本技术提供了一种高通量器官芯片的应用,根据上述高通量器官芯片结构的应用,用于模拟预设生理环境结构。为生理病理模型研究和药物评价提供有效的实验数据。
30.本技术提供的一种高通量器官芯片及其应用,具有如下技术效果:
31.本技术的器官芯片便于实施自动化操作,如可通过xyz三轴位移台和电动移液器实施对第一培养层的加液、换液、采样操作;也可通过将可插入式电极棒浸入细胞培养孔,然后和电极层分别与电化学工作站相连,进而能够进行屏障结构跨膜电阻测量,为生理病理模型研究和药物评价提供有效的实验数据。
32.本技术的器官芯片通过设置第一培养层为开放式培养层且第二培养层为封闭式培养层,通过开放式与封闭式培养体系结合,在器官芯片内实现血管-器官模型的构建;或者在器官芯片内培养至少两种器官细胞,构建多器官共培养模型,可以为大规模代谢类药物筛选及相关机理研究提供平台。本技术通过将可插入式电极棒浸入第一培养层的细胞培养孔,同时将可插入式电极棒和电极层分别与电化学工作站相连,进而能够进行屏障结构跨膜电阻测量,为生理病理模型研究和药物评价提供有效的实验数据。
33.本技术的器官芯片通过开放式的第一培养层有利于与药物进行相互作用,高效地施加药物。本技术的器官芯片模拟了人体器官结构和功能,是微型化、自动化和可视化的工
具,可为生理病理模型研究和药物评价提供有效的实验数据。
34.本技术的器官芯片通过采用两圈环形的电极结构,使产生的电信号能够均匀分布在细胞共培养区域的同时不影响成像观察细胞。
附图说明
35.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
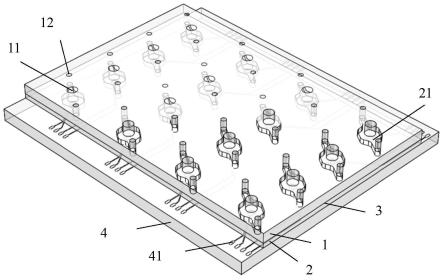
36.图1是本技术实施例提供的一种高通量器官芯片的结构示意图;
37.图2是本技术实施例提供的一种高通量器官芯片的俯视图;
38.图3是本技术实施例提供的一种高通量器官芯片的结构分层示意图;
39.图4是本技术实施例提供的一个培养模块的电极结构的俯视图;
40.图5是本技术实施例提供的一种高通量器官芯片与检测平台的结构示意图;
41.图6是本技术实施例提供的高通量器官芯片的培养模块插入电极棒后进行电化学阻抗谱测量的示意图;
42.图7是本技术实施例提供的hcmec/d3细胞在芯片中培养至第3天的ve-cadherin表达的免疫荧光图像;
43.图8是本技术实施例提供的在器官芯片中培养hcmec/d3细胞时的电化学阻抗谱结果示意图。
44.其中,图中附图标记对应为:1-第一培养层;2-第二培养层;3-多孔隔膜层;4-电极层;11-细胞培养孔;12-流体孔;21-细胞培养流道;41-电极结构。
具体实施方式
45.下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本技术保护的范围。
46.对于以下定义的术语,除非在权利要求书或本说明书中的其他地方给出一个不同的定义,否则应当应用这些定义。所有数值无论是否被明确指示,在此均被定义为由术语“约”修饰。术语“约”大体上是指一个数值范围,本领域的普通技术人员将该数值范围视为等同于所陈述的值以产生实质上相同的性质、功能、结果等。由一个低值和一个高值指示的一个数值范围被定义为包括该数值范围内包括的所有数值以及该数值范围内包括的所有子范围。
47.需要说明的是,本公开的说明书和权利要求书及上述附图中的术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含。
48.对本技术实施例进行进一步详细说明之前,对本技术实施例中涉及的名词和术语进行说明,本技术实施例中涉及的名词和术语适用于如下的解释。
49.上皮组织(epithelium):是个体发生中最先形成的一种组织,由密集排列的上皮
细胞构成,一般彼此相连成膜片状,被覆在机体体表或衬于机体内中空器官的腔面,以及体腔腔面。构成皮肤的上皮细胞使皮下组织免受损伤、细菌侵入及危险化学物质的损害,并且避免过度失去水分。必要的时候,皮肤的上皮细胞还会分泌汗液调节体温。覆盖胰腺的上皮细胞会分泌酶促进消化。小肠表面的上皮细胞会从消化的食物中吸收养分。呼吸道表面的上皮细胞构成黏膜,这些黏膜能分泌黏液阻止吸入的细菌与病毒进入肺部。皮肤,鼻子,舌头,眼睛等与神经末梢接触的器官上还分泌有特化的上皮细胞,它们能够识别感觉刺激。上皮细胞的主要功能涉及,分泌,吸收,保护。上皮组织有明显的极性,上皮细胞的两侧在结构上和功能上有差别,一侧表面朝向体表或体内管、腔、囊的腔面,叫游离面;与游离面相对的另一侧,叫基底面。紧密连接(zonulae occludens)将上皮细胞的浆膜分隔成游离面和基底面。分布在不同部位的上皮组织的细胞游离面常有不同的特化结构与其特定的功能相适应,如肠上皮有密集的微绒毛扩大了吸收面;呼吸道上皮有能摆动的纤毛,可以排出侵入的灰尘等异物。基底面一般借一层基膜与其深层的结缔组织相连。考虑到分布的广泛性及功能的重要性,针对上皮细胞(包括内皮细胞)的研究已涉及生理学、病理学、药学和毒理学多个领域。
50.内皮组织(endothelium):是上皮组织的一种,内皮细胞构成内皮组织,内皮细胞分布在血管的内表面,在管腔中,内皮组织构成了血液循环系统或淋巴系统与血管其他部分的界面。与血液直接接触的内皮细胞被称为血管内皮细胞,而与淋巴直接接触的内皮细胞被称为淋巴内皮细胞。从心脏到最小的毛细血管,血管内皮细胞遍布整个循环系统。覆盖血管壁的内皮细胞能够调控血管中的血流,这种细胞能够释放no,no是一种血管扩张因子,与血管收缩和血管扩张相关,促进血液循环,有助于控制血压。内皮细胞还能分泌多种蛋白导致血液障碍,但同时也会止血。肾小球内部就含有内皮细胞,其作用在于过滤血液。
51.下面结合图1所示的器官芯片结构图来对本技术实施提供的技术方案进行详细说明。
52.具体的,如图1、图2和图3所示,一种高通量器官芯片,芯片包括:多个培养模块;单个培养模块包括:第一培养层1、第二培养层2、多孔隔膜层3和电极层4;第一培养层1为开放式培养层;第二培养层2为封闭式培养层;第一培养层1设置有细胞培养孔11和至少两个流体孔12;细胞培养孔11和流体孔12相邻设置;第二培养层2设置有细胞培养流道21;细胞培养流道21与流体孔12相连通;多孔隔膜层3设置于细胞培养流道21和细胞培养孔11之间;所述电极层4设置于所述第二培养层2远离所述第一培养层1的一侧。需要说明的是,该器官芯片不仅仅包括培养模块,还可以包括细胞动态培养的灌流系统。灌流系统是指培养液从流体孔12进入之后,经过细胞培养流道21后,从另一流体孔12排出的整个过程。需要说明的是,培养液中也可加入所需药物。
53.在一些实施例中,封闭式培养层内用于模拟血管;开放式培养层内用于模拟实质器官,便于自动移液操作和施加上方电极。
54.本技术的器官芯片通过设置第一培养层为开放式培养层且第二培养层为封闭式培养层,通过开放式与封闭式培养体系结合,在器官芯片内实现血管-器官模型的构建;或者在器官芯片内培养至少两种器官细胞,构建多器官共培养模型,可以为大规模代谢类药物筛选及相关机理研究提供平台。
55.本技术的器官芯片通过开放式的第一培养层有利于与药物进行相互作用,高效地
施加药物。本技术的器官芯片模拟了人体器官结构和功能,是微型化、自动化和可视化的工具,可为生理病理模型研究和药物评价提供有效的实验数据。
56.在一些实施例中,细胞培养孔11用于培养类器官、细胞球状体或单层贴壁细胞中的至少一种,以及储存细胞培养基或药物稀释液。细胞培养孔可用于插入电极进行屏障结构跨膜阻抗的测量。需要说明的是,细胞培养孔11可加入实质细胞用于构建血管-器官芯片模型;也可加入内皮/上皮屏障支撑细胞用于构建模拟体内细胞生长环境的屏障模型;也可加入细胞培养基或药物稀释液等,用于为整个体系提供生长所必需的养分或者需要测试的药物;也可使用机械臂插入电极用于屏障结构跨膜阻抗的测量。
57.在一些实施例中,细胞培养孔11为直孔,细胞培养孔11的孔径为5~20mm;具体地,其中第一培养层1的至少两个流体孔12,一个为液体进入口,另一个为液体出口,流体孔12可通过连接头(如鲁尔接头)与注射泵或蠕动泵等外接泵的管路连接,用于对第二培养层2的细胞培养流道21内的液体输送,流体孔12的孔径为0.8~3mm。需要说明的是,在环境需要条件下,可设置多个流体孔,具体地,可以为一个液体进入孔,两个为液体进出孔;也可以为两个液体进入孔,1个为液体进出孔;其流体孔的数量在此不作限定。
58.在一些实施例中,细胞培养孔11的孔径可以为5~15mm。
59.在一些实施例中,细胞培养孔11的孔径可以为10~15mm。
60.在一些实施例中,多孔隔膜层3的材料包括聚对苯二甲酸乙二醇酯(pet)、聚二甲基硅氧烷(pdms)、聚碳酸酯(pc)和玻璃中的至少一种。其中,pet薄膜也称pet多孔膜,其为一种性能比较全面的包装薄膜,其强韧性是所有热塑性塑料中最好的,抗张强度和抗冲击强度比一般薄膜高得多,其透明性好,有光泽,具有良好的气密性等性质作为选择中间膜提供可靠依据。
61.在一些实施例中,多孔隔膜层3为孔径较小且孔隙率较高的多孔膜。所述多孔隔膜层3用于分隔所述细胞培养流道和所述细胞培养孔并提供所述第一培养层和所述第二培养层的培养体系交互的通道。多孔隔膜层3的孔径比细胞尺寸小,避免第一培养层和第二培养层的培养区域细胞的移动串层。具体地,多孔隔膜层3的孔径为0.4um~3um。需要说明的是,多孔隔膜层3上孔的大小和密度可根据需要选择。
62.在一些实施例中,电极层4上设置有电极结构41,请参考图4,电极结构41采用两圈环形电极设计,使产生的电信号能够均匀分布在细胞共培养区域的同时不影响成像观察细胞。
63.电极结构41的一端设置于细胞培养流道21处;电极结构41与细胞培养流道21内的液体相接触;在进行跨膜电阻的测量的情况下,电极结构41与细胞培养孔11内插入的电极配合。
64.电极结构用于对细胞培养孔和流体孔内的细胞进行屏障结构跨膜阻抗测量。
65.在一些实施例中,电极结构41的电极材料可以为金和铂中的至少一种,在第二培养层2远离多孔隔膜层3的表面上形成有电极结构41的方式可以为金属溅射和金属蚀刻中的至少一种。
66.本技术通过将可插入式电极棒浸入第一培养层的细胞培养孔,同时将可插入式电极棒和电极层上设置的电极结构分别与电化学工作站相连,进而能够进行屏障结构跨膜电阻测量,为生理病理模型研究和药物评价提供有效的实验数据。其中,可插入式电极棒可采
用商品化同心轴电极,可插入式电极棒的上部电极材料可选用铂或金,可插入式电极棒的上部电极的直径小于第一培养层1的细胞培养孔11的直径。
67.在一些实施例中,细胞培养流道21用于静态培养或动态培养上皮或内皮屏障细胞构成的生物屏障细胞层;动态培养为基于目标对象的血液流动的参数设置细胞培养流道21内流体的参数;在动态培养时,流体孔21通过连接头(如鲁尔接头)和软管连接到蠕动泵或注射泵连接,蠕动泵或注射泵控制细胞培养流道21中溶液的流速。细胞培养流道21用于模拟血管中的血液流动。具体地,细胞培养流道21中流体的平均线速度范围为:1-3000微升/分钟。
68.在一些实施例中,细胞培养流道21尺寸形状作限定,可以为长直通道,也可以为宽度渐变通道,优选地,细胞培养流道21与两个流体孔12相连通的两端的尺寸与流体孔12的尺寸相同,细胞培养流道21从两端向中间的宽度逐渐变宽。具体地,细胞培养流道21的流道宽度可以为5-20mm,细胞培养流道21的流道长度可以为10-30mm,细胞培养流道21的流道高度可为0.1-5mm。
69.在一些实施例中,细胞培养流道21的流道宽度可以为5-15mm,细胞培养流道21的流道长度可以为10-20mm,细胞培养流道21的流道高度可为0.1-4mm。
70.在一些实施例中,细胞培养流道21的流道宽度可以为10-15mm,细胞培养流道21的流道长度可以为15-20mm,细胞培养流道21的流道高度可为1-4mm。
71.在一些实施例中,器官芯片中包括多个阵列排布的培养模块。需要说明的是,每个培养模块的尺寸相同,从而满足高通量的应用,进行高通量的细胞培养功能,高通量培养技术具有微量、快速、灵敏和准确等特点,可通过一次实验获得大量有价值的信息,便于使细胞培养的结果更准确可靠。
72.在本技术实施例中,本技术的器官芯片的尺寸与常规96孔板尺寸相同,则可直接将器官芯片放入酶标仪等仪器中进行直接读数,省掉转移的步骤,既方便又快捷。
73.在一些实施例中,第一培养层1和第二培养层2的材料为聚甲基丙烯酸甲酯、聚苯乙烯、聚二甲基硅氧烷和玻璃中的至少一种。需要说明的是,第一培养层1和第二培养层2的材料不限于所列举的材料。
74.在一些实施例中,器官芯片的加工方式为一体成型和分层加工中的至少一种;器官芯片的微加工方法包括玻璃内雕法、数控铣刻方法、激光刻蚀方法、化学腐蚀方法、软刻蚀方法、注塑成型、热压法、金属溅射和金属电镀中的至少一种。需要说明的是,芯片的形成方式不作限定,其中,一体成型的形成手段可以为激光刻蚀,也可以为一次性注塑,形成呈一体的培养体系。分层加工的形成手段具体为在各层上形成相应的细胞培养孔、流体孔和细胞培养流道,形成上下培养体系,将各层依次叠放,可以通过双面胶、超声、热键合、plasma和热压等封接工艺将各层芯片粘结组装到一起。示例性的,芯片键合的方式为涂胶键合,采用固态胶粘剂作为器官芯片的粘结剂,通过胶粘接加温与常温键合,使其三层键合在一起,最后得到一个结构完整的芯片,请参考图1、图3,图3为器官芯片键合前的分层结构示意图,图1为器官芯片三层键合后的结构示意图。在器官芯片键合工艺中,选择胶粘键合的方式,旨在使多孔隔膜层3与第一培养层1和第二培养层2更好贴合,避免出现漏液等问题。
75.在一个具体的实施例中,在器官芯片第一培养层1的细胞培养孔11内培养体外3d
肝脏模型,第二培养层2的细胞培养流道21培养小肠吸收模型,建立肠肝共培养模型,实现了可预测药物肠道吸收和肝脏毒性的体外模型的构建。
76.在另一个具体的实施例中,通过第一流体孔12向器官芯片的第二培养层2的细胞培养流道21通入包被液i型鼠尾胶原进行包被处理,然后通过第一流体孔12再向器官芯片的第二培养层2的细胞培养流道21加入脑微血管内皮细胞hcmec/d3,将器官芯片翻转倒置,第一培养层置于底部,第二培养层置于顶部,使刚加入的脑微血管内皮细胞hcmec/d3沉降在细胞培养流道21的上表面即多孔隔膜层3靠近细胞培养流道21的一侧,待脑微血管内皮细胞hcmec/d3贴附生长在多孔隔膜层3上后,将器官芯片再次翻转使正置,向第一培养层1的细胞培养孔11中加入星形胶质细胞,实现了芯片内脑微血管内皮细胞与星形胶质细胞的共培养,第一流体孔12和第二流体孔12接通蠕动泵,通入培养液进而实现细胞培养流道21内的培养基流动,实现动态共培养,构建血脑屏障模型。请参考图7,图7是本技术实施例提供的hcmec/d3细胞在芯片中培养至第3天的ve-cadherin表达的免疫荧光图像。需要说明的是,该图的比例尺为50微米,在血脑屏障器官芯片生理指标检测时,细胞是否紧密排列对模型构建至关重要,同时血管内皮细胞钙粘连蛋白(ve-cadherin)是血管内皮细胞(ec)之间粘着连接的关键分子。本技术对培养至第3天器官芯片模型的进行ve-cadherin免疫荧光表征,结果如图7所示,从图中可明显的看出器官芯片内脑微血管内皮细胞hcmec/d3紧密排列并且在细胞中检测到了ve-cadherin,说明本技术构建的血脑屏障模型具有可靠性。
77.对上述构建的血脑屏障模型进行屏障模型跨膜电阻测量:
78.将可插入式电极棒浸入第一培养层1的细胞培养孔11的液面下,将可插入式电极棒和第二培养层2的细胞培养流道21内的电极结构分别与电化学工作站相连,进行电化学阻抗谱(eis)测试,获得屏障模型的跨膜阻抗(teer),需要说明的是,阻抗技术用于测量跨膜阻抗,作为细胞屏障完整性和通透性的指标。该方法可用于实时监测芯片内的细胞屏障状态,量化屏障特性随时间的变化。图8是本技术实施例提供的器官芯片培养hcmec/d3细胞时的电化学阻抗谱结果示意图。将血脑屏障模型进行等效电路分析,需要说明的是,电化学阻抗谱的等效电路分析能够获得能够表征细胞屏障特性的电参数,例如介质电阻(r
medium
)、细胞的电容成分(c
cell
)和细胞电阻(r
cell
),能够了解模型屏障形成状态。图8为典型的eis结果,从图中可以看出,在高频(》10khz)下,阻抗幅度|z|保持不变,其与介质电阻有关,在低频(《10hz)下,阻抗幅度|z|由细胞电阻与介质电阻一起确定。将实验eis数据拟合到等效电路模型来估计由电流通过跨细胞通路引入的细胞电容分量以获得最佳拟合参数。
79.在一些实施例中,高通量器官芯片还包括移液工作站;移液工作站用于对第一培养层1进行加液、换液和采样处理;移液工作站的xyz三轴位移臂将可插入式电极棒浸入细胞培养孔11与电极结构41配合进行跨膜电阻的测量,请参考图6。
80.在一些实施例中,高通量器官芯片还包括电化学工作站;跨膜电阻的测量为采用电化学工作站的恒电流电化学阻抗谱测试模式,得到10hz至1mhz的频率下的阻抗谱,获得跨膜阻抗信息,测量过程持续约5-20秒。
81.另一方面,本技术还提供了一种高通量器官芯片的检测平台,请参考图4,图4是本技术实施例提供的一种高通量器官芯片与检测平台的结构示意图;一种高通量器官芯片的检测平台包括用于进行屏障结构跨膜电阻测量的机械臂,机械臂上设置有第一电极;还包括与上述高通量器官芯片的电极结构相匹配的第二电极,通过第一电极和第二电极能够实
现电化学阻抗谱测试和屏障结构跨膜阻抗测量。
82.另一方面,本技术还提供了一种高通量器官芯片的应用,根据上述的高通量器官芯片结构的应用,用于模拟预设生理环境结构。为生理病理模型研究和药物评价提供有效的实验数据。
83.由本技术实施例的上述方案可见,本技术提供的一种高通量器官芯片及其应用,具有如下技术效果:
84.本技术的器官芯片通过设置第一培养层为开放式培养层且第二培养层为封闭式培养层,通过开放式与封闭式培养体系结合,在器官芯片内实现血管-器官模型的构建;或者在器官芯片内培养至少两种器官细胞,构建多器官共培养模型,可以为大规模代谢类药物筛选、以及相关机理研究提供平台。
85.本技术通过将可插入式电极棒浸入第一培养层的细胞培养孔,同时将可插入式电极棒和电极层上设置的电极结构分别与电化学工作站相连,进而能够进行屏障结构跨膜电阻测量,为生理病理模型研究和药物评价提供有效的实验数据。
86.本技术的器官芯片通过开放式的第一培养层有利于与药物进行相互作用,高效地施加药物。本技术的器官芯片模拟了人体器官结构和功能,是微型化、自动化和可视化的工具,可为生理病理模型研究和药物评价提供有效的实验数据。
87.以上所述,仅为本技术的具体实施方式,但本技术的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本技术揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本技术的保护范围之内。因此,本技术的保护范围应所述以权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1