水稻OsUBC27基因或其编码的蛋白在提高水稻产量中的应用的制作方法
水稻osubc27基因或其编码的蛋白在提高水稻产量中的应用
技术领域
1.本发明涉及生物工程技术领域,具体涉及水稻osubc27基因或其编码的蛋白在提高水稻产量中的应用。
背景技术:
2.水稻是世界上重要的粮食作物,随着人口的不断增长,如何提高水稻产量,保障粮食安全,已经成重要的科学问题。影响水稻产量的因素有很多,如分蘖数、单穗粒数和粒重等内在遗传因素;以及包括光照、温度、水分和盐度等非生物胁迫和病害、虫害生物胁迫在内的环境因素;另外,人为的栽培管理、施肥模式以及病虫害防治方法等也对水稻产量起着重要的作用。
3.植物泛素/蛋白酶体系是细胞内蛋白质降解的主要途径,在植物的生长发育、形态构建和抗逆、抗病等过程中起重要作用(hershko,2005,the ubiquitin system for protein degradation and some of its roles in the control of the cell-division cycle(nobel lecture).angewandte chemie international edition,44(37):5932-5943.)。该系统由泛素激活酶e1、泛素结合酶e2、泛素连接酶e3、蛋白酶体和去泛素化酶(dubs)组成。泛素结合酶e2s(ubcs)催化泛素向底物或e3连接酶的转移,是靶蛋白泛素化修饰的关键酶。然而,水稻(oryza sativa l.)作为世界第一大主粮和植物学研究的模式植物之一,对水稻ubc基因家族基因的研究却很少。目前已经在水稻中鉴定到48个ubc家族基因(osubc1-48)。泛素化在植物的生物和非生物胁迫响应过程中扮演了重要角色([1]dielen,badaoui et al.2010,the ubiquitin/26s proteasome system in plant-pathogen interactions:a never-ending hide-and-seek game.mol plant pathol,11(2):293-308.[2]marino,peeters et a1.2012,ubiquitination during plant immune signaling.plant physiol,160(1):15-27.),在拟南芥中过表达基因atubc32使植株对盐胁迫的响应敏感度下降(cui,liu et al.2012,arabidopsis ubiquitin conjugase ubc32 is an erad component that functions in brassinosteroid-mediated salt stress tolerance.plant cell,24(1):233-244.),在拟南芥中过表达绿豆基因vrubc1,表现对aba和渗透胁迫的高敏感反应,增强了aba或盐诱导的气孔关闭,提高了抗旱性(chung,cho et al.2013,overexpression of vrubc1,a mung bean e2 ubiquitin-conjugating enzyme,enhances osmotic stress tolerance in arabidopsis.plos one,8(6):e66056.),野生稻中的基因ogubc在拟南芥中异位表达,能够增强植株对灰葡萄孢及紫外线uv-b辐射的抗性(jeon,pak et al.2012,ectopic expression of ubiquitin-conjugating enzyme gene from wild rice,ogubc1,confers resistance against uv-b radiation and botrytis infection in arabidopsis thaliana.biochem biophys res commun,427(2):309-314.)。
[0004]
虽然已经报道了几种植物ubcs的作用,但是我们对大多数这些酶的生物学功能的理解仍然非常有限,对于水稻等粮食作物的ubcs功能的了解尤其缺乏。另外,水稻osubc27
基因或其编码的osubc27蛋白在提高水稻产量中的应用未见报道。
技术实现要素:
[0005]
本技术提供了水稻osubc27基因或其编码的蛋白在提高水稻产量中的应用。水稻osubc27基因,其核苷酸序列如seq id no.1所示。将构建的植物过表达载体pcubi1390-osubc27在野生型日本晴中进行表达,发现转基因植株分蘖数比野生型植株明显增多,稻谷谷粒粒长和千粒重比野生型植株的相对应指标有所增加。可见,本发明所述的水稻osubc27基因是一个潜在的可作为基因工程提高水稻产量的靶点,具有重要的应用价值。
[0006]
具体的技术方案如下:
[0007]
本发明提供了水稻osubc27基因或其编码的蛋白在提高水稻产量中的应用。
[0008]
本发明提供了水稻osubc27基因或其编码的蛋白在选育分蘖数增加的水稻品种中的应用。
[0009]
本发明提供了水稻osubc27基因或其编码的蛋白在调控水稻谷粒粒长和粒重中的应用。
[0010]
所述osubc27基因的碱基序列如seq id no.1所示,osubc27基因编码的蛋白的氨基酸序列如seq id no.2所示。
[0011]
本发明提供了一种提高水稻产量的方法,在水稻作物中过表达osubc27基因,所述osubc27基因的碱基序列如seq id no.1所示。
[0012]
具体的,包括以下步骤:
[0013]
(1)构建过表达osubc27基因载体;
[0014]
(2)构建将步骤(1)过表达osubc27基因载体导入水稻的细胞中将碱基序列如seq id no.1所示的osubc27基因过表达,培养后获得转基因植株。
[0015]
优选的,所述植物表达载体为pcubi1390。
[0016]
转化受体植物时,可采用农杆菌介导转化的方法,所述的农杆菌具体可以为农杆菌eha105菌株,步骤(2)将基因过表达载体转入农杆菌后,侵染水稻的细胞。
[0017]
所述受体植物为水稻。所述水稻的品种可以为粳稻日本晴(nipponbare),但不仅限于日本晴。
[0018]
利用所述的基因过表达对水稻进行遗传转化,经测试发现,osubc27基因过表达能够导致分蘖数增加。
[0019]
优选的,农杆菌侵染的细胞来源为水稻种子诱导的愈伤组织。除了水稻种子诱导的愈伤组织,也包括水稻植株上取得的组织样品诱导的愈伤组织,或者是其他在转基因后能够培育出植株的方式也可以。
[0020]
本发明具备的有益效果:
[0021]
本发明通过在水稻中过表达osubc27基因,转基因植株的分蘖数比野生型植株明显增多,与野生型植株相比,稻谷谷粒粒长和千粒重增加。
附图说明
[0022]
图1为转基因株系中基因osubc27表达量qrt-pcr鉴定图;其中,m为蛋白maker,1,2,3分别为转基因株系,4为日本晴野生型株系,5为pcubi1390质粒。
[0023]
图2为转基因植株潮霉素pcr鉴定图。
[0024]
图3为osubc27基因在水稻不同组织中的表达谱图。
[0025]
图4为osubc27基因的亚细胞定位图。
[0026]
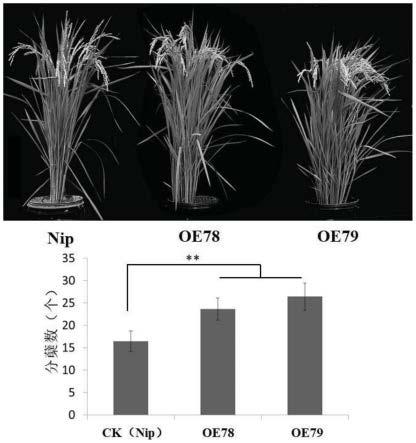
图5为osubc27基因过表达株系分蘖数统计图;其中,**代表p<0.01。
[0027]
图6为osubc27基因过表达株系粒长和千粒重统计图。
具体实施方式
[0028]
实施例1
[0029]
水稻osubc27基因的克隆和转化。
[0030]
提取水稻幼嫩叶片的rna,并用mlv反转录试剂(takara)进行逆转录反转录成cdna备用。
[0031]
使用nucleozol试剂盒(macherey-nagel,germany)提取总rna,具体步骤如下:
[0032]
(1)取100mg叶片放入2ml灭菌离心管中,管中各加入1个小钢珠,迅速将样品放入液氮中,用打样机将叶片组织打碎;
[0033]
(2)加入1mlnucleozol提取液,混匀后,每1mlnucleozol提取液中加入400μl rnase-free水,以裂解叶片,用力震荡15s,室温下孵育5-15分钟;
[0034]
(3)室温条件下,12000rpm,样品离心15分钟;
[0035]
(4)转移1ml上清液至新的2ml离心管中;
[0036]
(5)每1ml的上清液加入1ml异丙醇以沉淀rna,室温下孵育10分钟,然后12000rpm样品离心10分钟,弃上清;
[0037]
(6)加入500μl的75%乙醇(v/v)洗涤rna,6000rpm离心2-3分钟,用移液枪吸走乙醇,重复乙醇洗涤一次,可在通风橱里静置吹风,去除残留乙醇;
[0038]
(7)加入30μl rnase-free水溶解rna,室温涡旋震荡3分钟提高溶解效率。
[0039]
根据水稻基因数据库(https://www.ricedata.cn/gene/)网站提供的基因osubc27(搜索号为loc_os01g16650.1)序列信息设计引物:
[0040]
ubc27-cds-f:5
′‑
ttacttctgcactaggtaccatggcgaggggcgagaacaa-3
′
;
[0041]
ubc27-cds-r:5
′‑
gaattcccggggatccctacgcggtgggcttgtagagc-3
′
;
[0042]
以水稻“日本晴”的叶cdna为模板进行pcr扩增。用infusion法将完整的orf(开放阅读框)通过同源重组构建到经kpni酶切后线性化载体pcubi1390上,转化大肠杆菌dh5α感受态,涂布于含有100μg/ml的卡那霉素抗性的lb固体培养基上,37℃培养12-16h后挑单克隆,菌落pcr检测阳性的克隆送测序验证,验证正确的载体克隆命名为pcubi1390-osubc27,即为基因osubc27的表达载体。将pcubi1390-osubc27转化根癌农杆菌eha105感受态,得到pcubi1390-osubc27农杆菌菌液。
[0043]
农杆菌转化法构建基因osubc27过表达株系。
[0044]
为获得基因osubc27的过表达材料,采用农杆菌介导的遗传转化方法转化。具体操作步骤如下:
[0045]
(1)愈伤诱导:挑选成熟饱满的种子20g左右,脱壳精选(无病菌与黑斑)。精选后的种子再经一系列消毒与清洗(于超净台中,依次用75%乙醇(v/v)处理1min,灭菌水洗5次,50%巴氏消毒液(v/v)浸泡30min,再用灭菌水清洗至无泡沫为止)。除菌后的种子置于无菌
滤纸上在超净台中吹干表面水分(约4h)。再将种子铺于诱导培养基上(n6d培养基),置于28℃黑暗培养一个月,进行愈伤组织培养;
[0046]
(2)农杆菌侵染:将约300μl复苏的农杆菌菌液(含pcubi1390-osubc27)加入含50mg/l乙酰丁香酮的150mlaam培养基中,28℃培养至od
600
约为0.1,然后侵染新鲜愈伤组织,将愈伤组织放入农杆菌菌液中浸泡30-60s,取出愈伤组织用无菌去离子水清晰8-10次,侵染后共培养3天(n6d-as培养基,密封,28℃黑暗培养);
[0047]
(3)抗性愈伤筛选:将上述愈伤组织用含400mg/l羧苄青霉素灭菌水清洗8次左右后,将愈伤组织铺于灭菌的滤纸上,沥干表面水分;最后将愈伤组织铺在含400mg/l羧苄青霉素和50mg/l潮霉素b的n6d固体培养基上;
[0048]
(4)分化与生根:将抗性愈伤组织(抗性组织颜色呈黄色)转移到含50mg/l潮霉素b和250mg/l羧苄青霉素分化培养基上;将分化培养基上长出约5cm的小苗转移到含50mg/l潮霉素b和200mg/l羧苄青霉素的生根培养基上;以上操作均在无菌操作台中进行;
[0049]
(5)转基因检测:对获得的转基苗进行检测。osubc27基因过表达株系用潮霉素引物进行pcr检测,引物信息如下:
[0050]
hygf:5
′‑
gtgcttgacattggggagtt-3
′
;
[0051]
hygr:5
′‑
gatgttggcgacctcgtatt-3
′
;
[0052]
结果表明,随机选取的3株转基因植株其潮霉素鉴定为阳性,初步说明pcubi1390-osubc27过表达载体已经成功转入水稻植株中(如图1所示)。
[0053]
实施例2
[0054]
过表达株系的osubc27基因表达量鉴定。
[0055]
收集潮霉素阳性转基因t0代水稻植株的种子,于2021年5-10月进行田间种植t2代株系,待水稻分蘖期选取幼嫩叶片提取总rna,反转录成cdna进行qrt-pcr(步骤同实施例1)。以水稻组成型表达基因actin为内参,引物序列如下:
[0056]
actinf:gaaatggagactgccaagacc;
[0057]
actinr:ttggcaatccacatctgctg;
[0058]
采用ubc27-cds-f和ubc27-cds-r引物检测osubc27基因在不同t2代水稻株系中的表达情况。结果表明,t2代转基因株系中编号为oe78和oe79的转基因株系osubc27基因的表达量显著高于野生型株系中osubc27基因的表达量,株系oe78和oe79为osubc27基因过表达株系(如图2所示)。
[0059]
实施例3
[0060]
osubc27在水稻不同器官中的表达特征。
[0061]
提取水稻根(35天)、茎(35天)、叶(35天)、穗(5-8em)、种子(12天)的rna,反转录成cdna进行qrt-pcr分析,步骤同实施例1。以水稻组成型表达基因actin为内参,采用ubc27-cds-f和ubc27-cds-r引物对来自不同水稻组织的cdna模板进行扩增,检测osubc27基因在不同组织中的表达情况。结果表明osubc27基因在根和穗中的表达量相当,高于在茎、叶和种子中的表达量(如图3所示)。
[0062]
实施例4
[0063]
基因osubc27的亚细胞定位。
[0064]
以水稻叶cdna为模板,用引物ubc27-cds-f和ubc27-cds-r扩增完整的osubc27基
因编码序列。用infusion法,将扩增纯化后的目标片段连接到线性化的pcambia1302(购自优宝生物,商品编号vt1843)载体上,经一系列连接转化、质粒提取和测序,最终获得含目的基因(基因osubc27)与gfp融合的编码基因的克隆载体。然后将该载体转入烟草中进行观察,具体操作步骤如下:
[0065]
(1)将上述构建好的基因osubc27融合gfp的编码基因载体转入农杆菌eha105菌株中,于lb固体培养基含利福平50μg/ml和卡那霉素50μg/ml,28℃培养40h;挑选单克隆于20ml lb液体培养基中含利福平50μg/ml和卡那霉素50μg/ml,置于摇床过夜培养(200rpm,28℃);
[0066]
(2)离心收集菌体(8000rpm,2min),用5ml侵染缓冲液(0.2mm mes,10mm mgcl2,10mm mes)重悬菌体2次,最后菌体细胞悬浮于2ml侵染缓冲液中,28℃黑暗静置3h以上;用去除针头的注射器吸取浸染液从烟草叶片下表皮轻轻按压注射。25℃光照培养箱中继续培养48h;
[0067]
(3)同时按照实施例1中的方法,将含空载pcambia1302的农杆菌侵染烟草叶片;
[0068]
(4)用剪刀剪下被农杆菌侵染过的叶片,用激光共聚焦显微镜观察gfp信号(zeiss-lsm700,488nm激发光,25倍水镜);
[0069]
结果显示:转入空载体质粒的烟草细胞的细胞核和细胞质膜上都有荧光信号分布,osubc27::gfp融合蛋白也分布于细胞核和细胞质膜中,表明基因osubc27可能细胞核质膜中发挥功能(如图4所示)。
[0070]
实施例5
[0071]
表型性状考察。
[0072]
将t2代转基因株系于5-10月份种植在大田环境中,常规日照和水肥管理。生长到分蘖盛期选取较野生型相比基因osubc27表达量明显升高的株系和野生型植株各10株,统计分蘖数(如图5所示)。至成熟期,收集野生型日本晴植株和基因osubc27过表达株系各10株,统计粒长和千粒重(如图6所示)。结果显示,过表达基因osubc27株系的分蘖数比野生型株系明显增多,谷粒粒长和千粒重也较野生型植株相对应指标有所增加。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1