一种利用微藻光合自养去除氨氮联产高直链淀粉的方法
1.本发明属于微藻技术领域,具体涉及一种利用微藻去除氨氮联产高直链淀粉的方法。
背景技术:
2.水体中氨氮含量是检验水体能否合格排放至外部环境的重要指标之一,主要原因是含氨氮废水的直接排放会引起水体富营养化污染,导致水体缺氧并进一步影响水生生物的生长,高浓度氨氮还会引起水体富营养化,与鱼类血红蛋白结合造成其窒息甚至死亡。常用的传统生物法对水体氨氮的除去效率较低,处理后产生大量活性污泥且商业价值极低。面对传统处理方法的低效率、高耗能、高成本,使用细菌的生物修复一直被认为是一种更好的方法,因为它更便宜,更环保,并导致有毒化合物的完全矿化。尽管使用细菌取得了良好的效果,但降解后产生的生物质目前没有任何商业价值。此外,大多数有效细菌都是致病的,且生长条件要求也相对苛刻。
3.微藻作为一种分布广泛的光合生物,能够通过光合作用将co2和太阳光转化成生物质并释放氧气,具有生长迅速,光合效率高、适应性强、不与粮争地、易于人工控制、后续附加值高等优点。同时,微藻可以利用氨氮作为氮源生长,每吸收1mg氨氮可以固定1.31~2.41mgco2,是缓解温室效应、实现碳中和的有效途径之一。然而,目前利用微藻吸收氨氮效率较低,光合自养下氨氮吸收速率在12.0-55.0mg/l/day,其主要问题在于氨氮吸收过程释放氢离子,导致ph急剧下降,致使微藻光合活性和生理代谢受到抑制,氨氮吸收过程也受到影响。目前控制培养液ph的方法为在线监测并实时添加酸碱,然而这需要额外配置复杂的ph监控装置,增加操作成本,且对于大量含氨氮废水的处理较困难。因此需要开发原位ph自控缓冲体系。传统的生物ph缓冲体系主要基于有机离子型缓冲剂,如三羟甲基氨基甲烷(tris)、 3-马啉丙磺酸(mops)、4-羟乙基哌嗪乙磺酸(hepes)等。这些缓冲试剂的添加不仅价格昂贵,而且会增加培养体系化学需氧量(cod),造成二次污染,不适用于实际废水体系氨氮的去除。因此,开发新型高效低成本无污染缓冲体系,是提高微藻氨氮吸收效率的重要途径。
4.直链淀粉是d-葡萄糖基以α-(1,4)糖苷键连接的多糖链,分子中有200个左右葡萄糖基,分子量在1
×
105~2
×
105,空间构象卷曲成螺旋形,每一回转为6个葡萄糖基。由于直链淀粉具有这样的空间结构,其分子间容易结合形成氢键,使淀粉糊易发生凝沉,同时具有抗剪切力强、成膜性能好的特点。高直链淀粉是指直链淀粉占总淀粉含量高于50%的淀粉,其保留了直链淀粉所具有的特性,可广泛应用于生物医用材料、特需医药食品等方面。高等植物(如玉米、大麦、马铃薯、小麦、水稻等)淀粉成分主要以支链淀粉为主,直链淀粉含量占总淀粉含量不超过40%。利用基因工程结合杂交技术选育高直链淀粉的农作物是目前常用的高直链淀粉种质选育方法,但其存在周期长、遗传不稳定、产量低等问题,导致目前我国高直链淀粉来源仍然长期受限。目前,国内年直链淀粉消费量约200万吨,由于高直链淀粉玉米相关种植资源不足,大多数从美国直接进口,价格是普通淀粉的16倍。此外,传统农作
物作为工业和医药用途的直链淀粉原料来源存在与人争粮、与粮争地的问题。因此,开发不依赖于粮食作物的高直链淀粉新来源,以提升其生产能力,将可能在较短时间内满足国内日益增长的市场需求,缓解未来粮食危机,具有良好的经济效益和社会效益。
5.某些微藻(如亚心形四爿藻)在胁迫条件下(如高光、低营养等)可以积累大量淀粉,且其培养不与粮争地,可与氨氮等废水处理过程耦合,易于人工控制,是生产非粮淀粉的理想途径。利用微藻生产高直链淀粉,不仅可以解决高直链淀粉生产使用依赖进口的问题,且养殖微藻不占用耕地,此举具有重要的经济和社会意义。然而,微藻淀粉与高等植物类似,其成分以支链淀粉为主,且现有微藻生产高直链淀粉产率及含量过低,不能满足社会对高直链淀粉的消耗需求。因此需要开发新的调控技术,实现微藻高直链淀粉积累并提高其生产效率。
技术实现要素:
6.鉴于上述不足,本发明提供了一种如何利用原位ph自控缓冲体系维持微藻光合活性和固碳能力,使其高效去除氨氮,同时联产具有高附加值的高直链淀粉的方法。
7.本发明是通过如下技术方案实现的:
8.在含氨氮的营养盐水体中,通入富含co2的空气并添加碳酸盐或碳酸氢盐,维持适宜ph 和光合活性,使微藻光合固碳吸收氨氮并积累高直链淀粉,在氨氮吸收完全并产生高直链淀粉后收获藻细胞。
9.进一步地,所述含氨氮营养盐水体组成包括:
10.nh
4+-n:10~100mg/l。
11.进一步地,所述含氨氮营养盐水体组成还包括:
12.po
43-:4~178mg/l;fe
3+
:0.33~0.98mg/l;edta
·
2na:2.18~6.54mg/l;
13.cu
2+
:1.95~5.84μg/l;moo
42-:2.45~7.34μg/l;zn
2+
:4.42~13.28μg/l;
14.co
2+
:1.24~3.72μg/l;mn
2+
:30.46~91.38μg/l;na
+
:7.37~12.33g/l;
15.cl-:13.29~24.31g/l;hco
3-:63.18~189.54mg/l;mg
2+
:0.53~1.59g/l;
16.ca
2+
:0.19~0.57g/l;k
+
:94.19~310.31mg/l;br-:28.91~92.10mg/l;
17.bo
33-:11.42~32.35mg/l。
18.进一步地,所述微藻为四爿藻(tetraselmis)。
19.进一步地,所述碳酸盐包括:碳酸镁和/或碳酸钙以及富含碳酸镁和/或碳酸钙的物质。
20.进一步地,所述碳酸氢盐包括:碳酸氢钠以及富含碳酸氢钠的物质。
21.进一步地,所述co2所占空气体积含量的1%~5%。
22.进一步地,所述碳酸盐或碳酸氢盐的添加量为10~90mm。
23.进一步地,所述添加碳酸盐或碳酸氢盐的时机为接种后的0~4天;收获时间为添加碳酸盐或碳酸氢盐后5~8天。
24.本发明还公开了一种根据上述任一方法获得的高直链淀粉。
25.与现有技术相比,本发明具有以下有益效果:
26.1、co
2-碳酸盐/碳酸氢盐缓冲体系实现了微藻培养的原位ph自控,不需要额外配置复杂的ph监控装置,操作简便,成本低廉,可以大规模处理含氨氮废水;该体系氨氮去除
速率快,在氨氮浓度小于100mg/l时,最高可达57mg/l/day,高于目前文献报道微藻光合自养氨氮去除速率,氨氮去除率在48h内可达100%。
27.2、利用co
2-碳酸盐/碳酸氢盐缓冲体系培养微藻积累淀粉,其直链支链比(am/a
p
)大于 1,实现了微藻高直链淀粉调控;直链淀粉浓度可达到0.36-0.48g/l,占细胞干重的 10.13-18.89%,是现有文献报道(7.3%)的1.6倍;在保证得到高直链淀粉的同时,总淀粉含量最高可达到细胞干重的37.50%,总淀粉浓度最高为0.96g/l,与现有微藻生产高直链淀粉相比,可提高40%;可通过调节碳酸盐的浓度和收获时间控制am/a
p
,实现不同等级的高直链淀粉定向生产,最高可获得几乎完全由直链淀粉组成的微藻淀粉(无法检测出支链淀粉)。
28.3、本发明采用微藻光自养的培养方式,co
2-碳酸盐/碳酸氢盐缓冲体系可作为碳源,每吸收1mg氨氮可以固定1.31~2.41mg co2,能够缓解温室效应。
29.4、本发明中培养微藻吸收氨氮并积累高直链淀粉的方法简便易操作,且不受自然天气影响,可连续生产、质量可控稳定,适合于精确设计的工业化生产,同时解决了传统农作物作为工业和医药用途的高直链淀粉原料来源存在与人争粮、与粮争地的问题,具有良好的经济效益和社会效益。
附图说明
30.图1为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm caco3作为缓冲体系的干重(dw)随培养时间变化比较。
31.图2为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm caco3作为缓冲体系的光合效率(fv/fm)随培养时间变化比较。
32.图3为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm caco3作为缓冲体系的ph随培养时间变化比较。
33.图4为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm caco3作为缓冲体系的氨氮浓度随培养时间变化比较。
34.图5为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm caco3作为缓冲体系的淀粉直链支链比(am/a
p
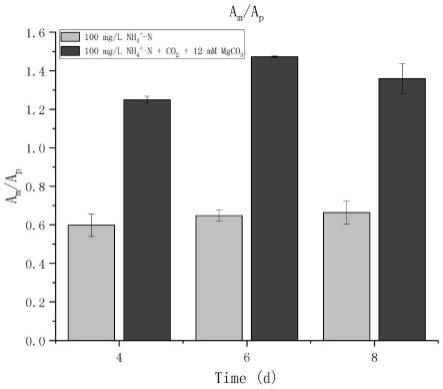
)随培养时间变化比较。
35.图6为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm caco3作为缓冲体系的总淀粉含量随培养时间变化比较。
36.图7为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm caco3作为缓冲体系的总淀粉浓度随培养时间变化比较。
37.图8为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm mgco3作为缓冲体系的干重(dw)随培养时间变化比较。
38.图9为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm mgco3作为缓冲体系的光合效率(fv/fm)随培养时间变化比较。
39.图10为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm mgco3作为缓冲体系的ph随培养时间变化比较。
40.图11为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm mgco3作为缓冲体系的氨氮浓度随培养时间变化比较。
41.图12为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm mgco3作为缓冲体系的淀粉直链支链比(am/a
p
)随培养时间变化比较。
42.图13为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm mgco3作为缓冲体系的总淀粉含量随培养时间变化比较。
43.图14为本发明在100mg/l氨氮浓度下,亚心形四爿藻对照及利用co
2-12mm mgco3作为缓冲体系的总淀粉浓度随培养时间变化比较。
44.图15为本发明在10mg/l氨氮浓度下,亚心形四爿藻对照及co
2-10~90mm caco3作为缓冲体系的光合效率(fv/fm)随培养时间变化比较。
45.图16为本发明在10mg/l氨氮浓度下,亚心形四爿藻对照及co
2-10~90mm caco3作为缓冲体系的ph随培养时间变化比较。
46.图17为本发明在10mg/l氨氮浓度下,亚心形四爿藻对照及co
2-10~90mm caco3作为缓冲体系的氨氮浓度随培养时间变化比较。
47.图18为本发明在100mg/l氨氮添加12mm碳酸氢钠(对照组)的基础条件下,高浓度(48mm)碳酸氢钠不同添加时机(0-4天)的亚心形四爿藻干重(dw)随培养时间变化。
48.图19为本发明在100mg/l氨氮添加12mm碳酸氢钠(对照组)的基础条件下,高浓度(48mm)碳酸氢钠不同添加时机(0-4天)的亚心形四爿藻光合效率(fv/fm)随培养时间变化比较。
49.图20为本发明在100mg/l氨氮添加12mm碳酸氢钠(对照组)的基础条件下,高浓度(48mm)碳酸氢钠不同添加时机(0-4天)的亚心形四爿藻培养体系ph随培养时间变化比较。
50.图21为本发明在100mg/l氨氮添加12mm碳酸氢钠(对照组)的基础条件下,高浓度(48mm)碳酸氢钠不同添加时机(0-4天)的亚心形四爿藻培养液中氨氮浓度随培养时间变化比较。
51.图22为本发明在100mg/l氨氮添加12mm碳酸氢钠(对照组)的基础条件下,高浓度(48mm)碳酸氢钠不同添加时机(0-4天)的亚心形四爿藻淀粉直链支链比(am/a
p
)随培养时间变化比较。
52.图23为本发明在100mg/l氨氮添加12mm碳酸氢钠(对照组)的基础条件下,高浓度(48mm)碳酸氢钠不同添加时机(0-4天)的亚心形四爿藻总淀粉含量随培养时间变化比较。
53.图24为本发明在100mg/l氨氮添加12mm碳酸氢钠(对照组)的基础条件下,高浓度(48mm)碳酸氢钠不同添加时机(0-4天)的亚心形四爿藻总淀粉浓度随培养时间变化比较。
具体实施方式
54.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为从商业渠道购买得到的。
55.本发明以亚心形四爿藻(tetraselmis subcordiformis)为实验材料,在光生物反应装置中,利用气体中的co2及添加营养盐的培养方式,连续光照,并外加碳酸盐或碳酸氢盐与通气中的co2形成缓冲体系,维持ph使光合活性维持并促进微藻吸收氨氮,同时积累高直链淀粉。气源为空气压缩机和co2气瓶,其流量通过管路上设置的气体减压阀和气体流量计控制;由气压缩机产生的空气与来自于气瓶的co2经过流量调节达到所需co2浓度后导入反应器。
56.实施例1
57.在氨氮浓度100mg/l条件下,利用co
2-碳酸钙缓冲体系促进亚心形四爿藻(tetraselmissubcordiformis)光合作用吸收氨氮并积累高直链淀粉。
58.(1)藻细胞种子液的获得
59.人工海水的配制:nacl 27g/l,nahco
3 0.04g/l,mgso4·
7h2o 6.8g/l,mgcl2·
6h2o 5.6 g/l,cacl2·
2h2o 1.5g/l。
60.藻细胞种子培养液的配制:向上述人工海水中加入tris 0.81g/l,乙酸0.33ml/l,kno
3 1.113g/l,kh2po
4 0.067g/l,fecl3·
6h2o 1.3mg/l,mncl2·
4h2o 0.36mg/l,h3bo
3 33.6mg/l, edta-na
2 45.0mg/l,zncl
2 0.21mg/l,cocl2·
6h2o 0.20mg/l,(nh4)4mo7o
24
·
4h2o 0.09mg/l, cucl2·
2h2o 0.14mg/l。110℃高压蒸汽灭菌15min,冷却后备用。
61.藻细胞种子液的培养:挑取平板分离纯化的亚心形四爿藻(tetraselmis subcordiformis) 单藻落,接入藻细胞种子培养液中,在摇瓶中逐级放大培养,培养条件为:温度25℃,连续光照强度为140μmol e
·
m-2
·
s-1
,静置培养,每天手工摇动3次以上。
62.(2)光生物反应装置培养
63.替换上述藻细胞种子培养液中氮源kno3为nh4cl,并剔除藻细胞种子培养液中有机碳源tris及乙酸后,设置不添加/添加12mm caco3两个培养条件,每个条件设置2个平行。所有培养液配制完成后,110℃高压蒸汽灭菌15min,冷却后备用。
64.配制完成的两种培养液组成如下:
65.100mg/l氨氮培养液组成为:nacl 27g/l,nahco30.04 g/l,mgso4·
7h2o 6.8g/l, mgcl2·
6h2o 5.6g/l,cacl2·
2h2o 1.5g/l,nh4cl 0.382g/l,kh2po
4 0.067g/l,fecl3·
6h2o 1.3 mg/l,mncl2·
4h2o 0.36mg/l,h3bo
3 33.6mg/l,edta-na
2 45.0mg/l,zncl
2 0.21mg/l, cocl2·
6h2o 0.20mg/l,(nh4)4mo7o
24
·
4h2o 0.09mg/l,cucl2·
2h2o 0.14mg/l。
66.100mg/l氨氮外加1.2g/l caco3培养液组成为:caco
3 1g/l,nacl 27g/l,nahco
3 0.04g/l,mgso4·
7h2o 6.8g/l,mgcl2·
6h2o 5.6g/l,cacl2·
2h2o 1.5g/l,nh4cl 0.382g/l, kh2po
4 0.067g/l,fecl3·
6h2o 1.3mg/l,mncl2·
4h2o 0.36mg/l,h3bo
3 33.6mg/l,edta-na
2 45.0mg/l,zncl
2 0.21mg/l,cocl2·
6h2o 0.20mg/l,(nh4)4mo7o
24
·
4h2o 0.09mg/l, cucl2·
2h2o 0.14mg/l。
67.藻细胞的培养:藻细胞种子液通过离心收获藻泥,并用人工海水洗涤三次。分别用上述 100mg/l氨氮培养液、100mg/l氨氮外加12mm caco3培养液重悬藻泥,随后接入121℃高压蒸汽灭菌20min后的反应器内。采用光生物反应装置进行培养,细胞接种时初始od
750
为0.6,温度25℃,140μmol e
·
m-2
·
s-1
光强连续光照,通入空气流量0.25vvm,co2含量2%。
68.(3)细胞干重的测定
69.藻液样品摇匀通过玻璃超细纤维过滤器(gf/c,whatman,uk)过滤,并在60℃下烘干至恒重,icp测定样品分离藻细胞后得到的上清液中的钙镁离子,计算未溶解的碳酸钙/碳酸镁,校正细胞干重。
70.(4)光合效率的测定
71.利用叶绿素荧光仪os30p((opti-sciences.usa)测定最大光量子产率fv/fm,以表征微藻光合效率。
72.(5)氨氮的测定
73.每日取样后,部分藻液4000r/min离心去掉藻细胞,保藏上清液。利用靛酚蓝比色法测定微藻培养液中氨氮浓度。
74.(6)淀粉的提取及测定
75.利用45%hclo4高氯酸提取淀粉,利用hovenkamp-hermelink等人的方法测定直链和支链淀粉含量。
76.从图1、图2和图3可知,在100mg/l氨氮浓度下,不同体系中微藻细胞生长状态差异较大。无co2通入和碳酸钙添加时(对照组),亚心形四爿藻生长受到明显抑制,干重积累低,ph在三日内降至3.56;fv/fm持续下降,最大干重出现在培养第三日,仅为1.2
±
0.1 g/l。在通入co2并外加12mm caco3条件下(实验组一),微藻生长状态良好,体系ph 稳定在7附近,干重不断积累,fv/fm在培养前四日处于高水平稳态期,最大干重出现在培养第六日,可达2.7
±
0.2g/l,是对照组最大干重的234.2%。由图4可知,对照组微藻细胞在培养第三日仅吸收了37.6
±
0.6mg氨氮,实验组一细胞则在培养第三日对氨氮吸收完全,是对照组细胞吸收氨氮含量的247.4%。此结果表明,在100mg/l氨氮浓度下,co
2-caco3体系可以维持微藻适宜ph和正常光合活性,使微藻细胞正常生长积累生物质,并促进微藻对氨氮类氮源的吸收,在72h内氨氮去除率达100%,氨氮去除速率最大可达52mg/l/day。
77.由图5可以看出,在培养第4、6、8日,实验组一微藻细胞所产淀粉am/a
p
明显高于对照组的am/a
p
(0.6),且am/a
p
>1.0,为高直链淀粉。从图6和图7可知,实验组一微藻细胞从第四日开始淀粉积累,至培养第六日可达最高淀粉浓度,为1.0
±
0.0g/l,最高可占干重的35.5%,对照组最高淀粉积累浓度出现在培养第四日,为0.3
±
0.0g/l,占干重的29.6%。对比可知实验组一所产淀粉浓度较对照组提高了220.4%,淀粉含量较对照组提高了20.0%。即说明在100mg/l氨氮浓度co
2-caco3体系下,可获得高直链淀粉,其最高淀粉浓度和含量均有较大提升。
78.实施例2
79.在氨氮浓度100mg/l条件下,利用co
2-碳酸镁缓冲体系促进亚心形四爿藻(tetraselmissubcordiformis)光合作用吸收氨氮并积累高直链淀粉。
80.将实施例1中12mm caco3条件改为12mm mgco3,其余同实施例1。
81.从图8、图9和图10可知,在100mg/l氨氮浓度下,不同体系中微藻细胞生长状态差异较大。无co2通入和碳酸镁添加时(对照组),亚心形四爿藻生长受到明显抑制,干重积累低,ph在三日内降至3.56;fv/fm持续下降,最大日干重出现在培养第三日,仅为1.2
ꢀ±
0.1g/l。在通入co2并外加12mm mgco3条件下(实验组二),微藻生长状态良好,ph 稳定在7.2附近,干重不断积累,fv/fm在培养前四日处于逐步增长期,在第四日达到最高为 0.769,最大日干重出现在培养第六日,可达3.2
±
0.1g/l,是对照组最大干重的286.3%。由图11可知,对照组微藻细胞在培养第三日则仅吸收了37.6
±
0.6mg氨氮,实验组二细胞则在培养第二日对氨氮吸收完全,是对照组细胞吸收氨氮含量的255.6%。此结果表明,在100 mg/l氨氮浓度下,co
2-mgco3体系可以维持微藻适宜ph和正常光合活性,使微藻细胞正常生长积累生物质,并促进微藻对氨氮类氮源的吸收,在48h内氨氮去除率达100%,氨氮去除速率最大可达54mg/l/day。
82.由图12可以看出,在培养第4、6、8日,实验组二微藻细胞所产淀粉am/a
p
比值明显高于对照组的am/a
p
(0.6),且am/a
p
>1.2,为高直链淀粉。从图13和图14可知,实验组二微藻细
胞从第四日开始进行淀粉积累,至培养第六日可达最高淀粉浓度,为0.5
±
0.0g/l,最高可占干重的14.5%,即说明在100mg/l氨氮浓度co
2-mgco3体系下,也可获得高直链淀粉。
83.实施例3
84.在氨氮浓度10mg/l条件下,利用co
2-碳酸钙缓冲体系促进亚心形四爿藻(tetraselmissubcordiformis)光合作用吸收氨氮并积累不同等级的高直链淀粉。
85.将实施例1中的氨氮浓度调整为10mg/l,并设置不添加caco3、添加10mm、20mm、 30mm、40mm、50mm、60mm、70mm、80mm、90mm caco3十个培养条件,其余同实施例1。
86.从图15和图16可知,在10mg/l氨氮浓度下,未添加碳酸钙条件(对照组),亚心形四爿藻生长受到一定抑制,fv/fm与其余实验组相比整体上下降更快,其ph在培养第一日降至最低5.87,且整体低于其余实验组。由图17可知,对照组及九组实验组微藻细胞在培养第二日氨氮吸收完全,氨氮去除率达100%。
87.10mg/l氨氮浓度添加不同浓度碳酸钙后的淀粉积累情况如表1所示。对照组在整个培养期内未出现高直链淀粉积累现象(am/a
p
《1.0,nhas);加入不同浓度碳酸钙后,均可获得高直链淀粉(am/a
p
不低于1.0)。添加10~30mm碳酸钙实验组在第六天am/a
p
达到 1.0-1.2,总淀粉浓度(ts yield,g/l)达到0.4-0.6g/l,总淀粉含量(ts content,%dw)达到 23.2-25.6%;添加40mm碳酸钙实验组在第三天am/a
p
达到1.0,总淀粉浓度(ts yield,g/l) 为0.5g/l,总淀粉含量(ts content,%dw)为29%;添加50mm碳酸钙实验组在第四天 am/a
p
达到1.1,总淀粉浓度(ts yield,g/l)为0.4g/l,总淀粉含量(ts content,%dw)为25.5%。以上结果表明,在低/中浓度caco3(10~50mm)下,微藻积累的高直链淀粉am/a
p
在1.0~1.2之间,即am/ts为50%~55%,可划分为普通高直链淀粉(am/ts=50%-65%,chas),且总淀粉浓度和总淀粉含量均高于目前文献报道的最高水平(0.4g/l和12%dw)。
88.在高浓度caco3(60~90mm)下,微藻积累的高直链淀粉am/a
p
进一步增加,可以达到 1.9~3.0,即am/ts为65%~75%,可划分为高级高直链淀粉(am/ts=65%-80%,ahas);在高浓度caco3(70~90mm)下,缩短培养时间至2天,可以获得am/ts超过80%的高直链淀粉,可划分为超高直链淀粉(am/ts》80%,uhas);尤其是在80mm caco3下,am/ts可以达到近90%,而淀粉含量(ts)仍能保持在17%dw,高于目前文献报道的微藻高直链淀粉的含量(12%dw);而70mm和90mm caco3下可以获得几乎完全由直链淀粉组成的微藻淀粉(无法检测出支链淀粉)。上述结果证明了利用简单廉价的caco3实现不同等级的微藻高直链淀粉生产调控的可行性。
89.表1 10mg/l氨氮浓度下不同浓度caco3添加对微藻高直链淀粉积累的影响
[0090][0091]
实施例4
[0092]
在氨氮浓度100mg/l条件下,利用co
2-碳酸氢钠缓冲体系促进亚心形四爿藻(tetraselmissubcordiformis)光合作用吸收氨氮并积累高直链淀粉,考察高浓度碳酸氢钠在不同添加时间对亚心形四爿藻(tetraselmis subcordiformis)高直链淀粉积累的诱导效果。
[0093]
(1)藻细胞种子液的获得
[0094]
同实施例1。
[0095]
(2)光生物反应装置培养
[0096]
替换藻细胞种子培养液中氮源为氯化铵(氨氮浓度为100mg/l),并剔除藻细胞种子培养液中有机碳源tris及乙酸,加入基础浓度的nahco312 mm维持培养体系正常ph状态。配制完成的培养液组成如下:nacl 27g/l,nahco
3 1g/l,mgso4·
7h2o 6.8g/l,mgcl2·
6h2o5.6g/l,cacl2·
2h2o 1.5g/l,nh4cl 0.382g/l,kh2po
4 0.067g/l,fecl3·
6h2o 1.3mg/l, mncl2·
4h2o 0.36mg/l,h3bo
3 33.6mg/l,edta-na
2 45.0mg/l,zncl
2 0.21mg/l,cocl2·
6h2o0.20mg/l,(nh4)4mo7o
24
·
4h2o 0.09mg/l,cucl2·
2h2o 0.14mg/l。所有培养液配制完成后,110℃高压蒸汽灭菌15min,冷却后备用。
[0097]
藻细胞的培养:藻细胞种子液通过离心收获藻泥,并用上述培养基洗涤三次后重悬藻泥,随后接入已经过121℃高压蒸汽灭菌20min后的反应器内。采用光生物反应装置进行培养,细胞接种时初始od
750
为0.6,温度25℃,140μmol e
·
m-2
·
s-1
光强连续光照,通入空气流量0.25vvm,co2含量2%。设置在微藻培养第0、1、2、3、4天加入48mm碳酸氢钠五个培养条件,用以诱导高直链淀粉积累,并以不额外添加碳酸氢钠为实验对照组,每个条件设置2个平行。
[0098]
(3)细胞干重、光合效率、氨氮和淀粉测定同实施例1。
[0099]
从图18、图19和图20可知,在100mg/l氨氮下添加12mm碳酸氢钠(对照组),可以维持适宜ph和正常光合活性,促进干重积累,且氨氮在2天内吸收完全,氨氮吸收速率最高可达57mg/l/day,表明co
2-碳酸氢钠体系可以实现微藻对氨氮的高效吸收。进一步在不同时机添加高浓度(48mm)碳酸氢钠对微藻细胞生长状态影响较大。48mm碳酸氢钠在培养第零天和第一天加入后,亚心形四爿藻生长受到明显抑制,干重积累较参照组低,fv/fm持续下降,最大日干重皆出现在培养培养第五日,分别为2.8
±
0.1g/l和3.4
±
0.1g/l。在培养第二天、
第三天和第四天加入48mm碳酸氢钠后,微藻生长状态良好,干重不断积累, fv/fm在培养前四日处于高水平稳态期,最大日干重出现在培养第八日,分别为4.3
±
0.1g/l、 4.1
±
0.2g/l、4.3
±
0.1g/l,分别是对照组最大干重的112.9%、106.8%、112.6%。由图21 可知,对照及实验组微藻细胞在培养第一日吸收氨氮速率无异,培养第〇天加入48mm碳酸氢钠实验组在培养第二日氨氮吸收率为90.5%,低于对照组的氨氮吸收率(>99%)及其余实验组的氨氮吸收率(>96%)。此结果表明,在100mg/l氨氮、12mm碳酸氢钠浓度条件下,微藻光合活性正常,且在培养第二日起加入高浓度碳酸氢钠对微藻细胞光合活性、正常生物质累积没有明显抑制作用,并促进微藻对氨氮类氮源的吸收,在添加高浓度碳酸氢钠后的24h内氨氮去除率达96%~100%。
[0100]
由图22、图23和图24可以看出,在培养第5、6、8日,对照组所产淀粉未达到高直链淀粉标准(am/a
p
<1.0)。第〇天和第一天添加高浓度碳酸氢钠实验组微藻细胞所产淀粉总量(淀粉浓度<0.1g/l,淀粉含量<5%dw)明显低于对照组总淀粉量(淀粉浓度>0.7g/l,淀粉含量>20%dw),说明在亚心形四爿藻培养早期添加高浓度碳酸氢钠对细胞的抑制作用明显,阻碍了细胞淀粉合成。在第二天、第三天和第四天添加高浓度碳酸氢钠实验组微藻细胞总淀粉量累积较高,分别在培养第五日、第六日和第八日获得最大淀粉积累量,所积累淀粉均为高直链淀粉,am/a
p
高于1.3,淀粉浓度分别为0.4
±
0.1g/l,0.7
±
0.0g/l和0.7
±
0.0g/l,淀粉含量分别为13.3%dw、19.0%dw和19.1%dw,均高于目前文献报道的微藻高直链淀粉积累水平(淀粉浓度0.4g/l,淀粉含量12%dw)。以上实验表明,高浓度碳酸氢钠在培养第二、三、四天的加入有利于直链淀粉的累积,证明了利用低价碳酸氢钠调控微藻生产高直链淀粉的可行性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1