一种规模化细胞三维培养装置及应用
1.本发明涉及无支架细胞三维培养领域,特别涉及一种规模化细胞三维培养装置及应用。
背景技术:
2.体外建立适合细胞生长的微环境对科学研究至关重要,而普通2d培养的细胞在形态、功能、增殖等方面都与体内细胞相差甚远。细胞三维培养可以更好的模拟细胞在体内的微环境及相互作用并对外部刺激产生与体内类似的响应。目前的三维培养方法按是否有支撑材料分为基于支架的三维培养方式和无支架的三维培养方式。基于支架的三维培养为细胞提供接近于体内环境的支架或基质,建立细胞与细胞间或细胞与细胞外基质的联系,但细胞与支架分离困难,支架的使用引入新的安全风险,支架中生长的细胞均质性差,条件培养基被大量吸附在支架中,不便于细胞和条件培养基的收集。无支架的三维培养基于细胞自聚集并产生内源性的细胞外基质蛋白,最终形成较大的聚集体,无需细胞与支架分离且不受支架降解、支架细胞毒性、批间差异等影响,是再生医学、基础研究、药物筛选等研究领域的理想选择。在再生医学方面,间充质干细胞无支架三维培养与2d培养相比可使旁分泌功能显著增强,增强其对组织的营养作用和免疫调控作用。在基础研究方面,胚胎干细胞或诱导性多能干细胞无支架三维培养时在外部因子刺激下可形成类脑,用于神经发生或疾病过程的研究。在药物筛选方面,无支架三维培养的肿瘤细胞微球是用来观测药物扩散,探索药物与肿瘤相互作用机制及治疗效果的理想模型。
3.目前常用的无支架三维培养方式包括悬滴培养和低粘附平面悬浮培养。悬滴培养是将细胞悬液用移液枪滴于细胞培养皿的皿盖后倒置培养,细胞在重力作用下自聚集成三维细胞球。但此方法操作繁琐,条件培养基和细胞微球收样慢、收率低、耗时长、无法规模化应用且由于悬滴之间相互独立,均质性较差。沃尔夫冈.莫里茨等人研发了悬滴板(专利wo2010031194),孔板经过特殊设计,当在小孔上方加入一滴细胞悬液时,孔板的几何构造就会引导细胞和培养基通过一个小洞,进而形成一个稳定的悬滴。此方法比悬滴培养法效率有所提高,但仍存在以上问题。低粘附平面悬浮培养是将细胞悬液在悬浮板上培养,细胞自发聚集成球,存在细胞成球大小不均一、批间差异大、重复性较差等问题。aggrewelltm或sumi,s.等[1]发明的3d细胞培养板主要用于eb的形成,微孔径400-800um使eb收集困难,且由于空间小,单位体积培养液供养的细胞量很大,需频繁更换培养液才能维持培养,操作不便,频繁换液容易使eb之间聚集,不适合于条件培养液的获取等。适用于各类细胞三维培养且成球均一、便捷、可规模化的三维细胞培养装置及应用将具有重要科学意义与实用价值。
[0004]
参考文献[1].sumi,s.,et al.,a multiple-funnels cell culture insert for the scale-up production ofuniform cell spheroids.regenerative therapy,2017.7:p.52-60.
技术实现要素:
[0005]
本发明提出了一种规模化细胞三维培养装置,包括:
[0006]
细胞板底座、细胞板板壁和底部隔室;
[0007]
所述细胞板板壁为方形中空结构,其中间底部配合安装有细胞板底座,细胞板底座安装有底部隔室,底部隔室上密布有若干细胞隔室,所述相邻细胞隔室成田字排布;
[0008]
所述细胞隔室上部截面为方形,长0.1-0.6cm,宽0.1-0.6cm,高0.05-0.6cm,细胞隔室底部为平底、u型、v型或半球型。
[0009]
进一步地,所述细胞板底座长高0.1-0.5cm。
[0010]
进一步地,所述细胞板板壁外缘高1-4cm,内缘高0.5-3cm,厚0.05-0.3cm。
[0011]
进一步地,所述细胞板底座、细胞板板壁和底部隔室材料为聚苯乙烯或光敏树脂。
[0012]
进一步地,所述细胞隔室还附有琼脂糖。
[0013]
进一步地,所述材料还包括玻璃,所述规模化细胞三维培养装置,其细胞板底座、细胞板板壁和底部隔室为一体打印制作。
[0014]
进一步地,所述材料还包括玻璃,所述规模化细胞三维培养装置,其细胞板底座、细胞板板壁和底部隔室分别打印,使用胶水组装。
[0015]
进一步地,所述规模化细胞三维培养装置,其细胞板底座、细胞板板壁和底部隔室通过开模制备方式制作。
[0016]
本发明还提出一种规模化细胞三维培养装置的应用,所述规模化细胞三维培养装置用于细胞三维培养或细胞条件培养基收集;所述细胞包括间充质干细胞、胚胎干细胞、人诱导型多能干细胞、肿瘤细胞。
[0017]
进一步地,所述规模化细胞三维培养装置用于细胞三维培养或细胞条件培养基收集,使用如下方式:
[0018]
1)判断底部隔室是否粘附细胞,如不粘附,则转3),粘附,则转2);
[0019]
2)用琼脂糖包被规模化细胞三维培养装置底部隔室;将50-70℃的1%-2%的琼脂糖溶液均匀倒入规模化细胞三维培养装置,10-30s后倒出琼脂糖溶液;未凝固的琼脂糖溶液要尽量全部倒出;转3)
[0020]
3)均匀倒入预先混匀的细胞悬液,静置10-20分钟使细胞均匀沉降至底部隔室后放入培养箱,培养期间尽量不要挪动;
[0021]
4)2-3天后,收集条件培养基或换液继续培养或收集细胞微球;收集条件培养基通过移液枪收集细胞上清液再加入新鲜培养基继续培养可连续获取条件培养基;收集细胞微球可在吸走细胞上清液后用培养基将细胞微球吹下来。
[0022]
本发明所设计的规模化细胞三维培养装置,基于该装置进行细胞三维培养,可减少三维培养操作时间,降低时间成本,且可使细胞三维培养规模化,提高均一性和收率。
附图说明
[0023]
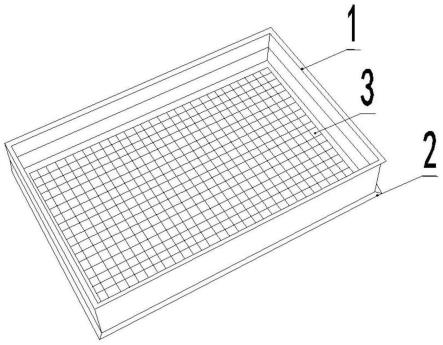
图1示出了本发明实施例中一种规模化细胞三维培养装置结构示意图;
[0024]
图2示出了本发明实施例中细胞隔室结构示意图;
[0025]
图3示出了本发明实施例中一种规模化细胞三维培养装置底部隔室包被琼脂糖图;
[0026]
图4示出了本发明实施例中人间充质干细胞规模化三维培养图;
[0027]
图5示出了本发明实施例中人间充质干细胞规模化三维培养旁分泌效应增强图;
[0028]
图6示出了本发明实施例中人胚胎干细胞规模化三维培养图;
[0029]
图7示出了本发明实施例中肿瘤细胞规模化三维培养图。
[0030]
图中:1、细胞板板壁;2、细胞板底座;3、底部隔室。
具体实施方式
[0031]
下面将参照附图更详细地描述本公开的示例性实施例。虽然附图中显示了本公开的示例性实施例,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更透彻地理解本公开,并且能够将本公开的范围完整地传达给本领域的技术人员。
[0032]
本发明设计一种规模化细胞三维培养装置,以下结合具体的实施例子对上述方案做进一步说明,本发明的优选实施例详述如下:
[0033]
实施例一:
[0034]
在本实施例中,如图1所示,一种规模化细胞三维培养装置,包括细胞板底座、细胞板板壁和底部隔室;
[0035]
所述细胞板板壁为方形中空结构,所述细胞板板壁为外高内低阶梯状,外缘高1-4cm,内缘高0.5-3cm,厚0.05-0.3cm。
[0036]
细胞板板壁中间底部配合安装有细胞板底座,所述细胞板高0.1-0.5cm。细胞板长宽取决于培养规模:细胞上清的需求量,或者细胞微球的需求量。需要的细胞微球越多,底部阵列的细胞隔室越多,板总体的长宽越大。优选的,长4-25cm、宽4-25cm。
[0037]
细胞板底座安装有底部隔室,底部隔室上密布有若干细胞隔室,如图2所示,所述相邻细胞隔室成田字排布;所述细胞隔室开口截面为方形,任意相邻两个细胞隔室共用一个隔室壁,节约资源。开口为其他形状细胞隔室,如圆形,则四个相邻的圆形细胞隔室之间会形成一个菱形的平台,落在这个平台上的细胞很难形成微球。如果相邻细胞隔室为交错排布,同样会形成平台,影响细胞生长。本技术使用方形结构,两个相邻的细胞隔室之间上部为线形,四个相邻的细胞隔室之间上部为点,细胞隔室之间不会有这个平台,能最大限度的使细胞沉降在底部隔室形成微球;同时,方形结构对应的隔室壁,厚度统一,便于实施,也节约资源。
[0038]
本技术考虑到实际培养需求,细胞微球实际大小从几十到几百微米不等。细胞隔室需满足细胞微球生长空间;更换培养基或收集条件培养时细胞微球不会随细胞上清吸走;不会在培养过程中因移动细胞板细胞微球被晃出细胞隔室;收集细胞微球时吸有培养基的移液枪轻柔吹打细胞隔室,微球便可被吹出细胞隔室进行收集,经实验论证,细胞隔室长0.1-0.6cm,宽0.1-0.6cm,高0.05-0.6cm可满足上述需求。细胞隔室底部为平底或上大下小立体结构,如u型、v型或半球型。其他上大下小立体结构还包括如倒棱锥、倒棱台、倒圆锥、倒圆台等。如图2所示,底部为半球型。
[0039]
实施例二:
[0040]
所述细胞板底座、细胞板板壁和底部隔室材料为聚苯乙烯、光敏树脂、玻璃,所述材料还包括其他聚合物类的3d打印材料,如工程塑料(abs/pc)、生物塑料(pla/pcl)、热固
性塑料等。
[0041]
3d打印可以设计出其三维图像(3d模型),如图1、图2所示,选择好相关材料,使用3d打印机打印。
[0042]
需要说明的是,在本技术中,通过3d打印(包括如何用软件生成3d模型、选择材料,选取合适的3d打印机打印等)得到相关装置或部分组件,其中,相关软件,3d模型生成,选择材料,使用3d打印机打印等均为现有技术,本技术目的是提出规模化细胞三维培养装置一种生产(制作)方式,且本技术不涉及3d模型生成技术、材料技术、3d打印相关技术的改进。
[0043]
所述规模化细胞三维培养装置,其细胞板底座、细胞板板壁和底部隔室为一体打印制作。
[0044]
实施例三:
[0045]
所述细胞板底座、细胞板板壁和底部隔室材料为聚苯乙烯、光敏树脂、玻璃,所述材料还包括其他聚合物类的3d打印材料,如工程塑料(abs/pc)、生物塑料(pla/pcl)、热固性塑料等。3d打印同实施例二所述。
[0046]
所述规模化细胞三维培养装置,其细胞板底座、细胞板板壁和底部隔室分别打印,使用胶水组装。胶水能够粘贴相应打印材料,如pdms(聚二甲基硅氧烷,polydimethylsiloxane)预聚体溶液、玻璃胶。使用胶水加热粘贴,使细胞板底座、细胞板板壁和底部隔室组合成规模化细胞三维培养装置。
[0047]
本技术中,细胞板底座、细胞板板壁和底部隔室,可以使用不同的材料进行打印,如细胞板底座使用聚苯乙烯,细胞板板壁和底部隔室使用工程塑料等。
[0048]
本技术考虑到所在底部隔室最外圈的细胞隔室,其最外侧的隔室壁问题。在底部隔室中间的细胞隔室,其隔室壁为相邻细胞隔室共用。而在最外圈的细胞隔室,至少有一个(位于四角细胞隔室的有两个)隔室壁与细胞板板壁内侧接触。而使用细胞板板壁作为细胞隔室的隔室壁时,如使用胶水组装,则细胞隔室与细胞板板壁连接处为线,而非面,则难以操作使之密封。且最外侧没有隔室壁时,移液枪难以将位于四角细胞隔室内的细胞微球吹出,最外侧有隔室壁时便于最外侧细胞隔室内细胞微球收集。因此,当使用组装方式时,最外层细胞隔室的隔室壁需要打印。
[0049]
因此,如使用一体打印制作时,细胞板板壁为外高内低阶梯状,下部较厚。如使用分开打印再组装时,细胞板板壁下部粘贴了隔室壁,也表现为外高内低阶梯状。
[0050]
实施例四:
[0051]
所述细胞板底座、细胞板板壁和底部隔室材料为聚苯乙烯、光敏树脂,所述材料还包括其他适合开模制备的材料,如工程塑料(abs/pc)、生物塑料(pla/pcl)、热固性塑料等。
[0052]
所述规模化细胞三维培养装置,通过开模制备方式一体制作。开模制备可以设计出三维图像,三维图像如图1、图2所示,交厂家开模制备。
[0053]
开模制备还可以根据三维图像制造模具,将聚苯乙烯或其他材料颗粒原料放入到模具中,加热,冷却后取出,参考cn109927238b、cn103737781b、cn103894837b相关技术。
[0054]
需要说明的是,本技术中,开模制备同样为现有技术,本技术不涉及三维图像技术、制造模具技术、制备技术的改进。本技术中的3d打印、3d打印且组装、开模制备均可以通过设计好3d模型,交相关工厂去制作完成。
[0055]
在开模制造时,同样考虑到最外侧隔室细胞微球收集问题。因此,细胞板板壁为外
高内低阶梯状,下部较厚。
[0056]
实施例五:
[0057]
所述的底部隔室还附有低粘附材料或琼脂糖,目的是使底部隔室表面疏水或电中性。底部隔室上密布有若干细胞隔室,在底部隔室上操作,即在若干细胞隔室上操作。
[0058]
某些材料培养悬浮细胞时会出现细胞贴壁的现象,如玻璃。防止细胞贴壁会用一些防止细胞贴壁的材料包被表面,即低粘附材料,如聚二甲基硅氧烷单体,附着方法参见cn108148756a。
[0059]
某些打印材料不适合直接培养悬浮细胞,如光敏树脂。则也需要在此材料外部附有其他材料,便于培养悬浮细胞。包被琼脂糖可以使细胞不贴壁、悬浮培养。
[0060]
当某些材料不粘附细胞,如聚苯乙烯,则不需要附有低粘附材料或琼脂糖。
[0061]
使用如下方法将琼脂糖附着于底部隔室表面。
[0062]
将50-70℃的1%-2%的琼脂糖溶液均匀倒入规模化细胞三维培养装置,10-30s后倒出琼脂糖溶液,尽量将未凝固的琼脂糖溶液全部倒出,效果如图3所示。
[0063]
实施例六:
[0064]
本技术所设计的规模化细胞三维培养装置,用于细胞三维培养或细胞条件培养基收集。
[0065]
所述细胞包括间充质干细胞、胚胎干细胞、人诱导型多能干细胞、肿瘤细胞或其它可三维培养形成细胞微球的细胞。
[0066]
本技术所设计的规模化细胞三维培养装置,使用如下方式进行细胞三维培养或细胞条件培养基收集。
[0067]
1)判断底部隔室是否粘附细胞,如不粘附,则转3),粘附,则转2);
[0068]
本技术所述底部隔室是否粘附细胞,指每一个细胞隔室是否粘附细胞;
[0069]
2)用琼脂糖包被规模化细胞三维培养装置底部隔室;将50-70℃的1%-2%的琼脂糖溶液均匀倒入规模化细胞三维培养装置,10-30s后倒出琼脂糖溶液;未凝固的琼脂糖溶液要尽量全部倒出;转3)
[0070]
本技术所述用琼脂糖包被规模化细胞三维培养装置底部隔室,指用琼脂糖包被所有细胞隔室;
[0071]
3)均匀倒入预先混匀的细胞悬液,静置10-20分钟使细胞均匀沉降至底部隔室后放入培养箱,培养期间尽量不要挪动;
[0072]
本技术中,沉降至底部隔室指沉降在各细胞隔室内;
[0073]
4)2-3天后,收集条件培养基或换液继续培养或收集细胞微球;收集条件培养基通过移液枪收集细胞上清液(简称:上清)再加入新鲜培养基继续培养可连续获取条件培养基;收集细胞微球可在吸走上清后用培养基将细胞微球轻轻吹下来。
[0074]
实施例七:
[0075]
如图4所示,人间充质干细胞(mesenchymal stem cells,msc)规模化三维培养,图4是培养后效果图。msc三维培养可增强其旁分泌功能。本技术中,实施例使用人源细胞,如对间充质干细胞三维培养使用是人间充质干细胞。其他来源细胞,如鼠源等,其规模化三维培养或细胞条件培养基收集与人源方式相同。
[0076]
1)2d培养的人间充质干细胞长至有明显旋涡状后吸走上清,用0.25%的胰酶消化
至细胞变圆,用等体积的培养基终止消化,离心弃上清,加入适量培养基使细胞悬液成6
×
10^4/ml;
[0077]
2)称取0.3g琼脂糖至锥形瓶中,加入30ml双蒸水,在微波炉中加热溶解后高压灭菌;待1%的琼脂糖溶液降温至50-70℃时均匀倒入规模化细胞三维培养装置,10s后将未凝固的琼脂糖溶液全部倒出;
[0078]
本操作中,琼脂糖溶液浓度为1%-2%均可,倒出时间在10-30s均可,操作时只要琼脂糖没有完全凝固均可;
[0079]
3)将预先制好48ml的人间充质干细胞悬液混匀后均匀倒入规模化细胞三维培养装置,静置15分钟,待细胞均匀沉降至底部隔室后放入细胞培养箱;
[0080]
本操作中,只要细胞悬液能够没过底部隔室,使培养基满足细胞生长需要即可。
[0081]
4)三天后用移液枪收集上清,获得条件培养基;
[0082]
5)用移液枪吸取2-5ml培养基将三维细胞球从细胞隔室轻轻吹落下,获得msc 3d细胞微球。
[0083]
如图5所示,图5为msc经三维细胞培养装置培养后与普通2d培养相比,部分旁分泌因子rna表达水平显著上升。
[0084]
实施例七:
[0085]
如图6所示,人胚胎干细胞(embryonic stem cells,escs,简称es、ek或esc细胞)规模化三维培养,图6是培养后效果图;人诱导型多能干细胞培养方法和胚胎干细胞相同。
[0086]
1)2d培养的人胚胎干细胞长至80%后吸走上清,用accutase(细胞消化液)消化1min后,吸走accutase加入培养基,用细胞刮将细胞刮下来,离心弃上清,加入适量培养基制备细胞悬液;
[0087]
2)称取0.3g琼脂糖至锥形瓶中,加入30ml双蒸水,在微波炉中加热溶解后高压灭菌;
[0088]
待1%的琼脂糖溶液降温至50-70℃时均匀倒入规模化细胞三维培养装置,10s后将未凝固的琼脂糖溶液全部倒出;
[0089]
3)将预先制好48ml的人胚胎干细胞悬液混匀后均匀倒入规模化细胞三维培养装置,静置15分钟,待细胞均匀沉降至底部隔室内后放入细胞培养箱;
[0090]
4)三天后用移液枪吸走上清,吸取培养基将eb(embryoidbody,拟胚体,胚胎干细胞或诱导多能干细胞悬浮培养形成的球状结构)从隔室轻轻吹落下进行收集。
[0091]
实施例八:
[0092]
如图7所示,人肿瘤细胞规模化三维培养,图7是培养后效果图。
[0093]
1)2d培养的人乳腺癌细胞(mcf-7)长至80-90%后吸走上清,用0.25%的胰酶消化至细胞变圆,用等体积的培养基终止消化,离心弃上清,加入适量培养基使细胞悬液成4
×
10^4/ml;
[0094]
2)称取0.3g琼脂糖至锥形瓶中,加入30ml双蒸水,在微波炉中加热溶解后高压灭菌:
[0095]
待1%的琼脂糖溶液降温至50-70℃时均匀倒入规模化细胞三维培养装置,10s后将未凝固的琼脂糖溶液全部倒出:
[0096]
3)将预先制好48ml的mcf-7悬液混匀后均匀倒入规模化细胞三维培养装置,静置
15分钟,待细胞均匀沉降至底部隔室后放入细胞培养箱,2-3天进行换液;
[0097]
4)五天后用移液枪吸走上清,吸取培养基将mcf-7微球从隔室轻轻吹落进行收集。
[0098]
本发明所设计的规模化细胞三维培养装置,基于该装置进行细胞三维培养,可减少三维培养操作时间,降低时间成本,且可使细胞三维培养规模化,提高均一性和收率。
[0099]
以上仅为本技术的实施例而已,并不用于限制本技术。对于本领域技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本技术的权利要求范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1