一株同时表达F4和F18菌毛的猪源大肠杆菌无毒分离株及其应用
一株同时表达f4和f18菌毛的猪源大肠杆菌无毒分离株及其应用
技术领域
1.本发明属于生物医学技术领域,具体涉及一株同时表达f4和f18菌毛的猪源大肠杆菌无毒分离株f418及其应用。
背景技术:
2.新生或断奶仔猪腹泻造成全球生猪养殖的重大损失,其中产肠毒素大肠杆菌(etec)是主要原因。猪源etec主要包括f4和f18两种血清型,可感染不同日龄的仔猪,导致仔猪黄痢、白痢、水肿病和断奶仔猪腹泻等疾病。据统计,etec引发的仔猪发病和死亡占仔猪总发病率和死亡率的56.2%和24.7%。
3.动物生产养殖针对etec的防控策略主要是应用抗生素,但在2020年国家出台“限抗”政策后,养殖过程的抗生素用量受限,猪etec感染率随之出现不断增长态势。此外,近年来新型的大肠杆菌耐药株不断出现,养殖生产中常用的抗生素类型均出现了相应的耐药菌株和多重耐药菌株,如β-内酰胺类(阿莫西林、头孢噻呋),氨基糖苷类(新霉素),喹诺酮类(恩诺沙星)和酰胺醇类(氟苯尼考)等。2015年我国学者首次在猪大肠杆菌中发现了针对多黏菌素的mcr-1耐药基因,打破了人类防控细菌的最后一道防线。因此,目前亟需新型有效的猪大肠杆菌病防控措施。
4.探究etec的感染机制有利于探寻科学合理的防控策略。etec的致病机制主要包括两个过程:首先etec f4或f18菌毛顶端的黏附素介导与猪小肠上皮细胞受体的结合,使细菌能够稳定地黏附定植在宿主体内。该黏附过程是建立感染的第一步,也是关键一步。黏附定植成功后etec f4产生的肠毒素产生毒理效应,导致动物发病:包括分泌热敏肠毒素(lt)和热稳定肠毒素(st)至肠腔内,被猪肠道上皮细胞吸收后可导致动物电解质失衡,快速脱水并引发代谢性酸中毒,不及时救治的动物往往在12小时内死亡。综合上述背景,理想的活细菌疫苗候选株应当具备功能性的黏附抗原结构,能够稳定地黏附定植于宿主但不会产生毒素,不会引发疾病,且能够有效刺激宿主产生特异性免疫应答,产生的抗f4或f18菌毛特异性抗体能抵抗病原菌etec f4或f18的黏附定植。目前有报道利用野生株敲除肠毒素基因构建弱毒株,但这种基因修饰的缺失株定植能力弱,在体内不稳定,且容易被清除,虽然相对安全,但仍然具有一定的毒性。考虑lt和stb基因由质粒编码,质粒多拷贝数,人为敲除多拷贝基因和敲除的精准鉴定有一定难度,且敲除基因后存在再重组的可能性,从而导致毒力返强,这种基因缺失株安全性需要长期评估。
技术实现要素:
5.发明目的:为了解决上述技术问题,本发明提供了一株同时表达f4和f18菌毛的猪源大肠杆菌无毒分离株f418及其应用,该菌株不产生肠毒素,能够良好地定植于宿主,诱导仔猪产生特异性免疫应答,并且不会导致动物发病和死亡。
6.技术方案:本发明提供了一株同时表达f4和f18菌毛的猪源大肠杆菌无毒分离株
(escherichia coli)f418,其特征在于,所述猪源大肠杆菌无毒分离株(escherichia coli)f418保藏于中国典型培养物保藏中心,保藏编号为cctcc no:m 2022089,保藏日期为2022年1月18日,保藏地址为中国武汉。
7.其中,所述无毒分离株缺失lt和stb肠毒素基因,经血清型测试和pcr验证其同时表达f4和f18两种菌毛抗原,培养特性、生长和生化特征与表达大肠杆菌f4菌毛的标准参考菌株c83902和表达大肠杆菌f18ab菌毛的标准参考菌株e coli 107/86基本一致。
8.其中,所述猪源大肠杆菌无毒分离株f418分离于2019年4月16日采集5日龄断奶仔猪30份粪便样品,采集人刘家奇(手机号18805274420),按照国家标准方法(gb4789.6-2016)进行。分离后保存于50%甘油和50%lb培养基的混合液,置于在-70℃超低温冰箱储存。细菌培养和复苏方法如下:从保存的菌种中挑取少量划线于lb或麦康凯培养基的固体平板,培养温度为37℃,其中在lb琼脂平板中,37℃培养后可形成黄白色圆形光滑菌落;在麦康凯琼脂平板中,37℃培养后可形成桃红色圆形菌落;经五种糖酵解试验、imvic试验和肠杆菌细菌生化反应鉴定为大肠杆菌;之后挑取菌落于试管中,震荡培养。
9.其中,所述振荡培养条件为180r/min震荡培养至od
600
为1时获得该菌株的新鲜菌液。
10.本发明内容还包括所述的同时表达f4和f18菌毛的猪源大肠杆菌无毒分离株(escherichia coli)f418在制备检测抗原介导间接凝集试验中的载体中的应用或在制备检测抗体介导间接凝集试验中的载体中的应用。
11.其中,所述猪源大肠杆菌无毒分离株(escherichia coli)f418与f4菌毛多克隆抗体、f18ab菌毛多克隆抗体和f18ac菌毛多克隆抗体均发生凝集,与k99菌毛多克隆抗体不发生凝集。
12.本发明内容还包括所述的同时表达f4和f18菌毛的猪源大肠杆菌无毒分离株(escherichia coli)f418在制备大肠杆菌f4和f18菌毛的特异性抗体中的应用。
13.本发明内容还包括一种特异性抗体,所述特异性抗体是由所述的猪源大肠杆菌无毒分离株(escherichia coli)f418免疫动物获得。
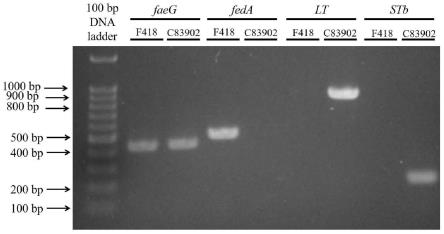
14.本发明内容还包括所述的同时表达f4和f18菌毛的猪源大肠杆菌无毒分离株(escherichia coli)f418在制备防控f4和f18大肠杆菌感染的活疫苗中的应用。
15.本发明内容还包括一种防控f4和f18大肠杆菌感染的疫苗,所述疫苗包括权利要求1所述的猪源大肠杆菌无毒分离株(escherichia coli)f418。
16.其中,所述疫苗包括但不仅限于口服疫苗等。
17.其中,所述的同时表达f4和f18菌毛的猪源大肠杆菌无毒分离株f418以1
×
108cfu,1
×
10
9 cfu和1
×
10
10 cfu灌胃5日龄仔猪3只,经过10天观察,不会导致上述3只仔猪发病和死亡;病理学检测结果表明f418感染组仔猪十二指肠、空肠和回肠黏膜结构完整,肠绒毛纤长,无明显病理变化,与对照组仔猪的病理学检查结果一致。
18.其中,所述的同时表达f4和f18菌毛的猪源大肠杆菌无毒分离株能够黏附定植于仔猪肠道,且能诱导仔猪产生针对大肠杆菌f4和f18菌毛的特异性抗体,第7天产生抗f4和f18菌毛的凝集抗体滴度均为1∶2,第14天的抗体滴度均为1∶4,第21天的抗体滴度均为1∶4和1∶8之间,第28天的抗体滴度均为1∶8,随后抗体效价进一步缓慢升高,第42天针对大肠杆菌f4和f18菌毛的特异性抗体滴度分别为1∶8和1∶16之间。
19.本发明按照国家标准方法(gb 4789.6-2016)从临床上分离得到一株同时表达f4和f18菌毛的猪源大肠杆菌,利用生化试验、血清学检测、pcr检测、30日龄断奶仔猪感染性试验对该分离株进行测试,确认该菌株为大肠杆菌无毒分离株,命名为f418,该菌株具有开发成细菌活疫苗候选株的潜力。在仔猪人工感染试验中,本发明所涉及无毒分离菌株对5日龄仔猪不致病,临床剖检未发现明显病变,病理组织切片也均正常,仔猪未出现任何感染症状。对人工感染仔猪在第7天、第14天、第21天、第28天、第35天和第42天进行血清f4和f18菌毛抗体检测和粪便dna样品的pcr测试,证明f4和f18菌毛抗体滴度逐渐升高并趋于稳定,验证了该菌株能长期稳定黏附定植在仔猪肠道,且较好地诱导仔猪产生免疫应答。粪便dna样品经pcr测试结果表明f418感染组的5只仔猪在口服f418无毒分离株后的6周内均可在粪便中检测到f4和f18菌毛特异性基因。
20.有益效果:与现有技术相比,本发明具有以下显著优点:本发明的大肠杆菌无毒分离菌株f418能同时表达f4和f18两种菌毛抗原的猪源自然分离株,pcr测试表明该菌株缺乏lt和stb肠毒素基因,且不产生肠毒素,能够良好地黏附定植于宿主,诱导仔猪产生特异性免疫应答,并且不会导致动物发病和死亡,将f418菌株以剂量1
×
109cfu灌胃30日龄断奶仔猪,黏附定植和感染仔猪后无一发病、死亡。f4和f18菌毛抗体监测结果表明该无毒分离株感染1个半月后仍然可以检测到高水平的f4和f18菌毛抗体;并且pcr测试粪便dna样品在6周内均可以检测到f4和f18菌毛特异性基因,说明该无毒分离株具有成为猪源无毒大肠杆菌活菌疫苗的潜在应用,通过口服大肠杆菌无毒分离株能够良好地黏附定植于宿主猪,诱导仔猪产生特异性免疫应答,发挥免疫效力,安全性具有保障。
附图说明
21.图1为分离株f418的pcr鉴定结果图;
22.图2为分离株f418的生长曲线测定;
23.图3为仔猪接种f418菌株后的石蜡切片组织图;
24.图4为仔猪接种f418分离菌株后6周内的血清f4和f18抗体变化情况;
25.图5为仔猪接种f418分离菌株第6周后粪便载菌pcr测定结果。
具体实施方式
26.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
27.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
28.实施例1猪源大肠杆菌无毒分离株f418的分离和鉴定
29.于2019年4月16日采集45日龄断奶仔猪30份粪便样品,采集人刘家奇,按照国家标准方法(gb 4789.6-2016)进行细菌学检测。将样品进行实验室留样,取约25g样品放置于含有225ml无菌液体lb培养基的无菌烧杯中,充分搅拌后置于无菌锥形瓶中180r/min震荡培养6h。取10μl培养物接种于30ml肠道菌增菌培养基(成分为每100ml水中含明胶胰酶水解物1g,二水合磷酸氢二钠0.8g,牛胆盐0.2g,亮绿0.0015g,葡萄糖0.5g,磷酸二氢钾0.2g,ph值7.2
±
0.2)置于42℃增菌18h。将增菌液划线接种麦康凯平板,置于37℃培养16h,挑取桃红色圆形可疑菌落。
30.挑取可疑菌落于三糖铁培养基中斜面划线,再于底层穿刺,置于37℃培养箱静置
培养48小时。同时挑取单个可疑菌落接种于乳糖、靛基质、蛋白胨水、硫化氢、尿素、氰化钾(kcn)生化微量反应管中,24小时内观察生化反应结果(见表2)。
31.挑取分离株的单菌落接种于lb培养基,37℃过夜培养后,于洁净玻片上滴加10μl鼠源k88ac(f4)多克隆抗体、k99菌毛多克隆抗体和f18ab、f18ac多克隆抗体,然后分别混合上述分离菌株培养物,观察其是否能产生血清凝集反应,判断其血清型。所述多克隆抗体均由本实验室保存(大肠杆菌k99菌毛fan操纵子的克隆表达及活性[j].微生物学报,羊扬,厚华艳,郁磊,等,2012)。将菌液分别与上述单抗或多抗与血清混匀上下晃动玻片,2min内呈现明显凝集颗粒者为阳性,呈均匀混浊者为阴性。同时以生理盐水、f4产肠毒素大肠杆菌c83902菌株(f4ac+,lt+,stb+)(k88ac+产肠毒素大肠杆菌相关新毒力因子的研究[d].扬州大学,周明旭,2016)、标准f18ab菌株e coli107/86(f18ab+,stx2e+)和标准f18ac菌株(f18ab+,sta+,stb+)(f18+大肠杆菌鞭毛与其致病相关性的研究[d].扬州大学,段强德2012)作为对照(结果见表3)。
[0032]
利用f4菌毛faeg基因、f18菌毛feda基因、肠毒素lt和stb基因特异性引物对上述分离菌株进行pcr鉴定,以标准f4产肠毒素大肠杆菌c83902菌株作为对照。引物序列见表1,序列从上至下依次为seq id no.1~8。
[0033]
三糖铁试验结果为斜面产酸呈黄色,底部产酸呈黄色,不产硫化氢。同时结合微量生化管试验可初步判断该分离株为猪源大肠杆菌。
[0034]
表1分离株f418血清型和肠毒素鉴定的pcr扩增引物表
[0035][0036]
表2分离株f418的生化鉴定情况
[0037][0038]
注:“+”代表生化反应阳性;
“‑”
代表生化反应阴性。
[0039]
表3分离株f418的血清学鉴定情况
[0040][0041]
注:“+”代表血清学凝集反应阳性;
“‑”
代表血清学凝集反应阴性。
[0042]
分离株f418与大肠杆菌f4多克隆抗体、f18ab多克隆抗体和f18ac多克隆抗体均发生凝集,与大肠杆菌k99多克隆抗体不凝集。f4强毒标准株c83902仅与f4多克隆抗体发生凝集,f18ab标准株和f18ac标准株均与f18ab多克隆抗体和f18ac多克隆抗体发生凝集。该结果表明f418为一株同时表达f4和f18菌毛抗原的大肠杆菌。
[0043]
以faeg up/lo引物经pcr扩增,图1结果显示,分离株f418、f4标准菌株c83902对照均可扩增出约446bp的片段;以feda up/lo引物经pcr扩增(扩增体系为诺唯赞green taq mix 12.5μl,ddh2o10.5μl,10μm上下游引物各0.5μl,基因组模板(震荡培养至od600为1时获得该菌株的新鲜菌液100℃ 5分钟后的上清液为细菌dna基因组模板)1μl;pcr程序为95℃预变性3min,95℃变性30s,55℃退火30s,72℃延伸1min,变性、退火和延伸步骤循环35次,最后72℃继续延伸5min),仅分离株f418可扩增出约509bp的片段。该结果进一步确定f418分离株同时携带f4和f18两种菌毛基因。以lt up/lo和stb up/lo为引物经pcr扩增(lt和stb的扩增体系和程序一致:扩增体系为诺唯赞green taq mix 12.5μl,ddh2o10.5μl,10μm上下游引物各0.5μl,细菌基因组1μl;pcr程序为95℃预变性3min,95℃变性30s,51℃退火30s,72℃延伸1min,变性、退火和延伸步骤循环35次,最后72℃继续延伸5min),结果显示,f4标准菌株c83902对照可扩增出约870bp和198bp大小的片段,而分离株f418均不可扩增出相应片段,综上可明确分离株f418为一株自然缺失肠毒素基因且表达f4和f18菌毛的大肠杆菌。该分离株f418保藏于中国典型培养物保藏中心(cctcc),保藏地址为中国武汉,保藏编号为cctcc no:m 2022089,保藏日期为2022年1月18日,分类命名为大肠杆菌(escherichia coli)。
[0044]
实施例2猪源大肠杆菌无毒分离株f418的生物学研究
[0045]
将上述分离株f418、f4强毒标准株c83902和f18ab标准株e coli 107/86单菌落接种于液体lb中37℃过夜震荡培养,次日吸取菌液划线于麦康凯平板进行培养特性比较。同时将三种菌株进行蔗糖、乳糖、葡萄糖、棉子糖、麦芽糖、甘露醇、靛基质、甘露糖、枸橼酸、卫矛醇、鸟氨酸、赖氨酸、氰化钾、硫化氢、尿素、onpg、mr试验、v-p试验、半固体琼脂、侧金盏
花、硝酸盐还原等微量生化反应(表4所示)。
[0046]
在麦康凯平板上分离株f418、f4强毒标准株c83902和f18ab标准株e coli 107/86均长出桃红色圆形光滑菌落。
[0047]
表4分离株f418和f4强毒标准株c83902的生化特性比较
[0048][0049]
注:“+”代表生化反应阳性;
“‑”
代表生化反应阴性。
[0050]
上述分离株f418和f4强毒标准株c83902生长曲线测定结果如图2所示,并用spss17.0中非参数检验方法对两种菌株的迟缓期、对数期、稳定期的生长曲线进行对比,发现分离株f418生长速度要显著低于f4强毒标准株c83902(p<0.05)。
[0051]
实施例3猪源大肠杆菌无毒分离株f418对30日龄断奶仔猪的感染试验
[0052]
将9只5日龄断奶仔猪的随机分成3组,每组3只,将分离菌株f418和f4强毒标准株c83902以1
×
109cfu/ml口服灌胃,另设平衡盐缓冲液对照组,口服剂量均为1ml。每组隔离饲养,无抗生素饲料饲喂,仔细观察一周,每天观察所有试验仔猪的腹泻症状和其它临床症状(如精神状态、进食情况等)。同时记录其死亡率情况,一周后剖检观察器官病变情况。采集各组仔猪的十二指肠、空肠和回肠进行制作切片观察病理组织变化。
[0053]
一周试验结果发现分离株f418感染组仔猪并未出现死亡,且饲养过程中仔猪状态良好,无任何症状及不良反应;而f4强毒标准株c83902感染组仔猪在一周内全部死亡,症状和剖解病变结果如下表4。
[0054]
表4分离株f418和f4强毒标准株c83902的致病性试验结果
[0055][0056]
各组部分石蜡切片检测如图3所示,其余石蜡切片结果均与展示结果一致。分离株
f418感染组仔猪十二指肠、空肠和回肠黏膜结构完整,肠绒毛纤长,无明显病理变化,与对照组仔猪的病理学检查结果一致。而f4强毒标准株c83902感染组多数肠黏膜坏死脱落,部分肠绒毛萎缩,十二指肠腺结构遭到破坏,黏膜上层和黏膜固有层有炎性细胞浸润。综合上述结果判断该分离株f418为猪源f4大肠杆菌无毒分离株。
[0057]
实施例4f4猪源大肠杆菌无毒株f418感染仔猪后血清f4和f18抗体检测情况和粪便载菌检测
[0058]
将12只5日龄断奶仔猪的随机分成4组,每组3只,将分离菌株f418分别以1
×
108cfu/ml,1
×
109cfu/ml,1
×
10
10
cfu/ml口服灌胃,另设平衡盐缓冲液对照组,口服剂量均为1ml。每组隔离饲养,无抗生素饲料饲喂,每周进行血液采集,利用血清学凝集方法检测血清f4和f18抗体水平,检测血清利用生理盐水稀释,持续检测至抗体水平趋于稳定。同时每周采集仔猪粪便,取0.5g粪便加1ml无菌超纯水后充分涡旋混合,100℃5分钟后的上清液作为粪便细菌dna模板,以faeg up/lo引物进行pcr鉴定(扩增体系为诺唯赞green taq mix 12.5μl,ddh2o10.5μl,10μm上下游引物各0.5μl,粪便细菌dna模板1μl;pcr程序为95℃预变性3min,95℃变性30s,54℃退火30s,72℃延伸1min,变性、退火和延伸步骤循环35次,最后72℃继续延伸5min)。
[0059]
血清f4和f18抗体变化情况见图4,口服感染结果表明1
×
108cfu/ml,1
×
109cfu/ml,1
×
10
10
cfu/ml剂量均可以诱导仔猪产生特异性抗体,其中1
×
109cfu/ml和1
×
10
10
cfu/ml诱导仔猪产生抗体的速度快,抗体效价高,且两者的效果没有显著差别;1
×
108cfu/ml诱导仔猪产生抗体的速度相较于上述两种剂量较为缓慢,但在感染后3周可达到与上述两种剂量相同的抗体效价,滴度在1∶4和1∶8之间。
[0060]
粪便dna的pcr检测结果表明1
×
108cfu/ml,1
×
109cfu/ml,1
×
10
10
cfu/ml剂量三种剂量的f418感染组仔猪在口服f418无毒株后的6周内均可在粪便中检测到f4和f18菌毛特异性基因,各组仔猪第六周粪便dna样品pcr检测结果见图5。以上结果说明f4猪源大肠杆菌无毒株f418能够有效长期稳定定植在猪宿主体内并且具有良好的免疫原性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1