纯化和/或病毒灭活的方法与流程
纯化和/或病毒灭活的方法
1.本发明涉及蛋白质(或蛋白质产品)的纯化方法和/或蛋白质(或蛋白质产品)的病毒灭活方法。本发明涉及糖蛋白(或糖蛋白产品)的纯化方法和/或糖蛋白(或糖蛋白产品)的病毒灭活方法。蛋白质/糖蛋白可以是例如在宿主细胞中产生的重组糖蛋白,诸如fsh、hcg或lh。蛋白质/糖蛋白可以是来源于尿的。
2.许多糖蛋白用于治疗性治疗。例如,促性腺激素是一类用于治疗不育的糖蛋白。促性腺激素是一组异源二聚糖蛋白激素,其调节雄性和雌性中的性腺功能。它们包括促卵泡激素(fsh)、黄体生成素(lh)和绒毛膜促性腺激素(cg)。
3.从怀孕的和更年期后的女性的尿中提取的fsh和hcg已经在不育治疗中使用了许多年。从尿中提取的fsh和hcg的产生涉及大量尿的收集和处理。
4.作为来源于尿的产品的备选方案,重组形式的fsh和hcg是可用的。目前批准的产品(来自merck serono的gonal-f,ovitrelle;来自msd的puregon)在中国仓鼠卵巢(cho)细胞中产生(表达)。
5.本技术人已经开发了重组fsh和重组hcg,两者均在细胞系中表达。来源于细胞系的fsh产品及其生产方法在国际专利申请号pct/gb2009/000978(公开为wo2009/127826a)和pct/ep2012/065507(公开为wo2013/020996)中公开。该产品(fe999049)已经在欧洲完成了iii期临床试验。来源于细胞系的重组hcg产品及其生产方法在pct/gb2010/001854(公开为wo2011/042688)中公开。
6.本技术人已经开发了可以用于纯化例如在哺乳动物细胞系中产生的重组fsh和重组hcg的技术(例如,wo2009/127826a和wo2013/020996中公开的重组fsh,和wo2011/042688中公开的重组hcg)。
7.根据本发明,在第一个方面,提供了一种纯化蛋白质[例如,糖蛋白,例如重组糖蛋白,(例如重组的)促性腺激素,(例如重组的)fsh、hcg或lh]的方法,所述方法包括用辛酸和乙醇的组合处理所述蛋白质[例如,糖蛋白,例如重组糖蛋白,(例如重组的)促性腺激素,(例如重组的)fsh、hcg或lh]的步骤。
[0008]
所述方法可以包括用辛酸和乙醇的组合处理蛋白质的溶液[例如,在水、缓冲液或其它介质(例如,缓冲液;100 mm乙酸铵,30-50 mm nacl,ph 9-ph 9.5)中]。所述方法可以包括在ph 6.5至12,例如ph 7.5至10,例如ph 9至9.5处理在缓冲液(例如乙酸铵缓冲液)中的蛋白质(例如糖蛋白)的溶液。
[0009]
用辛酸和乙醇的组合处理糖蛋白的步骤可以在酸性ph进行,例如在ph 2至ph 6.5,例如ph 3至ph 6.5,例如ph 4至ph 6(例如ph 5.5
±
0.1),优选ph 4.5至ph 5.5]进行。使用酸性条件(例如,ph 4
–
ph 6)归因于辛酸活性。辛酸能够通过破坏病毒膜来灭活包膜病毒;这通过辛酸的不带电形式(其能够穿透病毒疏水膜)实现。辛酸在接近其pka的ph(ph 4.9)是不带电的。在1单位升高的δph(~ph 5.9)下,100%的辛酸分子带负电荷,并且因此对病毒灭活效率较低。
[0010]
蛋白质可以是重组蛋白质或来源于尿的蛋白质。蛋白质可以是糖蛋白。蛋白质/糖蛋白可以是促性腺激素,例如fsh、hcg或lh。糖蛋白可以是重组糖蛋白,例如重组促性腺激
素,例如重组fsh、hcg或lh。优选地,蛋白质/糖蛋白是通过以下方法在细胞(细胞系)中产生的重组糖蛋白(例如重组促性腺激素,例如重组fsh、hcg或lh),所述方法包括在合适的培养基中培养细胞(细胞系)并且从所述细胞(细胞系)和/或所述培养基收获重组糖蛋白(例如,从细胞培养上清中收获重组蛋白质)。所述细胞(细胞系)可以是哺乳动物细胞(细胞系),例如cho细胞(系),细胞(系),hek293细胞(系),ht1080细胞(系),cos细胞(系),nos细胞(系),sp20细胞(系)等。优选地,细胞(细胞系)是细胞(系)。
[0011]
糖蛋白(促性腺激素,fsh,hcg,lh等),无论它们是尿的或重组的,通常都是培养基中的溶液/悬浮液的形式。如本领域所熟知的,糖蛋白可以作为单一同种型或作为同种型的混合物存在。在本文中,术语蛋白质、糖蛋白、促性腺激素、fsh、hcg、lh等涵盖包含蛋白质、糖蛋白、促性腺激素、fsh、hcg、lh等的溶液或悬浮液。在本文中,术语蛋白质、糖蛋白、促性腺激素、fsh、hcg、lh等涵盖包含蛋白质、糖蛋白、fsh、hcg、lh等的溶液或悬浮液,其中所述蛋白质、糖蛋白、fsh、hcg、lh等作为单一同种型或作为同种型的混合物存在。因此,术语fsh涵盖包含fsh的溶液或悬浮液(例如,其中fsh作为单一同种型或作为同种型的混合物存在)。
[0012]
在本文中,短语“用辛酸和乙醇的组合处理蛋白质(糖蛋白,促性腺激素,fsh,hcg,lh等)”意指将辛酸和乙醇二者应用于蛋白质(糖蛋白,促性腺激素,fsh,hcg,lh等),使得蛋白质(糖蛋白,促性腺激素,fsh,hcg,lh等)同时暴露于辛酸和乙醇二者。因此,该短语涵盖了这样的技术,其中辛酸和乙醇作为混合物或作为两个分离的试剂被添加至蛋白质(糖蛋白,促性腺激素,fsh,hcg,lh等)的溶液中,因此溶液变成辛酸、乙醇和蛋白质(糖蛋白,促性腺激素,fsh,hcg,lh等)的混合物;该短语也涵盖了辛酸和乙醇二者同时作用于蛋白质(糖蛋白,促性腺激素,fsh,hcg,lh等)的其它技术。
[0013]
申请人已经意想不到地发现,在酸性ph,用乙醇和辛酸(例如20mm辛酸/30%乙醇的组合)处理含有重组蛋白质/糖蛋白(例如重组fsh,重组hcg)的溶液可以导致一些病毒的变性(导致其灭活)和/或其它病毒和宿主细胞蛋白质(杂质)的沉淀。然后可以将溶液离心或过滤(以去除沉淀的病毒和/或宿主细胞蛋白质,例如使用深度过滤器诸如玻璃过滤器),使得上清包含纯化的糖蛋白(例如重组fsh,重组hcg)以用于后续的处理和使用。申请人已经发现用乙醇和辛酸处理含有重组糖蛋白(例如重组fsh,重组hcg)的溶液可以(i)灭活包膜病毒;和/或(ii)通过沉淀清除无包膜病毒(沉淀的病毒然后可以通过后续的离心或过滤(通过例如玻璃纤维过滤器)的步骤去除);和/或(iii)通过沉淀去除宿主相关的蛋白质(沉淀的宿主相关的蛋白质然后能够通过后续的离心或过滤(通过例如玻璃纤维过滤器)的步骤去除)。这种相对简单的处理和过滤方法提供了显著的杂质去除(在该方法中去除了64%至79%的宿主相关的杂质),而产物糖蛋白损失最小(即产量高)。
[0014]
使用辛酸和乙醇(例如在重组fsh和/或重组hcg的纯化/病毒灭活中)具有其它优点。首先,辛酸与乙醇的组合可以缩短纯化过程,因为单一步骤可以具有双重功能:病毒灭活和沉淀,以及宿主细胞蛋白质的沉淀。其次,如上所述,辛酸在ph~4.9对于病毒灭活的活性最高,但是该低ph理论上能够损害重组fsh产品(通过分子的解离等)。根据henderson-hasselbalch等式,在ph 5.5,约20%的ca不带电,这提供了病毒灭活而对重组fsh的损害的风险降低的良好平衡;加入etoh(例如30%etoh)补偿了这些条件下辛酸活性的损失,这对蛋白质的危害更小。最后,由于安全问题,辛酸/etoh的组合允许使用较低浓度的etoh(例如
30%),这在制造过程中是极其重要的。
[0015]
辛酸浓度可以是10mm至30mm辛酸,例如18mm至25mm辛酸,例如19mm至23mm辛酸,例如20mm辛酸。etoh可以是20%至50%etoh,例如25%至50%etoh,例如30%至50%etoh,例如30%etoh。所述方法可以包括用30%至50%乙醇和18mm至25mm辛酸(例如20mm辛酸和30%乙醇)处理糖蛋白的步骤。
[0016]
所述方法可以包括在搅拌的情况下用乙醇和辛酸在23
±
2℃的温度温育1分钟至6小时来处理蛋白质(糖蛋白)(例如对于病毒灭活,观察到沉淀),例如在搅拌的情况下用乙醇和辛酸在23
±
2℃的温度温育0.5小时至1小时来处理蛋白质(糖蛋白)(例如对于病毒灭活,观察到沉淀)。所述方法可以包括在不搅拌的情况下用乙醇和辛酸在4
°‑
8℃的温度温育1分钟至32小时处理蛋白质(糖蛋白)(该步骤可以继续/允许宿主细胞蛋白质(hcp)和无包膜病毒的沉淀),例如在不搅拌的情况下用乙醇和辛酸在4
°‑
8℃的温度温育14小时至16小时处理蛋白质(糖蛋白)(该步骤可以继续/允许hcp和无包膜病毒的沉淀)。在优选的实施例中,所述方法包括如下处理蛋白质(糖蛋白):在搅拌的情况下用乙醇和辛酸在23
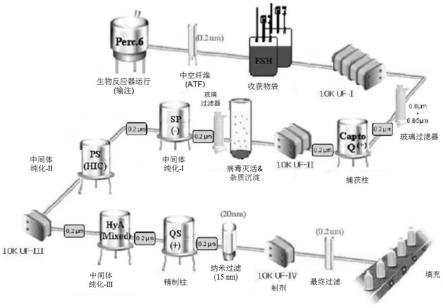
±
2℃的温度温育0.5小时至1小时,然后降至4
°‑
8℃的温度并随后在不搅拌的情况下温育16
±
2小时(例如14小时至16小时)。
[0017]
所述方法可以包括用乙醇和辛酸在5.5
±
0.1的ph和23
±
2℃的温度处理蛋白质(糖蛋白),持续1小时
±
10分钟。
[0018]
所述方法可以包括如下的另外步骤:在用辛酸和乙醇处理之后离心或过滤蛋白质(糖蛋白)(溶液)(例如,通过深度过滤器,例如玻璃纤维过滤器)。
[0019]
所述方法可以包括将蛋白质(糖蛋白)(溶液)浓缩至(蛋白质/糖蛋白的)所需浓度的另外步骤和/或其它(例如后续的)纯化/制剂步骤。
[0020]
根据本发明,在另外的方面,提供了一种蛋白质[例如,糖蛋白,例如重组糖蛋白,(例如重组的)促性腺激素,(例如重组的)fsh、hcg或lh]中病毒灭活的方法,所述方法包括用辛酸和乙醇的组合处理所述蛋白质[例如,糖蛋白,例如重组糖蛋白,(例如重组的)促性腺激素,(例如重组的)fsh、hcg或lh]的步骤。
[0021]
所述方法可以包括用辛酸和乙醇的组合处理糖蛋白的溶液[例如,在水、缓冲液或其它介质(例如,缓冲液;100mm乙酸铵,30-50mm nacl,ph 9-ph 9.5)中]。所述方法可以包括在ph 6.5至12,例如ph 7.5至10,例如ph 9至9.5处理在缓冲液(例如乙酸铵缓冲液)中的蛋白质(例如糖蛋白)的溶液。
[0022]
用辛酸和乙醇的组合处理糖蛋白的步骤可以在酸性ph进行,例如在ph 2至ph 6.5,例如ph 3至ph 6.5,例如ph 4至ph 6(例如ph 5.5
±
0.1),优选ph 4.5至ph 5.5]进行。使用酸性条件(例如,ph 4
–
ph 6)归因于辛酸活性。辛酸能够通过破坏病毒膜来灭活包膜病毒;这通过辛酸的不带电形式(其能够穿透病毒疏水膜)实现。辛酸在接近其pka的ph(ph 4.9)是不带电的。在1单位升高的δph(~ph 5.9)下,100%的辛酸分子带负电荷,并且因此对病毒灭活效率较低。
[0023]
辛酸浓度可以是10mm至30mm辛酸,例如18mm至25mm辛酸,例如19mm至23mm辛酸,例如20mm辛酸。etoh可以是20%至50%etoh,例如25%至50%etoh,例如30%至50%etoh,例如30%etoh。所述方法可以包括用30%至50%乙醇和18mm至25mm辛酸(例如20mm辛酸和30%乙醇)处理糖蛋白的步骤。
[0024]
所述方法可以包括在搅拌的情况下用乙醇和辛酸在23
±
2℃的温度温育1分钟至6小时来处理蛋白质(糖蛋白),例如在搅拌的情况下用乙醇和辛酸在23
±
2℃的温度温育0.5小时至1小时来处理蛋白质(糖蛋白)。所述方法可以包括在不搅拌的情况下用乙醇和辛酸在4
°‑
8℃的温度温育1分钟至32小时处理蛋白质(糖蛋白),例如在不搅拌的情况下用乙醇和辛酸在4
°‑
8℃的温度温育14小时至16小时处理蛋白质(糖蛋白)。在优选的实施例中,所述方法包括如下处理糖蛋白:在搅拌的情况下用乙醇和辛酸在23
±
2℃的温度温育0.5小时至1小时,然后降至4
°‑
8℃的温度并随后在不搅拌的情况下温育14小时至16小时。
[0025]
所述方法可以包括用乙醇和辛酸在5.5
±
0.1的ph和23
±
2℃的温度处理蛋白质(糖蛋白),持续1小时
±
10分钟。
[0026]
所述方法可以包括如下的另外步骤:在用辛酸和乙醇处理之后离心或过滤蛋白质(糖蛋白)(溶液)(例如,通过玻璃纤维过滤器)。
[0027]
所述方法可以包括如下的另外步骤:将蛋白质(糖蛋白)(溶液)浓缩至(蛋白质/糖蛋白的)所需浓度和/或其它(例如后续的)纯化/制剂步骤。
[0028]
蛋白质可以是重组蛋白质或来源于尿的蛋白质。蛋白质可以是糖蛋白。蛋白质/糖蛋白可以是促性腺激素,例如fsh、hcg或lh。蛋白质/糖蛋白可以是重组糖蛋白,例如重组促性腺激素,例如重组fsh、hcg或lh。优选地,蛋白质/糖蛋白是通过以下方法在细胞(细胞系)中产生的重组糖蛋白(例如重组促性腺激素,例如重组fsh、hcg或lh),所述方法包括在合适的培养基中培养细胞(细胞系)并且从所述细胞(细胞系)和/或所述培养基收获重组糖蛋白(例如,从细胞培养上清中收获重组蛋白质)。所述细胞(细胞系)可以是哺乳动物细胞(细胞系),例如cho细胞(系),细胞(系),hek293细胞(系),ht1080细胞(系),cos细胞(系),nos细胞(系),sp20细胞(系)等。优选地,细胞(细胞系)是细胞(系)。
[0029]
根据本发明,在另外的方面,提供了已经通过上述方法被纯化和或病毒灭活的蛋白质。蛋白质可以是重组蛋白质或来源于尿的蛋白质。蛋白质可以是糖蛋白。糖蛋白可以是重组糖蛋白,例如重组促性腺激素,例如重组fsh、hcg或lh。优选地,糖蛋白是通过以下方法在细胞(细胞系)中产生的重组糖蛋白(例如重组促性腺激素,例如重组fsh、hcg或lh),所述方法包括在合适的培养基中培养细胞(细胞系)并且从所述细胞(细胞系)和/或所述培养基收获重组糖蛋白(例如,从细胞培养上清中收获重组蛋白质)。所述细胞(细胞系)可以是哺乳动物细胞(细胞系),例如cho细胞(系),细胞(系),hek293细胞(系),ht1080细胞(系),cos细胞(系),nos细胞(系),sp20细胞(系)等。优选地,细胞(细胞系)是细胞(系)。
[0030]
根据本发明,在另外的方面,提供了一种药物组合物[例如,为了(用于)治疗不育],所述药物组合物包含已经通过上述方法被纯化和或病毒灭活的蛋白质(例如糖蛋白,例如重组糖蛋白,例如重组fsh,重组hcg)。
[0031]
根据本发明,在另外的方面,提供了一种治疗方法(例如治疗不育的方法),所述方法包括向有需要的患者施用药物组合物的步骤,所述药物组合物包含已经通过上述方法被纯化和或病毒灭活的蛋白质(例如糖蛋白,例如重组糖蛋白,例如重组fsh,重组hcg)。
[0032]
不育的治疗可以包括辅助生殖技术(art),诱导排卵或子宫内授精(iui)。药物组合物可以用于例如其中使用已知fsh、lh、hcg制剂的医疗适应症。
[0033]
可以将产品或组合物配制为熟知的组合物,其用于任何途径的药物施用,例如口
腔、直肠、肠胃外、透皮(例如贴片技术)、静脉内、肌肉内、皮下、脑池内、阴道内、腹膜内、局部(粉末、膏剂或滴剂)或作为颊含或鼻喷雾剂。典型的组合物包含药用载体,如水溶液、非毒性赋形剂,包括盐和防腐剂,缓冲剂等,特别如在remington’s pharmaceutical sciences fifteenth edition(雷明顿药物科学第15版)(matt出版公司,1975),在1405-1412页和第1461-87页,和national formulary(国家处方集)xiv,第14版(american pharmaceutical association(美国药物协会),1975)中所述。
[0034]
合适的水性和非水性药物载体、稀释剂、溶剂或赋形剂的实例包括水、乙醇、多元醇(如甘油、丙二醇、聚乙二醇等)、羧甲基纤维素及其合适的混合物、植物油(如橄榄油)和可注射的有机酯如油酸乙酯。本发明的组合物还可以含有添加剂,诸如但不限于防腐剂、湿润剂、乳化剂、表面活性剂和分散剂。可以包含抗细菌剂和抗真菌剂以防止微生物生长并且包括例如间甲酚、苄醇、对羟基苯甲酸酯类、氯丁醇、苯酚、山梨酸等。如果包含防腐剂,则苄醇、苯酚和/或间甲酚是优选的;然而,防腐剂绝不限于这些实例。此外,包含等渗剂(诸如糖、氯化钠等)是所期望的。产品或组合物可以进一步包含盐,所述盐包括选自由以下组成的组的药用碱金属阳离子:na
+
盐或k
+
盐,或其组合。优选地,所述盐是na
+
盐,例如nacl或na2so4。
[0035]
优选地,产品或组合物包含糖蛋白,以及聚山梨醇酯20,l-甲硫氨酸,苯酚,硫酸二钠和磷酸钠缓冲剂,蔗糖和柠檬酸缓冲剂中的一种或多种。
[0036]
可以例如通过经由保留细菌的(bacterial-retaining)过滤器过滤,或通过掺入无菌固体组合物形式的灭菌剂(其可以在使用前即刻溶解或分散在无菌水或其它无菌可注射介质中)对可注射制剂进行灭菌。可注射制剂可以在任何合适的容器,例如小瓶、预先填充的注射器、注射药筒等中供应。
[0037]
所述组合物可以经配制用于单次使用或用于多次使用(多个剂量)。如果产品或组合物经配制用于多次使用,优选的是包含防腐剂。如果包含防腐剂,则苄醇、苯酚和/或间甲酚是优选的;然而,防腐剂绝不限于这些实例。单次使用或多次使用配制的产品或组合物可以进一步包含盐,所述盐包括选自由以下组成的组的药用碱金属阳离子:na
+
盐或k
+
盐,或其组合。优选地,所述盐是na+盐,例如nacl或na2so4。
[0038]
产品或组合物可以包含于容器如小瓶、预先填充的药筒(例如用于单次施用或多次使用)或者注射装置如用于例如施用多个剂量的“笔(pen)”中。
[0039]
小瓶可以以泡罩包装或其它方式包装以维持无菌。任何产品可以任选地含有使用fsh(和例如hcg,如果存在的话)制剂的说明书。可以根据本领域的常规实践来调整药物组合物中的各种组分的ph和精确浓度。参见goodman和gilman的the pharmacological basis for therapeutices(治疗剂的药理学基础),第7版。在优选的实施方案中,本发明的组合物可以作为肠胃外施用的组合物进行供应。用于制备肠胃外制剂的一般方法是本领域中已知的并且在remington;the science and practice of pharmacy(雷明顿:药物科学和实践),见上文,在780-820页中描述。肠胃外组合物可以以液体制剂或作为固体供应,所述固体可以在施用前即刻与无菌可注射介质混合。在尤其优选的实施方案中,以易于施用和剂量均一性的剂量单位形式供应肠胃外组合物。
[0040]
现在将参考附图描述本发明,其中:
[0041]
图1显示了根据本发明的实施方案的重组fsh纯化(病毒灭活)方法的方案;
[0042]
图2显示了对于多种处理的uf2-ad(透析后超滤)fsh样品的杂质去除进行定性评估之后的凝胶图案,所述fsh样品在12%的还原page(聚丙烯酰胺凝胶电泳)上运行,其中泳道1是lmw(低分子量)标记,泳道2是样品缓冲液,泳道3是uf2-ad,泳道4是uf2-ad+10mm ca,ph 5.5,泳道5是uf2-ad+10mm ca,30%乙醇,ph 5.5,泳道6是样品缓冲液,泳道7是低范围mw,泳道8是uf2-ad,泳道9是uf2-ad+20mm ca,ph 5.5,且泳道10是uf2-ad+20mm ca,30%乙醇ph 5.5(参见实施例3);和
[0043]
图3显示了对于多种处理的hcg样品的杂质去除进行定性估计之后的凝胶图案,所述hcg样品在12%的还原page(聚丙烯酰胺凝胶电泳)上运行,其中泳道1是lmw(低分子量)标记,泳道2是含hcg的收获物-ad,泳道3是nr-不相关的(not relevant),泳道4是[收获物-ad+15mm c.aph 5.0]的上清,泳道5是[收获物-ad+20mm c.a+10%乙醇ph 5.0]的上清,参见实施例4。
[0044]
实施例1
[0045]
图1显示了整个重组fsh纯化过程的概述。从图1中可以看出,使用生物反应器在通过wo2013/020996和wo2009/127826a中公开的方法改造的细胞系中表达重组fsh。
[0046]
使用可从repligen获得的hollofibre(atf4)系统,通过本领域技术人员已知的方法将生物反应器接种并促进细胞生长,并且生物反应器以灌注模式运行以产生并连续收获重组fsh。在6gro培养基中以4
±
1升的总体积接种至少1x106个细胞/ml。生产发生在proper-1培养基中,并且生物反应器收获物被收集到聚乙烯袋中。因此,在该实施例中,蛋白质(糖蛋白)是通过以下方法在细胞系中产生的重组糖蛋白(重组fsh),所述方法包括在合适的培养基(proper-1培养基)中培养细胞系并且从培养基中收获重组糖蛋白(通过从细胞培养上清中收获重组蛋白质)。
[0047]
汇集生物反应器收获物并进行10kda超滤/渗滤步骤(uf1),所述超滤/渗滤步骤降低收获物的浓度,调节收获物(在ph和电导率方面)用于capto-q色谱,并且去除培养基的色素和低分子量组分。渗余物通过0.8+0.65μm的玻璃纤维过滤器过滤以澄清处理溶液(参见图1),并且随后经受0.2μm过滤作为生物负载对照。然后通过本领域熟知的方法使用capto-q阴离子交换色谱以捕获重组fsh,并且去除dna、内毒素、宿主细胞蛋白质和生产相关的杂质。进行另外的0.2μm过滤作为生物负载对照。
[0048]
过滤后的capto-q洗脱液通过本领域公知的方法进行另外的10kda超滤/渗滤(uf2),目的是在纯化/病毒灭活之前脱盐和减少体积。
[0049]
ca/etoh步骤
[0050]
uf2的渗余物是重组fsh在缓冲液(100mm乙酸铵,30mm nacl,ph 9.3
–
ph 9.7)中的溶液。蛋白质溶液的ph首先在搅拌的情况下在23
±
2℃从ph 9.3-ph 9.7降至ph 6.3
±
0.3,然后用20mm辛酸/30%乙醇(ca/etoh)的组合处理,然后进一步调节ph至4.5
–
5.6(通过1m hcl调节ph)。在该处理后,蛋白质溶液在搅拌的情况下在23
±2°
保持温育0.5小时至1小时(在这段时间期间发生病毒灭活并观察到白色薄片样沉淀)。在0.5小时-1小时结束时,将蛋白质溶液的温度降低到4
°‑
8℃,并且在不搅拌的情况下将溶液温育另外的14小时至18小时(例如14至16小时)(这使得hcp和无包膜病毒的沉淀继续)。ca/etoh处理步骤具有三重活性:(i)灭活包膜病毒;(ii)通过沉淀以及随后的澄清步骤(旨在去除沉淀物)清除无包膜病
毒;和(iii)通过沉淀去除宿主相关的蛋白质。
[0051]
沉淀的杂质(无包膜病毒和宿主相关的蛋白质)通过经由0.8+0.65微米的玻璃纤维过滤器过滤的步骤去除,该过滤步骤也澄清了重组fsh溶液。
[0052]
进行另外的0.2μm过滤作为生物负载对照。
[0053]
然后将溶液通过本领域熟知的方法进行磺丙基-琼脂糖(sulfopropyl-sepharose)阳离子交换色谱(sp-ff)以去除辛酸、乙醇和另外的宿主细胞蛋白质。进行另外的0.2μm过滤作为生物负载对照,然后使用苯基-琼脂糖(phenyl-sepharose)疏水相互作用色谱(ps-ff)进行额外的纯化步骤以去除游离的重组fsh亚基和宿主细胞蛋白质。
[0054]
将ps洗脱液进行第三次10kda超滤/渗滤步骤(uf3)以去除盐,并且调节溶液用于下一个步骤。进行另外的0.2μm过滤作为生物负载对照,然后进行羟磷灰石吸附色谱(hya),旨在去除离解的fsh亚基和碱性异源二聚体,然后进行另外的0.2μm过滤作为生物负载对照。
[0055]
q-sepharose阴离子交换色谱(qs-ff)“精制步骤”以结合/洗脱模式进行以去除宿主蛋白质、dna、内毒素和潜在的病毒。然后进行另外的生物负载对照0.2μm过滤,然后汇集qs mp并且进行纳米过滤以去除潜在的病毒。将上清进行第四次10kda超滤/渗滤步骤(uf4)以将重组fsh浓缩至0.5至1.1mg/ml,然后加入聚山梨醇酯20至0.005mg/ml的终浓度。这些是本领域熟知的透析和缓冲液调整步骤。将重组fsh进行最终的0.2μm过滤步骤,然后分装到初级包装中并在-20℃储存直到装运。
[0056]
申请人已经发现用辛酸/乙醇处理能够显著降低宿主相关的杂质。根据各种制造过程(数据未显示),通过上述ca/etoh步骤(和随后的玻璃纤维过滤)去除了64至79%的宿主相关的杂质,同时高产率的约90至95%的fsh被回收。这是宿主相关的杂质的显著降低,其通过简单的方法提供,而产物蛋白质(产物糖蛋白)的损失最小。
[0057]
表1总结了该步骤的显著的病毒清除效率,其显示了log
10
降低因子的总结,其在≥4.25至≥5.41的区域内。对数降低因子(lrf)≥4log
10
(例如,高达8log 10
或更高)通常被认为是高的、强的且有效的。
[0058]
表1log
10
降低因子(rfsh)的总结
[0059][0060]
(1)
使用emcv的研究含有处理之后的玻璃纤维过滤
[0061]
上述实施例涉及rfsh,但是本领域技术人员将会理解,上述方法[例如,ca/etoh步骤(和随后的玻璃纤维过滤)]可容易地适用于其它蛋白质(例如糖蛋白)如rhcg[例如,通过pct/gb2010/001854(公开为wo2011/042688)中的方法在细胞系中产生的rhcg]的纯化/病毒灭活。
[0062]
实施例2
[0063]
在本发明的方法的另一个实施例中,提供了hcg纯化/病毒灭活方法。与上述实施例1类似的方法(减去磺丙基-琼脂糖阳离子交换色谱(sp-ff)步骤)用于通过pct/gb2010/001854(公开为wo2011/042688)中的方法在per.c6细胞系中产生的rhcg的纯化/病毒灭活。申请人发现,在酸性ph通过辛酸和乙醇的化学灭活,即使用实施例1中描述的ca/etoh步骤,去除了约65%的非hcg杂质(通过沉淀),而高产率的约90%的hcg被回收。
[0064]
实施例中ca/etoh步骤的优异病毒清除效率在表2中总结。如通过所获得的高lrf(在≥5.31至≥5.48的范围内)所确定的,mulv的病毒灭活是有效的。对于ca/etoh处理和沉淀物去除,获得≥2.03和≥2.74之间的lrf。
[0065]
表2log
10
降低因子(rhcg)的总结
[0066][0067]
实施例3:评价含有rfsh的溶液中去除杂质的沉淀条件
[0068]
实验描述:
[0069]
使用实施例1的rfsh纯化方法(直到ca/etoh步骤)获得的uf2-ad(透析后超滤)中间体含有100mm乙酸铵+30mm nacl ph9.50
±
0.20,11.00
±
0.50ms/cm。将其等分,并使每个等分部分经历不同的沉淀条件用于去除杂质(rfsh可溶于溶液中)。测试的沉淀条件如下:
[0070]
1.未处理的uf2-ad(对照)
[0071]
2.uf2-ad+10mm辛酸(ca),ph 5.5
[0072]
3.uf2-ad+10mm ca,30%乙醇,ph 5.5
[0073]
4.uf2-ad+20mm ca,ph 5.5
[0074]
5.uf2-ad+20mm ca,30%乙醇,ph 5.5
[0075]
将所有处理过的样品在搅拌的情况下在rt温育30分钟,然后在不搅拌的情况下额外温育30分钟。另外的温育在2-8℃进行16-20小时。通过离心去除产生的沉淀物,同时收集上清。
[0076]
沉淀过程的性能参数:
[0077]
rfsh回收
[0078]
通过fsh elisa确定所有样品中的rfsh浓度,并且计算处理后每个样品的产量并列于表3中。
[0079]
从表3中可以看出,在用10mm ca、10mm ca+30%乙醇、20mm ca和20mm ca+30%乙醇沉淀后,分别回收了uf2-ad处理溶液中96%、106%、106%和98%的rfsh。这表明rfsh不被沉淀并且在溶液中保持可溶。
[0080]
杂质去除
[0081]
测量未处理的uf2-ad和处理过的uf2-ad的每种上清中280nm处的吸光度,并且计算杂质去除,如表3中所示。在用10mm ca、10mm ca+30%乙醇、20mm ca和20mm ca+30%乙醇沉淀之后,分别去除了uf2-ad中33.9%、64.9%、65.9%和68.8%的总a
280
杂质。
[0082]
未处理的uf2-ad和多种处理过的uf2-ad的上清在12%的还原page(聚丙烯酰胺凝胶电泳)上运行以定性评估杂质去除。凝胶图案在图2中显示。相对于分别通过10mm ca ph 5.5(泳道4)和20mm ca(泳道9)沉淀后获得的上清,通过10mm ca+30%乙醇(泳道5)和20mm ca+30%乙醇ph 5.5(泳道10)沉淀后获得的上清是实质上更纯的。这显示了在沉淀步骤中将乙醇添加到辛酸中的协同效应。
[0083]
实验结论:
[0084]
1.与仅使用辛酸获得的产品相比,用乙醇和辛酸沉淀uf2-ad导致更纯的产品。
[0085]
2.乙醇和辛酸的组合不沉淀rfsh,其在溶液中保持可溶,表明了这是高产率的纯化和病毒灭活步骤。
[0086]
表3.从不同的沉淀条件获得的中间体rfsh溶液中杂质去除的结果
[0087][0088][0089]
实施例4:评价含有hcg的收获物中杂质去除的沉淀条件
[0090]
实验描述:
[0091]
将含有hcg的收获物浓缩~40倍,并且通过10kda超滤(uf)系统用100mm甘氨酸、50mm nacl ph 9.0,6ms/cm缓冲液进行透析。在uf结束时,将回收的蛋白质溶液,即收获物-ad(透析后)材料等分,并且使每个等分部分经历不同的沉淀条件用于去除杂质(而hcg可溶于溶液中)。测试的沉淀条件如下(表4):
[0092]
1.未处理的收获物-ad,作为对照;
[0093]
2.收获物-ad+15mm ca,ph 5.0
[0094]
3.收获物-ad+20mm ca,ph 5.0
[0095]
4.收获物-ad+20mm ca+10%乙醇,ph 5.0。
[0096]
所有处理过的样品在搅拌的情况下在r.t温育1小时。通过离心去除产生的沉淀物,同时收集上清。
[0097]
沉淀过程的性能参数:
[0098]
hcg回收
[0099]
确定未处理的收获物和处理过的收获物ad的每个上清中的hcg浓度,并如表4中详述的计算回收率。
[0100]
杂质去除
[0101]
确定未处理的收获物和处理过的收获物ad的每个上清中的280nm处的吸光度(a
280
),并如表4中详述的计算杂质去除。
[0102]
未处理的收获物和多种处理过的收获物ad的上清在12%的还原page(聚丙烯酰胺凝胶电泳)上运行以定性评估杂质去除。凝胶图案在图3中显示。
[0103]
讨论:
[0104]
1.hcg回收-在用15mm ca、20mm ca和20mm ca+10%乙醇沉淀之后分别回收了收获物-ad中91%、86%和83%的hcg。
[0105]
2.通过a
280
的杂质去除-在用15mm ca、20mm ca和20mm ca+10%乙醇沉淀之后分别去除了收获物-ad中56.6%、55.8%和63.0%的总a
280
。
[0106]
3.通过凝胶的杂质去除-相对于通过15mm caph 5.0(泳道4)的沉淀之后获得的上清,通过20mm ca+10%乙醇ph 5.0(泳道5)的沉淀之后获得的上清是实质上更纯的。
[0107]
结论:
[0108]
1.与仅使用辛酸获得的相比,添加了乙醇和辛酸的含hcg的收获物的沉淀导致更纯的产品。
[0109]
表4.从不同的沉淀条件获得的含有hcg的收获物中杂质去除的结果
[0110]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1