外泌体分离纯化方法与流程
1.本发明属于生物技术领域,尤其是涉及一种外泌体分离纯化方法。
背景技术:
2.外泌体是由活细胞分泌的直径约为30-200 nm的小囊泡,具有典型的脂质双分子层结构及茶托型结构,主要分泌于细胞培养上清液、乳汁、血清、血浆、唾液、尿液、羊水及植物组织中;外泌体携带有多种蛋白质、脂类、rna等重要信息,不仅在细胞与细胞间的物质和信息传递中起重要作用,更有望成为多种治疗药物的载体及一些疾病的早期诊断标志物。
3.牛奶外泌体是进化上保守的独特微泡类别,其在穿过胃和胃肠道途中保持其内含的核酸和蛋白质的完整性,它们可以在局部发挥作用或被运送到循环系统中。此外,牛奶外泌体比其他天然存在的外泌体更稳定,其在酸性条件下或其他恶劣条件下表现出比其他来源的外泌体更高的稳定性,同时作为外泌体它具有低免疫原性及高度的血脑屏障通透性。牛奶外泌体的这种特性可用来实现蛋白质、多肽、核酸、小分子化学物等药物的载体,并可通过口服给药增加药物的耐受性。
4.目前外泌体制备方法主要由以下几种方法:一是离心法,主要通过增加离心力逐级沉降或使用特定的介质根据外泌体自身密度使其悬浮于特定的位置,从而达到外泌体的分离、纯化的目的。离心法目前是提取分离外泌体最常用的方法,被认为是分离外泌体的“金标准”,其优点是操作简单,分离的外泌体纯度较高,但整个工艺处理时间长通常大于5h,同时样品量受离心机限制处理量较少,所分离的外泌体的种类、数量及质量受离心过程参数(离心力及离心时间)影响较大,样品质量属性的重现性较差。
5.二是peg多聚物沉淀法,该方法主要通过多聚物与疏水性蛋白和脂质分子结合共沉淀达到分离外泌体的目的,此方法操作简单,可实现大批量分离且能显著提高外泌体产量,但获得外泌体纯度较低,通常混有大量共沉淀的蛋白及核酸杂质。
6.三是亲和层析法,包括免疫亲和层析及磷脂酰丝氨酸亲和层析法,此方法是一种通过外泌体表面的膜蛋白(cd9、cd81、cd63、tim4)与其相应的抗体或磷脂酰丝氨酸亲和吸附来达到外泌体的分离,此方法分离的外泌体特异性及纯度高,外泌体形态完整,但亲和层析介质昂贵,纯度成本较高,无法进行工业大规模分离纯化。尤其亲和层析过程需要先将外泌体吸附,再通过洗脱的方式将其分离获得,从操作上来看更为复杂。
7.四是超滤法,此方法通过不同截留分子量的超滤膜将外泌体与样本中杂质分子根据其大小进行分离纯化,具有操作过程简单、样品处理量大及较高的浓缩倍数的优点,但分离后的外泌体纯度较低。
8.五是尺寸排阻色谱法,该方法通过外泌体与杂质分子量大小的不同,在经过层析柱中不同孔径及粒径的凝胶填料时达到分离纯化的目的,具有操作简单、重现性好及纯度高等优点,但样品处理量较少,对层析设备有较高要求。
9.综上所述,目前外泌体的分离纯化方式存在无法同时满足高纯度、低成本、高回收
率及工业化生产等问题,尤其面对处理大量原料时,获得的外泌体纯度和产量更是需要付出极大代价。
技术实现要素:
10.为解决上述技术问题,本发明提供一种外泌体分离纯化方法。
11.本发明采用的技术方案是:外泌体分离纯化方法,取含有外泌体的体液或培养液,先3000g-8000g离心,离心后取上清和/或过滤器除蛋白的方法去除沉淀蛋白,然后通过深层滤器进行深层过滤去除脂肪球,再经阴离子交换层析、阳离子交换层析和分子筛层析,获得的流穿液为纯化后的外泌体溶液。
12.优选地,进行阴离子交换层析、阳离子交换层析和/或分子筛层析前预先进行超滤。
13.优选地,阴离子交换层析填料的配基为强阴离子交换配基或弱阴离子交换配基。
14.优选地,阴离子交换配基为季铵基、二乙氨基乙基、二乙氨基丙基中的一种或几种的组合,填料粒径范围为15-300μm,孔径范围为20-150nm,阴离子交换层析过程中平衡缓冲液ph为7.0-7.4,缓冲液电导率不高于10ms/cm。
15.优选地,阳离子交换层析填料的配基为强阳离子交换配基或弱阳离子交换配基。
16.优选地,阳离子交换配基为磺酸基丙基或羧甲基的一种或两种的组合,填料粒径范围为15-300μm,孔径范围为20-150nm,阳离子交换层析过程中平衡缓冲液ph为8.0-8.4,缓冲液电导率不高于10ms/cm。
17.优选地,含有外泌体的体液为乳源样品时,预先对样品进行杂质去除处理;杂质去除处理为酸沉淀、凝乳酶处理和盐析处理中的一种或多种的组合。
18.优选地,杂质去除处理为去除杂质蛋白和/或脂肪球,其中杂质蛋白为酪蛋白及其他等电点为ph4.0-5.5的杂蛋白。
19.优选地,具体步骤如下:一级纯化:对乳源样品进行杂质去除处理,去除杂质后得到外泌体粗提液;二级纯化:实施方式一、方式二和方式三的纯化步骤,其中方式一、方式二和方式三能够按照任意顺序进行排布,方式一、方式二和方式三均至少包括一次;可按照方式一-方式二-方式三的顺序,或者按照方式二-方式一-方式三的顺序,或者按照方式三-方式一-方式二的顺序,或者按照方式一-方式三-方式二的顺序,或可根据实际情况对某一种方式重复进行,如按照方式一-方式三-方式二-方式三的顺序,以及其他类似规律的排布方式均属于本发明所要求权利范围;方式一:将上一步骤纯化所得溶液通过超滤膜包或中空纤维柱进行超滤浓缩换液;对浓缩后的外泌体粗提液进行阴离子交换层析进行纯化,取流穿液;方式二:将上一步骤纯化所得溶液通过超滤膜包或中空纤维柱进行超滤浓缩换液;对浓缩后的外泌体溶液进行阳离子交换层析进行纯化,取流穿液;方式三:将上一步骤纯化所得溶液通过超滤膜包或中空纤维柱进行超滤浓缩换液;
对浓缩后的外泌体溶液进行分子筛层析进行纯化,取外水峰范围流穿液;最终获得的外泌体纯化溶液即为纯化后的外泌体溶液。
20.优选地,乳源样品为生乳样品、脱脂乳样品或巴氏消毒乳样品。
21.本发明具有的优点和积极效果是:在大规模的外泌体需求中,能够低成本、高效率的获得高纯度的外泌体;与现有的外泌体纯化方法如离心法、peg多聚物沉淀法、亲和层析法、超滤法、分子筛尺寸排阻色谱法相比,本发明可以实现不同体积(100ml至500l)外泌体连续纯化,以流穿的模式代替传统色谱柱的洗脱模式,简化分离步骤,缩短纯化周期,不同色谱柱配合使用时,更显优势;尤其处理杂质蛋白较多的乳源制品,也可获得纯度99%的乳源外泌体,同时与具有低成本及高回收率的优势,能满足工业化生产的需求。
附图说明
22.图1是本发明的实施例1中最终纯化后的外泌体电镜观察示意图;图2是本发明的实施例2中最终纯化后的外泌体电镜观察示意图;图3是本发明的实施例3中最终纯化后的外泌体电镜观察示意图;图4是本发明的实施例4中最终纯化后的外泌体电镜观察示意图;图5是本发明的实施例5中最终纯化后的外泌体电镜观察示意图;图6是本发明的对比例1中最终纯化后的外泌体电镜观察示意图;图7是本发明的实施例1中最终纯化后的外泌体蛋白标志物检测示意图;图8是本发明的实施例2中最终纯化后的外泌体蛋白标志物检测示意图;图9是本发明的实施例3中最终纯化后的外泌体蛋白标志物检测示意图;图10是本发明的实施例4中最终纯化后的外泌体蛋白标志物检测示意图;图11是本发明的实施例5中最终纯化后的外泌体蛋白标志物检测示意图;图12是本发明的对比例1中最终纯化后的外泌体蛋白标志物检测示意图;图13是本发明的实施例1中最终纯化后的外泌体粒径分布示意图;图14是本发明的实施例2中最终纯化后的外泌体粒径分布示意图;图15是本发明的实施例3中最终纯化后的外泌体粒径分布示意图;图16是本发明的实施例4中最终纯化后的外泌体粒径分布示意图;图17是本发明的实施例5中最终纯化后的外泌体粒径分布示意图;图18是本发明的对比例1中最终纯化后的外泌体粒径分布示意图;图19是本发明的实施例1中最终纯化后的外泌体纯度示意图;图20是本发明的实施例2中最终纯化后的外泌体纯度示意图;图21是本发明的实施例3中最终纯化后的外泌体纯度示意图;图22是本发明的实施例4中最终纯化后的外泌体纯度示意图;图23是本发明的实施例5中最终纯化后的外泌体纯度示意图;图24是本发明的对比例1中最终纯化后的外泌体纯度示意图。
具体实施方式
23.下面结合附图对本发明的实施例做出说明。
24.本发明涉及一种外泌体分离纯化方法,取含有外泌体的体液或培养液,采用流穿
模式经过阴离子交换层析、阳离子交换层析及分子筛层析后直接获得纯化后的外泌体溶液。外泌体可来源于血清,乳清或其他体液,亦或可来源于真核/原核细胞培养上清液。依次对含有外泌体的溶液进行阴离子交换层析、阳离子交换层析和/或分子筛层析,采用流穿模式,通过各个色谱柱的填料对不同种类杂质的吸附作用,充分去除外泌体溶液中其他杂质,从而获得高纯度的外泌体溶液。本发明某些实施例中,在层析之前预先进行超滤浓缩,降低了层析填料的使用体积并提高了层析效率。
25.阴离子交换层析填料的配基为强阴离子交换配基或弱阴离子交换配基,优选的填料配基为季铵基、二乙氨基乙基、二乙氨基丙基中的一种或几种的组合,其中,填料粒径范围为15-300μm,孔径范围为20-150nm,可选的填料包括cityva公司的capto q、capto deae、capto q impres、q sepharose xl,bio-rad公司的nuvia hp-q 、nuvia-q,默克公司的fractogel
®ꢀ
emd tmae 、fractogel
®ꢀ
emd deae填料及国产同类型填料。层析填料使用平衡缓冲液平衡1-10个柱体积,然后将调节ph后的样品按样品体积与层析柱柱体积1:2至1:10的比值进行上样,调节上样样品ph为7.0-7.4,阴离子交换层析过程中平衡缓冲液ph为7.0-7.4,上样样品与平衡缓冲液ph相同,缓冲液电导率不高于10ms/cm,上样过程中样品在层析柱上的保留时间不低于1min,阴离子层析开始后收集流穿液,流穿液中即为含有外泌体的样品。本步骤根据外泌体及杂质的特性,杂质将吸附在层析填料上,而目标外泌体不结合在层析柱上从而达到分离杂质与外泌体的目的。
26.阳离子交换层析填料的配基为琼脂糖或聚丙烯酸酯聚合物,填料配基为羧甲基、羧甲基的一种或两种的组合,其中所用层析填料粒径范围为15-300μm之间,孔径范围为20-150nm之间,可选的填料包括cityva公司的captosp、captospimpres、captospimpact填料及国产同类型填料。层析填料使用平衡缓冲液平衡1-10个柱体积,然后将调节ph后的样品按样品体积与层析柱柱体积1:2至1:10的比值进行上样,调节上样样品ph为8.0-8.4,阳离子交换层析过程中平衡缓冲液ph为8.0-8.4,上样样品与平衡缓冲液ph相同,缓冲液电导率不高于10ms/cm,上样过程中样品在层析柱上的保留时间不低于1min,阳离子层析开始后收集流穿液,流穿液中即为含有外泌体的样品。本步骤根据外泌体及杂质的特性,杂质将吸附在层析填料上,而目标外泌体不结合在层析柱上从而达到分离杂质与外泌体的目的。
27.分子筛层析填料的分离范围为1kd-20000kd,可选的填料包括不同厂家的4ff、6ff、6pg等填料,层析过程中所用缓冲液的ph范围为5-10,外泌体样品在分子筛层析过程中的外水峰中。
28.本发明尤其适合用于提取并纯化乳源样品中的外泌体,乳源来源广泛,但是乳源中外泌体以外的杂质更多,种类更为繁杂,使用传统方法处理乳源样本时,得到的外泌体纯度会受到严重影响,而使用本发明所公开的纯化方法,分类别分次序依次去除不同种类的杂质,真正实现高效率高纯度的纯化过程。当含有外泌体的体液为乳源样品时,需预先对样品进行杂质去除处理,杂质去除处理为酸沉淀、凝乳酶处理和盐析处理中的一种或多种的组合,目的在于去除杂质蛋白和/或脂肪球。其中杂质蛋白为酪蛋白及其他等电点为ph4.0-5.5的杂蛋白,普遍存在于乳源样品中;脂肪球由于其粒径与外泌体相似,严重影响外泌体纯度;本方案某些实施例中,可通过离心分离含有外泌体和粗提液、脂肪球和杂质蛋白,杂质蛋白位于粗提液下部,脂肪球位于粗提液上部,采用中速离心,其中离心力可设置为3000-8000g。本方案某些实施例中酸沉淀可采用盐酸、磷酸、醋酸、柠檬酸、硫酸、乳酸中的
一种或几种的组合进行酸沉淀。
29.乳源样品外泌体溶液纯化过程具体步骤如下:对乳源样品进行杂质去除处理,首先将样品ph最终调节至4.0-5.5之间,然后静置沉杂蛋白时间不低于5min,通过酸沉淀去除主要杂蛋白酪蛋白及其他等电点为ph4.0-5.5的杂蛋白;去除沉淀蛋白后得到外泌体粗提液;在本发明某些实施例中,可通过离心后取上清和/或过滤器除蛋白的方法去除沉淀蛋白;离心后取上清可采用离心力3000g-8000g,离心时间为10-30min,将沉淀的杂蛋白与含有外泌体的上清进行分离,同时能够去除脂肪球;使用过滤器去除沉淀蛋白,过滤器可采用袋式过滤器,其截留孔径范围为1μm-20μm,将沉淀后的杂蛋白截留在过滤器中,含有外泌体的澄清溶液穿透滤器并进行收集,达到了快速的固液分离;在本发明某些实施例中,可单独采用一种方法除去沉淀蛋白,也可根据外泌体来源类型依次采用两种方式除去沉淀蛋白;深层过滤:将离心后或过滤后的上清溶液使用截留孔径大小为0.5-10μm的深层滤器进一步澄清过滤以去除残留酪蛋白沉淀及脂肪微球,过滤速度为80-150l/m2/h,收获上清溶液。
30.将外泌体粗提液通过截留分子量为30-750kd超滤膜包或中空纤维柱进行超滤浓缩换液,浓缩倍数为2-10倍,随后使用缓冲液进行等体积换液,换液倍数为2-10倍;超滤换液后的样品使用2m tris或0.5m naoh溶液调节ph至6-10;对浓缩外泌体粗提液进行阴离子交换层析,阴离子交换层析填料基质为琼脂糖或聚丙烯酸酯聚合物,填料配基为季铵基、二乙氨基乙基、二乙氨基丙基中的一种或几种的组合,其中所用层析填料粒径范围为15-300μm之间,孔径范围为20-150nm之间;阴离子交换层析根据目标外泌体与主要杂质如乳清蛋白、酪蛋白之间表面所带电荷的差异及缓冲液体系的盐离子浓度和ph的不同,将含有外泌体的样品流经层析填料过程中,杂质可吸附在阴离子层析填料上而目标外泌体不吸附,进而达到分离外泌体的目的。层析填料使用平衡缓冲液平衡1-10个柱体积,然后将调节ph后的样品按样品体积与层析柱柱体积1:2至1:10的比值进行上样,阴离子交换层析过程中平衡缓冲液ph为7.0-7.4,缓冲液电导率不高于10ms/cm,上样过程中样品在层析柱上的保留时间不低于1min,阴离子层析开始后收集流穿液,获得的流穿液为外泌体溶液;对浓缩外泌体粗提液进行阳离子交换层析,阳离子交换层析填料基质为琼脂糖或聚丙烯酸酯聚合物,填料配基为羧甲基、羧甲基的一种或两种的组合,其中所用层析填料粒径范围为15-300μm之间,孔径范围为20-150nm之间;阳离子交换层析根据目标外泌体与杂质蛋白如免疫球蛋白g、免疫球蛋白m、免疫球蛋白a之间表面所带电荷的差异及缓冲液体系的盐离子浓度和ph的不同,将含有外泌体的样品流经层析填料过程中,杂质可吸附在阳离子层析填料上而目标外泌体不吸附,进而达到分离外泌体的目的。层析填料使用平衡缓冲液平衡1-10个柱体积,然后将调节ph后的样品按样品体积与层析柱柱体积1:2至1:10的比值进行上样,阳离子交换层析过程中平衡缓冲液ph为8.0-8.4,缓冲液电导率不高于10ms/cm,上样过程中样品在层析柱上的保留时间不低于1min,阳离子层析开始后收集流穿液,获得的流穿液为外泌体溶液;将外泌体样品液通过截留分子量为30-750kd超滤膜包或中空纤维柱进行超滤浓
缩换液,超滤浓缩倍数为1-20倍,换液倍数为1-20倍,超滤换液所用缓冲液ph范围为4-10;对浓缩外泌体溶液进行分子筛层析,分子筛层析填料的分离范围为1kd-20000kd,分子筛层析是由不同孔径大小的层析填料组成,大的物质不能进入填料孔内只能流经填料外水体积,因而在层析过程中优先从层析填料中流出,而小分子物质流经填料孔内,所经过的路径大于体积更大的外泌体,在层析过程中较晚流出,进而达到分离外泌体及小分子物质的目的。分子筛层析过程中所用缓冲液的ph范围为5-10,取外水峰范围流穿液即为纯化后的外泌体溶液。
31.其中,可先进行阴离子交换层析,再进行阳离子交换层析,最后再经分子筛层析;也可以先进行阳离子交换层析,再进行阴离子交换层析,最后再经分子筛层析,可根据实际情况选择顺序,为了节省流程,减少操作步骤,阴离子交换层析和阳离子交换层析步骤间可省略超滤浓缩过程。
32.本发明可用于提取并纯化不同类型乳源样品中的外泌体,乳源样品可为生乳样品、脱脂乳样品或巴氏消毒乳样品。本发明即便在大规模的外泌体需求中,也能够低成本、高效率的获得高纯度的外泌体;与现有的外泌体纯化方法如离心法、peg多聚物沉淀法、亲和层析法、超滤法、分子筛尺寸排阻色谱法相比,本发明可以实现不同体积(100ml至500l)外泌体纯化,同时具有低成本及高回收率的优势,可连续生产,能满足工业化生产的需求。
33.下面以牛乳外泌体为例,结合具体实施例对本发明方案做出说明,其中,未具体说明操作步骤的实验方法,均按照相应商品说明书进行,实施例中所用到的仪器、试剂、耗材如无特殊说明,均可从商业公司购买得到。
34.实施例1步骤一1.1 酸沉取2l牛奶使用盐酸调节ph至4.6,调节ph过程中使用磁力搅拌器室温搅拌,然后静置酸沉60min。
35.1.2样品澄清将酸沉后样品置于离心杯中,使用离心机在离心力3500g条件下离心30min,取离心后上清。或使用科百特截留孔径为10μm的袋式过滤器进行过滤,过滤速度为50ml/min,取过滤后上清溶液。
36.1.3 深层过滤将离心后或过滤后的上清溶液使用截留孔径大小为0.5-10μm的深层滤器进一步澄清过滤,过滤速度为100l/m2/h,获得上清溶液。
37.步骤二2.1缓冲溶液制备a.配置0.5m naoh 溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
38.b.配置ph7.4,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
39.c.配置1m nacl溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
40.d.配置10mm naoh 溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
41.e.配置ph4.6,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
42.f.配置ph8.0,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
43.2.2超滤浓缩换液超滤膜包:100kd超滤膜包超滤缓冲液:ph4.6,20mm磷酸盐缓冲液。
44.将深层过滤后样品使用超滤膜包先浓缩5倍,浓缩过程中进液端流速控制在100ml/min,跨膜压控制在2.9psi,回流端压力不控制。浓缩结束后使用超滤换液缓冲液等体积换液10倍。
45.2.3样品调节ph使用0.5m氢氧化钠溶液调节超滤换液后样品ph至8.0。
46.2.4阳离子交换层析a.连接80mlspsepharose high performance层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph8.0,20mm磷酸盐缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
47.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
48.c.使用ph8.0 ,20mm磷酸盐缓冲液平衡层析柱ph至8.0,平衡完毕后设置层析系统紫外检测器归零。
49.d.使用akta150层析系统上样泵上样,上样流速为4ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
50.e.步骤d结束后使用1m nacl溶液再生层析柱,然后使用0.5m naoh 溶液清洗层析柱。
51.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
52.步骤三3.1 阴离子交换层析a.连接100mlcaptodeae层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.4,20mm磷酸盐缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
53.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
54.c.使用ph7.4 ,20mm磷酸盐缓冲液平衡层析柱ph至7.4,平衡完毕后设置层析系统紫外检测器归零。
55.d.将阳离子交换层析后样品调节ph至7.4,使用akta150层析系统上样泵上样,上样流速为20ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
56.e.步骤d结束后使用1m nacl溶液清洗层析柱,然后使用0.5m naoh 溶液清洗层析柱。
57.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
58.步骤四4.1超滤浓缩换液
a.设置中空纤维超滤系统泵流速为100ml/min,使用0.5m naoh 溶液将100kd 中空纤维柱循环重洗30-60min,然后使用注射水清洗2l。
59.b.设置中空纤维超滤系统泵流速为100ml/min,使用ph7.4,20mm磷酸盐缓冲液平衡中空纤维柱至中空纤维柱透过端溶液ph为7.4。
60.c.设置中空纤维超滤系统跨膜压为5psi,系统泵流速为100ml/min,超滤浓缩倍数为5倍,使用ph7.4,20mm磷酸盐缓冲液等体积换液倍数为5倍。
61.4.2分子筛层析a. 连接200ml6ff层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.4,20mm磷酸盐缓冲液瓶中。
62.b.使用0.5m naoh 溶液以线性流速20cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
63.c.使用ph7.4,20mm磷酸盐缓冲液平衡层析柱ph至7.4,平衡完毕后设置层析系统紫外检测器归零。
64.d.将超滤后样品使用akta150层析系统上样泵上样,上样流速为20cm/h,上样完毕后,层析系统紫外吸收值上升时开始收集,第一个外水峰紫外吸收值降至平稳时结束收集,收集的第一个外水峰样品即为牛奶外泌体样品,收集样品放置于-80℃低温保存。
65.e.步骤d结束后使用使用0.5m naoh 溶液清洗层析柱。
66.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
67.实施例2步骤一1.1 酸沉取2l牛奶使用盐酸调节ph至4.6,调节ph过程中使用磁力搅拌器室温搅拌,然后静置酸沉60min。
68.1.2样品澄清将酸沉后样品置于离心杯中,使用离心机在离心力3500g条件下离心30min,取离心后上清。或使用科百特截留孔径为10μm的袋式过滤器进行过滤,过滤速度为50ml/min,取过滤后上清溶液。
69.1.3 深层过滤将离心后或过滤后的上清溶液使用截留孔径大小为0.5-10μm的深层滤器进一步澄清过滤,过滤速度为100l/m2/h,获得上清溶液。
70.步骤二2.1缓冲溶液制备a.配置0.5m naoh 溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
71.b.配置ph7.0,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
72.c.配置1m nacl溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
73.d.配置10mm naoh 溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
74.e.配置ph4.6,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
75.f.配置ph8.4,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
76.g.配置ph7.4,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
77.2.2超滤浓缩换液超滤膜包:100kd超滤膜包超滤缓冲液:ph4.6,20mm磷酸盐缓冲液。
78.将深层过滤后样品使用超滤膜包先浓缩5倍,浓缩过程中进液端流速控制在100ml/min,跨膜压控制在2.9psi,回流端压力不控制。浓缩结束后使用超滤换液缓冲液等体积换液10倍。
79.2.3样品调节ph使用0.5m氢氧化钠溶液调节超滤换液后样品ph至8.4。
80.2.4阳离子交换层析a.连接80mlspsepharose high performance层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph8.4,20mm磷酸盐缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
81.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
82.c.使用ph8.4 ,20mm磷酸盐缓冲液平衡层析柱ph至8.4,平衡完毕后设置层析系统紫外检测器归零。
83.d.使用akta150层析系统上样泵上样,上样流速为4ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
84.e.步骤d结束后使用1m nacl溶液再生层析柱,然后使用0.5m naoh 溶液清洗层析柱。
85.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
86.步骤三3.1阴离子交换层析a.连接100mlcaptodeae层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.0,20mm磷酸盐缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
87.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
88.c.使用ph7.0,20mm磷酸盐缓冲液平衡层析柱ph至7.0,平衡完毕后设置层析系统紫外检测器归零。
89.d.将阳离子交换层析后样品调节ph至7.0,使用akta150层析系统上样泵上样,上样流速为20ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
90.e.步骤d结束后使用1m nacl溶液清洗层析柱,然后使用0.5m naoh 溶液清洗层析柱。
91.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
92.步骤四4.1超滤浓缩换液
a.设置中空纤维超滤系统泵流速为100ml/min,使用0.5m naoh 溶液将100kd 中空纤维柱循环重洗30-60min,然后使用注射水清洗2l。
93.b.设置中空纤维超滤系统泵流速为100ml/min,使用ph7.4,20mm磷酸盐缓冲液平衡中空纤维柱至中空纤维柱透过端溶液ph为7.4。
94.c.设置中空纤维超滤系统跨膜压为5psi,系统泵流速为100ml/min,超滤浓缩倍数为5倍,使用ph7.4,20mm磷酸盐缓冲液等体积换液倍数为5倍。
95.4.2分子筛层析a. 连接200ml6ff层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.4,20mm磷酸盐缓冲液瓶中。
96.b.使用0.5m naoh 溶液以线性流速20cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
97.c.使用ph7.4,20mm磷酸盐缓冲液平衡层析柱ph至7.4,平衡完毕后设置层析系统紫外检测器归零。
98.d.将超滤后样品使用akta150层析系统上样泵上样,上样流速为20cm/h,上样完毕后,层析系统紫外吸收值上升时开始收集,第一个外水峰紫外吸收值降至平稳时结束收集,收集的第一个外水峰样品即为牛奶外泌体样品,收集样品放置于-80℃低温保存。
99.e.步骤d结束后使用使用0.5m naoh 溶液清洗层析柱。
100.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
101.实施例3步骤一1.1 酸沉取2l牛奶使用盐酸调节ph至4.6,调节ph过程中使用磁力搅拌器室温搅拌,然后静置酸沉60min。
102.1.2样品澄清将酸沉后样品置于离心杯中,使用离心机在离心力3500g条件下离心30min,取离心后上清。或使用科百特截留孔径为10μm的袋式过滤器进行过滤,过滤速度为50ml/min,取过滤后上清溶液。
103.1.3 深层过滤将离心后或过滤后的上清溶液使用截留孔径大小为0.5-10μm的深层滤器进一步澄清过滤,过滤速度为100l/m2/h,获得上清溶液。
104.步骤二2.1缓冲溶液制备a.配置0.5m naoh 溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
105.b.配置ph7.4,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
106.c.配置1m nacl溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
107.d.配置10mm naoh 溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
108.e.配置ph4.6,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
109.f.配置ph8.0,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
110.2.2超滤浓缩换液超滤膜包:100kd超滤膜包超滤缓冲液:ph4.6,20mm磷酸盐缓冲液。
111.将深层过滤后样品使用超滤膜包先浓缩5倍,浓缩过程中进液端流速控制在100ml/min,跨膜压控制在2.9psi,回流端压力不控制。浓缩结束后使用超滤换液缓冲液等体积换液10倍。
112.2.3样品调节ph使用0.5m氢氧化钠溶液调节超滤换液后样品ph至7.4。
113.2.4阴离子交换层析a.连接100mlcaptodeae层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.4,20mm磷酸盐缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
114.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
115.c.使用ph7.4,20mm磷酸盐缓冲液平衡层析柱ph至7.4,平衡完毕后设置层析系统紫外检测器归零。
116.d.将超滤后样品使用akta150层析系统上样泵上样,上样流速为20ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
117.e.步骤d结束后使用1m nacl溶液清洗层析柱,然后使用0.5m naoh 溶液清洗层析柱。
118.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
119.3.1阳离子交换层析a.连接80mlspsepharose high performance层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph8.0,20mm磷酸盐缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
120.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
121.c.使用ph8.0,20mm磷酸盐缓冲液平衡层析柱ph至8.0,平衡完毕后设置层析系统紫外检测器归零。
122.d.将阴离子交换层析后样品0.1m naoh调节ph至8.0,使用akta150层析系统上样泵上样,上样流速为4ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
123.e.步骤d结束后使用1m nacl溶液再生层析柱,然后使用0.5m naoh 溶液清洗层析柱。
124.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
125.步骤四4.1超滤浓缩换液a.设置中空纤维超滤系统泵流速为100ml/min,使用0.5m naoh 溶液将100kd 中
空纤维柱循环重洗30-60min,然后使用注射水清洗2l。
126.b.设置中空纤维超滤系统泵流速为100ml/min,使用ph7.4,20mm磷酸盐缓冲液平衡中空纤维柱至中空纤维柱透过端溶液ph为7.4。
127.c.设置中空纤维超滤系统跨膜压为5psi,系统泵流速为100ml/min,超滤浓缩倍数为5倍,使用ph7.4,20mm磷酸盐缓冲液等体积换液倍数为5倍。
128.4.2分子筛层析a. 连接200ml6ff层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.4,20mm磷酸盐缓冲液瓶中。
129.b.使用0.5m naoh 溶液以线性流速20cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
130.c.使用ph7.4,20mm磷酸盐缓冲液平衡层析柱ph至7.4,平衡完毕后设置层析系统紫外检测器归零。
131.d.将超滤后样品使用akta150层析系统上样泵上样,上样流速为20cm/h,上样完毕后,层析系统紫外吸收值上升时开始收集,第一个外水峰紫外吸收值降至平稳时结束收集,收集的第一个外水峰样品即为牛奶外泌体样品,收集样品放置于-80℃低温保存。
132.e.步骤d结束后使用使用0.5m naoh 溶液清洗层析柱。
133.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
134.实施例4步骤一1.1 杂质去除取2l牛奶置于烧杯中,将0.5mol/l氯化钙溶液加入上述溶液中至其终浓度为0.001mol/l,随后按照终浓度为5su/ml加入凝乳酶,使用磁力搅拌器30℃搅拌均匀。
135.1.2 样品澄清将凝乳酶沉淀酪蛋白后样品置于离心杯中,使用离心机在离心力4000g条件下离心30min,取离心后上清。或使用科百特截留孔径为10μm的袋式过滤器进行过滤,过滤速度为50ml/min,取过滤后上清溶液。
136.1.3 深层过滤将离心后或过滤后的上清溶液使用截留孔径大小为0.5-10μm的深层滤器进一步澄清过滤,过滤速度为100l/m2/h,获得上清溶液。
137.步骤二2.1缓冲溶液制备a.配置0.5m naoh 溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
138.b.配置ph7.4,20mmtris-hcl缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
139.c.配置1m nacl溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
140.d.配置10mm naoh 溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
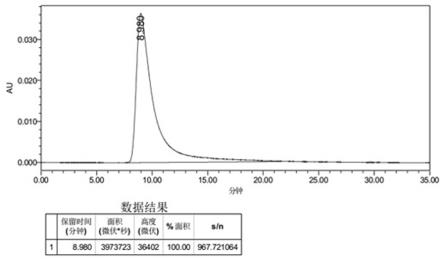
141.e.配置ph8.0,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
142.f.配置ph7.4,20mm磷酸盐缓冲液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
143.2.2超滤浓缩换液中空纤维柱:100kd中空纤维柱;超滤缓冲液:ph4.6 20mmtris-hcl缓冲液。
144.将深层过滤后样品使用超滤膜包或中空纤维柱先浓缩5倍,浓缩过程中进液端流速控制在100ml/min,跨膜压控制在5psi,回流端压力不控制。浓缩结束后使用超滤换液缓冲液等体积换液5倍。
145.2.3 样品调节ph使用2m tris溶液调节超滤换液后样品ph至7.4。
146.2.4阴离子交换层析a.连接100ml capto q层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.4,20mmtris-hcl缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
147.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
148.c.使用ph7.4,20mmtris-hcl缓冲液平衡层析柱ph至7.4,平衡完毕后设置层析系统紫外检测器归零。
149.d.将超滤后样品使用akta150层析系统上样泵上样,上样流速为20ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
150.e.步骤d结束后使用1m nacl溶液清洗层析柱100ml,然后使用0.5m naoh 溶液清洗层析柱。
151.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
152.步骤三3.1阳离子交换层析a.连接80ml sp sepharose high performance层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph8.0,20mm磷酸盐缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
153.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
154.c.使用ph8.0,20mm磷酸盐缓冲液平衡层析柱ph至8.0,平衡完毕后设置层析系统紫外检测器归零。
155.d.将阴离子交换层析后样品0.1m naoh调节ph至8.0,使用akta150层析系统上样泵上样,上样流速为4ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
156.e.步骤d结束后使用1m nacl溶液清洗层析柱,然后使用0.5m naoh 溶液清洗层析柱。
157.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
158.步骤四4.1超滤浓缩换液a.设置中空纤维超滤系统泵流速为100ml/min,使用0.5m naoh 溶液将100kd 中
空纤维柱循环重洗30-60min,然后使用注射水清洗2l。
159.b.设置中空纤维超滤系统泵流速为100ml/min,使用ph7.4,20mm磷酸盐缓冲液平衡中空纤维柱至中空纤维柱透过端溶液ph为7.4。
160.c.设置中空纤维超滤系统跨膜压为5psi,系统泵流速为100ml/min,超滤浓缩倍数为5倍,使用ph7.4,20mm磷酸盐缓冲液等体积换液倍数为5倍。
161.4.2 分子筛层析a. 连接200ml4ff层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.4,20mmtris-hcl缓冲液瓶中。
162.b.使用0.5m naoh 溶液以线性流速20cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
163.c.使用ph7.4,20mmtris-hcl缓冲液平衡层析柱ph至7.4,平衡完毕后设置层析系统紫外检测器归零。
164.d.将超滤后样品使用akta150层析系统上样泵上样,上样流速为20cm/h,上样完毕后,层析系统紫外吸收值上升时开始收集,第一个外水峰紫外吸收值降至平稳时结束收集,收集的第一个外水峰样品即为牛奶外泌体样品,收集样品放置于-80℃低温保存。
165.e.步骤d结束后使用使用0.5m naoh 溶液清洗层析柱。
166.f.层析柱清洗完毕后使用10mm naohl保存层析柱。
167.实施例5步骤一1.1 酸沉取20l牛奶使用乳酸调节ph至4.6,调节ph过程中开启搅拌器室温搅拌,然后静置酸沉60min。
168.1.2 样品澄清将酸沉后样品置于离心杯中,使用离心机在离心力4000g条件下离心30min,取离心后上清。或使用科百特截留孔径为10μm的袋式过滤器进行过滤,过滤速度为200ml/min,取过滤后上清溶液。
169.1.3 深层过滤将离心后或过滤后的上清溶液使用截留孔径大小为0.5-10μm的深层滤器进一步澄清过滤,过滤速度为100l/m2/h,获得上清溶液。
170.步骤二2.1缓冲液配置参考实施例3中配置。
171.2.2超滤浓缩换液超滤膜包:300kd超滤膜包超滤缓冲液:ph4.620mm磷酸盐缓冲液。
172.将深层过滤后样品使用超滤膜包先浓缩5倍,浓缩过程中进液端流速控制在100l/h,跨膜压控制在2.9psi,回流端压力不控制。浓缩结束后使用超滤换液缓冲液等体积换液5倍。
173.2.3样品调节ph使用0.5m氢氧化钠溶液调节超滤换液后样品ph至7.4。
174.2.4阴离子交换层析a.连接1lcapto q层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.4,20mm磷酸盐缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
175.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
176.c.使用ph7.4,20mm磷酸盐缓冲液平衡层析柱ph至7.4,平衡完毕后设置层析系统紫外检测器归零。
177.d.将超滤后样品使用akta150层析系统上样泵上样,上样流速为100ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
178.e.步骤d结束后使用1m nacl溶液清洗层析柱,然后使用0.5m naoh 溶液清洗层析柱。
179.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
180.步骤三3.1阳离子交换层析a.连接800mlsp sepharose high performance层析柱至akta150层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph8.0,20mm磷酸盐缓冲液瓶中,将系统管路b2放置于1m nacl溶液中。
181.b.使用0.5m naoh 溶液以线性流速90cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
182.c.使用ph8.0,20mm磷酸盐缓冲液平衡层析柱ph至8.0,平衡完毕后设置层析系统紫外检测器归零。
183.d.将阴离子交换层析后样品0.1m naoh调节ph至8.0,使用akta150层析系统上样泵上样,上样流速为40ml/min,上样过程中紫外吸收值上升至1mau后开始收集样品,紫外吸收值降至1mau后结束收集样品。
184.e.步骤d结束后使用1m nacl溶液清洗层析柱,然后使用0.5m naoh 溶液清洗层析柱。
185.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
186.步骤四4.1超滤浓缩换液a.设置中空纤维超滤系统泵流速为300ml/min,使用0.5m naoh 溶液将100kd 中空纤维柱循环重洗30-60min,然后使用注射水清洗5l。
187.b.设置中空纤维超滤系统泵流速为300ml/min,使用ph7.4,20mm磷酸盐缓冲液平衡中空纤维柱至中空纤维柱透过端溶液ph为7.4。
188.c.设置中空纤维超滤系统跨膜压为5psi,系统泵流速为300ml/min,超滤浓缩倍数为5倍,使用ph7.4,20mm磷酸盐缓冲液等体积换液倍数为5倍。
189.4.2分子筛层析
a. 连接4l思拓凡6ff层析柱至pilot600r层析系统上,将系统管路a1放置于0.5m naoh 溶液中,将系统管路a2放置于注射水瓶中,将系统管路b1放置于ph7.4,20mm磷酸盐缓冲液瓶中。
190.b.使用0.5m naoh 溶液以线性流速20cm/h流速清洗层析柱,然后使用注射水冲洗层析柱至电导值小于0.1ms/cm。
191.c.使用ph7.4,20mm磷酸盐缓冲液平衡层析柱ph至7.4,平衡完毕后设置层析系统紫外检测器归零。
192.d.将超滤后样品使用akta150层析系统上样泵上样,上样流速为20cm/h,上样完毕后,层析系统紫外吸收值上升时开始收集,第一个外水峰紫外吸收值降至平稳时结束收集,收集的第一个外水峰样品即为牛奶外泌体样品,收集样品放置于-80℃低温保存。
193.e.步骤d结束后使用使用0.5m naoh 溶液清洗层析柱。
194.f.层析柱清洗完毕后使用10mm naoh保存层析柱。
195.对比例11、溶液配制配制2m、1.65m、1.3m、0.95m、0.6m、0.25m蔗糖溶液,配制0.2g/ml dtt溶液,使用0.2μm真空抽滤瓶过滤,室温25
±
3℃保存。
196.2、超速离心(1)将50ml牛奶分装至50ml离心管中,使用离心机在4℃条件下200g离心10min,收集上清至一新的离心管中。
197.(2)将上述离心后上清在4℃条件下2000g离心20min,收集上清至一新的离心管中。
198.(3)将上述离心后上清在4℃条件下10000g离心20min,收集上清至一新的离心管中,沉淀中加入1.5ml 0.2g/ml dtt,37℃孵育10分钟,与上清混合。
199.(4)将步骤3中混合样品在4℃条件下10000g离心20min,吸取上清0.45um滤膜过滤,转移至新的超速离心管中。
200.(5)将步骤4中样品使用超速离心机在4℃条件下100000g离心105min,收集离心后沉淀,加入0.5ml 250mm蔗糖溶液重悬沉淀用于蔗糖密度梯度离心。
201.3、蔗糖密度梯度离心(1)向超速离心管中依次加入7.0ml 2m、1.65m、1.3m、0.95m、0.6m蔗糖溶液,同时各加入1.5ml蔗糖外泌体溶液,在4℃条件下100000g离心24h。离心结束后以4ml、7ml、7ml、7ml、7ml、7ml的固定体积液体转移至新超速离心管中合并,并对其相应部分进行编号为i、ii、iii、iv、v、vi。
202.(2)将步骤1中收集的样品在4℃条件下100000g离心105min,离心结束后使用1ml pbs溶液重悬沉淀。通过电镜及hplc检测外泌体在不同组分中的分布。
203.实施例6:外泌体样品的检测对实施例1-5以及对比例1中制备得到的外泌体样品进行检测和分析,外泌体电镜观察示意图如图1-图6所示,蛋白标志物如图7-图12所示,外泌体粒径分布图如图13-图18所示,外泌体纯度如图19-图24所示,对比各个参数结果,如表1所示。
204.表1
实施例1、2、3、4和5及对比例1中获得的最终外泌体样品结果显示,外泌体的在纯度、粒径分布、蛋白标志物上无显著差异,不同制备方法不会影响外泌体样本基本特性。由表1数据能够看出,实施例1-5中外泌体收率均较高,分别是对比例1的2.4倍、2.4倍、2.5倍、2.4倍及2.2倍;实施例5是对大剂量牛奶样品的外泌体制备,从结果能够看出,即便是针对大剂量的提取样本,本制备方法也能够保证较高的外泌体收率和降低杂质蛋白含量,保证提取得到的外泌体纯度。
205.与现有技术比较,本发明方案不需要使用超速离心机,对离心机的转速要求较低,降低了离心成本同时提高了生产效率;另外通过离心,超滤和层析的相互结合,能够实现大批量高效率的外泌体制备,制备得到的外泌体纯度高,杂质少。本发明每批次的处理量可在50ml-500l及以上规模,因此具有收率高、工艺时间短及可产业化生产牛奶外泌体的优势。
206.以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1