一种扣囊复膜酵母及其在小曲清香型原酒中的应用的制作方法
1.本发明涉及生物工程技术领域,具体是涉及一种扣囊复膜酵母及其在小曲清香型原酒中的应用。
背景技术:
2.扣囊复膜酵母(saccharomycopsis fibuligera),又称扣囊拟内孢霉 (endomycopsis fibuligera),是一类能够产生子囊孢子的二形态酵母,由于其可以分泌淀粉酶、糖化酶、酸性蛋白酶和β-葡萄糖苷酶等,广泛的应用于食品、发酵、生物燃料和医药行业。白酒生产中扣囊复膜酵母所产的酶活性决定了其能够以各种原料为底物进行发酵产酒精,也为其他白酒微生物的生长提供营养物质。孙思佳等(食品与发酵工业,2019)对筛选自芝麻香型白酒高温大曲中的1株高产淀粉酶扣囊复膜孢酵母的产酶条件和酶学性质进行研究,优化后淀粉酶活力达到12297u/g,且所产淀粉酶能够适应大曲发酵的酸性高温环境,具有应用于高温大曲生产的潜力。中国专利(cn201810274972.8)报道了一株扣囊复膜孢酵母及其应用,该菌株产α-淀粉酶活是目前已知最高酶活(7425.4u/g)的2.56倍,同时还具有产生糖化酶、酸性蛋白酶、脂肪酶等7种酶的能力,应用于速腐菌剂可直接快速彻底腐熟酒糟。中国专利(cn201710539656.4)报道了一种扣囊复膜孢酵母及其在中高温大曲生产中的应用,所述的菌株淀粉酶活力能够达到 7425.7u/g。将该菌株制备加工成菌剂,应用于芝麻香型中高温大曲的生产中,强化后的中高温大曲的糖化力和液化力显著高于对照大曲,提高了大曲制备过程中原料的利用率。
3.此外,扣囊复膜酵母可产生多种酯类、内酯类、醇类、有机酸类和醛酮类化合物,对白酒风味的形成具有重要作用。王晓丹等(食品科学,2017)从茅台大曲中分离出一株编号为fbkl2.0071扣囊复膜酵母,固态发酵物具有浓郁的果香味,其中以乙酸乙酯、乙酸异戊酯、苯乙醇、乙酸苯乙酯、棕榈酸乙酯含量较高。张宸瑞等(中国酿造,2021)对10种不同的米酒曲和黄酒曲中的高产酸酵母菌进行了分离、筛选及鉴定,筛选到一株产酸率高、耐高温和乙醇能力强的扣囊复膜酵母菌株。中国专利(201510636469.9)报道了一种扣囊复膜孢酵母及其用途,该菌株能在酱香型白酒中产异戊醇。且扣囊复膜酵母与其他微生物的协同作用,对酒精的生成和白酒风味的形成都具有重要贡献。su等(food researchinternational,2020)采用扣囊复膜酵母和酿酒酵母混合酵母作为川法小曲酒的微生物强化接种剂,结果表明,与传统小曲相比,接种强化菌剂制备的强化曲的糖化酶和酸性蛋白酶活力明显提高,酿造的白酒乙醇和总酯含量分别提高了42.5%和11.8%,而醛酮和杂环化合物分别下降了73.7%和77.1%。吴健等(中国酿造, 2020)将扣囊复膜酵母与其他酵母制备复配酵母,与纯种米根霉菌共培养制备风味米曲,并以市售小曲为对照,结果表明,产香酵母的添加,使得风味米曲的产酯能力与产酸能力明显提升,极大的改善了米香型白酒香气。中国专利 (cn201910264999.3)报道了一株产酯酵母zb406及其应用,筛选分离的扣囊复膜酵母与酿酒酵母的共酵实现酒精发酵与香气物质合成的同步进行,实现液态发酵米醋香气风味的明显提升。
4.目前小曲清香型白酒普遍存在酯含量较低的问题,导致白酒的品质和口感具有较大的提升空间。因此,提高小曲清香型白酒的主体酯-乙酸乙酯是急需解决的问题,而产酯酵母的应用是提高白酒中乙酸乙酯含量的关键方法。文献报道高产乙酸乙酯的酵母大多为异常威克汉姆酵母、酿酒酵母、汉逊德巴利酵母、库德里阿兹威毕赤酵母等,扣囊复膜酵母在白酒中的应用专利授权的仅有能够产异戊醇和提高大曲的糖化力和液化力。鉴于扣囊复膜酵母的高酶活性以及产酯产香能力决定了其在酿造行业有巨大的作用,但是其在小曲清香型白酒中的应用还是空白。作为清香型白酒中的优势酵母菌株,其对小曲白酒的品质贡献如何,有必要对扣囊复膜酵母的功能进行研究,获得性能优良菌株进行强化制曲,提高酒曲质量,最终应用于白酒生产,改善小曲白酒品质。
技术实现要素:
5.本发明的一个目的是提供一种扣囊复膜酵母菌株,通过获得该性能优良菌株进行强化制曲,提高酒曲质量,最终应用于白酒生产,改善小曲白酒品质。
6.一种扣囊复膜酵母(saccharomycopsis fibuligera)y162,该菌株保藏于中国典型培养物保藏中心,保藏单位地址为中国武汉武汉大学,保藏日期为2022年3月10日,保藏编号为cctccno.m2022245。
7.本发明的另一个目的是提供一种含上述扣囊复膜酵母的固态酿酒酒曲制备方法,包括下述步骤:
8.(1)种曲和酵母培养基的制备
9.将早籼米浸泡8-10h,磨浆,在米浆中加入过20目筛的早籼米粉和米糠,搅拌均匀后,接种安琪根霉,接种量为早籼米、米粉及米糠总重量的3.0-3.5%;再用手捏成直径为6-7cm的饼型曲坯,将曲坯排列于培养室内的木箱上,曲坯间距为2-3cm,盖上竹垫;培养室温度控制在30-32℃,当曲坯品温升至35℃,揭去竹垫子;继续培养至曲坯品温将至25-28℃,然后将其在35℃下烘干,此曲坯即为种曲;
10.称取糖蜜,加入85℃的热水,所述热水的体积为糖蜜重量的2倍,搅拌至糖蜜溶解得到溶液,再加入溶液体积的0.1%的浓硫酸,搅匀静置12小时,将上层清液加至发酵罐中,并补水至糖蜜培养基的糖度为10bx-15bx;按质量百分含量为0.2%、0.1%、0.1%、0.1%、0.2%、10%的比例称取硫酸铵、尿素、磷酸二氢铵、硫酸镁、酵母浸粉和消泡剂,倒入发酵罐中,加水至罐容积的60-80%,开启搅拌使营养盐完全溶解,灭菌冷却,即得酵母培养基;
11.(2)扣囊复膜酵母y162纯种菌剂的制备
12.按照1g/100ml的比例称取麦芽浸粉,用水溶解后,分装至1000ml的三角瓶中,每瓶装液量500ml,灭菌备用;将保藏编号为cctcc no.m2022245的扣囊复膜酵母(saccharomycopsis fibuligera)y162试管纯培养物接入三角瓶中, 30℃下140rpm摇床培养20-36h;将培养y162的三角瓶接入装有步骤(1)制备的酵母培养基的发酵罐中发酵,再接种到经过灭菌的麸皮培养基中,30℃培养 36h,干燥后制成y162纯种菌剂;
13.(3)强化扣囊复膜酵母的固态酿酒酒曲制备
14.将观音土粉碎后过14目筛,米糠过16目筛,将步骤(1)制备的种曲碾碎后过20目筛;将步骤(2)制备的y162纯种菌剂与米糠、种曲碾混合搅拌均匀,再加入观音土搅匀,所述观音土:米糠:种曲:y162纯种菌剂的重量比为75:25:1.4-1.8:0.7,得混合料;加水至混合
料中,使混合料中的含水量为50%;搅匀后将混合料制成直径为7-8cm的球形曲坯,将制好的曲坯整齐摆放置于培养室内的培养箱中,在曲坯上铺竹垫,进行培养;培养结束后,将曲坯置于烘房内与 35-40℃下烘干至含水量≤5%,即制得强化扣囊复膜酵母y162的固态酿酒酒曲。
15.优选地,步骤(1)中早籼米:早籼米粉:米糠的重量比为63:35:2。
16.优选地,步骤(2)中设置发酵罐的溶氧量为45%、ph=3-5、转速为 100-500rpm、温度为35℃,培养22h。
17.优选地,步骤(3)中控制培养室的温度为28-30℃之间,培养16h后;检查培养箱内曲坯的温度,当曲坯品温升至30-35℃时,揭开竹垫,撑起培养箱;待曲坯品温降至室温时,将曲坯捡出,曲坯相互之间不能挤压,继续培养5天。
18.本发明的另一个目的于提供一种含上述扣囊复膜酵母的固态酿酒酒曲在小曲清香型白酒生产中的应用,包括下述步骤:
19.糯高粱经70-80℃水浸泡20h后,经过初蒸、焖粮和复蒸得到熟粮,熟粮摊凉后降温至30℃,按0.8-1.2%的接种量加入步骤(3)所制备的强化扣囊复膜酵母y162的固态酿酒酒曲,将强化扣囊复膜酵母y162的固态酿酒酒曲与粮食搅拌均匀后送至糖化箱场进行培菌糖化;按照粮糟比为1:4-1:5添加配糟,混匀后低温入发酵池,入池温度控制在15-20℃;粮糟入池发酵,充分拌匀,发酵周期为8天,蒸馏,即得小曲原酒。
20.优选地,糖化过程中控制入箱温度为23-28℃,上中下粮层温差不超过2℃,经培菌糖化22-26h后进行开箱。
21.本发明利用强化扣囊复膜酵母y162应用在小曲清香型原酒酿造中,生产出的酒体中乙酸乙酯含量达2g/l,比生产对照组显著提升了50.37%(p<0.01),且生产出的小曲原酒清香纯正,入口醇甜,酯香突出,香味协调,尾净爽口,风格典型。
附图说明
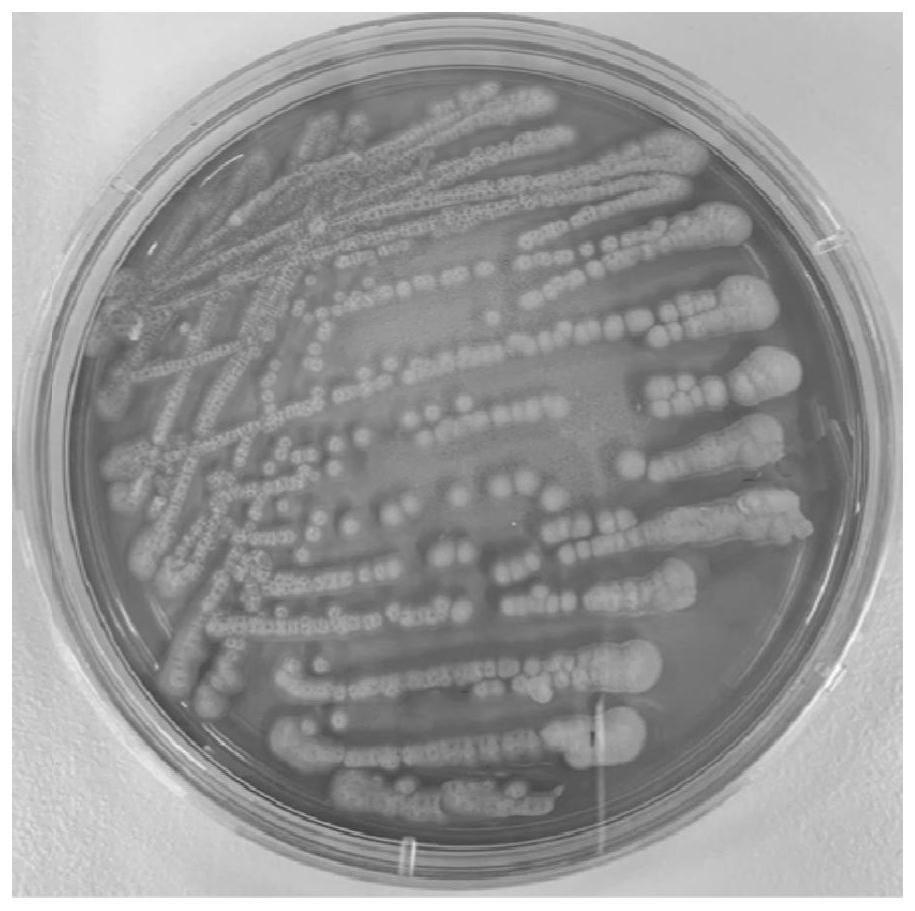
22.图1是y162酵母菌落宏观形态图;
23.图2是不同扣囊复膜酵母液态培养产淀粉酶酶活活情况示意图;
24.图3不同扣囊复膜酵母在不同温度下的生长情况示意图;
25.图4是不同扣囊复膜酵母在不同乙醇浓度下的生长情况示意图;
26.图5是不同扣囊复膜酵母在不同酸性条件下的生长情况示意图;
27.图6是扣囊复膜酵母y162强化酒曲应用于小曲白酒生产数据对比示意图。
具体实施方式
28.为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施例,进一步阐述本发明,但下述实施例仅仅为本发明的优选实施例,并非全部。基于实施方式中的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得其它实施例,都属于本发明的保护范围。下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
29.本发明公开的扣囊复膜酵母y162菌株从小曲清香型白酒酒曲中分离经筛选获得。该菌株有如下特征:
30.扣囊复膜酵母y162在ypd平板上培养2d的菌落形态特征是:白色,圆形突起,表面粗糙,微绒毛,且干燥,外边缘整齐。在ypd液体培养基摇床培养 30h的显微形态特征是:细胞呈圆形或椭圆形,假菌丝状,出芽增殖。
31.1.y162的分离与筛选步骤
32.1.1培养基的制备
33.①
ypd琼脂培养基
34.葡萄糖20g/l,蛋白胨20g/l,酵母粉10g/l,琼脂粉20g/l,ph自然。
35.②
ypd液体培养基
36.葡萄糖20g/l,蛋白胨20g/l,酵母粉10g/l,ph自然。
37.③
淀粉培养基
38.可溶性淀粉5g/l,蛋白胨5g/l,酵母浸粉5g/l,氯化钠5g/l,磷酸二氢钾 1g/l,氯化钙0.5g/l,硫酸镁0.5g/l,硫酸亚铁0.05g/l,ph自然。固体培养基在此基础上添加20g/l琼脂粉。
39.以上培养基均在121℃,灭菌20min。
40.1.2菌株的分离、筛选与鉴定
41.将小曲清香型白酒酒曲样品用粉碎机粉碎后,制成粉状备用。称取曲粉5g,放入盛有95ml无菌水并带有玻璃珠的250ml三角瓶中,200r/min振摇30min,使曲粉与水充分混合,制成菌悬液。用1ml移液枪从三角瓶中吸取1ml菌悬液注入盛有9ml无菌水的试管中,制成10-1
稀释度的曲粉溶液,按照同样的方法以此类推分别制成10-2
、10-3
和10-4
稀释度的曲粉溶液。然后分别从10-1
、10-2
、 10-3
和10-4
稀释度试管中吸取0.2ml曲粉溶液放入制备好的无菌ypd培养皿中,每个梯度设置两个平行样品,用无菌玻璃涂棒将菌液在平板上涂布均匀,然后平放于试验台上20~30min,使菌液渗入培养基表层内,然后将平板倒置于30℃培养箱中培养。培养24~48h后,用无菌接种环把平板上的单个菌落挑出,划线接种于另一个空白ypd平板上,继续培养,经过2~3次平板划线后得到初步纯化的菌落转入ypd斜面试管低温保存。
42.1.2.1产酶活菌株平板初筛
43.将纯化后的单菌株点接至淀粉培养基中,培养待菌落长出后,加入适量的稀碘液,观察有无透明圈,有明显透明圈的菌落为初步产淀粉酶酶活的菌株。
44.1.2.2产酶活菌株液态培养复筛
45.将初筛有淀粉酶活的菌株接种至淀粉液体培养基中进行培养,培养完后离心取上清液进行α-淀粉酶酶活的测定,确定产淀粉酶活的菌株。
46.表1透明圈法平板初筛酵母产淀粉酶酶活情况
[0047][0048]
从上表1可知,菌株编号3#产淀粉酶酶活最高,初步判定为酒曲中酶活较高的酵母菌株,将此菌株进行甘油管保藏纳入实验室菌种库,编号为y162。y162 酵母菌落特征为:白色,圆形突起,表面粗糙,微绒毛,且干燥,外边缘整齐,菌落易挑起,菌落直径d=3mm,参见图1。在ypd液体培养基摇床培养30h 的显微形态特征是:细胞呈圆形或椭圆形,能形成假菌丝及产子囊孢子。
[0049]
1.2.3菌种鉴定
[0050]
将筛选出的产酶活较高的菌株进行分子生物学鉴定,利用酵母特异分类鉴定引物扩增菌株的18srna,经凝胶电泳检测,接着进行测序对比,确定菌种的属种,结果是扣囊复膜酵母。
[0051]
扣囊复膜酵母的序列为:
[0052]
aaaaaaagggtataagttttagacctgcgcttactgcgcggtttaataaactcttatacacagtgtttttgtttgcgaattt ggtttagtttgttggttttcattcgaaaggatgaagattgattgctaaatcttattcagctttttaaactcagatctctttttaagagaa atgtatttttttaattacaactagtcgattttacaaactaaaagtttaaaactttcagcaacggatctcttggttctcgcatcgatga agaacgcagcgaattgcgataagtaatgtgaattgcagattttcgtgaatcatcgaatctttgaacgcatattgcgctctatagt attctatagagcatgcctgtttgagcgtcatttctctcttaaacctttgggtttagtattgaaggttgtgttagcttctgctaactcct ttgaaatgacttggcaattgattgagttttccatatatttgcttaaggatttaatattaggttctaccaacttattaaatacccttttgc gaaggacttactcgtgtatcaaggccttataactttgtcattaattttgacctcaaatcaggtaaggatacccgctgaacttaag catatcaataagccgggagaaaaggtattctgtttttttatttaaaaaaggggttaaatggggggttta。
[0053]
1.2.4不同来源扣囊复膜酵母酶活比较
[0054]
将y162酵母与菌种库中保藏的不同来源扣囊复膜酵母在ypd液体培养基中活化后,接种于淀粉培养基中,摇床培养后,离心取上清液为粗酶液,测定α
‑ꢀ
淀粉酶酶活。由图2结果可知,同种属不同来源的扣囊复膜酵母在相同培养条件下产α-淀粉酶酶活情况不同,分离于小曲清香型中的扣囊复膜酵母y162产淀粉酶酶活最高,为155.58u/ml,确定了在同种属酵母中该酵母为产α-淀粉酶酶活较高的菌株。
[0055]
由于酵母在白酒酿造生产过程中起主导作用,与此同时,酿造环境对酵母的生长及代谢有着十分重要的影响。在白酒酿造过程中,由于酒醅中氧含量、乙醇浓度、酸度、营养物质等不断变化,造成酵母所处环境也时刻发生变化,从而酵母的生存受到各种胁迫因素的制约。只有适应这些胁迫条件,发酵活动才能顺利进行。我们对y162酵母菌株进行了一系列的耐受性试验,具体如下。
[0056]
2.y162酵母菌株耐受性试验
[0057]
1)酵母的活化
[0058]
挑取一环酵母菌体接种于装有10ml ypd液体培养基中,30℃静止培养3 天后,取50μl菌液于下列各培养基中。
[0059]
2)耐受性实验
[0060]
a耐温实验
[0061]
配制ypd液体培养基,121℃灭菌20min,分别取2ml培养液于试管中,对应接种不同来源的扣囊复膜酵母y112、y115、y120、y162、y168和y231 6 株酵母,分别在25℃、30℃、37℃、40℃、45℃和50℃静置培养4d,然后在波长为600nm处测菌的吸光度,试验结果见图3。
[0062]
从图3可以看出,当温度超过30℃后,酵母生物量随着温度的升高均降低,当温度达到40℃以后菌株死亡较快,45和50℃是几乎无生长。说明扣囊复膜酵母培养温度不能超过40℃。且不同来源酵母耐热性有一定的差异,如在40℃时扣囊复膜酵母y168生物量最高,而扣囊酵母y231生物量最低。
[0063]
b耐酒精实验
[0064]
配制ypd液体培养基,121℃灭菌20min,然后加无水乙醇使培养基中酒精浓度分别为:4%、6%、8%、10%、12%(v/v),再分别取3ml培养液于试管中,对应接种y112、y115、y120、y162、y168和y231 6株酵母,30℃进行静置培养4d,然后利用酶标仪在600nm处测定菌浓度,试验结果见图4。
[0065]
由于发酵过程产生的高浓度乙醇会对酵母细胞代谢带来毒害,使酵母停滞生长或死亡。从图4可知,随着乙醇浓度的增加,酵母的生长受到抑制,当乙醇浓度超过6%时,酵母生物量随着乙醇浓度升高而下降。y115、y168和y231能耐受8%的乙醇浓度,其余3株酵母均不能耐受。当乙醇浓度达到10%时,酵母均不能生长。而发酵后期酒醅中乙醇浓度不超过6%,因此扣囊复膜酵母均能够耐受发酵过程中乙醇含量的增加。
[0066]
c耐乳酸实验
[0067]
配制ypd液体培养基,121℃灭菌20min,冷却加乳酸至不同的酸度(%v/v): 4(ph=2.90)、6(ph=2.69)、8(ph=2.54)、10(ph=2.43)、12(ph=2.32),再分别取3ml 培养液于试管中,对应接种y112、y115、y120、y162、y168和y231 6株酵母, 30℃静置培养4d,然后利用酶标仪在600nm处测定菌浓度,试验结果见图5。
[0068]
由于高浓度的酸类物质会降低酵母细胞的代谢速率,抑制或杀死细胞,从而影响发酵能力。从图5可知,扣囊复膜酵母能够在乳酸浓度为1%(ph值3.55) 生长,当乳酸浓度为4%(ph值2.87)时酵母生物量均较低(吸光值在0.1左右),即当ph值低于3时,扣囊复膜酵母生长受抑制。而酒醅发酵过程ph值为4左右,因此扣囊复膜酵母能够适应酒醅的酸性环境。
[0069]
本发明的另一个目的是提供一种含扣囊复膜酵母的固态酿酒酒曲制备方法,包括
下述步骤:
[0070]
(1)种曲和酵母培养基的制备
[0071]
将早籼米浸泡8-10h,磨浆,在米浆中加入过20目筛的早籼米粉和米糠,其中早籼米:早籼米粉:米糠的重量比为63:35:2,搅拌均匀后,接种安琪根霉,接种量为早籼米、米粉及米糠总重量的3.0-3.5%;再用手捏成直径为6-7cm的饼型曲坯,将曲坯排列于培养室内的木箱上,曲坯间距约为2-3cm,盖上竹垫;培养室温度控制在30-32℃,当曲坯品温升至35℃,揭去竹垫子;继续培养至曲坯品温将至25-28℃,然后将其在35℃下烘干,此曲坯即为种曲。
[0072]
称取糖蜜,加入85℃的热水,所述热水的体积为糖蜜重量的2倍,搅拌至糖蜜溶解得到溶液,再加入溶液体积的0.1%的浓硫酸,搅匀静置12小时,将上层清液加至发酵罐中,并补水至糖蜜培养基的糖度为10bx-15bx;按质量比为 2
‰
、1
‰
、1
‰
、1
‰
、2
‰
、10%称取硫酸铵、尿素、磷酸二氢铵、硫酸镁、酵母浸粉和消泡剂并倒入发酵罐中,加水至罐容积的60-80%,开启搅拌使营养盐完全溶解,灭菌冷却,即得酵母培养基。
[0073]
(2)扣囊复膜酵母y162纯种菌剂的制备
[0074]
按照1g/100ml的比例称取麦芽浸粉,用水溶解后,分装至1000ml的三角瓶中,每瓶装液量500ml,灭菌备用;将保藏编号为cctcc no.m2022245的扣囊复膜酵母(saccharomycopsis fibuligera)y162试管纯培养物接入三角瓶中,30℃下140rpm摇床培养20-36h;将培养y162的三角瓶接入装有步骤(1)制备的酵母培养基的发酵罐中,设置发酵罐的溶氧量45%、ph=3-5、转速为 100-500rpm、温度35℃培养22h,再接种到经过灭菌的麸皮培养基中,30℃培养 36h,干燥后制成y162纯种菌剂。
[0075]
(3)强化扣囊复膜酵母的固态酿酒酒曲制备
[0076]
将观音土粉碎后过14目筛,所述观音土产地为湖南临澧县,米糠过16目筛,将步骤(1)制备的种曲碾碎后过20目筛后和步骤(2)制备的纯种y162麸皮酵母先与米糠混合搅拌均匀,再加入膨润土搅匀,所述膨润土:米糠:种曲:纯种酵母麸皮种的重量比为75:25:1.4-1.8:0.7,得混合料;加水至混合料中,使混合料中的含水量为50%;搅匀后将混合料制成直径为7-8cm的球形曲坯,将制好的曲坯整齐摆放置于培养室内的培养箱中,在曲坯上铺竹垫,控制培养室的温度为28-30℃之间,培养16h后;检查培养箱内曲坯的温度,当曲坯品温升至30-35℃时,揭开竹垫,撑起培养箱;待曲坯品温降至室温时,将曲坯捡出,曲坯相互之间不能挤压,继续培养5天;培养结束后,将曲坯置于烘房内与35-40℃下烘干至含水量≤5%,即制得强化扣囊复膜酵母y162的固态酿酒酒曲。
[0077]
本发明的另一个目的于提供扣囊复膜酵母的固态酿酒酒曲在小曲清香型白酒生产中的应用,包括下述步骤:
[0078]
(1)小曲清香型原酒的制备
[0079]
糯高粱经70-80℃水浸泡20h后,经过初蒸、焖粮和复蒸得到熟粮,熟粮摊凉后降温至30℃,按1%的接种量加入步骤(3)所制备的强化扣囊复膜酵母的酒曲,将曲与粮食搅拌均匀后送至糖化箱场进行培菌糖化,控制入箱温度为 23-28℃,上中下粮层温差不超过2℃,经培菌糖化22-26h后进行开箱。按照粮糟比为1:4-1:5添加配糟,混匀后低温入5.4m3发酵池,入池温度控制在15-20℃。粮糟入池发酵,要充分拌匀,发酵周期为8天,蒸馏,即得小曲原酒。并以同一时间段不添加扣囊复膜酵母的酒曲酿造的原酒做对照。
[0080]
(2)原酒检测及数据对比分析
[0081]
将步骤(1)获得的原酒准确移取1ml于2ml样品瓶中,加入10μl三内标使用液(叔戊醇(is1):17028.1mg/l,乙酸正戊酯(is2):16864mg/l,2-乙基己醇(is3):12104.2mg/l),盖上瓶盖,摇匀,采用气相色谱法测定原酒中各成分含量。色谱条件为:agilent 780a气相色谱仪,检测器fid,cp-wax毛细管色谱柱(50m*0.2μm*0.25mm)。升温程序:柱温40℃保持8min,以5℃/min升至150℃。进样口温度250℃,检测器温度260℃,空气、氢气流速比300:30,载气为氮气,分流比30:1,柱流量1.0ml/min,进样方式:自动进样器。检测结果见图6。
[0082]
由图6可知,强化y162酒曲产酒中乙酸乙酯含量达2g/l,而对照酒曲乙酸乙酯含量为1.33g/l,比对照显著提升了50.37%(p<0.01);酒率和其他色谱指标与对照相当。因此,可以看出在原有酒曲的基础上强化扣囊复膜酵母y162 在提乙酸乙酯方面具有明显优势,说明此酵母对小曲清香型原酒中乙酸乙酯的提升有显著促进作用。且通过专业品评人员品评,本发明所生产出的小曲原酒清香纯正,入口醇甜,酯香突出,香味协调,尾净爽口,风格典型。
[0083]
实施例
[0084]
本实施例的强化扣囊复膜酵母的固态酿酒酒曲在小曲清香型原酒中的应用,包括下述步骤:
[0085]
(1)种曲和酵母培养基的制备
[0086]
将早籼米浸泡8-10h,磨浆,在米浆中加入过20目筛的早籼米粉和米糠,其中早籼米:早籼米粉:米糠的重量比为63:35:2,搅拌均匀后,接种安琪根霉,接种量为早籼米、米粉及米糠总重量的3.2%;再用手捏成直径为6-7cm的饼型曲坯,将曲坯排列于培养室内的木箱上,曲坯间距约为2-3cm,盖上竹垫;培养室温度控制在30-32℃,当曲坯品温升至35℃,揭去竹垫子;继续培养至曲坯品温将至25-28℃,然后将其在35℃下烘干,此曲坯即为种曲。
[0087]
称取糖蜜,加入85℃的热水,所述热水的体积为糖蜜重量的2倍,搅拌至糖蜜溶解得到溶液,再加入溶液体积的0.1%的浓硫酸,搅匀静置12小时,将上层清液加至发酵罐中,并补水至糖蜜培养基的糖度为10bx-15bx;按质量比为 2
‰
、1
‰
、1
‰
、1
‰
、2
‰
、10%称取硫酸铵、尿素、磷酸二氢铵、硫酸镁、酵母浸粉和消泡剂并倒入发酵罐中,加水至罐容积的60-80%,开启搅拌使营养盐完全溶解,灭菌冷却,即得酵母培养基。
[0088]
(2)扣囊复膜酵母y162纯种菌剂的制备
[0089]
按照1g/100ml的比例称取麦芽浸粉,用水溶解后,分装至1000ml的三角瓶中,每瓶装液量500ml,灭菌备用;将保藏编号为cctcc no.m2022245的扣囊复膜酵母(saccharomycopsis fibuligera)y162试管纯培养物接入三角瓶中, 30℃下140rpm摇床培养30h;将培养y162的三角瓶接入装有步骤(1)制备的酵母培养基的发酵罐中,设置发酵罐的溶氧量45%、ph=4、转速为400rpm、温度35℃培养22h,再接种到经过灭菌的麸皮培养基中,30℃培养36h,干燥后制成纯种y162菌剂。
[0090]
(3)强化扣囊复膜酵母的固态酿酒酒曲制备
[0091]
将观音土粉碎后过14目筛,所述观音土产地为湖南临澧县,米糠过16目筛,将步骤(1)制备的种曲碾碎后过20目筛后和步骤(2)制备的纯种y162麸皮酵母先与米糠混合搅拌均匀,再加入膨润土搅匀,所述膨润土:米糠:种曲:纯种酵母麸皮种的重量比为75:25:1.6:0.7,得混合料;加水至混合料中,使混合料中的含水量为50%;搅匀后将混合料制成直径为
7-8cm的球形曲坯,将制好的曲坯整齐摆放置于培养室内的培养箱中,在曲坯上铺竹垫,控制培养室的温度为28-30℃之间,培养16h后;检查培养箱内曲坯的温度,当曲坯品温升至30-35℃时,揭开竹垫,撑起培养箱;待曲坯品温降至室温时,将曲坯捡出,曲坯相互之间不能挤压,继续培养5天;培养结束后,将曲坯置于烘房内与35-40℃下烘干至含水量≤5%,即制得含扣囊复膜酵母y162的固态酿酒酒曲。
[0092]
(4)小曲清香型原酒的制备
[0093]
糯高粱经70-80℃水浸泡20h后,经过初蒸、焖粮和复蒸得到熟粮,熟粮摊凉后降温至30℃,按1%的接种量加入步骤(3)所制备的强化扣囊复膜酵母的酒曲,将曲与粮食搅拌均匀后送至糖化箱场进行培菌糖化,控制入箱温度为 23-28℃,上中下粮层温差不超过2℃,经培菌糖化24h后进行开箱。按照粮糟比为1:4添加配糟,混匀后低温入5.4m3发酵池,入池温度控制在18℃。粮糟入池发酵,要充分拌匀,发酵周期为8天,蒸馏,即得小曲原酒。并以同一时间段不添加扣囊复膜酵母的酒曲酿造的原酒做对照。将获得的原酒准确移取1ml于2 ml样品瓶中,加入10μl三内标使用液(叔戊醇(is1):17028.1mg/l,乙酸正戊酯(is2):16864mg/l,2-乙基己醇(is3):12104.2mg/l),盖上瓶盖,摇匀,采用气相色谱法测定原酒中各成分含量。色谱条件为:agilent 780a气相色谱仪,检测器fid,cp-wax毛细管色谱柱(50m*0.2μm*0.25mm)。升温程序:柱温 40℃保持8min,以5℃/min升至150℃。进样口温度250℃,检测器温度260℃,空气、氢气流速比300:30,载气为氮气,分流比30:1,柱流量1.0ml/min,进样方式:自动进样器。结果表明强化扣囊复膜酵母y162酒曲产酒中乙酸乙酯含量达2g/l。
[0094]
本公司现有的同期未使用该菌株的酒曲产酒乙酸乙酯含量为1.33g/l,本发明所提供的保藏编号为cctcc no.m2022245的扣囊复膜酵母 (saccharomycopsis fibuligera)y162按实施例1的方法应用于小曲清香型原酒的生产,与现有方法相比乙酸乙酯含量显著提升了50.37%。且本实施例生产出小曲原酒清香纯正,入口醇甜,酯香突出,香味协调,尾净爽口,风格典型。表明在传统酒曲中配合使用扣囊复膜酵母y162菌剂可以明显改善酒质,使小曲清香型原酒中主要香味成分含量明显增加,使酒中的香气更加协调,口感更佳。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1