一种同时分离纯化制备5种稻曲菌毒素的方法
1.本发明涉及一种稻曲菌毒素的分离纯化制备方法,特别是涉及一种同时分离纯化制备5种稻曲菌毒素的工艺技术方法。
背景技术:
2.稻曲菌毒素(ustiloxins)是由水稻稻曲病菌ustilaginodea virens(cooke) takahashi产生的一种真菌毒素,是一系列的杂环肽类化合物,目前已分离出7 种结构相近的稻曲菌毒素,主要为稻曲菌毒素ustiloxins a、ustiloxins b、ustiloxins c、ustiloxins d、ustiloxins e、ustiloxins f和ustiloxins g。其中稻曲菌毒素ustiloxins e和ustiloxins g含量极微,因此有关稻曲菌毒素的研究主要针对的是ustiloxins a、ustiloxins b、ustiloxins c、ustiloxins d和ustiloxins f 5种稻曲菌毒素。自80年代以来,由稻曲菌引发的稻曲病已成为稻米生产中的主要病害,现已广泛分布于世界各水稻栽培区,其中较为严重的国家有日本、中国、美国、印度和菲律宾等。我国每年稻曲病的发生面积约有300万hm2,而且呈现不断加重趋势,不仅严重影响了我国稻米的产量,也已经成为稻米质量安全的主要影响因素之一,同时由于目前人们对稻曲菌毒素研究与认知的局限性,也引起了广大种植户的恐慌。
3.近年来随着稻曲病发生率的加剧,稻曲菌毒素的研究也引起了越来越多学者的关注,大多集中于植物保护、作物栽培、环境科学和遗传育种等学科领域。目前,稻曲菌毒素对植物的毒性是被广泛认可的,它可以抑制植物细胞的有丝分裂进而引起水稻幼苗根部和胚芽的异常肿胀,主要机制是毒素抑制细胞微管蛋白的聚合,干扰细胞骨架的形成进而造成细胞有丝分裂进程的停滞。然而有关稻曲菌毒素对人体健康方面的影响却知之甚少,仅见早期极少粗浅的报道,发现不论是将稻曲球磨成粉掺入饲料中饲喂动物(鸡、兔及大小鼠)还是将稻曲球水提液腹腔注射,即便是极低的含量也会引起动物慢性中毒及内脏病变,其中心脏、肺部表面会有出血点并出现结节,肝、肾出现严重坏死,胃部出现溃疡及严重腐蚀,甚至还存在遗传毒性,影响子代发育。而且这些研究都主要采用的是整粒的稻曲球,或者是稻曲球的粗提液,这是一个非常复杂的样品体系,除去稻曲菌毒素还有大量杂质,且相关文献年代久远,无法系统性的体现稻曲菌毒素的毒性,个别研究仅涉及稻曲菌毒素a单体化合物,至今有关稻曲菌毒素对人体健康影响的研究尚未有大的突破与进展。
[0004]“民以食为天,食以安为先。”食品安全是关系人民群众身体健康和生命安全的大事。近年来,新技术、新方法的应用也给食品安全带来了严峻的挑战。随着水稻新品种的推广应用、耕作方式、施肥用量、气候环境等因素的改变,稻曲病已成为水稻生产中的主要病害并且日益严重,影响稻米产量的同时更是直接影响着稻米的质量安全。我国作为世界第一粮食生产及消费大国,稻米的年产量约占全国粮食总产量的50%,同时也是我国大部分地区人民的主食,稻米的品质及质量安全对于消费者的营养需求和身体健康具有重大影响。但目前人们对市场销售的稻米及其相关制品中稻曲菌毒素的污染情况尚未可知。将稻曲菌毒素纳入稻米及制品质量安全指标已刻不容缓,国家政府部门也越来越关注稻米中稻
曲菌毒素的污染问题。2020年我国农业农村部最新出台了有关稻曲菌毒素的质量安全检测控制方法标准,但由于缺乏稻曲菌毒素的标准样品的商品化供给,该方法标准的实际应用受到了很大的限制,很多稻米及制品无法进行稻曲菌毒素的分析与质量控制,具有很大的安全隐患。
[0005]
无论是稻曲菌毒素对人体健康影响研究进程缓慢,还是我国新出台的有关稻曲菌毒素的质量安全检测控制方法标准实际应用的受限,究其根本原因,主要是稻曲菌毒素单体化合物难以获得。稻曲菌毒素的支链上均含有羧基和氨基,具有高度的亲水性及两性特点,它作为一种两性化合物容易在较宽的ph范围内发生电离,采用传统的纯化方法具有较大的难度,因而稻曲菌毒素各个单体化合物的获得非常困难。目前有关稻曲菌毒素的分离提取及纯化制备工艺研究鲜少报道. 查阅相关文献,主要是早年日本东京大学kobayashi博士以及江苏省农业科学院祭芳老师进行过稻曲菌毒素的分离纯化制备研究,kobayashi博士的方法主要采用的是反相硅胶、树脂和正相硅胶结合,多次反复纯化,工艺非常繁琐;祭芳老师进行的稻曲菌毒素的分离纯化制备研究仅是针对单一的稻曲菌毒素ustiloxina,而且两者的分离纯化制备方法都用到了二氯甲烷有机溶剂,给环境污染以及操作人员身体健康都带来了很大的危害。另外,从合成角度来看,由于稻曲菌毒素的闭环结构特点,其合成工艺步骤多达二十几步,且得率非常低。种种原因限制,目前稻曲菌毒素各种单体化合物并无市场化的供应。而高纯度的稻曲菌毒素各单体化合物的获得是稻曲菌毒素研究及应用的前提和基础,也是目前限制稻曲菌毒素深入研究和应用的最大瓶颈问题,亟待解决。
技术实现要素:
[0006]
本发明的目的在于:针对目前并无市场化的稻曲菌毒素单体化合物供应,从而限制了人们对稻曲菌毒素的深入研究以及对稻米质量安全的风险控制工作的开展等问题,本发明提供一种同时分离纯化制备5种稻曲菌毒素的技术方法,突破性解决目前限制水稻稻曲病菌毒素深入研究的关键瓶颈问题,可为今后有关稻曲菌毒素对人体健康影响、稻米质量安全风险监测、暴露评估以及稻米中稻曲菌毒素限量标准的研究与制定提供必要前提和基础。
[0007]
本发明所采用的具体技术方案如下:
[0008]
一种同时分离纯化制备5种稻曲菌毒素的方法,其包括如下步骤:
[0009]
s1、以稻曲球整球或者稻曲球孢子粉为原料,以水作为提取溶液对原料进行匀浆破碎、震荡提取和离心分离,获得的上清液经过真空冷冻干燥得到稻曲菌毒素的粗提物;
[0010]
s2、采用精细树脂hp20ss作为柱层析的填料按湿法装柱方式填入耐有机中压层析柱中,将耐有机中压层析柱安装于高效液相色谱仪的色谱柱位置,采用高效液相色谱仪作为输液系统,对层析柱进行压柱;
[0011]
s3、将粗提物用水溶解后离心,获取的上清液过膜滤去杂质后,上层析柱进行柱层析分离;
[0012]
s4、采用高效液相色谱仪作为输液系统进行稻曲菌毒素目标化合物的洗脱,洗脱溶液为甲醇-水体系,洗脱方式为梯度洗脱,梯度洗脱中流动相比例由5%梯度升至25%,洗脱液使用全自动部分收集器逐管收集;
[0013]
s5、对收集的洗脱液中的稻曲菌毒素类型进行追踪鉴定,合并属于同一类稻曲菌
毒素的洗脱液,再分别对合并后的5种洗脱液进行真空离心浓缩,得到 ustiloxin a、ustiloxin b、ustiloxin c、ustiloxin d和ustiloxin f 5种稻曲菌毒素的柱层析分离提取物;
[0014]
s6、对5种稻曲菌毒素的柱层析分离提取物通过固相萃取技术进行富集净化后再进一步纯化,最终得到ustiloxin a、ustiloxin b、ustiloxin c、ustiloxin d和 ustiloxin f 5种稻曲菌毒素的纯化物。
[0015]
作为优选,所述s6中,所述富集净化的方式是:将5种稻曲菌毒素的柱层析分离提取物各自通过固相萃取柱进行固相萃取,得ustiloxin a、ustiloxin b、ustiloxin c、ustiloxin d和ustiloxin f 5种稻曲菌毒素的富集净化物。
[0016]
作为优选,所述s6中,所述纯化的方式是:将经过富集净化得到的5种稻曲菌毒素的富集净化物,分别经制备型或半制备型高效液相色谱进一步分离制备,液相色谱馏分收集器根据目标化合物保留时间设置自动收集,收集液经真空冷冻干燥,最终分别得到含量均大于90%的5种稻曲菌毒素单体化合物ustiloxina、ustiloxin b、ustiloxin c、ustiloxin d和ustiloxin f纯化物。
[0017]
作为优选,所述s5中,利用高效液相色谱-质谱联用仪对收集的洗脱液进行追踪鉴定。
[0018]
作为优选,所述高效液相色谱-质谱联用仪中,采用esi源负离子模式,色谱柱为c18柱,以0.1%甲酸水-甲醇溶液体系为流动相进行梯度洗脱。
[0019]
作为优选,所述稻曲球的获得方法是:在发生稻曲病的水稻生长后期,从水稻稻穗部采摘墨绿色或黄绿色的球状物即稻曲球,于-20℃冰箱保存,备用;所述稻曲球孢子粉的获得方法是:在发生稻曲病的水稻生长后期,从水稻稻穗部采摘墨绿色或黄绿色的球状物即稻曲球,晾干,收集稻曲球外层包裹的粉状物,即为稻曲球孢子粉。
[0020]
作为优选,所述s1中,原料以物料比为1:5体积的水进行浸泡,用高速匀浆机充分破碎匀浆,并用超声波提取器超声助溶30min,再置于恒温水浴震荡器中35℃震荡提取8个小时以上,然后在不低于10000r/min的转速下高速离心,上清液经纱布过滤后真空冷冻干燥72小时,得到稻曲菌毒素的粗提物。
[0021]
作为优选,所述耐有机中压层析柱的径高比为1:32,进行梯度洗脱过程中,依次设置5个流动相比例梯度,分别为5%、10%、15%、20%和25%,各流动性比例梯度的洗脱体积为一倍柱体积,洗脱液流速为1.2ml/min。
[0022]
作为优选,利用固相萃取柱对5种稻曲菌毒素的柱层析分离提取物进行固相萃取时,稻曲菌毒素ustiloxin a、ustiloxin c、ustiloxin d和ustiloxin f 4种稻曲菌毒素采用混合阳离子交换柱(pcx)进行富集净化处理,而稻曲菌毒素 ustiloxin b采用混合阳离子交换柱(pcx)和混合阴离子交换柱(pax)串联方式进行富集净化处理。
[0023]
作为优选,所述纯化过程中,采用半制备型高效液相色谱仪结合自动馏分收集器依据目标化合物保留时间,以甲醇-水溶液等度洗脱,根据5种稻曲菌毒素各自的特征吸收波长进行自动收集。
[0024]
本发明相对于现有技术而言,具有以下优点:
[0025]
1)本发明为首次采用精细树脂填料同时对ustiloxin a、ustiloxin b、ustiloxinc、ustiloxin d和ustiloxin f 5种稻曲菌毒素进行一次性完全分离。
[0026]
2)本发明在进行分离、提取以及纯化制备工艺研究中,打破了传统的先进行整体提取分离,再净化,最后柱层析等分离制备的常规思路,在提取分离得到粗提物后,首先进行5种稻曲菌毒素单体化合物的柱层析分离,得到完全分离的 5种稻曲菌毒素化合物之后,再采用固相萃取技术分别对其进行富集净化处理,不仅可以简化前期净化工艺条件,同时由于没有5种毒素之间的相互兼顾与干扰,节约净化成本的同时,还可以很好地降低各种毒素的损失,提高其得率。
[0027]
3)本发明在进行富集净化时根据5种稻曲菌毒素的各自以及本方法工艺特点,不同的稻曲菌毒素采用不同的固相萃取柱进行富集净化处理,有单一固相萃取柱、有串联固相萃取柱,富集净化的同时,兼顾得率。
[0028]
4)本发明相对于现有多次反复分离纯化的方法,工艺流程简单,快速高效,重复性好,而且没有用到二氯甲烷等有机溶剂,安全无污染。
[0029]
5)本发明创新性地将高效液相色谱仪与柱层析装置相结合,打破了传统的柱层析分离方法中采用蠕动泵作为输液系统的方法,将高效液相色谱仪代替蠕动泵作为输液系统应用于柱层析填料的装填与洗脱分离,避免了实验过程中容易产气、断层、前后流速变化比较大、重复装填等问题,实验结果稳定,重现性好,而且实验过程少去了人工配制洗脱溶液问题,省时省力,建立了一套完美有效的柱层析分离体系。
[0030]
本发明可分离纯化制备得到5种稻曲菌毒素单体化合物,突破了多年来限制稻曲菌毒素对人体健康影响的深入研究以及风险监测、风险评估以及限量标准研究等方面缺乏稻曲菌毒素标准样品的关键瓶颈问题,5种稻曲菌毒素单体化合物的获得,可以为今后稻曲菌毒素的深入研究与应用,提供基本前提与保障,加快人们对稻曲菌毒素的认知与发展进程。
附图说明
[0031]
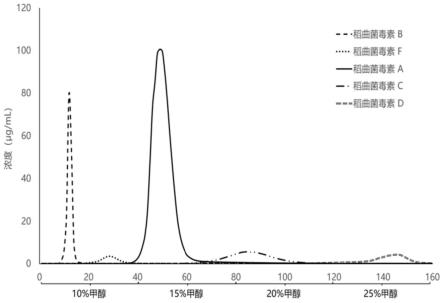
图1为5种稻曲菌毒素柱层析分离曲线图。
[0032]
图2为稻曲菌毒素ustiloxin a纯化物高效液相色谱图。
[0033]
图3为稻曲菌毒素ustiloxin b纯化物高效液相色谱图。
[0034]
图4为稻曲菌毒素ustiloxin c纯化物高效液相色谱图。
[0035]
图5为稻曲菌毒素ustiloxin d纯化物高效液相色谱图。
[0036]
图6为稻曲菌毒素ustiloxin f纯化物高效液相色谱图。
具体实施方式
[0037]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。本发明各个实施例中的技术特征在没有相互冲突的前提下,均可进行相应组合。
[0038]
在本发明中,提供了一种同时分离纯化制备5种稻曲菌毒素的方法,其包括如下步骤:
[0039]
s1、以稻曲球整球或者稻曲球孢子粉为原料,以水作为提取溶液对原料进行匀浆
破碎、震荡提取和离心分离,获得的上清液经过真空冷冻干燥得到稻曲菌毒素的粗提物。
[0040]
作为本发明的一个较佳实施例中,稻曲球整球或者稻曲球孢子粉均可以作为本发明的原料,两者可以按照如下方式获取,其中:
[0041]
所述稻曲球的获得方法是:在发生稻曲病的水稻生长后期,从水稻稻穗部采摘墨绿色或黄绿色的球状物即稻曲球,于-20℃冰箱保存,备用;
[0042]
所述稻曲球孢子粉的获得方法是:在发生稻曲病的水稻生长后期,从水稻稻穗部采摘墨绿色或黄绿色的球状物即稻曲球,晾干,收集稻曲球外层包裹的粉状物,即为稻曲球孢子粉。
[0043]
作为本发明的一个较佳实施例,上述提取粗提物的具体工艺参数可根据实际进行优化调整,优化后的做法为:原料以物料比为1:5体积的水进行浸泡,用高速匀浆机充分破碎匀浆,并用超声波提取器超声助溶30min,再置于恒温水浴震荡器中35℃震荡提取8个小时以上,然后在不低于10000r/min的转速下高速离心,上清液经纱布过滤后真空冷冻干燥72小时,得到稻曲菌毒素的粗提物。在该做法下,以水作为提取溶液,相比于用甲醇进行提取的方法具有更高的提取效率。
[0044]
s2、采用精细树脂hp20ss作为柱层析的填料按湿法装柱方式填入耐有机中压层析柱中,将耐有机中压层析柱安装于高效液相色谱仪的色谱柱位置,采用高效液相色谱仪作为输液系统,对层析柱进行压柱。
[0045]
需要说明的是,精细树脂hp20ss属于市售产品,其粒径分布为60-150μm。耐有机中压层析柱亦可采用市售的中压层析柱,其具体型号不限,只要其能够耐受淋洗液中的有机相即可。精细树脂hp20ss在进行装柱时需要进行活化并用相应的流动相配成悬浮液,以便于填入层析柱中,其具体可根据厂商所提供的的方法实现。
[0046]
作为本发明的一个较佳实施例,上述精细树脂hp20ss可预先用甲醇进行活化,然后用甲醇-水体系配成悬浮液,甲醇-水体系中甲醇含量为20%。再按照湿法装柱的具体做法,将悬浮液注入柱子中使精细树脂hp20ss逐渐填满耐有机中压层析柱。然后再将耐有机中压层析柱安装于高效液相色谱仪中,替换原本的色谱柱,继续用上述20%的甲醇-水溶液体系作为淋洗剂对耐有机中压层析柱进行压柱,此时压柱的压力来源于高效液相色谱仪自带的泵,淋洗剂由高效液相色谱仪自动压入层析柱中。一般压柱24小时,即可得到待上样的层析柱。
[0047]
另外,上述装柱过程中的径高比会影响后续的洗脱特性,在本发明的一个较佳实施例,径高比优选设置为1:32的比例。
[0048]
上述精细树脂hp20ss是在对ustiloxin a、ustiloxin b、ustiloxin c、ustiloxind和ustiloxin f 5种稻曲菌毒素的分离特性研究基础上,经过大量筛选后选定的填料类型,它可以较好地实现同时对5种稻曲菌毒素的一次性完全分离。
[0049]
s3、将粗提物用水溶解后离心,获取的上清液过膜滤去杂质后,上层析柱进行柱层析分离。
[0050]
本发明中柱层析分离的基本实现步骤属于现有技术,其具体的工艺参数需要根据实际进行优化调整。作为本发明的一个较佳实施例,可事先根据层析柱填料装填用量计算其上柱样品量;然后将上述粗提物于50ml离心管中,用少量水溶解,超声波提取器超声助溶30min,离心取上清液,过0.22μm滤膜后上装填了精细树脂hp20ss的层析柱进行分离。
[0051]
s4、采用高效液相色谱仪作为输液系统进行稻曲菌毒素目标化合物的洗脱,洗脱溶液为甲醇-水体系,洗脱方式为梯度洗脱,梯度洗脱中流动相比例由5%梯度升至25%,洗脱液使用全自动部分收集器逐管收集。
[0052]
需要说明的是,本发明中采用了高效液相色谱仪作为输液系统,因此洗脱溶液仅需要将a相甲醇和b相水置于高效液相色谱仪中,并设置好梯度比例,高效液相色谱仪即可按照相应的比例自动进行梯度调整。
[0053]
梯度洗脱的具体流动相比例梯度需要根据实际的试验进行优化调整。作为本发明的一个较佳实施例,针对上述填料的径高比为1:32的耐有机中压层析柱,进行梯度洗脱过程中,依次设置5个流动相比例梯度,分别为5%、10%、15%、 20%和25%,各流动相比例梯度的洗脱体积为一倍柱体积(约400ml),洗脱液流速为1.2ml/min。5种稻曲菌毒素洗脱流出顺序为ustiloxin b、ustiloxin f、 ustiloxin a、ustiloxin c和ustiloxin d,为了能够分离5种不同的稻曲菌毒素,需使用电脑全自动部分收集器收集,本实施例中收集体积为4ml/管。
[0054]
s5、对收集的洗脱液中的稻曲菌毒素类型进行追踪鉴定,合并属于同一类稻曲菌毒素的洗脱液,再分别对合并后的5种洗脱液进行真空离心浓缩,得到 ustiloxin a、ustiloxin b、ustiloxin c、ustiloxin d和ustiloxin f 5种稻曲菌毒素的柱层析分离提取物。
[0055]
作为本发明的一个较佳实施例中,可利用高效液相色谱-质谱联用仪(lc-ms/ms)对收集的洗脱液进行追踪鉴定。而且lc-ms/ms进行追踪鉴定时,需依据稻曲菌毒素质谱全扫描质谱图、母离子准确质量数、同位素丰度比和二级裂解规律进行总结分析,确定包括色谱柱、柱温、进样量、流动相及梯度洗脱程序、离子源、扫描模式、扫描范围、质谱分辨率、裂解模式、鞘气(n 2)压力、辅助气(n 2)压力、毛细管温度、毛细管电压等lc-ms/ms色谱-质谱条件,得到高效、准确的5种稻曲菌毒素含量分析及确证方法。作为本发明的一个较佳实施例,高效液相色谱-质谱联用仪中,可采用esi源负离子模式,色谱柱为c18 柱,以0.1%甲酸水-甲醇溶液体系为流动相进行梯度洗脱。
[0056]
s6、对5种稻曲菌毒素的柱层析分离提取物通过固相萃取技术进行富集净化后再进一步纯化,最终得到ustiloxin a、ustiloxin b、ustiloxin c、ustiloxin d和 ustiloxin f 5种稻曲菌毒素的纯化物。
[0057]
需要说明的是,上述富集净化和纯化的具体做法不限,以能够通过富集净化对稻曲菌毒素进行富集和除杂净化以及进一步纯化为准。
[0058]
作为本发明的一个较佳实施例,上述富集净化的方式是:将5种稻曲菌毒素的柱层析分离提取物各自通过固相萃取柱进行固相萃取,得ustiloxin a、ustiloxinb、ustiloxin c、ustiloxin d和ustiloxin f 5种稻曲菌毒素的富集净化物。
[0059]
不同的稻曲菌毒素所需的固相萃取柱不同。进一步的,在一优选实施例中,可利用固相萃取柱对5种稻曲菌毒素的柱层析分离提取物进行固相萃取时,稻曲菌毒素ustiloxin a、ustiloxin c、ustiloxin d和ustiloxin f 4种稻曲菌毒素采用混合阳离子交换柱(pcx)进行富集净化处理,而稻曲菌毒素ustiloxin b采用混合阳离子交换柱(pcx)和混合阴离子交换柱(pax)串联方式进行富集净化处理。
[0060]
作为本发明的一个较佳实施例,上述纯化的方式是:将经过富集净化得到的 5种
稻曲菌毒素的富集净化物,分别经制备型或半制备型高效液相色谱进一步分离制备,液相色谱馏分收集器根据目标化合物保留时间设置自动收集,收集液经真空冷冻干燥,最终分别得到含量均大于90%的5种稻曲菌毒素单体化合物 ustiloxin a、ustiloxin b、ustiloxin c、ustiloxin d和ustiloxin f纯化物。
[0061]
进一步的,在纯化过程中,优选采用半制备型高效液相色谱仪,其中采用半制备型高效液相色谱仪结合自动馏分收集器依据目标化合物保留时间,可以甲醇
ꢀ‑
水溶液等度洗脱,根据5种稻曲菌毒素各自的特征吸收波长进行自动收集。在一个优选实施例中,半制备型高效液相色谱仪中的洗脱流速设置为1.5ml/min,收集器模式设置为基于时间,流动相如下:ustiloxin a、ustiloxin c和ustiloxin d3种稻曲菌毒素为10%甲醇-水溶液等度洗脱,ustiloxin b和ustiloxin f 2种稻曲菌毒素为5%甲醇-水溶液等度洗脱。检测波长依据不同稻曲菌毒素的特征吸收确定ustiloxin a、ustiloxin b、ustiloxin c均为254nm和290nm,以254nm波长为主,290nm波长收集参考;ustiloxin d和ustiloxin f检测波长为227nm和 287nm,以227nm波长为主,287nm波长收集参考。
[0062]
下面通过具体实施例,对本发明的技术方案作进一步的具体说明。
[0063]
实施例:
[0064]
本实施例中所采用的材料与试剂、仪器与设备、实验方法等如下:
[0065]
1.材料与试剂
[0066]
1.1稻曲球的获得:在发生稻曲病的水稻生长后期,从水稻稻穗部采摘墨绿色或黄绿色的球状物即稻曲球,于-20℃冰箱保存,备用。
[0067]
1.2试剂、耗材:层析柱为2.5cm
×
100cm耐有机中压层析柱(北京瑞达恒辉有限公司);hp20ss精细树脂,粒径为60-150μm(北京绿百草科技发展有限公司);色谱纯甲醇(默克化工技术(上海)有限公司);质谱级甲醇(默克化工技术(上海)有限公司);色谱纯甲酸(北京百灵威科技有限公司);色谱纯氨水(上海阿拉丁生化科技股份有限公司);超纯水(自制);0.22μm滤膜(上海安谱实验科技股份有限公司);bond elut plexa pcx,500mg,6ml(美国安捷伦科技有限公司);bond elut plexa pax,500mg,6ml(美国安捷伦科技有限公司);bond elut c18,500mg,6ml(美国安捷伦科技有限公司);色谱柱agilenteclipse plus c18,2.1mm
×
50mm,1.8μm(美国安捷伦科技有限公司);色谱柱 agilent eclipse xdb c18,9.4mm
×
250mm,5μm(美国安捷伦科技有限公司)。
[0068]
2仪器与设备
[0069]
低温真空冷冻干燥机(美国labconco);低温离心浓缩仪(美国 labconco);高速离心机(日本久保田3740);恒温水浴震荡器(浙江金华市荣华仪器制造有限公司);高速匀浆机(上海弗鲁克流体机械制造有限公司);超声波清洗器(上海科导超声仪器有限公司);高效液相色谱仪1260型(美国安捷伦科技有限公司);高效液相色谱馏分收集器g1364c型(美国安捷伦科技有限公司);高效液相色谱-质谱联用仪6470型(美国安捷伦科技有限公司);healforce超纯水系统(中国香港力康生物医疗科技控股集团);电脑全自动部分收集器dbs-100型(中国上海青浦沪西仪器厂)。
[0070]
3实验具体方法
[0071]
3.1稻曲球水提液及粗提液冻干粉的制备
[0072]
称取100g稻曲球整球为原料,以物料比为1:5体积的水浸泡,用高速匀浆机充分破
碎匀浆,超声波提取器超声助溶30min,置于恒温水浴震荡器中,35℃震荡提取8个小时以上,然后在12000r/min的转速下高速离心,过纱布后取上清液真空冷冻干燥72小时,得稻曲球的粗提液冻干粉i。
[0073]
3.2稻曲菌毒素的柱层析分离
[0074]
3.2.1层析柱装填:采用精细树脂hp20ss作为柱层析的填料,其粒径为 60-150μm,层析柱为中压耐有机层析柱,柱尺寸2.5cm
×
100cm。上述精细树脂 hp20ss预先用甲醇进行活化,然后用含20%甲醇的甲醇-水体系配成悬浮液,再按照湿法装柱的具体做法,将悬浮液注入柱子中使精细树脂hp20ss逐渐填满耐有机中压层析柱,以1:32的径高比装填,填料高度为80cm。然后再将装有填料的耐有机中压层析柱安装于高效液相色谱仪中,替换原本的色谱柱,采用高效液相色谱仪作为输液系统利用20%甲醇的甲醇-水体系作为淋洗液进行压柱,24小时后层析柱装填完毕,待上样。
[0075]
3.2.2柱层析分离:称取5g稻曲球粗提液冻干粉i,于50ml离心管中,用 20ml水溶解,超声波提取器超声助溶30min,离心取上清液,过0.22μm滤膜滤后上层析柱进行分离。以1.2ml/min的流速,甲醇-水溶液5%-25%的洗脱体系进行梯度洗脱,各比例洗脱体积为一倍柱体积,约为400ml。5种稻曲菌毒素洗脱流出顺序为ustiloxin b、ustiloxin f、ustiloxin a、ustiloxin c和ustiloxin d,使用电脑全自动部分收集器收集,收集体积为4ml/管。
[0076]
本实施例中,5种稻曲菌毒素的柱层析分离曲线图如图1所示,可见上述精细树脂hp20ss可以较好地实现同时对ustiloxin a、ustiloxin b、ustiloxin c、 ustiloxin d和ustiloxin f5种稻曲菌毒素的一次性完全分离,各自的出峰几乎不存在重叠。
[0077]
3.2.3稻曲菌毒素的lc-ms/ms追踪鉴定方法
[0078]
每管收集的洗脱液中的稻曲菌毒素类型采用高效液相色谱-质谱联用仪 (lc-ms/ms)追踪鉴定,合并属于同一类稻曲菌毒素的洗脱液,再分别对合并后的5种洗脱液进行真空离心浓缩,得到ustiloxin a、ustiloxin b、ustiloxin c、 ustiloxin d和ustiloxin f 5种稻曲菌毒素柱层析分离提取物ii。
[0079]
稻曲菌毒素分离纯化过程中均采用高效液相色谱-质谱联用仪进行追踪鉴定,色谱质谱条件为色谱柱:agilent eclipseplus c18(2.1mm
×
50mm,1.8μm);柱温:25℃;进样量1.0μl;流动相:a相为0.1%甲酸水溶液;b相为甲醇;流速:0.2μl/min;梯度洗脱程序:0~2.00min,90%a;2.00~10.00min,90%~20% a;10.00~12.00min,90%a;离子源:esi源负离子模式;扫描模式:全扫描;扫描范围:m/z 200-1 000;质谱分辨率:100000;裂解模式:碰撞诱导解离(cid);鞘气(n 2)压力:241.33kpa;辅助气(n 2)压力:34.48kpa;毛细管温度为 350℃。
[0080]
3.3稻曲菌毒素的富集净化
[0081]
为了验证不同固相萃取柱的富集净化效果,分别采用c18、混合阴离子交换柱和混合阳离子交换柱3种不同净化原理的固相萃取柱对上述5种稻曲菌毒素柱层析分离提取物进行净化,具体为c18、pax、pcx。比较三者富集净化结果发现,c18吸附能力最强,几乎吸附全部毒素,难以洗脱;pax、pcx均有一定程度的富集净化作用,由于5种稻曲菌毒素结构式中均含有多个亚氨基,因此利用酸性条件下可带正电的特性,运用吸附目标物和吸附杂质两种不同处理方法对样品净化,最终目标物吸附模式选择pcx混合阳离子交换柱。由于稻曲菌
毒素b经柱层析分离时最先洗脱出来,杂质含量较高,只采用pcx富集净化达不到较为理想的效果,因此采用pcx-pax及pcx-pcx两种固相萃取柱串联的方式进行富集净化。采用高效液相进行含量及确证结果发现,pcx-pax串联时富集净化效果较好,因此本实施例中最终确定稻曲菌毒素ustiloxin b采用 pcx-pax串联富集净化,其他稻曲菌毒素ustiloxin a、ustiloxin c、ustiloxin d 和ustiloxin f均直接采用pcx进行富集净化,从而分别得到ustiloxin a、 ustiloxin b、ustiloxin c、ustiloxin d和ustiloxin f 5种稻曲菌毒素富集净化物 iii。
[0082]
3.4稻曲菌毒素高效液相色谱制备收集
[0083]
将上述5种稻曲菌毒素富集净化物iii分别经半制备型高效液相色谱进一步纯化制备,采用半制备型高效液相色谱仪结合自动馏分收集器,依据目标化合物保留时间进行收集。其中,流速1.5ml/min,收集器模式设置为基于时间,流动相为ustiloxin a、ustiloxin c和ustiloxin d 3种稻曲菌毒素为10%甲醇-水溶液等度洗脱,ustiloxin b和ustiloxin f 2种稻曲菌毒素为5%甲醇-水溶液等度洗脱。检测波长依据不同稻曲病菌毒素的特征吸收确定ustiloxin a、ustiloxin b、 ustiloxin c均为254nm和290nm,以254nm波长为主,290nm波长收集参考; ustiloxin d和ustiloxin f检测波长为227nm和287nm,以227nm波长为主,287nm 波长收集参考。收集液经真空冷冻干燥得到含量均大于90%的5种稻曲菌毒素单体化合物ustiloxin a、ustiloxin b、ustiloxin c、ustiloxin d和ustiloxin f纯化物iv。
[0084]
最终,图2~图6分别展示了本实施例的上述稻曲菌毒素ustiloxin a~f的纯化物高效液相色谱图,表明本实施例中同时分离纯化制备5种稻曲菌毒素,其纯度较高,没有明显的杂质。本发明得到的5种稻曲菌毒素ustiloxin a、ustiloxinb、ustiloxin c、ustiloxin d和ustiloxin f的纯度均可以达到90%以上,可做为标准样品使用。
[0085]
综上,本发明以水作为提取溶剂,采用精细树脂进行柱层析分离,采用固相萃取技术做为富集净化方法,采用半制备型高效液相色谱进行制备收集,液相色谱-质谱联用仪追踪鉴定,可以同时分离纯化制备5种稻曲菌毒ustiloxin a、 ustiloxin b、ustiloxin c、ustiloxin d和ustiloxin f单体化合物。本发明方法操作简单、快速高效、重复性好、安全无污染、纯度高。
[0086]
以上所述的实施例只是本发明的一种较佳的方案,然其并非用以限制本发明。有关技术领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此凡采取等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1