一种增强间充质干细胞免疫调节能力的方法与流程
5ng/ml。
11.进一步,步骤(1)的培养条件为:37℃,5% co2培养箱中培养66-78小时,优选地,培养72小时;步骤(2)在传代后培养42-54小时,优选地,培养48小时;之后再添加白细胞介素因子和/或肿瘤坏死因子继续培养18-30小时,优选地,可培养24小时。
12.进一步,步骤(1)的初始接种密度为4000-8000/cm2,后续每一次传代的接种密度为5000-7000/cm2。
13.进一步,在步骤(1)中,在每一次细胞传代之前都需要用消化酶将消化成单细胞,并制成细胞悬液。
14.本发明还提供了一种由上述所述的方法构建的间充质干细胞。
15.本发明还提供了一种如上述任一项所述的方法在构建间充质干细胞上的应用。
16.相对于现有技术,本发明所述的增强间充质干细胞免疫调节能力的方法,克服了现有技术存在的诸多缺点,具有以下优越性:(1)更加持续稳定增强msc抗炎免疫调节能力,较单独添加蛋白因子抗炎功能更强,持续性更好,批间处理更稳定;(2)增强抗炎及免疫活性的同时并未影响msc细胞表面关键标志物改变,保证细胞质量的同时大大降低了临床应用过程风险;(3)与单纯使用蛋白因子预处理增强免疫活性相比,本发明采用的方法增强抗炎同时并未降低msc增殖能力及对衰老的促进,进而保证了细胞的活性及制备产量;(4)本发明使用的是l-抗坏血酸衍生物,其本身无毒,处理过程简单,且处理后易于从细胞上洗脱,对后续临床应用无安全性风险,且处理后的细胞降低促进血管生成能力,从而降低了msc体内促瘤风险。
17.(5)与现有技术手段相比,本发明操作过程简单,降低了蛋白因子使用成本。
附图说明
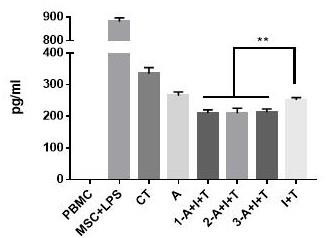
18.构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:图1为上清中炎性因子tnfα的分泌情况;pbmc为阴性组,pbmc+lps为阳性组,ct为对照组,即对比例1;a+i+t为l-抗坏血酸衍生物与白细胞介素因子和肿瘤坏死因子联合使用组,1-a+i+t为实施例1,2-a+i+t为实施例2,3-a+i+t为实施例3;a为只添加l-抗坏血酸衍生物组,即对比例2;i+t为只添加白细胞介素因子和肿瘤坏死因子组,即对比例3;图2为上清中抗炎因子il-10的分泌情况;pbmc为阴性组,pbmc+lps为阳性组,ct为对照组,即对比例1;a+i+t为l-抗坏血酸衍生物与白细胞介素因子和肿瘤坏死因子联合使用组,1-a+i+t为实施例1,2-a+i+t为实施例2,3-a+i+t为实施例3;a为只添加l-抗坏血酸衍生物组,即对比例2;i+t为只添加白细胞介素因子和肿瘤坏死因子组,即对比例3;图3为cd105表型检测结果;(a)为实施例1,(b)为实施例2,(c)为实施例3,(d)为对比例1,(e)为对比例3;图4为细胞形态及融合度情况图;(a)为实施例1,(b)为实施例2,(c)为实施例3,(d)为对比例1,(e)为对比例3;
图5为培养后细胞数量图;ct为对照组,即对比例1;a+i+t为l-抗坏血酸衍生物与白细胞介素因子和肿瘤坏死因子联合使用组,1-a+i+t为实施例1,2-a+i+t为实施例2,3-a+i+t为实施例3;i+t为只添加白细胞介素因子和肿瘤坏死因子组,即对比例3;图6为测试不同组细胞衰老情况;(a)为实施例1;(b)为实施例2;(c)为实施例3;(d)为无任何添加物的对照组,对比例1;(e)为只添加蛋白因子il-1β和tnf-α组,对比例3。
具体实施方式
19.需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
20.twist1基因是一种有效的上皮-间充质转化诱导因子,参与在肿瘤发生和发展过程中血管形成的调节。临床应用时,在体外扩增msc的过程中通常会使用含有bfgf的培养基成分来促进msc增殖,而bfgf诱导twist1基因表达上调,促进血管生成素vegfc和cyr61和fgf5的表达,提高timp1、timp2和ctgf的表达从而增强血管生成能力,不利于那些不适合血管生成的适应症治疗,例如关节修复或急性或慢性的炎症反应,同时也增加了其在体内的促瘤风险。
21.而twist1的下调不仅可以降低msc血管生成及体内促瘤风险,同时还会显著增强了msc免疫调节能力,这种免疫活性的增强主要是通过吲哚胺2,3-二加氧酶(ido1),血红素加氧酶1(hmox1),前列腺素过氧化物酶合酶2(ptgs2/cox2)实现, twist1基因表达下调诱导前列腺素e合酶(ptges)和集落刺激因子1(csf1),并表达更高水平的ido1蛋白。体外混合淋巴反应实验也证明与对照相比,将twist1表达下调可显著抑制t细胞增殖及th1的表达。
22.l-抗坏血酸-2-磷酸三钠盐是一种长效的维生素c衍生物,其稳定性优于一般的蛋白因子。使用低浓度l-抗坏血酸-2-磷酸三钠盐处理msc连续2代以上,可明显下调twist1基因的表达,增强其抗炎能力。pge2分泌增加,il-6分泌减少。但并未影响msc生长细胞、衰老和凋亡。此外,流式细胞术分析表明twist1基因沉默后并不显着改变msc上共刺激分子的表达。因此,twist1的下调增强免疫抑制活性而不影响msc的免疫原性。
23.此外,il-1β和tnf-α通常用于msc预处理以增加msc的抗炎能力,其作用机理为通过cox2-pge途径达到明显的抗炎效果,二者起效添加浓度不小于10ng/ml,若要达到明显的抗炎效果,处理天数需3天以上。
24.我们将两种预处理形式联合顺次使用,可在稳定增强抗炎功效的同时,降低蛋白因子的使用量及使用时间,从而降低其对细胞表型的影响。
25.下面将参考附图并结合实施例来详细说明本发明。
26.实施例1本发明所述的增强间充质干细胞免疫调节能力的方法包括如下步骤:(1)将l-抗坏血酸-2-磷酸三钠盐用dpbs配置成5mm的母液,用0.22μm的滤膜过滤除菌。
27.(2)将复苏的细胞以8000/cm2接种于培养容器中,向培养基中添加l-抗坏血酸-2-磷酸三钠盐母液混匀,使l-抗坏血酸-2-磷酸三钠盐的终浓度为0.05mm;之后置于37℃,5% co2培养箱中培养72小时。
28.(3)细胞传代:72小时后,细胞融合度达到约80%进行传代。
29.收集培养上清液,2000g、5分钟离心,收集上清。按照培养容器面积,每平方厘米加入0.2ml的dpbs清洗细胞,弃掉洗液。按照培养容器面积,每平方厘米加入0.015ml消化酶覆盖细胞,静置5分钟,待细胞完全脱落,加入消化酶2倍体积的上述培养液离心上清稀释消化液,500g离心5分钟。用完全培养基重悬细胞至适当浓度,以6500/cm2接种于培养容器中,向培养基中添加l-抗坏血酸-2-磷酸三钠盐母液混匀,使其终浓度为0.05mm。置于37℃,5% co2培养箱中培养72小时。72小时后重复上述传代过程,连续传代两次。之后使用不含l-抗坏血酸-2-磷酸三钠盐的培养基继续培养,持续培养2代。
30.(4)传代后培养48小时后,向培养基中添加il-1β和tnf-α,使终浓度均为1ng/ml。继续培养24小时后,收获细胞。
31.实施例2本发明所述的增强间充质干细胞免疫调节能力的方法包括如下步骤:(1)将l-抗坏血酸钙盐用dpbs配置成5mm的母液,用0.22μm的滤膜过滤除菌。
32.(2)将复苏的细胞以8000/cm2接种于培养容器中,向培养基中添加l-抗坏血酸钙盐母液混匀,使l-抗坏血酸钙盐的终浓度为0.1mm;之后置于37℃,5% co2培养箱中培养70小时。
33.(3)细胞传代:70小时后,细胞融合度达到约80%进行传代。
34.收集培养上清液,2000g、5分钟离心,收集上清。按照培养容器面积,每平方厘米加入0.2ml的dpbs清洗细胞,弃掉洗液。按照培养容器面积,每平方厘米加入0.015ml消化酶覆盖细胞,静置5分钟,待细胞完全脱落,加入消化酶2倍体积的上述培养液离心上清稀释消化液,500g离心5分钟。用完全培养基重悬细胞至适当浓度,以6500/cm2接种于培养容器中,向培养基中添加l-抗坏血酸钙盐母液混匀,使其终浓度为0.1mm。置于37℃,5% co2培养箱中培养72小时。72小时后重复上述传代过程,连续传代两次。之后使用不含l-抗坏血酸钙盐的培养基继续培养,持续培养2代。
35.(4)传代后培养50小时后,向培养基中添加il-1α和tnf-α,使终浓度均为5ng/ml。继续培养28小时后,收获细胞。
36.实施例3本发明所述的增强间充质干细胞免疫调节能力的方法包括如下步骤:(1)将l-抗坏血酸2-葡糖苷用dpbs配置成5mm的母液,用0.22μm的滤膜过滤除菌。
37.(2)将复苏的细胞以8000/cm2接种于培养容器中,向培养基中添加l-抗坏血酸2-葡糖苷母液混匀,使l-抗坏血酸2-葡糖苷的终浓度为0.06mm;之后置于37℃,5% co2培养箱中培养74小时。
38.(3)细胞传代:74小时后,细胞融合度达到约80%进行传代。
39.收集培养上清液,2000g、5分钟离心,收集上清。按照培养容器面积,每平方厘米加入0.2ml的dpbs清洗细胞,弃掉洗液。按照培养容器面积,每平方厘米加入0.015ml消化酶覆盖细胞,静置5分钟,待细胞完全脱落,加入消化酶2倍体积的上述培养液离心上清稀释消化液,500g离心5分钟。用完全培养基重悬细胞至适当浓度,以6500/cm2接种于培养容器中,向培养基中添加l-抗坏血酸2-葡糖苷母液混匀,使其终浓度为0.06mm。置于37℃,5% co2培养箱中培养72小时。72小时后重复上述传代过程,连续传代两次。之后使用不含l-抗坏血酸2-葡糖苷的培养基继续培养,持续培养2代。
40.(4)传代后培养50小时后,向培养基中添加il-6和tnf-β,使终浓度均为2ng/ml。继续培养26小时后,收获细胞。
41.对比例1在上述实施例1的基础上,既不添加l-抗坏血酸-2-磷酸三钠盐,也不添加il-1β和tnf-α,培养相同天数。
42.对比例2在上述实施例1的基础上,只添加l-抗坏血酸-2-磷酸三钠盐培养相同天数。
43.对比例3在上述实施例1的基础上,只添加il-1β和tnf-α培养相同天数。
44.结果分析1、在体外建立炎性模型,即用lps(脂多糖)刺激pbmc(外周血单个核细胞)模拟炎性环境,在此基础上分别加入实施例1-3和对比例1-3不同组别间充质干细胞(msc)共培养,检测上清中炎性因子tnfα及il-10分泌情况,如图1和图2。
45.图1为上清中炎性因子tnfα的分泌情况,图2为上清中抗炎因子il-10的分泌情况;其中,pbmc为阴性组,是指未进行炎性刺激,不表达炎性因子,用于内控;pbmc+lps为阳性组,是指pbmc添加lps进行炎性刺激,高表达炎性因子,用于内控;ct为对照组,即将对比例1的间充质干细胞加入pbmc+lps炎性环境中进行炎性测试;a+i+t为l-抗坏血酸衍生物与白细胞介素因子和肿瘤坏死因子联合使用组,即将实施例1-3的间充质干细胞加入pbmc+lps炎性环境中进行炎性测试,1-a+i+t为实施例1,2-a+i+t为实施例2,3-a+i+t为实施例3;a为只添加l-抗坏血酸-2-磷酸三钠盐组,即对比例2;i+t为只添加il-1β和tnf-α组,即将对比例3的间充质干细胞加入pbmc+lps炎性环境中进行炎性测试。
46.图中结果显示,实施例1-3联合处理组较其他组显著抑制炎性因子tnfα分泌和促进抗炎因子il-10分泌。
47.说明本发明方法能更加持续稳定增强msc抗炎免疫调节能力,较单独添加蛋白因子抗炎功能更强,持续性更好,批间处理更稳定。
48.2、cd105为间充质干细胞关键表面标记物之一。行业内参照2006年国际细胞治疗协会发表的文献,作为间充质干细胞进行鉴别及质控标准,其中包括cd105阳性率大于95%。
49.图3为通过流式细胞术对细胞表面标志物cd105进行检测,(a)为实施例1,(b)为实施例2,(c)为实施例3,(d)为对比例1,(e)为对比例3。结果显示,对比例1和实施例1-3联合使用组cd105阳性表达率均在95%以上,而对比例3单纯使用il-1β和tnf-α组cd105表达率为81.8%,远低于前两组,不符合msc质量标准。
50.说明本发明采用的方法增强抗炎及免疫活性的同时并未影响msc细胞表面关键标志物改变,保证细胞质量的同时大大降低了临床应用过程风险。
51.3、图4为细胞形态及融合度情况图,(a)为实施例1,(b)为实施例2,(c)为实施例3,(d)为对比例1,(e)为对比例3。
52.图4所示,通过培养后收获前镜下观察细胞形态及融合度情况,结果表明,对比例1的对照组和实施例1-3联合使用组细胞形态正常,呈长梭形,细胞基本布满整个培养表面,融合度约90%,且二者间无明显差异。但对比例3单纯使用il-1β和tnf-α组,并未完全布满培养表面,融合度约70%,说明联合使用组对细胞增殖无明显抑制作用及毒副作用,而单纯使
用il-1β和tnf-α组对细胞增殖有抑制作用。
53.说明与单纯使用蛋白因子预处理增强免疫活性相比,本发明采用的方法增强抗炎同时并未降低msc增殖能力及对衰老的促进,进而保证了细胞的活性及制备产量。
54.4、图5为培养后细胞数量图,如图5所示,通过培养后细胞计数结果表明,对比例1的对照组和实施例1-3联合使用组收获细胞总数无明显差异,但显著高于对比例3单纯使用il-1β和tnf-α组,说明联合使用组对细胞增殖无明显抑制作用及毒副作用,而单纯使用il-1β和tnf-α组对细胞增殖有抑制作用。
55.说明本发明使用的是l-抗坏血酸衍生物,其本身无毒,处理过程简单,且处理后易于从细胞上洗脱,对后续临床应用无安全性风险,且处理后的细胞降低促进血管生成能力,从而降低了msc体内促瘤风险。
56.5、图6为测试不同组细胞衰老情况,衰老时衰老相关β-半乳糖苷酶活性水平上调,对β-半乳糖苷酶进行染色,在普通的光学显微镜下就可以观测到细胞或组织的衰老情况,染色后变成蓝色说明细胞或组织已发生衰老。图6所示,对照组和实施例1-3联合使用组在镜下仅显示有极少且不明显的蓝色,而单纯使用il-1β和tnf-α组部分细胞被染成数量和颜色都更加显著的蓝色,说明细胞发生衰老。
57.通过上述实施例和对比例证明,添加l-抗坏血酸衍生物与白细胞介素因子和/或肿瘤坏死因子联合顺次使用可以持续、稳定的提高间充质干细胞抗炎功能,而不影响细胞增殖、免疫原性,以及后续临床应用的安全性。
58.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1