具有抗菌活性的双阳离子季铵盐抗菌肽模拟物及其制备方法
1.本发明属于药物化学技术领域,公开了具有抗菌活性的双阳离子季铵盐抗菌肽模拟物及其制备方法。
背景技术:
2.抗生素的发现和广泛使用在人类文明的发展过程中有着不可磨灭的意义,根据不同机制分为影响细菌蛋白质合成的氨基糖苷类、四环素类、氯霉素类、大环内酯类、林可霉素类;干扰细菌细胞壁合成的β-内酰胺类;损伤细菌细胞膜的多黏菌素类及干扰叶酸代谢的磺胺类和甲氧苄啶;影响核酸代谢的喹诺酮类等。但是伴随着社会和经济的快速发展,抗生素耐药性(antimicrobial resistance,amr)成为了抗生素时代以来细菌对公共健康的主要威胁。细菌耐药主要分为固有耐药和获得性耐药,而获得性耐药主要就是细菌在抗生素的作用下发生一定的基因突变或者获得外源性的耐药基因而产生的(cell,2007,128(6):1037-1050.)。主要分为几类:细菌产生灭活酶,使抗生素失效;细菌产生特异性外排泵,促使药物外排,降低菌体内部药物浓度,进而导致药物失活;细菌对抗生素渗透性的降低导致抗生素无法进入细菌菌体发挥作用;细菌通过对已有抗生素的靶点进行修饰或突变导致抗生素的靶标不明确,进而降低活性。如耐甲氧西林金黄色葡萄球菌(mrsa)就是通过产生特殊的青霉素结合蛋白(pbp2a)使得β-内酰胺类抗生素与青霉素结合蛋白的结合能力降低,进而使其失去抗菌活性。而万古霉素作为对抗革兰阳性菌的“最后一道防线”,也出现了耐药倾向(science,2008,321,356-361)。因此迫切需要开发新型对耐药菌有效的抗菌药物。
3.为了解决细菌耐药性问题,研究人员在1960年代到1980年代之间的研究发现了具有广谱抗菌作用的抗菌肽(antimicrobial peptides,amps)。amps作为一类具有抗菌活性的生物活性肽,分子大小、结构和组成大都不相同(一般含有5-50个氨基酸),因其裸露的阳离子和疏水性残基使其具有两亲性的特点。抗菌肽的二级结构和一般多肽一样,都具有α-螺旋、β-折叠或者环状结构等。这些结构特点使得amps具有破坏细菌细胞膜完整性的功能,而细胞膜的破坏也使得细菌很难产生相应的耐药机制,这也是抗菌肽不易产生耐药性的主要原因。但是随着抗菌肽作为一种新型抗菌药物被广泛研究,越来越多的问题也暴露在研究者面前,尤其是在药物方面的发展,受到了其本身内在缺点的限制,例如分子量较大,生产成本高,易被蛋白质酶降解,有盐类物质的存在下活性差,对宿主细胞具有较高细胞毒性和较差的药代动力学等。研究人员根据天然抗菌肽的两亲性结构特征,合成抗菌肽模拟物来克服上述缺点。如cai课题组以呋喃妥因为母核,合成具有疏水性烷烃链和正电荷的一系列化合物,表现出很好的活性(j.med.chem.,2017,60,8456);haldar课题组设计合成一系列对称的季铵盐化合物,通过改变中间烷烃和侧链的长度来调节活性和毒性,得到活性较好的化合物(j.med.chem.,2016,59,1075)。
4.在现有抗菌肽模拟物的研究基础上还需要进一步设计和开发具有高效、低毒的小分子抗菌肽模拟物。
技术实现要素:
5.基于现有技术现状,本发明目的在于提供一系列具有高抗菌活性的双阳离子季铵盐抗菌肽模拟物,有利于新抗菌药物研发;另一目是提供其制备方法。
6.为实现本发明目的,本发明以二甲基季铵盐结构为亲水基团,通过改变疏水区域的结构设计分子,并通过体外抗菌实验以及溶血毒性实验验证其抗菌能力以及毒性大小。
7.具体技术方案如下:
8.该化合物具有如下结构通式i和ⅱ:
[0009][0010]
特征:该结构以二溴烷烃作为中间连接部分,苯醚结构为疏水尾链结构,中间链长m=6,8,10;侧链长n=2,3,4。其为如下化合物:
[0011]
2a:m=6;n=2;
[0012]
2b:m=6;n=3;
[0013]
2c:m=6;n=4;
[0014]
2d:m=8;n=2;
[0015]
2e:m=8;n=3;
[0016]
2f:m=8;n=4;
[0017]
2g:m=10;n=2;
[0018]
2h:m=10;n=3;
[0019]
2i:m=10;n=4;
[0020][0021]
特征:该结构以二溴烷烃作为中间连接部分,苯基结构为疏水尾链结构,中间链长m=6,8,10;侧链长n=2,3。其为如下化合物:
[0022]
3a:m=6;n=2;
[0023]
3b:m=6;n=3;
[0024]
3c:m=8;n=2;
[0025]
3d:m=8;n=3;
[0026]
3e:m=10;n=2;
[0027]
3f:m=10;n=3;
[0028]
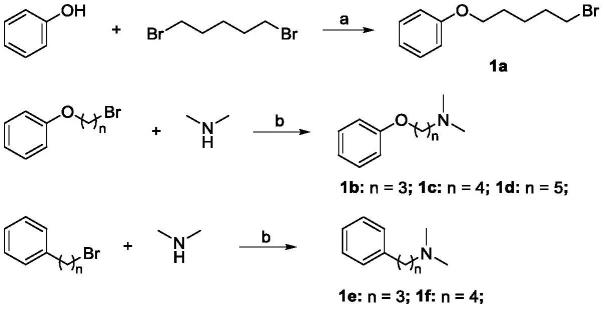
合成本发明双阳离子季铵盐抗菌肽模拟物(1a
–
1f,2a
–
2i,3a
–
3f)的路线如下:
[0029][0030]
反应条件:a)n,n-二甲基甲酰胺,碳酸钾,室温,24小时;b)乙醇,碳酸钾,室温,12小时。
[0031]
路线一中间体1a
–
1f的制备
[0032][0033]
反应条件:c)乙醇,耐压管,90℃,96-168小时。
[0034]
路线二终产物2a
–
2i,3a
–
3f的制备
[0035]
具体通过如下步骤实现:
[0036]
(1)将苯酚溶解在n,n-二甲基甲酰胺中,加入碳酸钾固体,与二溴戊烷反应得到中间体1a;将不同链长的苯氧基溴代烷和碳酸钾加入到乙醇中,然后加入二甲胺水溶液反应生成中间体1b
–
1d;将不同链长的苯基溴代烷和碳酸钾加入到乙醇中,然后加入二甲胺水溶液反应生成中间体1e和1f。
[0037]
(2)将不同长度的二溴烷烃分别和中间体1b
–
1d和中间体1e
–
1f在乙醇中,90℃耐压管中进行反应,分别得到目标终产物2a
–
2i和3a
–
3f。
[0038]
本发明创新点和优点:以二溴烷烃作为中间连接部分,以苯醚疏水基团和苯基疏水基团为侧链。通过改变中间链和侧链的长度,研究中间碳链和侧链的长度以及不同疏水基团对该类化合物活性和毒性的影响。实验证实:本发明所述的部分双阳离子季铵盐抗菌肽模拟物对革兰氏阳性菌,革兰氏阴性菌均表现出很好的活性,说明该系列化合物具有优异的抗菌活性。部分化合物(2g,2h,2i,3f)对金黄色葡萄球菌,大肠杆菌,粪肠球菌和嗜麦芽窄食单胞菌四种标准细菌的mic值(最小抑菌浓度)在0.5-4μg/ml之间。hc
50
(半数溶血浓度)结果显示其有较低的溶血毒性,具有较高的选择性。因此,本发明中提供的双阳离子季铵盐抗菌肽模拟物有望作为新的抗菌候选药物进行深入的研究,并对解决目前全球面临的耐药菌问题有重要意义。
具体实施方式
[0039]
下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明要求保护的范围。以下没有特别说明所述百分含量均为质量百分含量。
[0040]
合成化合物表征使用的仪器:nmr谱使用瑞典bruker dpx-400型超导核磁共振仪测定。
[0041]
实施例1中间体1a的制备:
[0042]
在圆底烧瓶(100ml)中,将苯酚(10.63mmol,1eq.)溶解在n,n-二甲基甲酰胺(dmf,10ml)中,加入碳酸钾(21.25mmol,2eq.)搅拌均匀。然后将二溴戊烷(15.94mmol,1.5eq.)滴加入反应体系中,并在室温下反应24h。反应结束后,加入乙酸乙酯(50ml)和水(50ml)稀释体系,然后萃取,保留有机相,再使用水(50ml)洗涤有机相3-5次,洗涤完成后用饱和氯化钠溶液(10ml)再洗涤1-3次,无水硫酸钠干燥。干燥过后过滤,浓缩,采用柱层析分离方法纯化产物(石油醚:乙酸乙酯=50:1,v:v)。
[0043]
1a:产率48%。1h nmr(400mhz,chloroform-d)δ7.31
–
7.26(m,2h),7.00
–
6.83(m,3h),3.97(t,j=6.3hz,2h),3.44(t,j=6.8hz,2h),1.99
–
1.90(m,2h),1.86
–
1.77(m,2h),1.69
–
1.58(m,2h).
13
c nmr(101mhz,chloroform-d)δ158.94,129.43,120.62,114.47,77.21,67.43,33.61,32.51,28.47,24.87.
[0044]
实施例2中间体1b的制备:
[0045]
在圆底烧瓶(100ml)中,将3-苯氧基溴丙烷(4.36mmol,1eq.)和碳酸钾(6.55mmol,1.5eq.)加入到乙醇(20ml)中,搅拌均匀后加入40%二甲胺水溶液(1.11ml,8.73mmol,2eq.),室温反应,12h结束反应后使用旋转蒸发仪蒸干体系,然后加入水(100ml)溶解固体,然后使用二氯甲烷(50ml)萃取3-5次,保留有机相,使用饱和氯化钠溶液(10ml)洗涤有机相1-3次,无水硫酸钠干燥。干燥过后过滤,浓缩,采用柱层析分离方法纯化产物(二氯甲烷:甲醇=20:1,v:v)。
[0046]
1b:产率75%。1h nmr(400mhz,chloroform-d)δ7.30
–
7.24(m,2h),6.98
–
6.86(m,3h),4.01(t,j=6.4hz,2h),2.45(t,j=7.3hz,2h),2.26(s,6h),2.00
–
1.91(m,2h).
13
c nmr(101mhz,chloroform-d)δ158.98,129.39,120.55,114.49,66.10,56.45,45.52,27.60.
[0047]
实施例3中间体1c的制备:制备方法同实施例2,所用苯氧基溴代烷为4-苯氧基溴丁烷。
[0048]
1c:产率78%。1h nmr(400mhz,chloroform-d)δ7.30
–
7.25(m,2h),7.01
–
6.82(m,3h),3.99(t,j=6.0hz,2h),2.56
–
2.46(m,2h),2.37(s,6h),1.94
–
1.65(m,4h).
13
c nmr(101mhz,chloroform-d)δ158.90,129.43,120.63,114.47,67.37,59.08,44.89,27.03,23.69.
[0049]
实施例4中间体1d的制备:制备方法同实施例2,所用苯氧基溴代烷为1a(5-苯氧基溴戊烷)。
[0050]
1d:产率79%。1h nmr(400mhz,chloroform-d)δ7.30
–
7.24(m,2h),6.95
–
6.87(m,3h),3.96(t,j=6.5hz,2h),2.31
–
2.25(m,2h),2.22(s,6h),1.85
–
1.76(m,2h),1.59
–
1.43(m,4h).
13
c nmr(101mhz,chloroform-d)δ159.05,129.38,120.47,114.47,67.71,59.76,45.55,29.26,27.55,24.01.
[0051]
实施例5中间体1e的制备:
[0052]
在圆底烧瓶(100ml)中,将3-苯基溴丙烷(4.69mmol,1eq.)和碳酸钾(7.04mmol,1.5eq.)加入到乙醇(20ml)中,搅拌均匀后加入40%二甲胺水溶液(1.19ml,9.38mmol,2eq.),室温反应12h。后处理和纯化方法同实施例2。
[0053]
1e:产率76%。1h nmr(400mhz,chloroform-d)δ7.30
–
7.26(m,2h),7.21
–
7.14(m,3h),2.68
–
2.60(m,2h),2.34
–
2.29(m,2h),2.24(s,6h),1.86
–
1.75(m,2h).
13
c nmr(101mhz,chloroform-d)δ142.18,128.36,128.31,125.74,59.24,45.40,33.65,29.34.
[0054]
实施例6中间体1f的制备:制备方法同实施例5,所用苯基溴代烷为4-苯基溴丁烷。
[0055]
1f:产率73%。1h nmr(400mhz,chloroform-d)δ7.30
–
7.24(m,2h),7.20
–
7.14(m,3h),2.63(t,j=7.6hz,2h),2.30
–
2.23(m,2h),2.20(s,6h),1.69
–
1.59(m,2h),1.55
–
1.44(m,2h).
13
c nmr(101mhz,chloroform-d)δ142.50,128.39,128.24,125.65,59.73,45.51,35.86,29.31,27.40.
[0056]
实施例7化合物2a的制备:
[0057]
将二溴辛烷(367.61μmol,1eq.)和中间体1b(1.10mmol,3eq.)加入到乙醇(5ml)中,在耐压管中90℃反应96-168小时。反应结束后,将体系蒸干得到黄色粘稠物,加入少量甲醇或者丙酮完全溶解油状物,然后加入大量乙酸乙酯重结晶,此时会析出黄白色的物质,将体系置于冰箱中一段时间,促进晶体析出。然后倾倒上层乙酸乙酯。重复上述重结晶操作可以得到纯品产物。若出现多次重结晶操作无法纯化产物的情况,则通过柱层析方法对产物进行进一步纯化(二氯甲烷:甲醇=20:1,v:v)。
[0058]
2a:产率38%。1h nmr(400mhz,dmso-d6)δ7.34
–
7.23(m,4h),6.99
–
6.93(m,6h),4.06(t,j=5.9hz,4h),3.53
–
3.42(m,4h),3.37
–
3.30(m,4h),3.08(s,12h),2.20
–
2.12(m,4h),1.73
–
1.63(m,4h),1.38
–
1.22(m,8h).
13
c nmr(101mhz,dmso-d6)δ158.07,129.52,120.86,114.44,64.46,62.89,60.35,50.13,28.32,25.65,22.19,21.68.
[0059]
实施例8化合物2b的制备:制备方法同实施例7,所用原料为二溴辛烷和中间体1c。
[0060]
2b:产率40%。1h nmr(400mhz,dmso-d6)δ7.33
–
7.25(m,4h),6.97
–
6.90(m,6h),4.02(t,j=6.0hz,4h),3.40
–
3.34(m,4h),3.32
–
3.25(m,4h),3.04(s,12h),1.87
–
1.60(m,12h),1.33
–
1.20(m,8h).
13
c nmr(101mhz,dmso-d6)δ158.36,129.46,120.56,114.41,66.42,62.88,62.42,49.97,28.31,25.69,25.53,21.69,18.80.
[0061]
实施例9化合物2c的制备:制备方法同实施例7,所用原料为二溴辛烷和中间体1d。
[0062]
2c:产率42%。1h nmr(400mhz,dmso-d6)δ7.31
–
7.26(m,4h),6.95
–
6.90(m,6h),3.99(t,j=6.3hz,4h),3.33
–
3.24(m,9h),3.02(s,12h),1.83
–
1.61(m,12h),7.31
–
7.26(q,j=7.8hz,4h),1.36
–
1.22(m,8h).
13
c nmr(101mhz,dmso-d6)δ158.51,129.44,120.42,114.34,66.88,62.94,62.81,49.90,28.33,28.11,25.71,22.52,21.71,21.47.
[0063]
实施例10化合物2d的制备:制备方法同实施例7,所用原料为二溴癸烷和中间体1b。
[0064]
2d:产率38%。1h nmr(400mhz,dmso-d6)δ7.34
–
7.28(m,4h),6.99
–
6.93(m,6h),4.06(t,j=5.9hz,4h),3.51
–
3.42(m,4h),3.35
–
3.28(m,4h),3.07(s,12h),2.20
–
2.10(m,4h),1.72
–
1.62(m,4h),1.37
–
1.21(m,12h).
13
c nmr(101mhz,dmso-d6)δ129.52,114.44,64.46,62.88,60.31,50.14,28.74,28.49,25.75,22.19,21.69.
[0065]
实施例11化合物2e的制备:制备方法同实施例7,所用原料为二溴癸烷和中间体
1c。
[0066]
2e:产率39%。1h nmr(400mhz,dmso-d6)δ7.33
–
7.26(m,4h),6.97
–
6.90(m,6h),4.02(t,j=5.9hz,4h),3.39
–
3.34(m,4h),3.31
–
3.23(m,4h),3.03(s,12h),1.89
–
1.59(m,12h),1.27(s,12h).
13
c nmr(101mhz,dmso-d6)δ158.36,129.45,120.57,114.40,66.40,62.90,62.41,49.99,28.76,28.49,25.80,25.52,21.70,18.80.
[0067]
实施例12化合物2f的制备:制备方法同实施例7,所用原料为二溴癸烷和中间体1d。
[0068]
2f:产率45%。1h nmr(400mhz,dmso-d6)δ7.31
–
7.26(m,4h),6.95
–
6.90(m,6h),3.99(t,j=6.3hz,4h),3.33
–
3.24(m,8h),3.03(s,12h),1.85
–
1.60(m,12h),1.48
–
1.39(m,4h),1.35
–
1.20(m,12h).
13
c nmr(101mhz,dmso-d6)δ158.51,129.44,120.41,114.34,66.88,62.93,62.76,49.90,28.75,28.48,28.11,25.80,22.51,21.72,21.47.
[0069]
实施例13化合物2g的制备:制备方法同实施例7,所用原料为二溴十二烷和中间体1b。
[0070]
2g:产率42%。1h nmr(400mhz,dmso-d6)δ7.34
–
7.28(m,4h),6.99
–
6.92(m,6h),4.06(t,j=5.9hz,4h),3.53
–
3.39(m,4h),3.34
–
3.27(m,4h),3.07(s,12h),2.22
–
2.09(m,4h),1.74
–
1.58(m,4h),1.54
–
1.18(m,16h).
13
c nmr(101mhz,dmso-d6)δ158.08,129.51,120.85,114.45,64.47,62.89,60.30,50.15,28.93,28.84,28.52,25.75,22.19,21.68.
[0071]
实施例14化合物2h的制备:制备方法同实施例7,所用原料为二溴十二烷和中间体1c。
[0072]
2h:产率48%。1h nmr(400mhz,dmso-d6)δ7.34
–
7.25(m,4h),6.98
–
6.90(m,6h),4.02(t,j=5.9hz,4h),3.38
–
3.31(m,4h),3.30
–
3.22(m,4h),3.02(s,12h),1.88
–
1.58(m,12h),1.32
–
1.20(m,16h).
13
c nmr(101mhz,dmso-d6)δ158.36,129.45,120.57,114.39,66.40,62.89,62.38,50.01,28.94,28.86,28.53,25.80,25.51,21.69,18.80.
[0073]
实施例15化合物2i的制备:制备方法同实施例7,所用原料为二溴十二烷和中间体1d。
[0074]
2i:产率51%。1h nmr(400mhz,dmso-d6)δ7.31
–
7.26(m,4h),6.95
–
6.90(m,6h),3.99(t,j=6.3hz,4h),3.34
–
3.26(m,8h),3.04(s,12h),1.84
–
1.59(m,12h),1.48
–
1.39(m,4h),1.34
–
1.22(m,16h).
13
c nmr(101mhz,dmso-d6)δ158.51,129.43,120.39,114.35,66.89,62.90,62.72,49.90,28.92,28.84,28.51,28.11,25.80,22.51,21.71,21.47.
[0075]
实施例16化合物3a的制备:制备方法同实施例7,所用原料为二溴辛烷和中间体1e。
[0076]
3a:产率37%。1h nmr(400mhz,dmso-d6)δ7.36
–
7.20(m,10h),3.34
–
3.27(m,8h),3.04(s,12h),2.62(t,j=7.7hz,4h),2.06
–
1.94(m,4h),1.67
–
1.56(m,4h),1.36
–
1.20(m,8h).
13
c nmr(101mhz,dmso-d6)δ140.35,128.39,128.31,126.17,62.86,62.43,50.02,31.62,28.26,25.63,23.64,21.64.
[0077]
实施例17化合物3b的制备:制备方法同实施例7,所用原料为二溴辛烷和中间体1f。
[0078]
3b:产率42%。1h nmr(400mhz,dmso-d6)δ7.33
–
7.17(m,10h),3.34
–
3.29(m,4h),3.28
–
3.22(m,4h),3.01(s,12h),2.64(t,j=7.5hz,4h),1.75
–
1.54(m,12h),1.35
–
1.20(m,
8h).
13
c nmr(101mhz,dmso-d6)δ141.45,128.31,128.24,125.87,62.87,62.63,49.94,34.31,28.31,27.66,25.69,21.69,21.29.
[0079]
实施例18化合物3c的制备:制备方法同实施例7,所用原料为为二溴癸烷和中间体1e。
[0080]
3c:产率45%。1h nmr(400mhz,dmso-d6)δ7.35
–
7.20(m,10h),3.32
–
3.23(m,8h),3.02(s,12h),2.61(t,j=7.7hz,4h),2.04
–
1.92(m,4h),1.65
–
1.53(m,4h),1.34
–
1.19(m,12h).
13
c nmr(101mhz,dmso-d6)δ128.39,128.30,62.86,62.42,50.05,31.62,28.74,28.47,25.74,23.62,21.65.
[0081]
实施例19化合物3d的制备:制备方法同实施例7,所用原料为为二溴癸烷和中间体1f。
[0082]
3d:产率37%。1h nmr(400mhz,dmso-d6)δ7.32
–
7.17(m,10h),3.34
–
3.30(m,4h),3.29
–
3.22(m,4h),3.02(s,12h),2.64(t,j=7.5hz,4h),1.74
–
1.54(m,12h),1.34
–
1.20(m,12h).
13
c nmr(101mhz,dmso-d6)δ141.46,128.30,128.24,125.85,62.85,62.56,49.93,34.30,28.74,28.46,27.66,25.78,21.69,21.28.
[0083]
实施例20化合物3e的制备:制备方法同实施例7,所用原料为为二溴十二烷和中间体1e。
[0084]
3e:产率40%。1h nmr(400mhz,dmso-d6)δ7.35
–
7.20(m,10h),3.33
–
3.23(m,8h),3.02(s,12h),2.61(t,j=7.7hz,4h),2.04
–
1.93(m,4h),1.64
–
1.55(m,4h),1.34
–
1.19(m,16h).
13
c nmr(101mhz,dmso-d6)δ140.34,128.38,128.30,62.84,62.39,50.05,31.62,28.93,28.83,28.50,25.74,23.62,21.64.
[0085]
实施例21化合物3f的制备:制备方法同实施例7,所用原料为为二溴十二烷和中间体1f。
[0086]
3f:产率41%。1h nmr(400mhz,dmso-d6)δ7.33
–
7.16(m,10h),3.32
–
3.26(m,4h),3.26
–
3.18(m,4h),2.99(s,12h),2.63(t,j=7.5hz,4h),1.74
–
1.52(m,12h),1.35
–
1.17(m,16h).
13
c nmr(101mhz,dmso-d6)δ141.43,128.31,128.23,125.87,62.88,62.58,49.96,34.31,28.96,28.87,28.52,27.64,25.79,21.67,21.27.
[0087]
应用例1体外抗菌活性测试
[0088]
(1)抗菌药物贮存液制备:制备抗菌药物贮备液的浓度为25600μg/ml,溶解度低的抗菌药物可稍低于上述浓度。溶解药物的溶剂选择超纯水或者二甲基亚砜。
[0089]
(2)待测菌的制备:用接种环挑取过夜培养的mh(a)培养皿上的单菌落于mh(b)培养基中,校准为0.5麦氏比浊标准,约含菌数1
×
108cfu/ml,然后稀释100倍,即得到约含菌数1
×
106cfu/ml的菌液,备用。
[0090]
(3)分别将抗菌药物贮备液母液(25600μg/ml)用超纯水稀释100倍,得到浓度为256μg/ml的抗菌药物溶液。取无菌的96孔板,第一孔加入200μl的抗菌药物,第二至十孔分别加入100μl的mh(b)肉汤培养基,从第一孔吸取100μl加入第二孔,混匀,再吸取100μl至第三孔,依次类推,第十孔吸取100μl弃去。此时各孔药物浓度依次为:128、64、32、16、8、4、2、1、0.5μg/ml,第十一孔加入200μl菌液(阳性对照),第十二孔加入200μl mh(b)培养基(阴性对照)。同时用万古霉素和美罗培南作为质控药物。
[0091]
(4)然后在1至10孔各加入50μl之前备好的菌液,使每管最终菌液浓度约为5
×
105cfu/ml,第1孔至第11孔药物浓度分别为128、64、32、16、8、4、2、1、0.5、0.25μg/ml。将96孔板放置37℃培养箱进行培养24h后观察菌液生长情况。
[0092]
(5)结果判断与解释:在读取和报告所测试菌株的mic前,应检查阳性对照管的细菌生长情况是否良好,阴性对照是否污染,质控药物的mic值是否处于质控范围。以肉眼观察,澄清的孔中对应的最低药物浓度,即为受试菌的mic。应用例2体外红细胞溶血性实验
[0093]
(1)pbs缓冲液:pbs磷酸盐用超纯水配置成1
×
pbs,然后进行高压灭菌。
[0094]
(2)5%红细胞悬浮液的制备:取300μl的血液至10ml ep管中,再加入5700μl 1
×
pbs混合均匀后低温离心(4℃,3500rpm,10min),破碎的血细胞会使上清液变红,此时将上清液弃去,加入5700μl 1
×
pbs混合均匀后低温离心,重复此操作直至上清液无色并弃去上清液。最后用5700μl 1
×
pbs重悬ep管底部的血细胞即为5%的红细胞悬浮液。用1
×
pbs配置0.1%的曲拉通x-100溶液作为阳性对照备用。
[0095]
(3)样品溶液的配置:用少量的dmso溶解待测试药物(dmso终浓度不能大于0.5%),并且用相同体积的dmso做阴性对照。溶解后的待测试药物溶液用pbs稀释,第一孔浓度为1280μg/ml,此时这支ep管内的药物为初始药物。然后平行取九支1.5mlep管置于试管架中,分别加入200μl的pbs(编号2号、3号、4号
……
10号)。所有药物都如此平行操作。最后,由初始药物ep管中吸取200μl的药品溶液加入2号ep管中,反复吹洗后吸取200μl到3号ep管中,反复吹洗
……
重复操作,直到10号ep管。如此,稀释好药物。
[0096]
(4)铺板:取96孔板,写好实验编号,药品代码,日期。将移液枪调至150μl,将配置好的5%红细胞悬液上下轻缓颠倒混匀,依次吸取铺入96孔板中(6
×
10)。然后将配置好的药物对应加入96孔板中,一个药物三个复孔。加完后放置37℃恒温箱内孵育1h。
[0097]
(5)后处理:将96孔板从恒温箱内取出,置于4℃离心机内离心(3500rpm,5min)。离心完毕,每块板对应都取一块新的96孔板。标注和离心后的板子对照。然后对应地吸取100μl上清液(孔孔对应)。吸取完毕后,与酶标仪中测取od值,分析数据,得到hc
50
。
[0098]
实验结果
[0099]
表一目标化合物2a
–
2i和3a
–
3f对革兰氏阴性及阳性敏感菌的mic(μg/ml)结果和体外红细胞溶血性hc
50
(μg/ml)结果
[0100][0101][0102]
注:a:万古霉素;b:美罗培南;nd:未检测
[0103]
由表一可见,所合成的化合物2a
–
2i和3a
–
3f中,部分化合物(例如化合物2g,2h,2i,3f)对革兰氏阳性菌金黄色葡萄球菌(s.aureus)和粪肠球菌(e.faecalis),革兰氏阴性菌大肠埃希菌(e.coli)和嗜麦芽窄食单胞菌(s.maltophilia)均表现出较好的活性,显示这类化合物具有显著的广谱抗菌活性;同时,其体外红细胞溶血性数据显示毒性较小,具有较好的选择性。另外从溶血毒性来看,本发明中带有苯醚或苯基结构的化合物在具有较好抗菌活性的同时,溶血毒性都较低,这也可能证明苯醚或苯基结构能够有效降低该类型化合物的溶血毒性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1