一种单细胞原位培养芯片及其原位纯培养物的分离方法与流程
1.本发明专利涉及材料、光学和生物医学工程等新兴交叉类技术领域,尤其是一种单细胞原位培养芯片及其原位纯培养物的分离方法,实现了实验中“不可培养”的微生物物种的高通量单细胞的原位培养。
背景技术:
2.自然界超过99%的微生物物种不会在体外合成培养基上生长,rrna和宏基因组学方法证明了这些未栽培物种的惊人多样性。同时几乎每个治疗领域——自身免疫性疾病、传染病、中枢神经系统、代谢疾病,甚至癌症——都以某种方式与微生物菌群的改变相关联。因此,获取这种“缺失”的微生物多样性对基础科学和应用科学都具有重要意义。
3.然而,人们对微生物的分析都是基于群体细胞的平均水平,这模糊了我们对微生物多样性的了解,掩盖了细胞功能性表型与基因的对应关系,丢失了单细胞异质性信息。
4.为了解决这一挑战,人们开发了一种在原位扩散室内培养微生物的方法。这种方法的基本原理是扩散将为室内的细胞提供天然存在的生长因子,并使那些在实验内“不可培养”的微生物物种放在自然环境的扩散室内生长。这种方法产生的微生物回收率比实验室标准技术高出许多倍。即便如此,这种方法很费力,随机性强,扩散室数量少,无法保证样品中微生物都在单个扩散室内培养,并且不能有效、高通量地分离大量单个微生物,这限制了该方法的适用性。
5.单细胞分选技术研究是当前国内外生物学研究热点。基于激光诱导前向转移(laser induced forward transfer,lift)原理的单细胞分选技术,能够在显微条件下,精准分选指定的单细胞用于基因分析,在生物、医学、食品等领域研究中应用广泛。
6.然而,lift技术存在一定局限性,在lift分选过程中无法在液体中实现单细胞捕获,一次可能分选多个细胞,并且激光作用牺牲层产生高温的蒸汽,生成的热量被牺牲层附近的细胞吸收,导致细胞损伤、死亡,这使得单细胞活体分选成功率大大降低,失去较大科研价值。目前,尚无一种在液体中有效实现单细胞捕获和降低分选损伤的可视化精准单细胞活体分选方法。
技术实现要素:
7.为了克服现有技术的不足,本发明提供了一种单细胞原位培养芯片及其原位纯培养物的分离方法,通过特殊的三层结构芯片设计,降低了物种培养随机性,提高样品中微生物在单个环境内培养率,满足有效高通量地分离单个微生物,实现从各种环境中平行培养和分离以前未培养的微生物物种。
8.为解决上述技术问题,本发明提供一种单细胞原位培养芯片及其原位纯培养物的分离方法,其中:
9.一种单细胞原位培养芯片,包括:
10.在金属镀膜玻璃片上,覆盖一层微孔膜,形成微孔分选芯片,在所述微孔膜上面覆
盖一层纳米级聚合物膜。上述三层结构共同构成具备多组微型扩散室的原位培养芯片,可为微型扩散室内的细胞提供天然存在的生长因子和营养物质,使那些在实验内不可培养的微生物物种在自然环境中原位生长。
11.进一步的,所述微孔膜为生物兼容性薄膜,采用微纳加工工艺覆盖在金属镀膜玻璃片上;
12.作为一种举例说明,所述金属镀膜玻璃片是指:通过磁控溅射方式将纳米级金属薄膜涂覆在玻璃片上。
13.作为一种举例说明,所述纳米级聚合物膜可以是0.1μm以下孔径的聚碳酸酯膜或醋酸纤维素滤膜等。
14.作为一种举例说明,所述不可培养是指:nonculture,是那些分离出来了却不能通过实验室培养和大量繁殖的微生物;这些微生物通过现有的实验室技术,没有找到合适的培养条件,只能在原位状态下传代与培养。
15.作为一种举例说明,所述微纳加工工艺包括三种方法:
16.方法一:
17.①
使用聚对二甲苯(parylene)沉积仪器将所需厚度的聚对二甲苯c层沉积到金属镀膜玻璃片上;
18.②
在聚对二甲苯c层上旋涂光刻胶,通过光刻图案方法在金属镀膜玻璃上制备所需微孔的孔径、形状、密度,形成密排微孔阵列;
19.③
对显影后漏出的聚对二甲苯c层进行反应离子蚀刻(rie),直到暴露出金属层;
20.④
通过将制备的微孔分选芯片浸泡在丙酮中,将光刻胶从分选芯片上洗掉,得到微孔分选芯片。
21.作为一种举例说明,所述光刻胶用作parylene的刻蚀模版,最后会被完全洗掉;
22.作为一种举例说明,所述密排微孔阵列中每个微孔均是:大小相等、形状相同、间距相等;
23.作为一种举例说明,所述微孔的形状为:等六边形、圆形或其他形状;
24.方法二:
25.①
使用光刻和深反应离子刻蚀(drie)制作si负型母版;
26.②
使用pdms翻模得到带有密排微柱结构的微流芯片模具,将其与玻璃片键合后通过注入成膜材料(pdms,紫外固化材料等)进行固化,固化后去掉模具得到微孔阵列芯片;
27.③
通过等离子体作用将其与金属镀膜玻璃片结合得到微型扩散室。
28.方法三:
29.金属镀膜玻璃片上旋涂光刻胶,通过光刻图案化显影得到微型扩散室;
30.微型扩散室孔径在20um-80um时便于使每个扩散微室装载单个细胞,则所得培养物是单特异性的;微型扩散室厚度在3um-15um时便于微生物生长后进行分离成纯培养物。
31.基于一种单细胞原位培养芯片的原位纯培养物的分离方法,结合激光诱导向前转移技术,对完成原位培养的单细胞进行可视化分离,得到原位纯培养物,实现实验室不可培养的微生物物种放在自然环境的扩散室内的生长与分选操作,包括:
32.步骤一、将所述微孔分选芯片放置在乙醇中进行消毒,干燥后使用无颗粒dna级水冲洗;将冲洗过的微孔分选芯片在等离子体作用下进行亲水处理,而后再进行微生物点样
处理;随后使用纳米级聚合物膜覆盖在所述微孔分选芯片上进行密封,形成原位培养芯片;
33.步骤二、将所述原位培养芯片浸入目标培养的细胞悬浮液中;此时,多组微型扩散室共同捕获包含一定数量细胞、一定体积的细胞悬浮液;每个微型扩散室捕获一个细胞;由于流体动力学和表面润湿性,细胞被单独地“困”在它们各自的微型扩散室中,彼此分离;
34.作为一种举例说明,细胞数量取决于稀释程度;
35.作为一种举例说明,采用纳米级聚合物膜可以有效防止细胞迁移出单个扩散室内。
36.步骤三、随后就地的、在细胞原始环境栖息地中固定所述原位培养芯片,此举可保证为孵化出固定的细胞提供了它们天然存在的营养物质和生长因子;
37.步骤四、孵化完成后,对所述原位培养芯片进行拆卸,拆掉纳米级聚合物膜,保留微孔分选芯片;然后在特殊设计的lift分选装置上进行自动化纯培养物的识别分选培养,结合测序用于后续进一步分析;
38.步骤五、lift分选装置的结构设计:
39.lift分选装置包括:单细胞分选模块,白光(或荧光)成像模块,芯片固定装置和接收装置;
40.作为一种举例说明,所述单细胞分选模块包括:532nm脉冲激光器、半波片、偏振分束器、第一扩束镜、第二扩束镜、第一反射镜、第二反射镜和第一显微镜物镜;
41.作为一种举例说明,所述532nm脉冲激光器的持续时间为5ns;
42.作为一种举例说明,所述白光成像模块包括:第二显微镜物镜、第三反射镜、凸透镜、分束器、多通道滤光片、led和相机;
43.作为一种举例说明,所述芯片固定装置为3d运动平台;
44.作为一种举例说明,所述接收装置为接收皿,放置在微孔分选芯片下方的机械加工槽中通过电控移动;
45.步骤六、通过lift分选装置结合微孔分选芯片,进行单细胞活体分选:
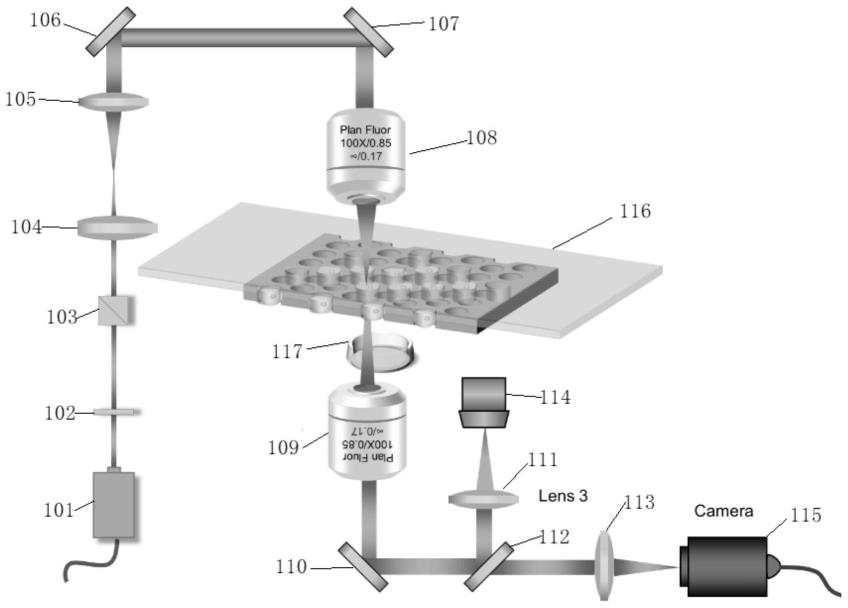
46.首先,将所述lift分选装置暴露在紫外线下至少30分钟,以消除其他细菌污染;
47.然后,把微孔分选芯片放置在3d运动平台;
48.最后,所有分选和收集过程都通过ccd相机进行观察和记录,ccd相机连接到计算机;上述该分选操作一键控制,将目标细胞分选到接收装置中。
49.与现有技术金属镀层芯片点样分选相比,微孔分选芯片克服了液体表面张力的影响,使细胞分散成单细胞微液滴,实现了单细胞的固定,并具有稳定高效的单细胞捕获效率;
50.进一步的,与在传统金属镀层芯片点样分选相比,所述通孔膜表面无液层阻碍分选,大大克服了液体表面张力对单细胞分选的束缚;
51.作为一种举例说明,通过模拟芯片牺牲层光热转化过程,探究分选温度对单细胞活性的影响,结果证实,与传统的lift分选方法相比,新型分选方法极大地降低了分选热损伤;因此通孔膜结合lift单细胞分选技术可实现精准的液体活体单细胞分选。
52.本发明的有益效果:
53.本发明通过特殊的三层结构芯片设计,降低了物种培养随机性,提高样品中微生物在单个环境内培养率,满足有效高通量地分离单个微生物,实现从各种环境中平行培养
和分离以前未培养的微生物物种。
54.在传统拉曼信号增强的芯片上,液体中的细胞无法固定,使得获取稳定的信噪比高的单细胞拉曼光谱成了难题。通过利用通孔膜与金属镀层芯片结合的方式,实现了单细胞的固定,大大增加了液体单细胞拉曼光谱的稳定性和信噪比,为单细胞液体拉曼识别分选奠定基础。
55.经微孔结构捕获的单细胞分选原理结合了流体动力学和表面润湿性,因此不同于传统金属镀膜芯片上利用lift技术的精准稳定单细胞分选方法。在传统的分选芯片上,细胞存在横向迁移导致无法精准分选,或分选过程存在射流使多个细胞一起被分选。微孔分选芯片与传统的分选芯片不同,单个细胞由于芯片材料的疏水特性形成了单细胞微液滴,在微孔内固定,实现单细胞捕获,便于进行后续的单细胞分选和培养。因此,这就是采用微孔阵列结合lift的分选方法进行单细胞捕获和单细胞分选的重要因素。
56.本发明不仅实现单细胞活体液体分选和培养,而且为在液体中获取稳定的单细胞拉曼光谱信号提供帮助。在传统芯片上,液体中的细胞无法固定,使得获取稳定的信噪比高的单细胞拉曼光谱成了难题。利用微孔分选芯片提供的单细胞固定和单细胞捕获方式,将大大增加了液体中采集单细胞拉曼光谱信号的稳定性,降低液体扰动的信号干扰,为单细胞液体拉曼识别分选奠定基础。
附图说明
57.图1是本发明一种单细胞原位培养芯片及其原位纯培养物的分离方法之活体液体单细胞弹射分选光路图。
58.图2是本发明一种单细胞原位培养芯片及其原位纯培养物的分离方法之微孔分选芯片结构示意图。
59.图3是本发明一种单细胞原位培养芯片及其原位纯培养物的分离方法之分选温度对单细胞活性影响的仿真分析图。
60.图4是本发明一种单细胞原位培养芯片及其原位纯培养物的分离方法之分选前的细胞上样示意图。
61.图5是本发明一种单细胞原位培养芯片及其原位纯培养物的分离方法之细胞捕获示意图
62.图6是本发明一种单细胞原位培养芯片及其原位纯培养物的分离方法之单细胞识别分选过程图
63.图7是本发明一种单细胞原位培养芯片及其原位纯培养物的分离方法之单细胞分选接收图。
64.图8是本发明一种单细胞原位培养芯片及其原位纯培养物的分离方法之分离流程操作示意图。
具体实施方式
65.下面结合附图对本发明的优选实施例进行详细说明。
66.参照图1至图8所示,本发明提供一种单细胞原位培养芯片及其原位纯培养物的分离方法,其中:
67.一种单细胞原位培养芯片,包括:
68.在金属镀膜玻璃片上,覆盖一层微孔膜,形成微孔分选芯片,在所述微孔膜上面覆盖一层纳米级聚合物膜,上述三层结构共同构成具备多组微型扩散室的原位培养芯片,可为微型扩散室内的细胞提供天然存在的生长因子和营养物质,使那些在实验内不可培养的微生物物种在自然环境中原位生长。
69.进一步的,所述微孔膜为生物兼容性薄膜,采用微纳加工工艺覆盖在金属镀膜玻璃片上;
70.作为一种举例说明,所述金属镀膜玻璃片是指:通过磁控溅射方式将纳米级金属薄膜涂覆在玻璃片上。
71.作为一种举例说明,所述纳米级聚合物膜可以是0.1μm以下孔径的聚碳酸酯膜或醋酸纤维素滤膜等。
72.作为一种举例说明,所述不可培养是指:nonculture,是那些分离出来了却不能通过实验室培养和大量繁殖的微生物;这些微生物通过现有的实验室技术,没有找到合适的培养条件,只能在原位状态下传代与培养。
73.作为一种举例说明,所述微纳加工工艺包括三种方法:
74.方法一:
75.①
使用聚对二甲苯(parylene)沉积仪器将所需厚度的聚对二甲苯c层沉积到金属镀膜玻璃片上;
76.②
在聚对二甲苯c层上旋涂光刻胶,通过光刻图案方法在金属镀膜玻璃上制备所需微孔的孔径、形状、密度,形成密排微孔阵列;
77.③
对显影后漏出的聚对二甲苯c层进行反应离子蚀刻(rie),直到暴露出金属层;
78.④
通过将制备的微孔分选芯片浸泡在丙酮中,将光刻胶从分选芯片上洗掉,得到微孔分选芯片。
79.作为一种举例说明,所述光刻胶用作parylene的刻蚀模版,最后会被完全洗掉;
80.作为一种举例说明,所述密排微孔阵列中每个微孔均是:大小相等、形状相同、间距相等;
81.作为一种举例说明,所述微孔的形状为:等六边形、圆形或其他形状;
82.方法二:
83.①
使用光刻和深反应离子刻蚀(drie)制作si负型母版;
84.②
使用pdms翻模得到带有密排微柱结构的微流芯片模具,将其与玻璃片键合后通过注入成膜材料(pdms,紫外固化材料等)进行固化,固化后去掉模具得到微孔阵列芯片;
85.③
通过等离子体作用将其与金属镀膜玻璃片结合得到微型扩散室。
86.方法三:
87.金属镀膜玻璃片上旋涂光刻胶,通过光刻图案化显影得到微型扩散室;
88.微型扩散室孔径在20um-80um时便于使每个扩散微室装载单个细胞,则所得培养物是单特异性的;微型扩散室厚度在3um-15um时便于微生物生长后进行分离成纯培养物。
89.基于一种单细胞原位培养芯片的原位纯培养物的分离方法,结合激光诱导向前转移技术,对完成原位培养的单细胞进行可视化分离,得到原位纯培养物,实现实验室不可培养的微生物物种放在自然环境的扩散室内的生长与分选操作,包括:
90.步骤一、将所述微孔分选芯片放置在乙醇中进行消毒,干燥后使用无颗粒dna级水冲洗;将冲洗过的微孔分选芯片在等离子体作用下进行亲水处理,而后再进行微生物点样处理;随后使用纳米级聚合物膜覆盖在所述微孔分选芯片上进行密封,形成原位培养芯片;
91.步骤二、将所述原位培养芯片浸入目标培养的细胞悬浮液中;此时,多组微型扩散室共同捕获包含一定数量细胞、一定体积的细胞悬浮液;每个微型扩散室捕获一个细胞;由于流体动力学和表面润湿性,细胞被单独地“困”在它们各自的微型扩散室中,彼此分离;
92.作为一种举例说明,细胞数量取决于稀释程度;
93.作为一种举例说明,采用纳米级聚合物膜可以有效防止细胞迁移出单个扩散室内。
94.步骤三、随后就地的、在细胞原始环境栖息地中固定所述原位培养芯片,此举可保证为孵化出固定的细胞提供了它们天然存在的营养物质和生长因子;
95.步骤四、孵化完成后,对所述原位培养芯片进行拆卸,拆掉纳米级聚合物膜,保留微孔分选芯片;然后在特殊设计的lift分选装置上进行自动化纯培养物的识别分选培养,结合测序用于后续进一步分析;
96.步骤五、lift分选装置的结构设计:
97.lift分选装置包括:单细胞分选模块,白光(或荧光)成像模块,芯片固定装置116和接收装置117;
98.作为一种举例说明,所述单细胞分选模块包括:532nm脉冲激光器(持续时间5ns)101、半波片102、偏振分束器103、第一扩束镜104,第二扩束镜105、第一反射镜106、第二反射镜107和第一显微镜物镜108;
99.作为一种举例说明,所述白光成像模块包括:第二显微镜物镜109、第三反射镜110、凸透镜111、分束器112、多通道滤光片113、led114和相机115;
100.作为一种举例说明,所述微孔分选芯片固定装置116为3d运动平台;
101.作为一种举例说明,所述接收装置117为接收皿,放置在微孔分选芯片下方的机械加工槽中,通过电控移动;
102.步骤六、通过lift分选装置结合微孔分选芯片,进行单细胞活体分选:
103.首先,将所述lift分选装置暴露在紫外线下至少30分钟,以消除其他细菌污染;
104.然后,把微孔分选芯片放置在3d运动平台;
105.最后,所有分选和收集过程都通过ccd相机进行观察和记录,ccd相机连接到计算机;上述该分选操作一键控制,将目标细胞分选到接收装置中。
106.与现有技术金属镀层芯片点样分选相比,微孔分选芯片克服了液体表面张力的影响,使细胞分散成单细胞微液滴,实现了单细胞的固定,并具有稳定高效的单细胞捕获效率;
107.进一步的,与在传统金属镀层芯片点样分选相比,所述通孔膜表面无液层阻碍分选,大大克服了液体表面张力对单细胞分选的束缚;
108.参照图3所示,通过模拟芯片牺牲层光热转化过程,探究分选温度对单细胞活性的影响,结果证实,与传统的lift分选方法相比,新型分选方法极大地降低了分选热损伤;因此通孔膜结合lift单细胞分选技术可实现精准的液体活体单细胞分选。
109.作为一种举例说明,所述图6和图7的培养皿可换成接收基板,可以是盖玻片放在
距离微孔膜500um处或其他距离值,方便观察单细胞从微孔中精准分选下来的一种操作;
110.在传统拉曼信号增强的芯片上,液体中的细胞无法固定,使得获取稳定的信噪比高的单细胞拉曼光谱成了难题。通过利用通孔膜与金属镀层芯片结合的方式,实现了单细胞的固定,大大增加了液体单细胞拉曼光谱的稳定性和信噪比,为单细胞液体拉曼识别分选奠定基础。
111.经微孔结构捕获的单细胞分选原理结合了流体动力学和表面润湿性,因此不同于传统金属镀膜芯片上利用lift技术的精准稳定单细胞分选方法。在传统的分选芯片上,细胞存在横向迁移导致无法精准分选,或分选过程存在射流使多个细胞一起被分选。微孔分选芯片与传统的分选芯片不同,单个细胞由于芯片材料的疏水的特性形成了单细胞微液滴,在微孔内固定,实现单细胞捕获,便于进行后续的单细胞分选和培养。因此,这就是采用微孔阵列结合lift的分选方法进行单细胞捕获和单细胞分选的重要因素。
112.本发明不仅实现单细胞活体液体分选和培养,而且为在液体中获取稳定的单细胞拉曼光谱信号提供帮助。在传统芯片上,液体中的细胞无法固定,使得获取稳定的信噪比高的单细胞拉曼光谱成了难题。利用微孔分选芯片提供的单细胞固定和单细胞捕获方式,将大大增加了液体中采集单细胞拉曼光谱信号的稳定性,降低液体扰动的信号干扰,为单细胞液体拉曼识别分选奠定基础。
113.以上所述的仅为本发明的优选实施例,所应理解的是,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想,并不用于限定本发明的保护范围,凡在本发明的思想和原则之内所做的任何修改、等同替换等等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1