一种寨卡/登革疫苗及其应用
一种寨卡/登革疫苗及其应用
1.本技术是申请日为2020年11月9日,申请号为202011243025.6,发明名称为“一种寨卡/登革疫苗及其应用”的发明专利申请的分案申请。
技术领域
2.本发明涉及生物技术领域,具体涉及一种寨卡/登革疫苗及其应用。
背景技术:
3.寨卡病毒(zika virus,zikv)是一种蚊媒病毒,属于黄病毒科黄病毒属。2015-2016年美洲爆发的zikv疫情蔓延至全球的84个国家,其中也包括中国。但是到目前为止尚没有疫苗和药物可供使用。尽管现在全球的zikv感染发生率已经减弱,但是zikv仍对生活在流行区的人们构成威胁,因此对于zikv的疫苗研发刻不容缓。
4.denv病毒(dengue virus,denv)有4种血清型,也是黄病毒科黄病毒属的一种蚊媒病毒。
5.zikv病毒和denv病毒的结构较为相似,均呈二十面体的球形结构,有囊膜,囊膜表面含有囊膜(envelope,e)蛋白,内部的病毒基因组是单股正链rna,长度约11kb,仅含有一个开放阅读框,经过翻译出的多聚蛋白可被切割成3个结构蛋白(c、prm、e)和7个非结构蛋白(ns1、ns2a、ns2b、ns3、ns4a、ns4b、ns5)。
6.e蛋白大小约53kd,是zikv和denv表面的主要蛋白,其介导病毒进入细胞和膜融合,因此是激活中和抗体的重要靶点,同时e蛋白也是在设计疫苗时很重要的一个靶蛋白。e蛋白有504个氨基酸,以二聚体形式存在,每个单体有三个结构域,分别是di、dii和diii。dii头部(98-109位氨基酸)包含一个高度保守的融合区(fusion loop,fl),其中,zikv病毒和denv病毒的fl区域序列完全一致,均为d98-r99-g100-w101-g102-n103-g104-c105-g106-l107-f108-g109。fl区在病毒入侵的膜融合过程中起关键作用,在病毒感染过程中,免疫细胞会产生大量的针对fl的抗体。
7.prm蛋白大小约26kd,辅助e蛋白的正确折叠,prm/e的3’端的跨膜区作为内质网滞留信号辅助prm和e形成异源二聚体。prm蛋白的一个主要功能是维持e蛋白的稳定,在不成熟的病毒粒子中,pr多肽位于e蛋白的尖端,形成pr-e刺突,隐藏了e蛋白的融合肽,此时由于位阻的原因prm不容易被弗林蛋白酶接触进行切割。之后高尔基体内的酸性环境诱导了重排反应,暴露出弗林蛋白酶的切割位点,prm蛋白被弗林蛋白酶切割成为m蛋白。此时,被切掉的pr多肽没有立刻从病毒粒子上解离,而是需暴露于中性ph的细胞环境中,pr多肽才被释放,出现成熟的病毒粒子。
8.由于zikv的遗传组成和抗原特性与4种血清型的登革病毒(dengue virus,denv)很相似,氨基酸的相似性约为56%,zikv的感染诱导的抗体会对denv有较强的交叉反应,这也是疫苗安全的问题中需要考虑的因素。大量证据表明zikv感染后的预存抗体由于与denv的交叉反应能够增强之后denv的感染(fowler et al.,2018;george et al.,2017;li et al.,2017;richner et al.,2017;stettler et al.,2016;valiant et al.,2018),这个现
象被叫做抗体依赖的感染增强(antibody-dependent enhancement,ade),ade指当抗体不足以中和病毒或者处于亚中和浓度时,反而会增强病毒的感染(beltramello et al.,2010;dejnirattisai et al.,2010)。尽管流行病学的调查还比较缺乏,来源于人、猴子和小鼠的预存的zikv抗体都已经被证明可以在细胞实验中增强denv的感染(george et al.,2017;richner et al.,2017;stettler et al.,2016;valiant et al.,2018)。此外,在猴子和小鼠模型中通过zikv感染、疫苗免疫或者胎儿从母体获得的抗体也被证实会加重denv感染症状(fowler et al.,2018;george et al.,2017;richner et al.,2017;stettler et al.,2016)。因此,在zikv疫苗设计中应考虑到zikv疫苗免疫后可能会对将来denv的感染有ade效应。
9.引起ade反应的抗体主要是由病毒的fl融合区诱导产生的(beltramello et al.,2010;dejnirattisai et al.,2010)。在黄病毒感染中,这类抗体在总的诱导抗体中占有较大比例。由于表位十分保守,这类抗体通常在不同血清型之间有交叉反应。它们又大多中和活性较低,容易导致ade反应,而大部分具有高中和活性的抗体都是结合在e蛋白的其它表位。一系列的zikv中和单克隆抗体已经被鉴定出来,会靶向e蛋白的第i结构域(domain i,di)、第ii结构域(domain ii,dii)和第iii结构域(domain iii,diii)或者是四级结构表位(barba-spaeth et al.,2016;stettler et al.,2016;wang et al.,2017;wang et al.,2016;zhao et al.,2016)。因此,理想的zikv疫苗设计策略是将免疫反应的热点表位从fl区转移到其它的中和表位上。
10.抗体是通过结合病毒粒子,再通过结合髓细胞表面的fcγ受体蛋白被细胞吸收,随后促进病毒的感染。由于denv有4种血清型,当第二次感染denv且是不同的血清型时,很可能会出现ade,这也就解释了人感染denv后出现的较为严重的疾病现象(katzelnick et al.,2017)。ade被用来解释目前唯一获批上市的denv疫苗的使用限制,被建议仅可用于denv血清阳性的人群使用,而对于血清阴性的个体而言,注射疫苗反而会加重登革的感染(rey et al.,2018;slon-campos et al.,2019)。因此,如何避免ade的产生也是denv疫苗研发中的一个挑战。
11.公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
12.发明目的
13.本发明的目的在于提供一种避免ade反应的寨卡/登革疫苗及其应用。本发明基于晶体结构解析和其他结构和功能的分析,获得了引起ade效应的主要抗体的表位信息。本发明中提供的抗原,在寨卡病毒或登革病毒的e蛋白fl融合区引入突变,具有该突变的抗原,都不能与引起ade的抗体(fle抗体)结合;本发明提供的基于所述抗原获得的疫苗,免疫后,能够避免fl表位诱导抗体的产生,从而实现降低或者消除ade效应。
14.解决方案
15.为实现本发明目的,本发明提供了一种抗原,所述抗原具有寨卡病毒或登革病毒的e蛋白fl融合区,所述e蛋白fl融合区具有以下突变中的一种:
16.(1)d98位点突变、n103位点突变中的一种或两种与g106、l107、f108三位点突变的
组合;
17.(2)g106位点突变、l107位点突变、f108位点突变中的一种或其组合;
18.(3)w101单位点突变。
19.(1)d98位点突变、n103位点突变中的一种或两种与g106、l107、f108三位点突变的组合中即为以下的任意一种:d98、n103、g106、l107、f108五位点突变;d98、g106、l107、f108四位点突变;n103、g106、l107、f108四位点突变。
20.(2)g106位点突变、l107位点突变、f108位点突变中的一种或其组合中,即为以下的任意一种:选自g106位点突变、l107位点突变、f108位点突变的单位点突变;选自g106位点突变、l107位点突变、f108位点突变的双位点突变;g106、l107、f108的三位点突变。
21.所述d98位点突变指e蛋白的98位的天冬氨酸(d)被除天冬氨酸之外的任一氨基酸取代;所述n103位点突变指e蛋白的103位的天冬酰胺(n)被除天冬酰胺之外的任一氨基酸取代;所述g106位点突变指e蛋白的106位的甘氨酸(g)被除甘氨酸之外的任一氨基酸取代;所述l107位点突变指e蛋白的107位的亮氨酸(l)被除亮氨酸之外的任一氨基酸取代;所述f108位突变指e蛋白的108位的苯丙氨酸(f)被除苯丙氨酸之外的任一氨基酸取代;所述w101位点突变指e蛋白的101位的色氨酸(w)被除色氨酸之外的任一氨基酸取代。
22.d98位点、w101位点、n103位点、g106位点、l107位点或f108位点位于e蛋白的fl融合区。fl(融合区)序列在黄病毒属病毒中高度保守,其中,zikv病毒和denv病毒的fl序列完全一致,均为d98-r99-g100-w101-g102-n103-g104-c105-g106-l107-f108-g109。本发明中,关于d98、w101、n103、g106、l107、f108位点的编号,参照寨卡病毒和登革病毒的e蛋白序列中的位置进行,具体可参照寨卡病毒(以zikv fss13025株为例,genbank:jn860885.1)e蛋白的seq id no.1中所示的98、101、103、106、107和108位点。
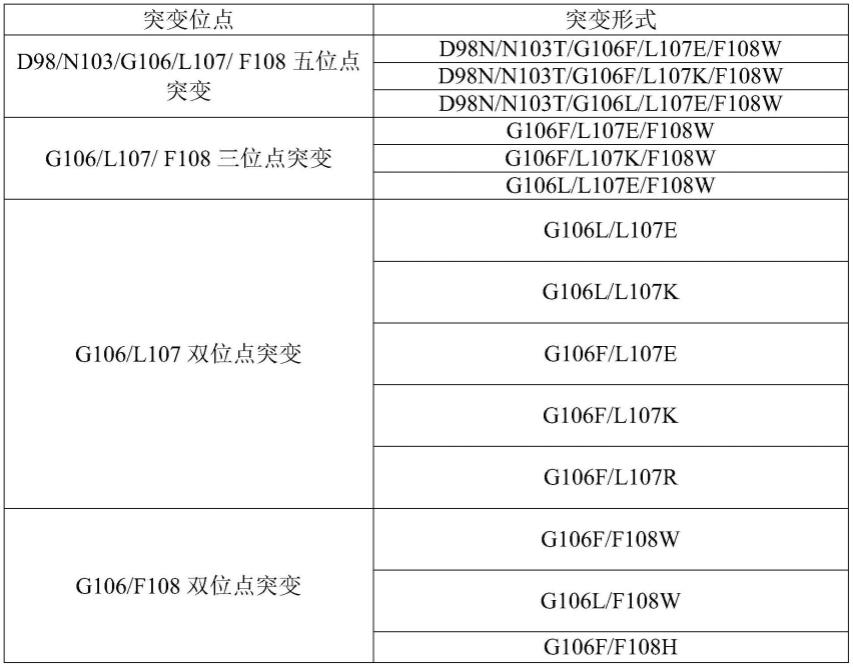
23.上述抗原在一种可能的实现方式中,e蛋白fl融合区的突变选自:d98、n103、g106、l107和f108五位点突变;
24.或,e蛋白fl融合区的突变选自:g106、l107和f108三位点突变;
25.或,e蛋白fl融合区的突变选自:g106和l107双位点突变;
26.或,e蛋白fl融合区的突变选自:g106和f108双位点突变;
27.或,e蛋白fl融合区的突变选自:l107和f108双位点突变;
28.或,e蛋白fl融合区的突变选自:g106单位点突变;
29.或,e蛋白fl融合区的突变选自:l107单位点突变;
30.或,e蛋白fl融合区的突变选自:f108单位点突变;
31.或,e蛋白fl融合区的突变选自:w101单位点突变。
32.上述抗原在一种可能的实现方式中,e蛋白fl融合区的突变选自以下突变或突变组合:
33.34.[0035][0036]
上述表格中,d98n突变指e蛋白的98位的天冬氨酸(d)被天冬酰胺(n)取代;
[0037]
n103t突变指e蛋白的103位的天冬酰胺(n)被苏氨酸(t)取代;
[0038]
g106f突变指e蛋白的106位的甘氨酸(g)被苯丙氨酸(f)取代;g106l突变指e蛋白的106位的甘氨酸(g)被亮氨酸(l)取代;
[0039]
l107e突变指e蛋白的107位的亮氨酸(l)被谷氨酸(e)取代;l107k突变指e蛋白的107位的亮氨酸(l)被赖氨酸(k)取代;
[0040]
f108w突变指e蛋白的108位的苯丙氨酸(f)被色氨酸(w)取代;
[0041]
氨基酸的突变依次类推,单字母所代表的氨基酸的种类即为本领域技术人员的常规理解。
[0042]
上述抗原在一种可能的实现方式中,当所述抗原具有寨卡病毒的e蛋白fl融合区时,所述抗原还包括全长或部分寨卡病毒的m蛋白序列;可选地,所述抗原还包括寨卡病毒m蛋白的全长序列;
[0043]
当所述抗原具有登革病毒的e蛋白fl融合区时,所述抗原还包括登革病毒的全长或部分m蛋白序列;可选地,所述抗原还包括登革病毒m蛋白的全长序列。
[0044]
m蛋白为prm结构蛋白被弗林蛋白酶切割后形成的。全长或部分m蛋白序列指m蛋白序列中的0.5%-100%、50-100%、60-100%、70-100%、80-100%、90-100%,所述序列既可以是从m蛋白上连续地选取的序列,也可以是从m蛋白序列分开选取的片段的组合。
[0045]
上述抗原在一种可能的实现方式中,当所述抗原具有寨卡病毒的e蛋白fl融合区时,所述抗原还包括全长或部分寨卡病毒的prm蛋白;可选地,所述抗原还包括寨卡病毒prm蛋白的全长序列;
[0046]
当所述抗原具有登革病毒的e蛋白fl融合区时,所述抗原还包括登革病毒的全长或部分prm蛋白;可选地,所述抗原还包括登革病毒prm蛋白的全长序列。
[0047]
所述prm蛋白为寨卡病毒或登革病毒的结构蛋白,大小约26kd,用于辅助e蛋白的正确折叠。全长或部分prm蛋白序列指prm蛋白序列中的0.5%-100%、50-100%、60-100%、70-100%、80-100%、90-100%的序列,所述序列既可以是从prm蛋白上连续地选取的序列,也可以是从prm蛋白序列分开选取的片段的组合。
[0048]
上述抗原在一种可能的实现方式中,当所述抗原具有寨卡病毒的e蛋白fl融合区时,所述抗原具有寨卡病毒的全长或部分e蛋白;可选地,所述抗原包括寨卡病毒的e蛋白的全长序列;
[0049]
当所述抗原具有登革病毒的e蛋白fl融合区时,所述抗原具有登革病毒的全长或部分e蛋白;可选地,所述抗原包括登革病毒的e蛋白的全长序列。
[0050]
包括全长或部分e蛋白序列指e蛋白的0.5%-100%、50-100%、60-100%、70-100%、80-100%、90-100%的序列,所述序列既可以是从e蛋白上连续地选取的序列,也可以是从e蛋白序列分开选取的片段的组合。
[0051]
所述寨卡病毒的e蛋白、prm蛋白、m蛋白序列可根据ncbi中公开的寨卡各病毒株的全序列以及现有技术的报道获得,所述登革病毒的e蛋白、prm蛋白、m蛋白序列可根据ncbi中公开的4种血清型的登革病毒的各病毒株的全序列以及现有技术获得。
[0052]
上述抗原在一种可能的实现方式中,所述寨卡病毒包括所有的寨卡毒株,如zikv fss13025株(genbank:jn860885.1)、zikk smgc-1株。
[0053]
上述抗原在一种可能的实现方式中,所述登革病毒包括四种血清型的登革病毒的各种登革毒株,如denv1(hawaii株,genbank:km204119)、denv2(new guinea c株,genbank:km204118.1)、denv3(yn02株,genbank:kf824903)和denv4(中国广州b5株,genbank:af289029)。
[0054]
本发明还提供了一种寨卡病毒e蛋白fl融合区的抗原表位,所述寨卡病毒e蛋白fl融合区基于氨基酸序列d98-r99-g100-w101-g102-n103-g104-c105-g106-l107-f108-g109具有以下突变中的一种:
[0055]
(1)d98位点突变、n103位点突变中的一种或两种与g106、l107、f108三位点突变的组合;
[0056]
(2)g106位点突变、l107位点突变、f108位点突变中的一种或其组合;
[0057]
(3)w101单位点突变。
[0058]
本发明还提供了一种含有上述抗原表位的寨卡病毒抗原。
[0059]
上述寨卡病毒抗原在一种可能的实现方式中,还包括以下序列的一种或多种:
[0060]
寨卡病毒的全长或部分e蛋白序列;
[0061]
寨卡病毒的全长或部分m蛋白序列;
[0062]
寨卡病毒的全长或部分prm蛋白。
[0063]
一种登革病毒e蛋白fl融合区的抗原表位,所述登革病毒e蛋白fl融合区基于氨基酸序列d98-r99-g100-w101-g102-n103-g104-c105-g106-l107-f108-g109具有以下突变中的一种:
[0064]
(1)d98位点突变、n103位点突变中的一种或两种与g106、l107、f108三位点突变的组合;
[0065]
(2)g106位点突变、l107位点突变、f108位点突变中的一种或其组合;
[0066]
(3)w101单位点突变。
[0067]
本发明还提供了一种含有上述抗原表位的登革病毒抗原。
[0068]
上述登革病毒抗原在一种可能的实现方式中,还包括以下序列的一种或多种:
[0069]
登革病毒的全长或部分e蛋白序列;
[0070]
登革病毒的全长或部分m蛋白序列;
[0071]
登革病毒的全长或部分prm蛋白。
[0072]
本发明还提供了由上述抗原、寨卡病毒抗原、登革病毒抗原获得的抗体。
[0073]
本发明还提供了一种编码上述抗原、抗原表位、寨卡病毒抗原、登革病毒抗原的多核苷酸。
[0074]
本发明还提供了一种包含上述多核苷酸的表达盒、重组载体、转基因细胞系、重组菌、腺病毒、慢病毒或病毒颗粒。
[0075]
本发明还提供了一种编码上述抗原、抗原表位、寨卡病毒抗原、登革病毒抗原的mrna。
[0076]
本发明还提供了一种疫苗,所述疫苗包括上述抗原,上述寨卡病毒抗原,上述登革病毒抗原,上述多核苷酸,上述表达盒、重组载体、转基因细胞系、重组菌、腺病毒、慢病毒或病毒颗粒,或上述mrna作为活性成分。
[0077]
上述疫苗在一种可能的实现方式中,所述疫苗包括灭活疫苗,减毒疫苗,dna疫苗,mrna疫苗,腺病毒疫苗,其它病毒载体疫苗,亚单位疫苗或病毒颗粒中的一种或多种。
[0078]
上述疫苗在一种可能的实现方式中,所述疫苗为腺病毒疫苗。
[0079]
上述疫苗在一种可能的实现方式中,所述疫苗还包括药学上或兽医学上可接受的媒介物、稀释剂、佐剂或赋形剂。
[0080]
本发明还提供了上述抗原,上述抗原表位,上述抗体,上述多核苷酸,上述表达盒、重组载体、转基因细胞系、重组菌、腺病毒、慢病毒或病毒颗粒,或上述mrna在制备用于预防和/或治疗黄病毒属病毒感染的疫苗中的应用。
[0081]
本发明还提供了上述抗原,上述抗原表位,上述抗体,上述多核苷酸,上述表达盒、重组载体、转基因细胞系、重组菌、腺病毒、慢病毒或病毒颗粒,或上述mrna在制备用于检测黄病毒属病毒感染的检测试剂或试剂盒中的应用。
[0082]
有益效果
[0083]
(1)本发明基于晶体结构解析和其他结构和功能的分析,获得了引起ade效应的主要抗体的表位信息。本发明中提供的抗原,在寨卡病毒或登革病毒的e蛋白fl融合区引入以下突变的一种:i.d98位点突变、n103位点突变中的一种或两种与g106、l107、f108三位点突变的组合;ii.g106位点突变、l107位点突变、f108位点突变中的一种或其组合;iii.w101单位点突变。具有该突变的抗原,都不能与引起ade的抗体(fle抗体)结合;本发明提供的基于所述抗原获得的疫苗,免疫后,能够避免fl表位诱导抗体的产生,从而实现降低或者消除ade效应。。
[0084]
(2)本发明中提供的抗原,不能与引起ade的抗体(fle抗体)结合,但与其他表位的抗体的结合力不受影响。本发明以基于所述抗原获得的几种寨卡病毒的腺病毒疫苗为例,证明了获得的重组腺病毒疫苗没有降低抗原的免疫原性,仍可以较好的激活中和抗体的产生;且在小鼠攻毒中起到完全的保护作用;可很好地保护小鼠抵抗病毒血症和组织器官的
感染;能够降低甚至消除免疫后对4种血清型denv病毒的ade效应。
[0085]
并证明了,突变后的e蛋白仍可以保持二聚体的形式,仅在fl被突变的氨基酸侧链发生了变化,对于其它中和抗体表位没有产生影响。对生发中心(gc)b细胞的单细胞测序分析重组腺病毒疫苗诱导小鼠的抗体反应,证明fl区突变了的重组腺病毒疫苗相比fl区野生型的疫苗,显著降低了fl表位诱导的抗体,抗原的优势表位发生了转移。这些解释了本发明提供的基于所述抗原获得的疫苗可以消除ade效应的作用机制。
[0086]
(3)本发明还以基于所述抗原获得的几种登革病毒的腺病毒的表达质粒为例,证明了所获得的抗原都不能与引起ade的抗体(fle抗体)结合;这说明基于本发明所述抗原获得的登革病毒疫苗免疫后,能够避免fl表位诱导抗体的产生,从而降低或者消除免疫后对后续denv病毒感染引起的ade效应。
[0087]
(4)本发明提供的基于所述抗原获得的疫苗可以包括各种形式,如核酸疫苗,mrna疫苗,腺病毒载体疫苗,其他病毒载体疫苗,病毒样颗粒,基于所述抗原序列的病毒减毒或灭活疫苗,其他骨架的嵌合疫苗等,可用于制备消除ade效应的寨卡和四价登革疫苗。
附图说明
[0088]
一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定。在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
[0089]
图1是野生型重组腺病毒疫苗adc7-m/e-wt和adc7-prm/e-wt免疫小鼠中和实验结果。
[0090]
图2是野生型重组腺病毒疫苗adc7-m/e-wt和adc7-prm/e-wt免疫小鼠的血清增强denv感染细胞的实验结果。
[0091]
图3是z6抗体对4种血清型的denv感染细胞均有一定程度的ade。
[0092]
图4是z6抗体的fab片段与zikv e蛋白的复合物结构。
[0093]
图5是不同抗体与黄病毒属病毒e蛋白的复合物结构,其中,图中的a为z6抗体与zikv e蛋白的复合物结构,b为2a10g6抗体与zikv e蛋白的复合物结构,c为e53抗体与wnv e蛋白的复合物结构,d为前三个抗体与zikv e蛋白结构的重叠图。
[0094]
图6是zikv e蛋白与z6抗体、zikv e蛋白与2a10g6抗体和wnv e蛋白与e53抗体结合的氨基酸位点分析。
[0095]
图7是黄病毒属病毒的进化树。
[0096]
图8是zikv m/e muta/b/c突变体的突变位点及序列。
[0097]
图9是流式细胞仪检测m/e-muta/b/c抗原活性结果。
[0098]
图10是padc7-m/e-mutb/mutc重组质粒的构建流程。
[0099]
图11是zikv重组腺病毒疫苗免疫balb/c小鼠后血清中和抗体滴度。
[0100]
图12是zikv重组腺病毒疫苗免疫ifnar1-/-小鼠后血清中和抗体滴度。
[0101]
图13是zikv重组腺病毒疫苗免疫的ifnar1-/-小鼠攻毒后的死亡率和体重变化结果。
[0102]
图14是zikv重组腺病毒疫苗保护ifnar1-/-小鼠抵抗zikv感染引起的病毒血症的实验结果。
[0103]
图15是zikv重组腺病毒疫苗保护ifnar1-/-小鼠抵抗zikv攻毒后对组织器官的感染的实验结果。
[0104]
图16是zikv重组腺病毒疫苗免疫ifnar1-/-小鼠后被注射zikv,攻毒前后的血清中中和抗体滴度变化的结果。
[0105]
图17是zikv重组腺病毒疫苗免疫balb/c小鼠的血清对4种血清型denv的交叉反应实验结果。
[0106]
图18是zikv重组腺病毒疫苗免疫balb/c小鼠的血清对4种血清型denv感染细胞的ade实验结果。
[0107]
图19是体内实验检测zikv重组腺病毒疫苗对denv2增强感染ifnα/βr-/-ifnγr-/-小鼠致病的影响的结果。
[0108]
图20是从zikv重组腺病毒疫苗免疫的balb/c小鼠淋巴结细胞中通过流式细胞术分选结合zikv e蛋白的gc b细胞的条件
[0109]
图21是zikv重组腺病毒疫苗免疫balb/c小鼠的结合zikv e蛋白的gc b细胞抗体谱分析结果。
[0110]
图22是adc7-m/e-wt疫苗免疫balb/c小鼠诱导产生的抗体谱中成对的hv和lv结果。
[0111]
图23是adc7-m/e-mutb疫苗免疫balb/c小鼠诱导产生的抗体谱中成对的hv和lv结果。
[0112]
图24-1是adc7-m/e-mutc疫苗免疫balb/c小鼠诱导产生的抗体谱中成对的hv和lv结果。
[0113]
图24-2是adc7-m/e-mutc疫苗免疫balb/c小鼠诱导产生的抗体谱中成对的hv和lv结果。
[0114]
图25是鉴定zikv重组腺病毒疫苗免疫balb/c小鼠诱导的抗体对不同的zikv e蛋白和denv e蛋白的结合能力。
[0115]
图26是检测代表性的adc7-m/e-wt疫苗免疫小鼠诱导的抗体促进denv感染细胞的ade效应的实验结果。
[0116]
图27是adc7-m/e-wt疫苗免疫小鼠诱导的单抗使用的v基因座与已报道的fle单抗的比较。
[0117]
图28-1是adc7-m/e-wt疫苗免疫小鼠诱导的单抗与已报道的fle单抗的序列相似性比较。
[0118]
图28-2是adc7-m/e-wt疫苗免疫小鼠诱导的单抗与已报道的fle单抗的序列相似性比较。
[0119]
图29是biacore检测zikv se-wt蛋白和zikv se-mutc蛋白与fle抗体的亲和力结果。
[0120]
图30是biacore检测zikv se-wt蛋白和zikv se-mutc蛋白与非fle中和抗体的亲和力结果。
[0121]
图31是zikv se-mutc和z3l1单链可变区片段(scfv)的复合物蛋白结构。
[0122]
图32是zikv se-mutc蛋白二聚体结构。
[0123]
图33是z3l1/zikv se mutc与z3l1/zikv se wt(pdb:5gzn)的复合物结构重叠后
的比较分析
[0124]
图34是zikv se-mutc的fl区域与zikv se-wt的fl区域(pdb:5jhm)重叠后的比较分析。
[0125]
图35是zikv se mutc的fl重叠进黄病毒属病毒中fle抗体与e蛋白的复合物结构的比较分析。图中的a、b和c分别使用了z6抗体与zikv se蛋白、2a10g6抗体与zikv se蛋白(pdb:5jhl)以及e53抗体与wnv se蛋白(pdb:3i50)。
[0126]
图34是zikv se-mutc的fl区域与zikv se-wt的fl区域(pdb:5jhm)重叠后的比较分析。
[0127]
图35是zikv se mutc的fl重叠进黄病毒属病毒中fle抗体与e蛋白的复合物结构的比较分析。a、b和c分别使用了z6抗体与zikv se蛋白、2a10g6抗体与zikv se蛋白(pdb:5jhl)以及e53抗体与wnv se蛋白(pdb:3i50)。
[0128]
图36是通过流式细胞术检测denv2野生型和突变体e蛋白的抗原活性结果。
[0129]
图37是通过流式细胞术检测zikv e蛋白101位色氨酸突变成其它19种氨基酸的抗原活性结果。
具体实施方式
[0130]
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
[0131]
另外,为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在一些实施例中,对于本领域技术人员熟知的原料、元件、方法、手段等未作详细描述,以便于凸显本发明的主旨。
[0132]
实施例1检测zikv野生型m/e和prm/e抗原构建的重组黑猩猩腺病毒疫苗诱导小鼠的体液免疫反应
[0133]
将zikv fss13025病毒株(genbank:jn860885.1)的m/e抗原构建进7型黑猩猩腺病毒载体,经过腺病毒包装培养和纯化,得到重组腺病毒疫苗adc7-m/e-wt(重组腺病毒疫苗adc7-m/e-wt的构建参照:xu et al.(2018)journal of virology.vol.92,6e01722-17.26feb.),实验证明其对小鼠具有很好的保护效果。有文献报道以zikv prm/e抗原构建的腺病毒疫苗同样具有保护效果,因此,将zikv-smgc-1病毒株的prm/e抗原构建进7型黑猩猩腺病毒载体,包装出重组腺病毒adc7-prm/e-wt(重组腺病毒adc7-prm/e-wt的构建参照hassan,ahmed o et al.(2019)cell reports,vol.28,10:2634-2646.e4.),作为后续实验的一个对照。
[0134]
对重组腺病毒疫苗adc7-m/e-wt和adc7-prm/e-wt诱导小鼠的体液免疫反应进行评价:
[0135]
将15只balb/c小鼠随机分成3组,分别免疫1.6x 10
11
vp(virus particles)的
adc7-m/e-wt腺病毒疫苗、adc7-prm/e-wt腺病毒疫苗和pbs,4周后取血,离心分离血清,将血清56℃加热30分钟灭活,使用微量中和实验检测血清中的中和抗体滴度。
[0136]
微量中和实验的过程是:将vero细胞提前一天铺96孔板,第二天使用96孔板用含1%fbs(gibco,10270-106)的dmem培养基(invitrogen,c11995500bt)梯度稀释血清,病毒也用1%fbs的dmem培养基稀释,把血清和病毒液混匀,每孔加入100ffu zikv-smgc-1,置于37℃孵育2小时。vero细胞板移除上清培养基,加入血清和病毒的混合物,培养2小时后补加含10%fbs的dmem。细胞在37℃培养箱中培养4天。4天后取出细胞培养板,弃去所有上清,用pbs洗一遍,加入150μl的甲醇进行固定,置于-20℃冰箱15-20分钟,之后用pbs洗2遍。使用pbs配置的2%脱脂牛奶(封闭液)进行封闭,室温放置30分钟,然后加入一抗。一抗为结合zikv e蛋白的z6抗体,使用封闭液稀释到5μg/ml工作浓度,室温孵育2小时。之后用pbst洗3遍,再加入二抗。二抗是偶联hrp的羊抗人抗体(proteintech,sa00001-17),用封闭液稀释1500倍,室温孵育2小时,之后用pbst洗4遍。加tmb显色液(碧云天,p0209)50μl,室温孵育,反应时间约20分钟,观察颜色变化,加入50μl 2m盐酸终止反应,在酶标仪上读取od450吸光值。使用graphpad prism软件对数据进行非线性拟合计算中和50%的细胞感染时相应的血清稀释倍数,即为中和滴度值(mn
50
)。当最低稀释倍数的血清仍无法中和50%的细胞感染时,定义该样品的mn
50
为最低稀释倍数的一半。
[0137]
中和实验结果如图1所示,免疫pbs的组为阴性对照组sham组(图中以sham表示),该组的血清中检测不到中和抗体;adc7-m/e-wt组(图中以m/e表示)和adc7-prm/e-wt组(图中以prm/e表示)的小鼠都能检测到中和抗体的log mn
50
平均值在2-2.5之间,统计分析这2组之间没有显著性差异,说明重组腺病毒疫苗adc7-m/e-wt和adc7-prm/e-wt都诱导小鼠产生了较高水平的中和抗体。
[0138]
实施例2体外实验检测野生型重组腺病毒疫苗adc7-m/e-wt和adc7-prm/e-wt免疫小鼠的血清对denv的ade
[0139]
由于黄病毒属病毒envelop(e)蛋白的fusion loop(fl)序列十分保守,感染zikv或者免疫表达zikv e蛋白的疫苗可以诱导产生与denv交叉反应的抗体,从而导致对denv的抗体依赖增强反应(antibody-dependent enhancement,ade)(stettler,k.,et al.(2016)science:science.aaf8505.)。因此,检测上述构建的重组腺病毒疫苗adc7-m/e-wt和adc7-prm/e-wt免疫小鼠的血清能否对denv产生ade。
[0140]
用含1%fbs的rpmi-1640培养基(invitrogen,c11875500bt)梯度稀释血清(取自实施例1中免疫了重组腺病毒疫苗的小鼠),将稀释样品加入96孔板,10μl每孔,随后加入相应的denv(denv2,genbank:km204118.1;denv3,genbank:kf824903;denv4,genbank:af289029;denv1为我们从深圳市第三人民医院的一个感染患者样品中分离的病毒株),置于37℃细胞培养箱中1小时。
[0141]
将培养的细胞表面表达有fcγriia受体的k562细胞800g离心5分钟,用含1%fbs的rpmi-1640培养基重悬后对细胞计数,再将细胞密度调整到3x 106个每ml,随后加入到病毒与血清的混合物中,10μl每孔,置于37℃细胞培养箱中孵育2小时。补加含2%fbs的rpmi-1640培养基,100μl每孔,置于37℃细胞培养箱中继续培养4天。4天后将细胞转移至96孔板,800g离心5分钟,去除上清,然后用pbs洗一遍并离心收集细胞。向96孔板加入fixation and permeabilization solution(bd,554722)100μl每孔,置于4℃冰箱20分钟。然后800g离心5
al.science translational medicine 9.420(2017).),因此,我们选择m/e抗原做后续的突变设计。
[0152]
此外,有文献报道基于prm/e抗原的zikv疫苗也具有很好的保护效果(dowd et al,science,2016,vol 354,issue 6309),并且我们前期的数据也证明了基于m/e抗原所做的突变设计在prm/e抗原上具有类似的效果,故本发明实施例中对基于prm/e抗原所做的突变设计的实验结果不再赘述。本发明实施例中对m/e抗原所做的突变设计对于prm/e抗原同样适用。
[0153]
表1.zikv se-z6复合物的数据收集及优化参数
[0154][0155]
实施例5利用进化距离较远的黄病毒属病毒fl构建嵌合病毒抗原蛋白
[0156]
通过比对黄病毒属病毒的e蛋白的fl表位的氨基酸序列,我们发现大部分病毒的fl序列都很保守,但是仍存在一些进化距离较远的病毒fl序列与zikv的fl序列有差异。为了在破坏zikv fl表位的同时不影响正常蛋白的折叠以及其它中和表位的展示,我们使用了黄病毒属中与zikv进化距离较远的病毒的fl的氨基酸序列(黄病毒属进化树如图7所示)
构建嵌合病毒抗原蛋白,推测能够较好的维持抗原整体构象,减少对突变位点以外的表位影响。
[0157]
我们以这些病毒的e蛋白fl序列为参考设计了zikv m/e抗原的突变体,m和e为全长,fl融合区发生突变的位点和序列如图8所示,其中muta来源于aefv(aedes flavivirus,genbank:kc181923.1),突变位点为d98n、n103t、g106f、l107e和f108w;
[0158]
mutb来源于cfav(cell fusing agent virus,genbank:nc_001564.2),突变位点为d98n、n103t、g106f、l107k和f108w;
[0159]
mutc来源于nakv(nakiwogo virus,genbank:nc_030400.1),突变位点为d98n、n103t、g106l、l107e和f108w。
[0160]
构建pcaggs-m/e-muta/b/c质粒时使用的引物如表2所示。以构建muta为例,使用质粒pcaggs-m/e-wt作为模板,以wt-f和muta-r为引物pcr得到产物muta-1。使用质粒pcaggs-m/e-wt作为模板,以wt-r和muta-f为引物pcr得到产物muta-2。再以muta-1和muta-2按照摩尔比1:1的比例混合作为模板,wt-f和wt-r作为引物进行pcr,得到pcr产物muta。将pcaggs质粒使用xhoi和ecori进行限制性酶切,得到带有双粘性末端的线性质粒。将酶切后的线性质粒与pcr产物muta按照摩尔比1:5的比例混合,使用in-fusion试剂盒进行重组,将重组产物转化dh5α感受态细胞,涂在氨苄抗性的平板上37℃培养,之后挑取克隆进行pcr鉴定及测序鉴定,然后提取质粒(pcaggs-m/e-muta)做后续的实验使用。
[0161]
表2构建pcaggs-m/e-muta/b/c时使用的引物
[0162][0163][0164]
实施例6检测m/e-muta/b/c抗原的活性
[0165]
将野生型质粒pcaggs-m/e-wt和突变体质粒pcaggs-m/e-muta、pcaggs-m/e-mutb和pcaggs-m/e-mutc分别转染293t细胞。48小时后收集细胞、消化成单细胞、固定通透、孵育结合zikv e的抗体、孵育羊抗人(goat anti-human)fitc二抗,最后用流式细胞仪检测样品的阳性比例,结果如图9所示。
[0166]
z3l1、z20和z23都是zikv特异性的高中和活性的抗体,分别结合在zikv e蛋白的di、dii和diii上(wang,qihui,et al.(2016)science translational medicine 8.369:369ra179.)。
[0167]
由图9可知,结合zikv e蛋白fl表位的抗体(z6和2a10g6)可以结合表达野生型m/e-wt抗原的细胞,但是都不结合表达3种突变体抗原的细胞。而结合在非fl表位的具有高中和活性的z3l1,z23和z20抗体既结合表达野生型m/e-wt抗原的细胞也结合表达3种突变体抗原的细胞,这说明m/e-muta、m/e-mutb和m/e-mutc抗原上的fl表位被破坏,导致相应的抗体不能结合,但是对于其它zikv强中和抗体结合的表位没有变化,相应的抗体仍然能够结合。
[0168]
即m/e-muta、m/e-mutb和m/e-mutc抗原能够较少或完全不诱导产生与denv fl相结合的抗体,从而降低对denv的ade;同时,m/e-muta、m/e-mutb和m/e-mutc抗原不会对其它的抗体表位产生影响。
[0169]
实施例7使用zikv的m/e-mutb和m/e-mutc抗原构建重组黑猩猩腺病毒疫苗adc7-m/e-mutb和adc7-m/e-mutc
[0170]
从图9可以看出,mutb和mutc的细胞阳性的强度略高于muta,因此后续的实验主要采用mutb和mutc进行。
[0171]
首先,将m/e-mutb和m/e-mutc抗原克隆进pshuttle载体。以质粒pcaggs-m/e-mutb或者pcaggs-m/e-mutc作为模板,使用to_pshuttle-f和to_pshuttle-r为引物进行pcr反应得到pcr产物to_pshuttle-mutb和pcr产物to_pshuttle-mutc。将pshuttle质粒使用xbai(thermo,fd0684)和kpni(thermo,fd0524)进行限制性酶切,得到带有双粘性末端的线性质粒。将酶切后的线性质粒分别与pcr产物to_pshuttle-mutb或者to_pshuttle-mutc按照摩尔比1:5的比例混合,使用in-fusion试剂盒进行重组,将重组产物转化dh5α感受态细胞,涂在卡纳抗性的平板上37℃培养,之后挑取克隆进行pcr鉴定及测序鉴定,然后提取质粒。之后在pshuttle质粒上把表达m/e-mutb和m/e-mutc的cassette构建进adc7载体。上述构建步骤参见:xu,kun et al.(2018)journal of virology.vol.92,6e01722-17.26feb。
[0172]
以质粒pshuttle-m/e-mutb或者mutc作为模板,to_adc7-f和to_adc7-r为引物进行pcr反应得到pcr产物to_adc7-mutb和to_adc7-mutc。将adc7质粒使用pi-scei(neb,r0696s)和i-ceui(neb,r0699s)进行限制性酶切,得到带有双粘性末端的线性质粒。将酶切后的线性质粒与pcr产物to_adc7-mutb或者to_adc7-mutc按照摩尔比1:5的比例混合,使用in-fusion试剂盒进行重组,将重组产物转化stbl2感受态细胞,涂在氨苄抗性的平板上30℃培养,之后挑取克隆进行pcr鉴定及测序鉴定,然后提取质粒。重组质粒的构建流程见图10。使用到的引物序列如表3所示。
[0173]
表3:以mutb和mutc抗原构建黑猩猩腺病毒zikv突变体疫苗引物
[0174][0175]
将padc7-m/e-mutb和padc7-m/e-mutc质粒用paci(neb,r0547s)限制性内切酶消化成线性,然后在65℃恒温浴中加热20分钟灭活内切酶。使用fugene-6转染试剂(promega,e2691)将质粒转染至hek293细胞,在37℃培养箱中培养至少7天,之后每天在显微镜下检查
m/e-mutc疫苗组。
[0186]
为了检测adc7-m/e-mutb和adc7-m/e-mutc疫苗能否保护小鼠抵抗病毒感染后引起的病毒血症,在该实验中收集了攻毒后第3天和第6天的小鼠血液,分离血清,然后使用magabio plus病毒rna试剂盒(博日科技,bsc58s1b)提取rna,然后使用fastking一步法反转录-荧光定量试剂盒(天根生化科技,fp314)对病毒rna进行定量,定量时使用的探针和引物序列如表4所示,定量结果如图14所示。
[0187]
表4:对zikv-smgc-1核酸进行rt-pcr定量使用的探针和引物序列
[0188][0189]
由图14可知,sham组小鼠在感染后第3天和第6天均可以检测较高的病毒载量,而免疫过adc7-m/e-wt、adc7-m/e-mutb和adc7-m/e-mutc腺病毒疫苗的小鼠在感染后第3天和第6天的血清里都检测不到病毒,说明adc7-m/e-mutb和adc7-m/e-mutc疫苗能够和野生型的adc7-m/e-wt疫苗一样很好地保护小鼠抵抗病毒血症。其中,图中sham指免疫pbs组,m/e-wt指免疫adc7-m/e-wt疫苗组,m/e-mutb指免疫adc7-m/e-mutb疫苗组,m/e-mutc指免疫adc7-m/e-mutc疫苗组。
[0190]
实施例11检测zikv疫苗的清除性免疫效果
[0191]
上述实验证明了adc7-m/e-mutb和adc7-m/e-mutc疫苗免疫小鼠可以提供保护抵抗zikv感染导致的病毒血症和死亡。进一步设计实验检测adc7-m/e-mutb和adc7-m/e-mutc疫苗是否能提供清除性免疫,具体步骤如下。
[0192]
将ifnar1-/-小鼠随机分成4组,通过肌肉注射方式免疫3种重组腺病毒疫苗adc7-m/e-wt、adc7-m/e-mutb和adc7-m/e-mutc,腺病毒疫苗免疫的剂量是1.6x10
11
vp,1组小鼠免疫pbs作为阴性对照。免疫后第28天采血分离血清,免疫后第30天通过腹腔途径注射5x104ffu的zikv(smgc-1株),在攻入zikv后的第6天再次采血,之后当天解剖取部分肝、脾、睾丸、脑和脊髓。将解剖取出的组织器官加入pbs溶液,然后使用研磨器(天根生化科技,ose-y30)研磨,离心取出上清使用magabio plus病毒rna试剂盒提取rna,再对zikv rna进行rt-pcr检测,结果如图15所示。
[0193]
由图15可知,sham组小鼠在5个器官中都检测出一定量的病毒,而免疫过adc7-m/e-wt、adc7-m/e-mutb和adc7-m/e-mutc腺病毒疫苗的这3组小鼠的所有组织器官中都没有检测到病毒。其中,图中sham指免疫pbs组,m/e-wt指免疫adc7-m/e-wt疫苗组,m/e-mutb指免疫adc7-m/e-mutb疫苗组,m/e-mutc指免疫adc7-m/e-mutc疫苗组。
[0194]
使用微量中和实验检测免疫后第28天和攻毒后第7天的血清中中和抗体滴度,结果如图16所示。
[0195]
由图16可知,攻毒前sham组检测不到中和抗体,攻毒后第7天sham组每只鼠都可以检测到较高滴度的中和抗体;免疫adc7-m/e-wt和adc7-m/e-mutb疫苗的这两组在攻毒前后的血清中和抗体滴度没有显著差异,维持在几乎相同的水平,这说明adc7-m/e-wt疫苗和adc7-m/e-mutb、adc7-m/e-mutc疫苗都可以提供攻毒完全免疫,adc7-m/e-mutb疫苗相对于adc7-m/e-mutc疫苗效果稍好,是完全的清除性免疫。其中,图中sham指免疫pbs组,m/e-wt
指免疫adc7-m/e-wt疫苗组,m/e-mutb指免疫adc7-m/e-mutb疫苗组,m/e-mutc指免疫adc7-m/e-mutc疫苗组;图16中从左至右依次为sham组,m/e-wt组,m/e-mutb组,m/e-mutc组结果。
[0196]
实施例12检测zikv疫苗免疫balb/c小鼠的血清对denv的交叉反应
[0197]
zikv感染导致对denv的ade的一个主要原因是zikv和denv的e蛋白fl表位较为保守,导致zikv诱导产生的一些抗体与denv有交叉反应(stettler,k.,et al.science(2016):science.aaf8505.)。因此,我们进一步通过elisa实验检测adc7-m/e-wt、adc7-m/e-mutb和adc7-m/e-mutc腺病毒疫苗免疫balb/c小鼠的血清对4种血清型denv的交叉反应,结果如图17所示。
[0198]
由图17可知,免疫adc7-m/e-wt、adc7-m/e-mutb和adc7-m/e-mutc疫苗组的balb/c小鼠的血清对zikv e蛋白的结合能力都较强。但是它们对4种血清型的denv e蛋白的结合能力有所不同:m/e-mutb组和m/e-mutc组的小鼠血清与4种血清型的denv e蛋白的结合力很低,而m/e-wt组小鼠血清对4种血清型的denv e蛋白的结合力仍维持在较高水平。这说明了突变体破坏了e蛋白的fl表位,降低了该表位所诱导的抗体的量,从而表现出adc7-m/e-mutb和adc7-m/e-mutc腺病毒疫苗免疫的小鼠血清结合denv e蛋白能力减弱。
[0199]
其中,图17中sham指免疫pbs组,m/e-wt指免疫adc7-m/e-wt疫苗组,m/e-mutb指免疫adc7-m/e-mutb疫苗组,m/e-mutc指免疫adc7-m/e-mutc疫苗组;图17中的a图为小鼠血清与寨卡病毒(zikv)e蛋白的结合力结果,b图为小鼠血清与1型血清型登革病毒(denv1)e蛋白的结合力结果,c图为小鼠血清与2型血清型登革病毒(denv2)e蛋白的结合力结果,d图为小鼠血清与3型血清型登革病毒(denv3)e蛋白的结合力结果,e图为小鼠血清与4型血清型登革病毒(denv4)e蛋白的结合力结果。
[0200]
实施例13体外实验检测zikv疫苗免疫balb/c小鼠的血清对denv的ade
[0201]
实施例12的实验结果证明了adc7-m/e-mutb和adc7-m/e-mutc疫苗降低了对denv的交叉抗体的诱导。我们进一步设计实验证明adc7-m/e-mutb和adc7-m/e-mutc疫苗是否可以减少对denv的ade,具体步骤如下。
[0202]
将实施例8中免疫balb/c小鼠的血清梯度稀释,分别与denv1,denv2,denv3和denv4混合孵育,再加入k562细胞,培养4天后使用fitc标记的z6抗体染色,接着用流式细胞仪检测阳性细胞的比例,结果如图18所示。
[0203]
在没有抗体的介导下,denv病毒不能感染k562细胞。由图18可以看出,sham组的血清由于不含有可以结合denv的抗体,因此检测的样品感染率为本底水平;m/e-wt组的小鼠血清在一定浓度下可以介导4种血清型的denv病毒感染k562细胞;而m/e-mutb和m/e-mutc两组样品的感染率都显著低于m/e-wt组,表现出对denv的ade的减弱甚至消除,说明adc7-m/e-mutb和adc7-m/e-mutc疫苗达到了很好的降低ade的效果。
[0204]
其中,图中sham指免疫pbs组,m/e-wt指免疫adc7-m/e-wt疫苗组,m/e-mutb指免疫adc7-m/e-mutb疫苗组,m/e-mutc指免疫adc7-m/e-mutc疫苗组。
[0205]
图18中的a图为小鼠血清对zikv增强感染k562细胞的检测,b图为小鼠血清对denv1增强感染k562细胞的检测,c图为小鼠血清对denv2增强感染k562细胞的检测,d图为小鼠血清对denv3增强感染k562细胞的检测,e图为小鼠血清对denv4增强感染k562细胞的检测。
[0206]
上述一系列体外实验均证明了adc7-m/e-mutb和adc7-m/e-mutc腺病毒疫苗能够
降低甚至消除免疫后对denv的ade。
[0207]
实施例14体内实验检测zikv疫苗免疫balb/c小鼠的血清对denv的ade
[0208]
为了进一步证明在生理条件下adc7-m/e-mutb和adc7-m/e-mutc疫苗能否降低对denv的ade,我们使用一个基于ifnα/βr-/-ifnγr-/-小鼠的模型验证对denv的ade效应。
[0209]
首先,将80只balb/c小鼠随机分成4组,每组20只,分别免疫adc7-m/e-wt、adc7-m/e-mutb和adc7-m/e-mutc腺病毒疫苗和pbs,腺病毒疫苗免疫的剂量是每只鼠1.6x10
11
vp,4周后采血,分离血清,56℃加热30分钟,将每组的20只小鼠的血清混合在一起,用于后面的被动免疫ifnα/βr-/-ifnγr-/-小鼠。将ifnα/βr-/-ifnγr-/-鼠随机分成4组,通过腹腔途径分别注射adc7-m/e-wt、adc7-m/e-mutb和adc7-m/e-mutc腺病毒疫苗或者pbs免疫balb/c鼠的血清(血清使用pbs以1:10的比例稀释,每只鼠注射稀释后的血清200μl)。24小时后通过皮下途径注射denv2病毒,每只注射5000ffu,注射之前对每只小鼠进行称重记录。之后每天观察小鼠状态、生存情况和称量体重,结果如图19所示。
[0210]
由图19可知,与sham组的小鼠相比,m/e-wt组小鼠整体死亡时间更早,说明adc7-m/e-wt疫苗免疫小鼠的血清增强了denv的发病,而m/e-mutb和m/e-mutc组的小鼠死亡时间和趋势与sham组一致(图19中的a图),说明对zikv e蛋白的突变减弱了能导致对denv产生ade效用的抗体的产生,使得m/e-mutb和m/e-mutc组小鼠的表现与sham组相似。体重的变化趋势也发现,m/e-wt组小鼠体重下降更快,而m/e-mutb和m/e-mutc组的小鼠体重变化趋势与sham组一致(图19中的b图)。这些体内实验结果很好的证明了adc7-m/e-mutb和adc7-m/e-mutc疫苗可显著降低野生型疫苗免疫后对denv的ade。
[0211]
其中,图19中sham指免疫pbs组,m/e-wt指免疫adc7-m/e-wt疫苗组,m/e-mutb指免疫adc7-m/e-mutb疫苗组,m/e-mutc指免疫adc7-m/e-mutc疫苗组。
[0212]
实施例15 zikv疫苗诱导balb/c小鼠产生的抗体谱分析
[0213]
由于fl替换了的zikv疫苗诱导了保护性免疫,同时又降低了对denv的ade反应,我们进一步分析了小鼠体内的zikv e的b细胞谱,来解释突变的疫苗是如何影响抗体反应的。
[0214]
将balb/c鼠随机分成3组,通过肌肉注射分别免疫adc7-m/e-wt腺病毒疫苗(wt组)、adc7-m/e-mutb腺病毒疫苗(mutb组)和adc7-m/e-mutc腺病毒疫苗(mutc组),每只鼠免疫1.6x10
11
vp。免疫后第20天,解剖取出淋巴结放在含1%fbs的1640培养基中,每个疫苗组的所有小鼠的淋巴结混合在一起,使用载玻片的粗糙面研磨,之后使用0.45μm滤网过滤。将淋巴细胞在400g 4℃下离心15分钟,倒掉上清,用1ml facs buffer重悬。facs buffer为加入0.5%fbs的pbs溶液。重悬后转移到1.5ml ep管,400g 4℃下离心10分钟,弃上清。用200μl facs buffer重悬细胞,加4μg生物素标记的zikv e单体蛋白和二聚体蛋白的混合物,4℃避光孵育30min。之后加入1ml的facs buffer,混匀,离心沉淀细胞。再加入1ml的facs buffer洗一遍,然后加抗体进行染色,抗体使用facs buffer稀释,每200μl的抗体液中包含:fitc-gl7,2μl(bd,553666);pe-cd138,4μl(bd,553714);pe/cy7-cd38,4μl(biolegend,102718);apc-cd93,4μl(biolegend,136510);bv421-b220,16μl(biolegend,103240);bv510
–
igd,2μl(bd,563110);bv711,4μl(bd,563262)。每个样品加入200μl的抗体液,在4度避光孵育30min,之后用facs buffer洗2遍。加入2ml fcas buffer,悬浮细胞,使用0.45μm滤网过滤,转移到流式管,分选条件是gl-7
+
b220
hi cd38
lo igd-cd93-cd138-+
(如图20所示),筛选出的是与zikv e反应的gc b细胞,然后进行测序前的建库。
[0215]
为了获得单细胞成对的b细胞受体(b cell receptor,bcr)序列,我们使用了单细胞测序技术。使用chromium single cell v(d)j enrichment kit,mouse b cell,96 rxns(10 x genomics,pn-1000072)试剂盒进行测序前的建库,之后进行高通量测序,分析每个细胞的重链和轻链的v(d)j片段全长序列,结果如图21和表5所示。
[0216]
由图21和表5可知,wt组样品得到451个重链可变区序列和661个轻链可变区序列,能够配对的是334对;mutb组样品得到310个重链可变区序列和379个轻链可变区序列,能够配对的是234对;mutc组样品得到664个重链可变区序列和776个轻链可变区序列,能够配对的是515对。其中,图21和表5中,wt指免疫adc7-m/e-wt疫苗组,mutb指免疫adc7-m/e-mutb疫苗组,mutc指免疫adc7-m/e-mutc疫苗组。
[0217]
表5 bcr测序数据总结
[0218][0219]
分析wt,mutb和mutc诱导小鼠产生的抗体谱发现,adc7-m/e-wt疫苗激活小鼠的可变区(variable,v)基因具有偏好性,大约其中60%重链使用的是ighv9-2-1、ighv1-22和ighv7-3,约60%轻链使用的是igkv10-96、igkv14-111和igkv6-23(图21)。然而对于替换了fl的adc7-m/e-mutb和adc7-m/e-mutc疫苗,bcr谱在重链可变区(hv)和轻链可变区(lv)上都显示出更加多样和分散(图21)。wt组中,激活最显著的几个可变区基因在fl替换了的疫苗组mutb和mutc组的抗体谱中明显降低甚至没有出现(图21)。
[0220]
然后我们分析了抗体谱中成对的hv和lv结果,结果分别如图22,图23和图24-1和图24-2所示。
[0221]
由图22可知,adc7-m/e-wt疫苗激活小鼠的gc b细胞克隆的hv:lv具有明显的偏好性,其中频率较高的是ighv9-2-1:igkv10-96(29.9%)、ighv1-22:igkv14-111(14.4%)和igkv1-22:igkv6-23(7.5%),这三者总和约为50%。
[0222]
由图23和图24-1和24-2可知,adc7-m/e-mutb和adc7-m/e-mutc疫苗激活小鼠的gc b细胞克隆的hv:lv使用种类更多,频率分布上也更加分散。wt组检测出最高的ighv9-2-1:igkv10-96,在mutb和mutc组中都没有出现。
[0223]
抗体谱分析结果表明,将adc7-m/e-wt疫苗的fl区域替换后,b细胞反应的免疫优势表位进行了转移。
[0224]
实施例16鉴定对denv感染有ade反应的主要fle抗体类型
[0225]
引起denv的ade反应的抗体中,较大部分靶向e蛋白的fle,而zikv感染诱导的抗体也会导致对denv的ade反应,于是我们鉴定上述分离出的单抗的结合特性,检测哪些是结合在fle以及是否会诱导对denv的ade反应。
[0226]
根据gc b细胞克隆的相似性分类,一些代表性的单抗基因被合成(金唯智,苏州),分别覆盖了adc7-m/e-wt,adc7-m/e-mutb和adc7-m/e-mutc这三组总数的63.38%、46.57%和43.88%(表6)。随后hv和lv基因分别被克隆至鼠igg2a和igκ表达载体。从adc7-m/e-wt疫
苗组(表6中以m/e-wt表示)来源的单抗分别被命名为zwt.1-10,从adc7-m/e-mutb疫苗组(表6中以m/e-mutb表示)和adc7-m/e-mutc疫苗组(表6中以m/e-mutc表示)来源的单抗分别被命名为zmutb.1-8和zmutc.1-13(表6)。
[0227]
表6表达的鼠源单克隆抗体
[0228]
[0229]
[0230][0231]a:考虑到7个基因组成元素:重链的hv、hd、hj基因和cdrh3长度,轻链的lv、lj和cdrl3长度,当克隆有4个或者大于4个元素相同时认为是属于同一个基因聚类。
[0232]b:elisa检测每一个单抗结合zikv e(单体或者二聚体),当样品的od
450
高于阴性对照值的5倍时认为是结合否则认为是不结合。
[0233]
我们将表达单抗的重链轻链质粒共转染293t细胞,3天后收集上清,通过elisa实验检测上清中的抗体与zikv-e蛋白的结合能力。
[0234]
elisa的实验方法为:将蛋白用elisa包被液(碳酸钠-碳酸氢钠缓冲液,ph 9.6)稀释至3μg/ml,96孔elisa板每孔加入100μl,4℃放置过夜。第二天倒掉包被液,使用pbs配置的5%脱脂牛奶封闭elisa板,室温放置1小时。倒掉封闭液,在elisa板中每孔加入100μl表达单抗的培养上清,室温孵育2小时,使用pbst洗3遍。之后加入使用封闭液1:2000稀释的goat anti-mouse hrp(ab6789)二抗,室温孵育1.5小时,pbst洗4遍。加入50μl tmb显色液显色,30分钟后加入50μl 2m盐酸终止反应,在酶标仪上检测od450读值。
[0235]
elisa检测结果如图25所示,大部分的单抗可以结合zikv se蛋白的单体或者二聚体形式;由表6可知,结合的阳性率分别达到me-wt组90%(9/10)、me-mutb组87.5%(7/8)、me-mutc组76.9%(10/13)。
[0236]
对26个结合zikv se蛋白的阳性单抗做进一步评测,由图25,我们发现所有来源于me-wt组的单抗都与zikv se-mutc蛋白没有反应,但是与1至4血清型的denv的se蛋白有交叉反应,表明来源于me-wt组的单抗是结合fle的单抗;而来源于me-mutb和me-mutc组的单抗主要是zikv特异性的抗体,它们几乎都不结合denv se。
[0237]
我们表达纯化了来源于me-wt组的代表性的fle单抗,以进一步评价这些抗体在k562细胞上对denv的ade效应,结果如图26所示。由图26可知,所有检测的来源于me-wt组的抗体对4种血清型的denv均有一定程度的增强感染效应。其中,图26中,zwt.1、4、6、8、9、10分别为来自于m/e-wt组的单抗;denv1、denv 2、denv 3、denv 4分别为1-4血清型的denv病毒;从a到d依次为zwt.1、4、6、8、9、10抗体促进4种血清型的denv的增强感染k562细胞的结果。
[0238]
me-wt组来源的fle单抗主要由4类hv:lv基因组合,我们试着在文献和数据库中检索以往报道的黄病毒fle鼠源单抗,再与我们分离到的抗体基因座和序列进行对比,发现了以下4个单抗:
[0239]
6b6c-1,是从蜱传脑炎病毒(tick-borne encephalitis virus,tbev)感染后分离得到(crill et al,(2004)journal of virology,78.24:13975-13986.);
[0240]
4g2和2a10g6都是从denv感染后分离得到(bennett et al.(2015),bmc biotechnology,15.1:71-71.;deng,yongqiang,et al.(2011),plos one 6.1);
[0241]
e53是从wnv感染后分离得到(oliphant et al.(2006),journal of virology 80.24:12149-12159.)。
[0242]
经过分析发现,我们从me-wt组分离到的fle单抗与这4个报道的单抗的基因座及序列有着较多相似,如图27、图28-1和图28-2所示。由图27可知,6b6c-1和4g2分别与zwt.1-3和zwt.4-5使用相同的hv:lv基因对,序列相似度较高;2a10g6和e53分别与zwt.6和zwt.8使用相同的hv基因。
[0243]
尽管2a10g6和zwt.6使用的lv基因不同,两个抗体的lv序列有一定相似,由图28-2可知,2a10g6和zwt.6的cdrl3和fr4完全相同。
[0244]
由以上分析发现,从adc7-m/e-wt疫苗免疫小鼠的淋巴结gc b细胞中克隆出的fle单抗与已报道的小鼠fle单抗使用接近甚至相同的基因座,在序列上较为相似,说明诱导小鼠产生结合fl表位的抗体使用的基因座具有偏好性,产生的fle抗体特性上也较为相似。
[0245]
图28-1中,a是zwt.1、zwt.2、zwt.3、6b6c-1的抗体重链与小鼠基因座的序列比对分析,b是zwt.1、zwt.2、zwt.3、6b6c-1的抗体轻链与小鼠基因座的序列比对,c是zwt.4、zwt.5、zwt.6、4g2、2a10g6的抗体重链与小鼠基因座的序列比对;图28-2中,d是zwt.4、zwt.5、4g2抗体轻链与小鼠基因座的序列比对,e是zwt.6、2a10g6的抗体轻链与小鼠基因座的序列比对。
[0246]
实施例17 spr实验检测野生型和突变体zikv e蛋白对zikv抗体的亲和力
[0247]
由于adc7-m/e-mutb和adc7-m/e-mutc疫苗能够提供小鼠完全的保护,同时又避免对denv的ade,为了解释潜在的分子机制,我们表达纯化可溶的se-mutc蛋白作为代表,与se-wt进行比较。
[0248]
biocore8000是基于表面等离子共振(surface plasmon resonance,spr)的原理,可以检测分子间的相互作用,实时反映分子结合过程中的动态变化情况,得到相互作用的动力学参数。
[0249]
使用biocore8000检测zikv se-wt蛋白和zikv se-mutc蛋白与fle抗体和非fle中和抗体的亲和力。利用氨基偶联方法,分别将zikv se-wt蛋白和zikv se-mutc蛋白固定到cm5芯片上,然后倍比稀释4种抗体作为流动相,试抗体依次流过固定的zikv se蛋白,得到不同的结合相应信号,收集的数据经过拟合计算,得到结果如图29和图30所示。
[0250]
图29中,从a到d依次为zikv se-wt蛋白和2a10g6抗体的结合结果(se-wt-2a10g6),zikv se-mutc蛋白和2a10g6抗体的结合结果(se-mutc-2a10g6),zikv se-wt蛋白和z6抗体的结合结果(se-wt-z6),zikv se-mutc蛋白和z6抗体的结合结果(se-mutc-z6)。其中,由图29中的a图可知,2a10g6抗体结合zikv se-wt蛋白的亲和力为9.13nm;由图29中的c图可知,z6抗体结合zikv se-wt蛋白的亲和力为7.14nm;由图29中的b图可知,zikv se-mutc蛋白完全不结合2a10g6抗体;由图29中的d图可知,zikv se-mutc蛋白完全不结合z6抗体;这个结果也和理论分析是一致的。
[0251]
图30中,从a到d依次为zikv se-wt蛋白和z3l1抗体的结合结果(se-wt-z3l1),zikv se-mutc蛋白和z3l1抗体的结合结果(se-mutc-z3l1),zikv se-wt蛋白和z23抗体的结合结果(se-wt-z23),zikv se-mutc蛋白和z23抗体的结合结果(se-mutc-z23)。其中,由图30中的a图和c图可知,z3l1和z23抗体结合zikv e-wt蛋白的亲和力分别是9.48μm和0.625μm;由图30中的b图和d图可知,z3l1和z23抗体结合zikv se-mutc蛋白的亲和力分别是8.01μm和0.701μm。突变体蛋白zikv se-mutc对z23和z3l1的亲和力与野生型zikv se-wt蛋白相比几乎没有改变;这说明设计的突变体能够维持蛋白的整体构象,没有对突变位点
以外的其它表位产生变化。
[0252]
实施例18突变体zikv se-mutc蛋白与z3l1抗体的复合物结构解析
[0253]
为了进一步解释突变体疫苗的作用机制,我们纯化了zikv se-mutc和z3l1单链可变区片段(single-chain variable fragment,scfv)的复合物蛋白,然后进行晶体筛选,后经过x射线衍射和结构解析,得到了分辨率为的复合物原子结构,如图31所示,复合物的数据收集及优化参数见表7。
[0254]
表7 zikv se mutc-z3l1复合物的数据收集及优化参数
[0255][0256][0257]
从图31可知,尽管在zikv e蛋白的fl序列中引入了5个点突变,se-mutc仍然以融合前状态的二聚体形式结合z3l1的scfv。详细分析二聚体接触界面发现,突变的fl氨基酸残基新建了相邻的两个e蛋白原体的相互作用,在n98和w108两处分别生成了4个和1个氢键,有利于e蛋白二聚体的稳定,如表8所示。
[0258]
从图32可知,se-mutc的折叠形式与野生型蛋白很相似,展示出正常的二级、三级
和四级表位结构。
[0259]
为了分析中和表位的构象,我们将zikv se-mutc和z3l1的scfv的复合物结构(z3l1/zikv se mutc)与z3l1和zikv se-wt蛋白的复合物结构(z3l1/zikv se wt,pdb:5gzn)重叠在一起,结果如图33所示。由图33可知,zikv野生型蛋白se-wt和突变体蛋白se-mutc与z3l1抗体的结合模式是相同的,结合处主要是di中的d0、e0和f0股以及150loop,还有dii里的kl发夹(wang,et al.(2016)science translational medicine8.369:369ra179.)。
[0260]
将se-mutc的fl区域与se-wt重叠在一起比较分析,结果见图34,由图34可知,二者fl表位的构象非常相似,仅在突变位点的侧链上显示出区别。
[0261]
为了分析突变体抗原se-mutc诱导fle抗体的可能性,我们将结构已知的fle抗体(z6抗体、2a10g6抗体和e53抗体)结合黄病毒e蛋白的结构与se-mutc的dii结构重叠在一起进行分析,结果如图35所示。
[0262]
图35中,从a到c分别使用了z6抗体与zikv se蛋白、2a10g6抗体与zikv se蛋白(pdb:5jhl)以及e53抗体与wnv se蛋白(pdb:3i50)的复合物结构。由图35可知,模拟单抗与se-mutc结合后,g106、l107和f108的突变会明显阻碍抗原与抗体的结合;g106l突出的长侧链会导致与这些fle抗体的结合有冲突;l107e突变使得形成了带电荷的侧链,这可能会破坏相互作用中局部的疏水作用;此外,f108w突变会形成位阻影响se-mutc的fl表位和2a10g6抗体的相互作用。因此zikv e蛋白的fl表位上,g106、l107和f108这3个关键的氨基酸突变起到了协同作用,消除了fle抗体的诱导产生。
[0263]
表8 zikv e二聚体内两个原体相互作用氨基酸分析
[0264][0265][0266]
实施例19构建muta、mutb和mutc突变的denv疫苗
[0267]
在denv疫苗的设计中如何避免ade仍然是一个悬而未决的问题(ref),zikv的fl与denv的fl序列十分保守,通过上述系统的实验证明了adc7-m/e-mutb和adc7-m/e-mutc腺病毒疫苗能够在给小鼠提供完全的保护时又避免了对denv的ade,因此,构建muta、mutb和mutc突变的denv疫苗以验证该疫苗是否具有类似的效果。
[0268]
首先,将来源于jev(乙型脑炎病毒(japanese encephalitis virus))的信号肽基
muta或m/e-mutb或m/e-mutc蛋白的结合能力大幅减弱甚至不结合。对于有较高中和活性的结合在非fl表位的mab513和d448抗体,仍可以结合引入muta、mutb和mutc突变的denv2的m/e-muta或m/e-mutb或m/e-mutc蛋白,说明denv2 e蛋白的fl表位的突变没有对其它表位产生显著影响。上述结果说明,这3种突变组合可在denv的疫苗中应用,基于g106,l107和f108位点突变组合的denv2 e蛋白抗原获得的疫苗可降低疫苗免疫后对后续denv病毒感染引起的ade效应。
[0275]
实施例20检测zikv e w101位突变成其它19种氨基酸后对抗原活性的影响
[0276]
在z6/zikv se和2a10g6/zikv se的结构中,e蛋白与抗体作用最多的氨基酸是w101,同时也有文献报道大多数的fle抗体对e蛋白的结合都依赖于w101(dejnirattisai,w.et al.(2015).nat immunol 16,170-177.),于是我们尝试了将w101突变成其它19种氨基酸,再通过细胞流式方法检测细胞表达抗原的表位是否改变,以筛选出最合适的突变。
[0277]
将来源于jev的信号肽基因(seq id no.17)和野生型zikv的m/e基因(seq id no.31)构建进pcaggs载体(addgene),得到可以表达野生型zikv的m/e蛋白的质粒pcaggs-m/e-wt。以该质粒为模板将e蛋白101位的色氨酸突变成其它19种氨基酸。以色氨酸突变成丙氨酸为例,使用质粒pcaggs-m/e-wt作为模板,以w101-wt-f和w101-1a-r为引物pcr得到产物w101-1a-1,引物序列见表10。使用质粒pcaggs-m/e-wt作为模板,以w101-wt-r和w101-1a-f为引物pcr得到产物w101-1a-2。再以w101-1a-1和w101-1a-2按照摩尔比1:1的比例混合作为模板,w101-wt-f和w101-wt-r作为引物进行pcr,得到pcr产物w101-1a。将pcaggs载体用xhoi(thermo,fd0694)和ecori(thermo,fd0274)进行限制性酶切,得到带有双粘性末端的线性质粒。将酶切后的线性质粒与w101-1a按照摩尔比1:5的比例混合,使用in-fusion试剂盒(takara,639648)进行重组,将重组产物转化dh5α感受态细胞,涂在氨苄抗性的平板上37℃培养,之后挑取克隆进行pcr鉴定及测序鉴定。
[0278]
表10 zikv的e蛋白101位色氨酸突变引物
[0279]
[0280][0281]
提取w101的19种突变体质粒后,将野生型质粒和19种突变体质粒分别转染293t细胞。48小时后移除上清,使用pbs洗一遍细胞,接着用胰蛋白酶消化细胞成单细胞,离心后使
用dmem培养基重悬,再用dmem培养基洗一遍。接着加入bd公司的fixation and permeabilization solution,置于冰上20分钟。然后800g离心10分钟收集细胞并用bd公司的1
×
perm/wash buffer清两遍。把每种样品分成5份,分别加入z6和2a10g6抗体,置于4℃冰箱1小时。离心收集细胞,并用1
×
perm/wash buffer洗两遍。接着加入goat anti-human fitc(proteintech,00003-12)抗体,置于4℃冰箱1小时。离心收集细胞,并用1
×
perm/wash buffer洗两遍。用pbs对细胞进行重悬(200μl每孔),使用流式细胞仪检测样品的阳性比例,实验结果如图37所示。
[0282]
由图37可知,zikv野生型m/e抗原可以结合z6和2a10g6抗体,但是19种突变体都几乎不能与z6和2a10g6抗体结合,说明zikv e蛋白101位色氨酸对于激活靶向fl的抗体十分关键,w101位点突变制备的疫苗将降低或避免产生fl表位诱导抗体,从而避免疫苗免疫后引起对denv的ade效应。
[0283]
实施例21检测zikv e蛋白g106,l107和f108位点突变对fle抗体结合能力
[0284]
基于上述的pcaggs-zikv-m/e表达质粒,做如下单位点及双位点突变,突变体质粒构建方法参照实施例20,构建突变质粒过程种所使用的引物见表11。
[0285]
表11 zikv的e蛋白g106,l107和f108位点的突变所用引物
[0286]
[0287]
[0288][0289]
将野生型质粒pcaggs-zikv-m/e-wt和构建成功的突变体质粒分别转染293t细胞。48小时后收集细胞、消化成单细胞、固定通透、孵育结合fl表位的ade抗体z6和2a10g6。孵育goat anti-human(mouse)fitc二抗,最后用流式细胞仪检测样品的阳性比例。阳性比例低于野生型阳性率的10%则认为是不结合,10%-50%认为是弱结合,结果如表12所示。
[0290]
由表12可知,上述突变基本上都能阻止fl表位代表性ade抗体(z6抗体和2a10g6抗
体)的结合,说明以这些突变为代表的g106,l107和f108位点的单点或协同突变制备的疫苗将能降低或避免产生fl表位诱导ade抗体,从而避免疫苗免疫后引起对denv的ade效应。
[0291]
表12 zikv e蛋白突变体与z6抗体和2a10g6抗体的结合结果
[0292][0293]
注:
‑‑
表示不结合。
[0294]
实施例22检测denv e蛋白g106、l107和f108位点突变对fle抗体结合能力
[0295]
基于上述的pcaggs-denv2-m/e表达质粒,做如下单位点及双位点突变,突变体质粒构建方法参照实施例19,构建突变质粒过程种所使用的引物见表13。
[0296]
表13 denv的e蛋白g106,l107和f108位点的突变所用引物
[0297]
[0298]
[0299][0300]
将野生型质粒pcaggs-zikv-m/e-wt,pcaggs-denv2-m/e-wt和上述表中的突变体构建分别转染293t细胞。48小时后收集细胞、消化成单细胞、固定通透、孵育结合fl表位的ade抗体z6和2a10g6。孵育goat anti-human(mouse)fitc二抗,最后用流式细胞仪检测样品的阳性比例。阳性比例低于野生型阳性率的10%则认为是不结合,10%-50%认为是弱结合,结果如表14所示。
[0301]
由表14可知,上述突变基本上都阻止fl表位代表性ade抗体的结合,说明以这些突变为代表的g106,l107和f108的单点或协同突变制备的疫苗将降低或避免产生fl表位诱导ade抗体,从而避免疫苗免疫后引起对denv的ade效应。
[0302]
表14 denv e蛋白突变体与z6抗体和2a10g6抗体的结合结果
[0303]
[0304][0305]
注:
‑‑
表示不结合。
[0306]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1