地钱类黄酮葡萄糖醛酸糖基转移酶及其编码基因与应用
1.本发明属于基因工程和酶工程技术领域,具体涉及地钱类黄酮葡萄糖醛酸糖基转移酶及其编码基因与应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.黄酮类化合物是自然界中重要的次级代谢产物,广泛存在于植物中,它们在植物体内主要以糖苷的形式存在。在植物中类黄酮的糖基化是由糖基转移酶(gt)催化的,它将活化的糖分子转移到受体底物上生成结构多样的糖苷产物。糖基化修饰可改善化合物的溶解性,并影响其在人体的生物利用度和生物活性。
4.黄酮糖苷具有多种药理活性,如抗氧化、抗炎和神经保护功能。类黄酮葡萄糖醛酸苷是一类黄酮上有一个或多个葡萄糖醛酸取代的化合物,由于其结构及在人体内代谢的特殊性,因此具有十分巨大的成药潜力。一些葡萄糖醛酸苷药用活性已被挖掘,如灯盏乙素,已被开发为治疗心脑血管疾病的临床用药。木犀草素-3'-o-葡萄糖醛酸苷可抑制膀胱癌细胞增殖。但该类化合物在植物中含量较低,提取分离过程复杂,人工获取较困难,因此鉴定类黄酮葡萄糖醛酸转移酶可用于高效简便的方法生物合成该类化合物。
5.目前鉴定得到的类黄酮糖基转移酶大都是以udp-葡萄糖为糖供体,葡萄糖醛酸糖基转移酶(ugat)报道的较少,主要从唇形科植物中鉴定得到。苔藓植物作为从水生到陆生过渡的重要植物类群,体内富含结构多样的次级代谢产物,而目前苔藓植物中的糖基转移酶只有少数被鉴定。地钱(marchantia polymorpha)是苔类植物的模式植物,地钱体内经鉴定也包含一些单糖或双糖的类黄酮葡萄糖醛酸苷,例如木犀草素-7,3
’‑
o-葡萄糖醛酸苷、木犀草素-7-o-葡萄糖醛酸苷、木犀草素-4
’‑
o-葡萄糖醛酸苷和芹菜素-7-o-葡萄糖醛酸苷。但发明人发现,地钱中催化类黄酮葡萄糖醛酸苷生成的糖基转移酶(gts)的研究尚未有报道。
技术实现要素:
6.基于上述现有技术的不足,本发明提供地钱类黄酮葡萄糖醛酸糖基转移酶及其编码基因与应用。本发明得到的来自于苔类植物地钱的葡萄糖醛酸糖基转移酶,经研究发现,该酶能够催化黄酮、二氢黄酮、黄酮醇的葡萄糖醛酸化,生成多种单糖苷及双糖苷产物,其中还包括灯盏乙素等一些药用化合物,此外,其还能催化二氢黄酮(柚皮素、橙皮素、乔松素)的葡萄糖基化,因此具有较高的实际应用价值和经济价值。
7.为实现上述技术目的,本发明采用技术方案如下:
8.本发明的第一个方面,提供一种名为mpugt742a1的蛋白质,所述名为mpugt742a1的蛋白质来源于地钱(marchantia polymorpha)。经试验验证,其能够高效催化黄酮、二氢
黄酮、黄酮醇的葡萄糖醛酸化,生成多种单糖苷及双糖苷产物,其中还包括灯盏乙素等一些药用化合物,此外,它还能催化二氢黄酮(柚皮素、橙皮素、乔松素)的葡萄糖基化。
9.其中,所述mpugt742a1具有如seq id no.1所示的氨基酸序列。
10.seq id no.1由513个氨基酸残基组成。
11.本发明的第二个方面,提供一种编码所述mpugt742a1的基因。
12.其中,所述基因具有如(a1)或(a2)中任一所述的核苷酸序列:
13.(a1)seq id no.2所示的核苷酸序列;
14.(a2)与(a1)互补的核苷酸序列。
15.seq id no.2由1542个核苷酸组成,其中第1-1539为编码序列,第1530-1542位核苷酸转录为终止密码子终止肽链合成。
16.本发明的第三个方面,含有上述编码基因的重组表达载体、含有上述编码基因的重组细胞或转化体亦在本发明的保护范围之内。
17.所述重组表达载体通过上述基因有效地连接到表达载体上获得,所述表达载体可以为质粒;所述质粒进一步包括pet32a和pgwb5;
18.所述重组细胞可以是细菌细胞、真菌细胞或植物细胞中的任意一种或多种;
19.所述细菌细胞包括大肠杆菌(如bl21(de3))、根癌农杆菌(如gv3101)、发根农杆菌等。
20.所述植物细胞包括烟草表皮细胞。
21.本发明的第四个方面,所述蛋白质mpugt742a1作为糖基转移酶的应用也应在本发明的保护范围之内。
22.本发明的第五个方面,所述编码基因、重组表达载体、转化细胞或转基因植物在制备mpugt742a1中的应用。
23.本发明的第六个方面,提供所述蛋白质mpugt742a1具有如下(b1)-(b2)中的应用:
24.(b1)催化黄酮及类黄酮类化合物的葡萄糖醛酸糖苷化或葡萄糖苷化;
25.(b2)制备糖苷类或糖醛酸苷类化合物;
26.所述(b1)中,所述黄酮及类黄酮类化合物包括但不限于黄酮类化合物、黄酮醇类化合物及二氢黄酮类化合物;
27.其中,所述黄酮类化合物包括但不限于芹菜素、木犀草素、黄芩素和野黄芩素;
28.所述黄酮醇类化合物包括但不限于槲皮素、山奈酚和异鼠李素;
29.所述二氢黄酮类化合物包括但不限于柚皮素、橙皮素、圣草酚、甘草素和乔松素。
30.更具体的,蛋白质mpugt742a1能够催化二氢黄酮类化合物的葡萄糖苷化和黄酮类、二氢黄酮类和黄酮醇类化合物的葡萄糖醛酸糖苷化;
31.本发明通过试验验证,mpugt742a1对柚皮素、橙皮素、乔松素都有较高的催化活性,并催化二氢黄酮-7-o-葡萄糖苷的生成。实际上,其对多种结构类型的类黄酮底物(黄酮、二氢黄酮、黄酮醇)均具有高催化活性,并催化生成多种单糖苷和双糖苷产物。
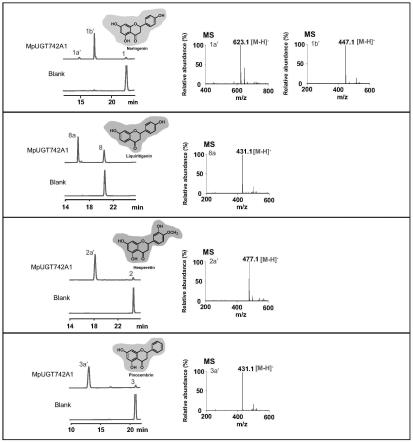
32.所述(b2)中,所述糖苷类化合物包括二氢黄酮葡萄糖苷类化合物;
33.所述糖醛酸苷类化合物包括黄酮葡萄糖醛酸苷类、二氢黄酮葡萄糖醛酸苷类和黄酮醇葡萄糖醛酸苷类化合物;
34.上述一个或多个技术方案的有益效果:
35.上述技术方案提供的来自于地钱的mpugt742a1是在苔类植物中首次发现的葡萄糖醛酸糖基转移酶,能够催化黄酮类、二氢黄酮类、黄酮醇类化合物的葡萄糖醛酸化生成多种单糖苷及双糖苷;其也能催化二氢黄酮类化合物葡萄糖基化。利用pcr技术从cdna获得了基因的全长序列。通过构建pet32a蛋白表达载体转化大肠杆菌bl21(de3)得到目的蛋白。体外酶活功能鉴定证明mpugt742a1能够高效催化二氢黄酮生成相应的葡萄糖苷或葡萄糖醛酸苷,也能催化黄酮和黄酮醇生成相应的葡萄糖醛酸苷,这个酶可用于生物合成多种类黄酮糖基化产物,因此具有较高的经济价值和广阔的应用前景。
附图说明
36.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
37.图1:目的基因mpugt742a1的orf扩增产物的电泳图。
38.图2:mpugt742a1蛋白的sds-page电泳图。其中:m:蛋白分子质量标准;泳道1:mpugt742a1的上清液;泳道2:mpugt742a1的纯化蛋白。
39.图3:mpugt742a1以udp-葡萄糖为糖供体的主要酶活催化反应的hplc图谱、产物的lc-ms图谱及反应式。糖受体分别为柚皮素、乔松素、橙皮素。每个酶活催化反应都以空载体的催化反应作为对照。
40.图4:mpugt742a1以udp-葡萄糖醛酸为糖供体,黄酮(野黄芩素、黄芩素、芹菜素、木犀草素)为糖受体的主要酶活催化反应的hplc图谱、产物的lc-ms图谱。每个酶活催化反应都以空载体的催化反应作为对照。
41.图5:mpugt742a1以udp-葡萄糖醛酸为糖供体,二氢黄酮(柚皮素、甘草素、橙皮素、乔松素)为糖受体的主要酶活催化反应的hplc图谱、产物的lc-ms图谱。每个酶活催化反应都以空载体的催化反应作为对照。
42.图6:mpugt742a1以udp-葡萄糖醛酸为糖供体,黄酮醇(山奈酚、槲皮素、异鼠李素)为糖受体的主要酶活催化反应的hplc图谱、产物的lc-ms图谱。每个酶活催化反应都以空载体的催化反应作为对照。
43.图7:mpugt742a1以udp-葡萄糖醛酸为糖供体时对一系列黄酮类化合物的转化率。
44.图8:mpugt742a1的亚细胞定位图。
45.其中:a:激发光下绿色荧光信号;b:激发光下叶绿体的荧光信号
46.c:自然光下烟草表皮细胞;d:a、b、c图的叠加。
具体实施方式
47.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
48.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。应理解,本发明的保护范
围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列具体实施方式中如果未注明具体条件的实验方法,通常按照本领域技术内的分子生物学的常规方法和条件,这种技术和条件在文献中有完整解释。参见例如sambrook等人,《分子克隆:实验手册》中所述的技术和条件,或按照制造厂商所建议的条件。
49.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
50.实施例1.表达基因mpugt742a1的克隆
51.1.1 ctab-pvp法提取地钱总rna
52.(1)取新鲜的地钱植物材料,清洗干净后用滤纸吸干水分,置于预冷的研钵中加液氮研磨至材料成粉末状。
53.(2)取适量粉末至提前预冷的2ml进口离心管中,加600-800μl 65℃预热的ctab-pvp提取液,上下颠倒混匀。
54.上述ctab-pvp提取缓冲液配制方法如下:
55.100mm tris
·
hcl(ph 8.0),2%ctab(w/v),2%pvp(w/v),25mm edta,2m nacl,高压蒸汽灭菌之后巯基乙醇加至0.2%;溶液配置用depc处理过的ddh2o,高压灭菌后备用。
56.(3)65℃水浴30min,每隔10min颠倒混匀一次。
57.(4)冷却至室温后加入600-800μl氯仿,颠倒混匀后在4℃13,000rpm离心10min。
58.(5)取上清转至新的进口2ml的离心管,加入600-800μl氯仿,振荡混合均匀后4℃13,000rpm离心10min。
59.(6)重复上步(即用氯仿抽提三次)。
60.(7)小心吸取上清转至新的进口1.5ml离心管中,加入1/3体积的8m licl,-20℃静置3h以上。
61.(8)4℃13,000rpm离心10min,弃上清。
62.(9)加入700μl 75%乙醇(depc水配制)洗涤沉淀2-3次。离心弃上清后挥干剩余乙醇。
63.(10)加入30μl proteinase k处理后的灭菌水溶解rna,制得总rna。使用biophotometer plus核酸蛋白测定仪测定提取的rna浓度及质量。
64.1.2 mpugt742a1基因全长扩增
65.1.2.1引物设计
66.利用软件bioxm 2.6找出mpugt742a1的开放阅读框(open reading frame)。在orf两侧设计全长引物mpugt742a1-f/r,对基因进行扩增。
67.1.2.2 cdna合成
68.以提取的地钱的总rna为模板,以primerscript rt master mix逆转录体系通过pcr技术获得cdna模板链。
69.逆转录体系及逆转录程序如下:
70.(1)除基因组dna
[0071][0072]
将上述各组分加入进口pcr管中,轻轻混匀后于42℃水浴5min。
[0073]
(2)逆转录pcr
[0074][0075]
在pcr仪中的逆转录程序为:37℃,15min;85℃变性15s,4℃保温。
[0076]
逆转录产物保存于-20℃,使用前稀释10倍。
[0077]
1.2.3目的基因扩增
[0078]
以稀释的逆转录的地钱cdna为模板,以mpugt742a1-f/r为引物进行扩增。
[0079]
扩增体系及扩增程序如下:
[0080][0081]
将以上组分加入200μl的pcr管中混合均匀,低速离心后放入pcr仪中按以下程序进行扩增:94℃预变性3min;94℃变性10s,52℃退火15s,72℃延伸45s,33个循环;72℃延伸10min。
[0082]
将pcr反应产物进行琼脂糖凝胶电泳检测,将目的大小条带切胶回收,方法如下。
[0083]
将上述pcr产物进行琼脂糖凝胶电泳(1.4%,w/v,g/100ml),并用tiangen胶回收试剂盒回收。步骤如下:
[0084]
(1)将上述pcr产物进行琼脂糖凝胶电泳后,经溴化乙锭(ethidium bromide,eb)染色5min,于紫外灯下快速切下含有目的大小条带的胶块,放入1.5ml离心管中。
[0085]
(2)加入200μl溶液pc,于55℃水浴5-6min溶解胶块。期间每隔2min颠倒震荡离心管使之充分溶解。
[0086]
(3)将吸附柱cb2置于2ml的收集管中,将上述溶胶液转移至吸附柱cb2,12,000rpm
离心1min,弃掉收集管中的滤液。
[0087]
(4)向吸附柱cb2中加入600μl漂洗液pw。12,000rpm离心1min,弃掉滤液。
[0088]
(5)重复操作步骤(4)。
[0089]
(6)弃掉滤液,将吸附柱cb2室温12,000rpm离心2min,尽量除去漂洗液。
[0090]
(7)将吸附柱cb2置于新的1.5ml离心管中,开盖放置至乙醇挥干。在柱子膜中央加入30μl ddh2o,室温静置2min,12,000rpm离心2min,收集dna溶液立即使用或-20℃保存。
[0091]
1.3目的片段平端载体连接
[0092]
将上述胶回收产物片段按照以下反应体系连接到平端载体ptopo:
[0093][0094]
将上述反应体系混匀放于pcr仪中25℃反应5分钟后,将最终产物进行大肠杆菌dh5α转化。
[0095]
1.4转化
[0096]-80℃保存的大肠杆菌dh5α感受态细胞(50μl)取出后置于冰上解冻,加入5μl连接产物,轻轻吹打混匀,于冰上放置30min;42℃水浴中热击45s后迅速置于冰上2min,加入500μl无抗lb培养基后于37℃培养箱振荡培养1h,取200μl转化液涂布于lb固体培养基(含100μg/ml氨苄抗性)上,37℃静置培养12h-16h。
[0097]
lb培养基组分(1l):酵母提取物5g、胰蛋白胨10g、nacl 10g,加水溶解后定容至1l。固体培养基加入琼脂(12g/l)后,高压蒸汽灭菌。
[0098]
1.5重组子阳性克隆鉴定
[0099]
随机挑选5个单克隆接种于200μl lb培养基中,37℃振荡培养4h。以菌液为模板进行菌落pcr。体系如下:
[0100][0101]
扩增程序:94℃预变性5min;94℃变性30s,52℃退火30s,72℃延伸60s,32个循环;72℃延伸10min;
[0102]
菌落pcr后进行琼脂糖凝胶电泳,能扩增出明亮且单一的目的大小条带的为阳性单克隆,将条带大小合适的阳性克隆送测序。测序成功的阳性克隆存菌:930μl菌液加70μ
ldmso,混合均匀后于-80℃冻存。
[0103]
实施例2.基因蛋白表达及酶活功能分析
[0104]
2.1提取mpugt742a1-ptopo质粒
[0105]
用质粒小量提取试剂盒(tiangen)提取质粒:
[0106]
(1)将所存菌株mpugt742a1-ptopo-dh5α划lb板(含100μg/ml amp),37℃,12h后长出单克隆,挑取单克隆于4ml含amp抗性的培养基中,37℃,110rpm培养10h。
[0107]
(2)取菌液室温12,000rpm离心1min,弃上清,收集菌体,尽可能倒掉上清。
[0108]
(3)向留有菌体沉淀的离心管中加入150μl溶液p1,涡旋振荡至菌体完全悬浮。
[0109]
(4)向离心管中加入150μl溶液p2,温和的上下翻转6-8次使菌体充分裂解。
[0110]
(5)向离心管中加入350μl溶液p5,立即快速的上下颠倒混匀,此时将出现絮状沉淀。静置2min后,12,000rpm离心5min。
[0111]
(6)将上一步收集的上清液转移到吸附柱cp3(吸附柱放入收集管中)。12,000rpm离心1min,倒掉收集管中的废液。
[0112]
(7)向吸附柱cp3中加入300μl漂洗液pwt,12,000rpm离心1min,倒掉收集管中的废液。
[0113]
(8)将吸附柱cp3放入收集管中,12,000rpm离心2min,将吸附柱中残余的漂洗液去除。
[0114]
(9)将吸附柱cp3置于一个干净的离心管中,挥干乙醇后,向吸附膜的中间部分悬空滴加30-50μl蒸馏水,12,000rpm离心2min将质粒溶液收集到离心管中。
[0115]
2.2扩增mpugt742a1 orf
[0116]
以构建的阳性单克隆质粒为模板,用带限制性内切酶酶切位点的引物对mpugt742a1-pet32a-f/r和primerstar max dna聚合酶扩增目的基因mpugt742a1的orf。
[0117]
以mpugt742a1-ptopo质粒为模板,用相应引物扩增其orf,扩增程序为:94℃预变性3min;94℃变性10s,52℃退火15s,72℃延伸45s,33个循环;72℃延伸10min。
[0118]
pcr产物经凝胶电泳分离后,按胶回收试剂盒对片段进行胶回收。(结果见图1)
[0119]
2.3酶切
[0120]
载体pet32a及mpugt742a1的pcr产物胶回收片段分别用bamhi与hindiii进行酶切,酶切体系如下:
[0121][0122]
酶切在37℃水浴反应3h。酶切产物加10
×
loading buffer终止反应后进行琼脂糖凝胶电泳并选择合适的条带进行胶回收,胶回收方法同上。
[0123]
2.4连接、转化及阳性验证
[0124]
酶切后的目的片段与酶切后的载体pet32a(购自novagen公司)用t4 dna ligase
(购自takara公司)连接,体系如下:
[0125][0126]
将上述组分充分混匀后,16℃过夜连接。连接产物转化大肠杆菌dh5α感受态。转化方法同上。挑取单克隆验证阳性并送测序,取测序正确的单克隆存菌并提取mpugt742a1-pet32a质粒。将构建好的原核表达载体质粒热击法转化大肠杆菌bl21(de3)感受态细胞,转化、筛选与鉴定方法同上。
[0127]
2.5 mpugt742a1重组蛋白原核表达
[0128]
2.5.1重组蛋白诱导纯化
[0129]
(1)挑取菌株mpugt742a1-pet32a-bl21阳性克隆接种于4ml含amp抗性的lb培养基中,在37℃,110rpm摇床震荡培养过夜。
[0130]
(2)将培养好的菌液按1:100的比例接于200ml含amp抗性的培养基中,相同条件下培养至od600≈0.5。在菌液中加入0.5mm iptg,于16℃,110rpm摇床里培养16-18h诱导目的蛋白表达。
[0131]
(3)收菌:将菌液离心5000rpm,5min后弃上清。
[0132]
(4)洗涤:按照菌量向离心管中加入适量的binding buffer洗涤液,使菌体重悬,5,000rpm,离心5min,收集菌体,洗涤两次后加15~20ml binding buffer重悬菌体。
[0133]
(5)裂解:将菌液置于冰水混合物中,超声裂解菌体,4℃12,000rpm,离心20min后收集上清进行过柱纯化,留部分上清液准备sds-page,以观察蛋白表达情况。
[0134]
(6)分离:将收集的上清加入平衡过的ni-nta柱子中,待上清流完,加入一柱体积的洗脱液(含有20mm咪唑)洗掉杂蛋白,然后用5ml elution buffer(含咪唑浓度为250mm)收集目的重组蛋白。
[0135]
(7)超滤:将洗脱下的蛋白液置于蛋白分子为30,000da规格的超滤管中,4,000rcf离心10min,并加入binding buffer换液2-3次,然后浓缩目的蛋白。
[0136]
(8)将浓缩液吸取至2ml收集管中,测定蛋白浓度,并留样。
[0137]
(9)蛋白加10%甘油后,用液氮速冻并保存至-80℃冰箱备用。
[0138]
binding buffer:分别称取2.42g tris-hcl、29.22g nacl,加水溶解,调ph8.0,定容至1000ml,灭菌后加入70μlβ-巯基乙醇,4℃保存。
[0139]
elution buffer:分别称取2.42g tris-hcl、29.22g nacl、34g imidazole,加水溶解,调ph8.0,定容至1000ml,灭菌后加入70μlβ-巯基乙醇,4℃保存。
[0140]
2.5.2蛋白的浓度测定
[0141]
采用bradford蛋白浓度测定试剂盒测定蛋白质浓度。
[0142]
(1)完全溶解蛋白标准品bsa,取10μl用0.9%nacl稀释至100μl,使其终浓度为0.5mg/ml作为标准品。
[0143]
(2)将标准品按0,1,2,4,8,12,16,20μl加到96孔板中,加0.9%nacl补足到20μl。
各做三个平行。
[0144]
(3)用0.9%nacl适当稀释留取的蛋白样品,同样加20μl。各做3个平行。
[0145]
(4)各孔加入200μl g250染色液,室温放置3-5min。
[0146]
(5)用酶标仪测定595nm处的吸光值(a595),根据标准品蛋白浓度和对应的吸光度绘制标准曲线,根据标准曲线计算出样品中的蛋白浓度。
[0147]
2.5.3蛋白sds-page电泳
[0148]
目的蛋白的表达及分离纯化情况用变性的聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,sds-page)进行检测。
[0149]
(1)采用垂直板式电泳,将玻璃板固定于胶架上。
[0150]
(2)配制12%分离胶,加入到电泳仪中,加水液封,静置直至分离胶凝固。
[0151]
(3)配制5%浓缩胶,倒掉上层水。将配制好的5%的浓缩胶混匀后立即倒入,将孔梳插入到玻璃板间(避免气泡的产生),待胶凝固后拔出孔梳。
[0152]
(4)在蛋白上清液和纯化的蛋白中分别加入2
×
loading buffer,100℃金属浴5min,使蛋白与loading buffer结合。
[0153]
13,000rpm离心5min,取上清10μl点样,同时吸取蛋白marker 3μl点样。
[0154]
(5)向电泳槽中加适量电泳缓冲液,先90v恒压进行电泳,待样品电泳到分离胶时改为120v恒压电泳,直至溴酚蓝至胶的下沿,停止电泳。
[0155]
(6)取下蛋白胶,放入考马斯亮蓝r-250染色液中浸泡染色,室温下轻摇染色4h。
[0156]
(7)用蒸馏水冲洗掉蛋白胶表面的染色液,冲洗2~3次后置于脱色液中脱色2h,脱色过程中更换脱色液数次,直至蛋白胶背景洗干净。
[0157]
(8)观察结果,蛋白电泳结果如图2。
[0158]
sds-page分离胶和浓缩胶的配制溶液及比例如下:
[0159][0160][0161]
2.6蛋白体外酶活功能鉴定
[0162]
2.6.1体外酶活分析
[0163]
mpugt742a1进行体外酶活功能鉴定,以加入pet32a蛋白的反应体系为对照组。糖供体为udp-葡萄糖或udp-葡萄糖醛酸,底物有黄酮、黄酮醇、二氢黄酮、二氢查尔酮、联苄和苯丙类化合物。酶活反应体系如下:
[0164][0165]
混匀上述组分,置于30℃反应30min后,以udp-葡萄糖为糖供体的酶活反应加等体积乙酸乙酯终止反应,等体积乙酸乙酯萃取两次后,合并有机相,挥干溶剂。用100μl的甲醇重溶,采用hplc进行酶活反应分析;以udp-葡萄糖醛酸为糖供体的酶活反应加甲醇终止反应,12,000rpm离心30min后取上清,采用hplc进行酶活反应分析。
[0166]
2.6.2酶活产物分析
[0167]
为了验证mpugt742a1的体外酶活功能,hplc被用于检测上述酶活反应的产物(图3、图4、图5、图6)。分析采用zorbax sb-b18,5μm,4.6
×
150mm(agilent)色谱柱,检测波长254nm,280nm和346nm,流速1.0ml/min,进样量为20μl。液相分析条件如下:
[0168]
以udp-葡萄糖为糖供体时,hplc分析条件为:
[0169][0170][0171]
以udp-葡萄糖醛酸为糖供体时,hplc分析条件为:
[0172][0173]
lc-ms用于酶活产物鉴定。分析采用hypersil gold,1.9μm,100
×
2.1mm色谱柱,检测波长254nm,280nm和350nm,流速0.3ml/min,进样量为2μl。分析条件为:
[0174][0175]
以udp-葡萄糖为糖供体的酶活反应分析结果如表1。
[0176]
表1 mpugt742a1对部分底物的转化率
[0177]
[0178][0179]a酶活反应糖基供体为udp-glucose;
[0180]b检测出微量产物;
[0181]c未能检测出产物;
[0182]d催化活性表示为转化率(%)
±
stdev。
[0183]
mpugt742a1以udp-葡萄糖为糖供体,二氢黄酮为糖受体的酶活反应结果如图3所示,其对柚皮素、橙皮素、乔松素都有较高的催化活性,并催化二氢黄酮-7-o-葡萄糖苷的生成。mpugt742a1以udp-葡萄糖醛酸为糖供体的酶活反应结果如图4、图5、图6、图7所示。它对多种结构类型的类黄酮底物(黄酮、二氢黄酮、黄酮醇)均具有高活性,并催化生成多种单糖苷和双糖苷产物。
[0184]
实施例3.基因亚细胞定位
[0185]
3.1目的基因gfp定位载体的构建
[0186]
根据目的基因mpugt742a1设计gateway引物:
[0187]
以mpugt742a1-pet32a质粒为模板进行扩增,扩增的体系和条件同上,扩增后纯化的产物进行gateway反应:
[0188]
(1)bp反应体系如下:
[0189][0190][0191]
(a)取出bp clonase
tm mix试剂放置冰上2min,按照如上反应体系依次将各组分加入ep管中,用枪尖吹打混匀。
[0192]
(b)将混合物置于25℃,孵育4-6h。
[0193]
(c)反应结束后,加入0.5μl proteinase k solution轻轻混匀,置于37℃水浴10min终止反应。
[0194]
(d)将最终反应产物转化大肠杆菌dh5α,涂于含有gent抗性的lb平板,37℃培养。连接转化及阳性单克隆的鉴定方法同上。
[0195]
(2)将测序成功的质粒(mpugt742a1-pdonr207)按以下操作体系进行lr反应:
[0196][0197]
(a)将上述混合液放置于25℃,反应6h左右,之后加入0.5μl proteinase ksolution,轻轻混匀,37℃反应10min终止反应;
[0198]
(b)反应结束后,将最终反应产物转化大肠杆菌dh5α,涂于含有kan抗性的lb平板,37℃培养。连接转化及阳性单克隆的鉴定方法同上。测序成功得到最终阳性质粒mpugt742a1-pgwb5。
[0199]
3.2冻融法转化农杆菌
[0200]
(1)于-80℃取出农杆菌感受态细胞gv3101,冰上融化,取1μg的mpugt742a1-pgwb5质粒和pgwb5空载体质粒分别加入到gv3101感受态细胞中,用移液枪轻轻吹打混匀,冰水浴5min;
[0201]
(2)液氮速冻5min后,置于37℃水浴5min,然后再冰置5min;
[0202]
(3)加入400μl无抗性yep液体培养基,30℃振荡培养2-3h;
[0203]
(4)取200μl菌液涂于yep固体培养基(含50μg/ml kan,100μg/ml rif)上。30℃静置培养2-3d;
[0204]
(5)挑取单克隆进行接种于培养基中,振荡培养,菌落pcr鉴定其阳性,取阳性克隆存菌,备用。
[0205]
yep培养基组分(1l):酵母提取物10g、胰蛋白胨10g、nacl 5g,加水溶解并定容。固体培养基加入琼脂(12g/l)后,高压蒸汽灭菌。
[0206]
3.3农杆菌瞬时转化法转化烟草表皮细胞
[0207]
(1)将mpugt742a1-pgwb5-gv3101、pgwb5-gv3101和抑制蛋白沉默的p19划板,30℃培养36h后挑单克隆接种至3ml yep液体培养液中(含kan 50μg/ml,gent50μg/ml,rif 100μg/ml)小摇,30℃,200rpm振荡培养36h左右。
[0208]
(2)将菌液按1:50接种于5ml yep液体培养液(含kan 50μg/ml,gent 50μg/ml,rif 100μg/ml)中震荡培养10h左右。
[0209]
(3)将菌液再次活化,按1:50接种于20ml yep液体培养液(含kan 50μg/ml,gent 50μg/ml,rif 100μg/ml)中大摇至od600在0.4-0.6。
[0210]
(4)收菌,4000rpm,离心20min,弃上清;烟草转化液洗涤1次,离心,弃上清。
[0211]
(5)菌体用少量转化液重悬,调od600≈1.0。
[0212]
(6)将mpugt742a1-pgwb5-gv3101、pgwb5-gv3101分别和p19按1:1混合后置于暗处
静置3-5h。
[0213]
(6)用1ml的注射器将农杆菌渗透到烟草叶片的下表皮细胞中。
[0214]
(7)36h后,取经农杆菌渗透的叶片在激光共聚焦显微镜上检测下表皮细胞的荧光信号(设置488nm的氩激发光,gfp信号的发射光波长495-570nm,叶绿体发出的信号波长650-760nm),结果见图8。
[0215]
烟草转化液:mes-koh(ph 5.6)、na3po4 2mm、葡萄糖0.5%(v/v)、乙酰丁香酮100μl。
[0216]
上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1