同时检测小鼠微小病毒和小鼠胸腺病毒的引物及探针组合物、检测方法、试剂盒及其应用与流程
1.本发明属于病毒检测技术领域,涉及同时检测小鼠微小病毒和小鼠胸腺病毒的引物和探针组合物及其应用,具体涉及一种同时检测小鼠微小病毒和小鼠胸腺病毒的双重荧光定量qpcr检测引物和探针组合物、检测方法、试剂盒及其应用。
背景技术:
2.随着重组蛋白类药物在医疗领域的广泛应用,生物制品的病毒安全问题也备受重视,啮齿类动物细胞系如中国仓鼠卵巢细胞系(cho-k1细胞)常用于蛋白质表达生产系统,以保证产品的正确构象和活性,然而无论是生物活性原材料还是复杂的生产操作过程,都不可避免地存在病毒污染的风险。
3.小鼠微小病毒(murine minute virus,mvm)为单链dna病毒,无囊膜,有极强的稳定性,易感染啮齿类动物细胞,如cho-k1、bhk21细胞等。小鼠胸腺病毒thymic virus(mtlv;murid herpesvirus 3)属于疱疹病毒科,病毒颗粒直径约为135nm,是一种含包膜的dna病毒,可感染并杀死新生小鼠胸腺内发育中的t淋巴细胞,属于一种实验动物易感病原体。ich q5a明确规定,mvm和mtlv作为啮齿类动物细胞系中的物种特异性病毒,需要进行外源因子污染检测。常用于mvm和mtlv的检测方法为病毒分离、elisa抗原检测、rt-pcr核酸检测,相比之下荧光定量qpcr检测方法更直观、快速,适合早期病毒安全风险把控。
4.目前样本中的小鼠微小病毒和小鼠胸腺病毒必须分别进行两个荧光定量qpcr检测,检测过程费工费时的技术,且市面上缺乏可同时检测mvm和mtlv的检测方法和试剂盒,为此,本发明提供了一种同时检测小鼠微小病毒和小鼠胸腺病毒的双重荧光定量qpcr检测引物和探针组合物、检测方法、试剂盒,解决了检测过程费工费时的问题。
技术实现要素:
5.本发明的目的是克服现有技术中小鼠微小病毒和小鼠胸腺病毒必须分别进行检测的问题。
6.为此,本发明提供了一种同时检测小鼠微小病毒和小鼠胸腺病毒的引物及探针组合物,包括检测小鼠微小病毒的上游引物p-mvm-f、下游引物p-mvm-r和探针mvm-p,检测小鼠胸腺病毒的上游引物p-mtlv-f、下游引物p-mtlv-r和探针mtlv-p;
7.所述上游引物p-mvm-f的序列为5
’‑
aacttacttcttctgctgcaca-3’;
8.所述下游引物p-mvm-r的序列为5
’‑
agacccagtagaaacaccaacc-3’;
9.所述探针mvm-p的序列为5
’‑
(fam)-ccaacctga/ixna_c/rgcgraaacg-(bhq)-3’;
10.所述上游引物p-mtlv-f的序列为5
’‑
aggacttgctttacctgttg-3’;
11.所述下游引物p-mtlv-r的序列为5
’‑
atacatacctctccaagaaccg-3’;
12.所述探针mtlv-p的序列为5
’‑
(fam)-ccaacctga/ixna_c/rgcgraaacg-(bhq)-3’;
13.其中/ixna_a/表示对碱基a进行锁核酸修饰;/ixna_t/表示对碱基t进行锁核酸修
饰;/ixna_g/表示对碱基g进行锁核酸修饰;/ixna_c/表示对碱基c进行锁核酸修饰。
14.本发明还提供了一种同时检测小鼠微小病毒和小鼠胸腺病毒的试剂盒,所述试剂盒包括上述引物及探针组合物,且所述上游引物p-mvm-f、所述下游引物p-mvm-r、所述上游引物p-mtlv-f和所述下游引物p-mtlv-r混合后形成混合引物,所述探针mvm-p和所述探针mtlv-p混合后形成混合探针。
15.具体的,上述混合引物中上游引物p-mvm-f的浓度为0.1-1mm,下游引物p-mvm-r的浓度为0.1-1mm,上游引物p-mtlv-f的浓度为0.1-1mm,下游引物p-mtlv-r的浓度为0.1-1mm。
16.具体的,上述混合探针中探针mvm-p的浓度为0.05-1mm,探针mtlv-p的浓度为0.05-1mm。
17.具体的,上述试剂盒还包括qpcr反应预混液;所述qpcr反应预混液包含探针法荧光定量专用预混液aceq universal u+probe master mix v2和mg
2+
。
18.具体的,上述试剂盒还包括定量标准品;所述定量标准品为puc57-mvm和puc57-mtlv质粒混合物。
19.具体的,上述试剂盒还包括阳性对照;所述阳性对照为灭活的mvm毒株和mtlv假病毒毒株混合物;所述mtlv假病毒毒株的核酸信息为ul27全长序列,使用admax包装系统进行组装。
20.具体的,上述引物及探针组合物或试剂盒可用于鼠源实验动物高发病原体的早期监测,也可实时检测啮齿类生物制品、原材料、及其生产过程中是否存在小鼠微小病毒和小鼠胸腺病毒的污染。
21.本发明还提供了一种同时检测小鼠微小病毒和小鼠胸腺病毒的双重荧光定量qpcr方法,包括以下步骤:
22.(1)提取待测样本的dna模板;
23.(2)利用如权利要求1所述的引物及探针组合物对dna模板进行荧光定量qpcr反应;
24.(3)待测样品ct值≤35,且有明显的扩增曲线时,判定待测样本小鼠微小病毒和小鼠胸腺病毒为阳性。
25.具体的,上述步骤(2)中qpcr扩增程序为95℃,10min;95℃、15s,55℃、30s,72℃、20s,41个循环。
26.与现有技术相比,本发明具有以下优点和有益效果:
27.1、本发明提供的这种引物及探针组合物、试剂盒可用于同时检测小鼠微小病毒和小鼠胸腺病毒,可以特异性扩增出mvm和mtlv这两种病毒,且不与其它病毒核酸发生交叉反应,也不会与样本中可能存在的各种常用细胞系基因组发生交叉反应,特异性良好,弥补了现有技术中小鼠微小病毒和小鼠胸腺病毒必须分别进行检测的短板。该试剂盒可用于鼠源实验动物高发病原体的早期监测,也可实时检测啮齿类生物制品、原材料、及其生产过程中是否存在小鼠微小病毒和小鼠胸腺病毒的污染,以便快速采取防范措施,将污染对动物种群生物安全、科研安全和企业的损失等影响降到最低。
28.2、本发明建立了一种同时检测小鼠微小病毒和小鼠胸腺病毒的双重荧光定量qpcr检测方法,可特异性的共检和区分小鼠微小病毒和小鼠胸腺病毒,该方法特异性强、敏
感性高、重复性好,可缩短检测时间,减少样品的使用量,降低检测成本,解决了现有检测过程费工费时的技术问题,为啮齿类动物生物制品的外源病毒污染防控提供了良好的检测手段,具有一定的社会应用前景。
29.以下将结合附图对本发明做进一步详细说明。
附图说明
30.图1是本发明实施例中双重荧光定量pcr检测方法的标准曲线。
31.图2是本发明实施例中双重荧光定量pcr检测方法的病毒检测结果。
32.图3是本发明实施例中mtlv专属性检测结果。
33.图4是本发明实施例中mvm专属性检测结果。
34.图5是本发明实施例中mtlv和mvm专属性结果示意图。
具体实施方式
35.下面将结合实施例对本发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。尽管已经详细描述了本发明的代表性实施例,但是本发明所属技术领域的普通技术人员将理解,在不脱离本发明范围的情况下可以对本发明进行各种修改和改变。因此,本发明的范围不应局限于实施方案,而应由所附权利要求及其等同物来限定。
36.下面通过具体实施例对本发明的引物及探针组合物、试剂盒、检测方法的效果进行研究。
37.实施例1:
38.1、设计引物及探针
39.跟据从ncbi上检索到的mvm和mtlv病毒核酸序列,经过megalign进行比对,找到保守序列,分别设计引物和探针对,序列如下:
40.上游引物p-mvm-f的序列为5
’‑
aacttacttcttctgctgcaca-3’;
41.下游引物p-mvm-r的序列为5
’‑
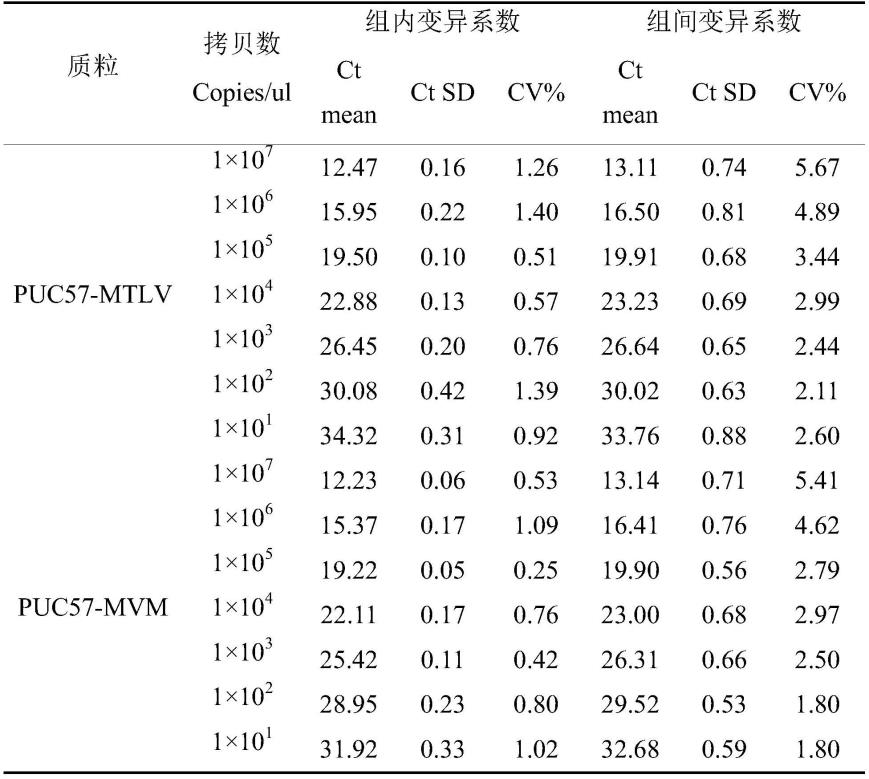
agacccagtagaaacaccaacc-3’;
42.探针mvm-p的序列为5
’‑
(fam)-ccaacctga/ixna_c/rgcgraaacg-(bhq)-3’;
43.上游引物p-mtlv-f的序列为5
’‑
aggacttgctttacctgttg-3’;
44.下游引物p-mtlv-r的序列为5
’‑
atacatacctctccaagaaccg-3’;
45.探针mtlv-p的序列为5
’‑
(fam)-ccaacctga/ixna_c/rgcgraaacg-(bhq)-3’;
46.其中/ixna_a/表示对碱基a进行锁核酸修饰;/ixna_t/表示对碱基t进行锁核酸修饰;/ixna_g/表示对碱基g进行锁核酸修饰;/ixna_c/表示对碱基c进行锁核酸修饰。
47.引物及探针由上海生工生物公司合成,将上游引物p-mvm-f、下游引物p-mvm-r、上游引物p-mtlv-f和下游引物p-mtlv-r混合后形成混合引物,探针mvm-p和探针mtlv-p混合后形成混合探针备用。混合引物中p-mvm-f、p-mvm-r、p-mtlv-f和p-mtlv-r浓度均为1mm;混合探针中mvm-p和mtlv-p的浓度均为1mm。
48.2、制备阳性对照品
49.使用灭活的mvm和含有目的片段的mtlv假病毒混合后作为阳性对照品。
50.其中mtlv假病毒通过以下方法构建:构建穿梭质粒gv315-mtlv(ul27),然后将所
得的穿梭质粒和辅助质粒:pbhg loxδe1,3 cre,共转染hek293细胞得到重组腺病毒ad/mtlv(ul27),使用adeno-x
tm
virus purification kit纯化病毒,终点稀释法测定病毒滴度。
51.3、提取病毒dna
52.使用市售病毒核酸纯化试剂盒(杭州新景生物试剂开发有限公司)提取mvm和mtlv病毒dna。
53.4、荧光定量pcr条件优化
54.本实施例中进行的荧光定量pcr反应体系和程序如下。
55.反应体系:qpcr反应预混液10μl,混合引物1.2μl,混合探针0.4μl,待测样本5μl,加无rna酶去离子水补足至20μl。
56.其中qpcr反应预混液为探针法荧光定量专用预混液aceq universal u+probe master mix v2(包含终浓度为的0.5mm mg
2+
)。
57.扩增程序:95℃预变性,10min;95℃变性、15s,55℃退火、30s,72℃延伸、20s,41个循环。
58.5、绘制标准曲线
59.puc57-mvm和puc57-mtlv质粒分别由生工生物工程(上海)股份有限公司合成并测序。
60.puc57-mtlv标准品保守区基因序列为:
61.atacatacctctccaagaaccggtaccgtacattcccgcttcaaactgtctaaagaattttaatggatgaaccaaataataaatttcaacaggtaaagcaagtcct
62.puc57-mvm标准品保守区基因序列为:
63.aacttacttcttctgctgcacagcaaagcagtcaaaccatgagtgatggcaccagccaacctgacagcggaaacgctgtccactcagctgcaagagttgaacgagcagctgacggccctggaggctctgggggtgggggctctggcgggggtggggttggtgtttctactgggtct
64.通过商用化试剂盒提取质粒并测定浓度后稀释混合成定量标准品1,定量标准品2,定量标准品3,定量标准品4,定量标准品5,定量标准品6,定量标准品7。其中,定量标准品1为1.0
×
101copies/μl的puc57-mvm和puc57-mtlv质粒混合物,定量标准品2为1.0
×
102copies/μl的puc57-mvm和puc57-mtlv质粒混合物,定量标准品3为1.0
×
103copies/μl的puc57-mvm和puc57-mtlv质粒混合物,定量标准品4为1.0
×
104copies/μl的puc57-mvm和puc57-mtlv质粒混合物,定量标准品5为1.0
×
105copies/μl的puc57-mvm和puc57-mtlv质粒混合物,定量标准品6为1.0
×
106copies/μl的puc57-mvm和puc57-mtlv质粒混合物,定量标准品7为1.0
×
107copies/μl的puc57-mvm和puc57-mtlv质粒混合物。
65.使用定量标准品1-7采用上述荧光定量pcr条件进行反应,结果如表1和图1所示,表中ct mean为ct值的平均值;ct sd为ct值的标准偏差;cv%为变异系数。
66.表1定量标准品荧光定量pcr反应结果
[0067][0068]
由图1和表1可知,本发明提供的引物和方法的定量限和检测限均可达到101copies/μl,在1.0
×
10
1-1.0
×
107浓度范围内扩增效率良好,其中,mtlv标准扩增曲线线性相关系数r2=1,扩增效率为100.1%,mvm标准扩增曲线线性相关系数r2=0.998,扩增效率为107.8%,表明本发明对mvm和mtlv的检测具有高灵敏度。
[0069]
如果供试品的ct值≤35,且有明显的扩增曲线,判定供试品外源性鼠源病毒为阳性。否则,样品为阴性。
[0070]
6、稳定性评估
[0071]
设置阳性对照组(mvm毒株和mtlv假病毒毒株混合样本)采用上述荧光定量pcr条件进行检出限和定量限实验,每次实验均有三组平行样品,进行三次重复实验,计算组内和组间的标准差和变异系数,评估所建立检测方法的稳定性,结果如图2所示,当溶液中mvm病毒滴度是10-1
tcid50/ml,mtlv假病毒的滴度为2
×
102pfu/ml时,可被本发明提供的引物和探针稳定检出。
[0072]
7、特异性评估
[0073]
为了检测本发明的特异性,使用本试剂盒检测balb/c 3t3、bhk21、cho-k1这3种常用细胞基因组和小鼠细小病毒mvm、小鼠胸腺病毒mtlv、小鼠多瘤病毒mpyv、小鼠肺炎病毒pvm、呼肠孤病毒reo3这5种鼠源病毒基因组的特异性,设置一个ntc对照,分析本发明提供的引物及探针对常见细胞系检出情况。实验结果如图2-图4所示。
[0074]
由图2可知,只有mtlv在fam通道可以正常扩增,判定为阳性,其它易感病毒mvm、
mpyv、pvm、reo3,常用细胞系balb/c 3t3、bhk21、cho-k1和阴性对照组均为无扩增情况,判定为阴性。
[0075]
如图3,只有mvm在hex通道可以正常扩增,为阳性,其它易感病毒mtlv、mpyv、pvm、reo3,常用细胞系balb/c 3t3、bhk21、cho-k1和阴性对照组均为无扩增情况,为阴性。
[0076]
如图4,当样本中存在mvm和mtlv两种病毒时,fam通道和hex通道均能正常扩增,为阳性,其它易感病毒mpyv、pvm、reo3,常用细胞系balb/c 3t3、bhk21、cho-k1和阴性对照组均为无扩增情况,为阴性。
[0077]
综上所述,本发明试剂盒可以特异性的扩增出mvm和mtlv这两种病毒,且不与其它病毒核酸发生交叉反应,也不会与样本中可能存在的各种常用细胞系基因组发生交叉反应,说明本试剂盒和方法特异性良好。
[0078]
以上例举仅仅是对本发明的举例说明,并不构成对本发明的保护范围的限制,凡是与本发明相同或相似的设计均属于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1